鸡肠道定殖乳酸杆菌分离鉴定及药物敏感性分析
2016-10-26李一经韩乐濛唐丽杰马孙婷布哈里姜艳平东北农业大学动物医学学院哈尔滨150030
李一经,韩乐濛,唐丽杰,马孙婷,布哈里,姜艳平,崔 文(东北农业大学动物医学学院,哈尔滨150030)
鸡肠道定殖乳酸杆菌分离鉴定及药物敏感性分析
李一经,韩乐濛,唐丽杰,马孙婷,布哈里,姜艳平,崔文
(东北农业大学动物医学学院,哈尔滨150030)
为筛选分析鸡肠道内定殖乳酸杆菌及其对抗生素药物敏感性,选取健康鸡肠道内容物,利用MRSCaCO3培养基平板,42℃厌氧培养,选择革兰氏阳性、不运动、无芽孢、杆状细菌检测过氧化氢酶、氧化酶和硝酸盐还原活性,糖发酵反应管作生化反应表型鉴定,利用PCR扩增16S rRNA并测定序列。结果表明,获得8株乳酸杆菌,其中包括3株Lactobacillus crispatus、2株Lactobacillus johnsonii、2株Lactobacillus salivarius和1株Lactobacillus saerimneri。8株乳酸杆菌在37和42℃均生长良好;抑菌试验表明,对革兰氏阳性及阴性细菌均有一定抑菌活性。体外粘附试验表明,8株乳酸杆菌均具有一定粘附特性,可在肠道内定殖。抗生素敏感性试验表明,8株乳酸杆菌对多种抗生素敏感。
鸡肠道;乳酸杆菌;分离鉴定;抑菌活性;体外粘附能力;药物敏感性
网络出版时间2016-6-17 15:21:50[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160617.1521.008.htm l
李一经,韩乐濛,唐丽杰,等.鸡肠道定殖乳酸杆菌分离鉴定及药物敏感性分析[J].东北农业大学学报,2016,47(6):51-59.
Li Yijing,Han Lemeng,Tang Lijie,et al.Separation and identification of colonized Lactobacillus from chickens intestine and analyzation antibiotics susceptibility[J].Journal of Northeast Agricultural University,2016,47(6):51-59.(in Chinese with English abstract)
乳酸菌(Lactic acid bacteria,LAB)能发酵糖类产生大量乳酸细菌,而非系统分类中严格意义上的科或属[1],目前已发现乳酸菌在细菌分类学上至少包括以乳酸杆菌属(Lactobacillus)、双歧杆菌属(Bifidobacterium)、链球菌属(Streptococcus)、明串珠球菌属(Leuconostoc)、肠球菌属(Enterococcus)、乳球菌属(Lactococcus)等为代表的8个属。绝大多数为厌氧或兼性厌氧化能异养菌,生长繁殖于厌氧或微耗氧、矿物质和有机营养物丰富酸性环境中。乳酸杆菌在动物消化道中含量较高,约占正常菌群10%[2],是人和动物正常菌群(Normal microbiota)组成部分。研究表明,乳酸杆菌是鸡嗉囊、空肠、回肠、盲肠和直肠中优势菌群,通常作为饲料安全益生菌剂添加[3-4]。
乳杆菌属、双歧杆菌属、芽孢杆菌属和链球菌属是目前生产活菌制剂常用菌种[5]。乳酸杆菌大量存在于动物肠道,维持肠道微生物群系“平衡”。乳酸杆菌制剂已被应用于肠道微生态治疗。乳酸杆菌可作为免疫接种活菌疫苗载体,在医学领域应用潜力较大[6]。鸡肠道黏膜上皮细胞表面及其周围粘附大量乳酸杆菌,可在小肠黏膜表面形成屏障,阻碍其他细菌特别是有害菌与小肠黏膜上皮细胞接触,减少有害菌通过肠道侵染鸡体机会。因此选择宿主自身且能定殖于肠道内乳酸杆菌菌株作活菌疫苗载体具有较大优势[7-9]。本研究从健康鸡肠道内分离乳酸杆菌,开展形态、生化反应及分子生物学鉴定,抑菌活性试验,体外粘附试验及药物敏感性试验分析,为鸡肠道内定殖乳酸杆菌生产应用奠定基础。
1 材料方法
1.1材料
1.1.1菌种
金黄色葡萄球菌(Staphylococcus aureus)、李氏杆菌(Listeria)、巴氏杆菌(Pasteurella)、鼠伤寒沙门氏菌(Salmonella typhimurium)、干酪乳杆菌L393(Lactobacillus casei393)由东北农业大学兽医微生物与免疫学试验室提供。
1.1.2试验动物
试验选取4只20日龄健康肉鸡,购自哈尔滨市胜利养鸡场。
1.1.3引物
根据已发表乳酸杆菌基因组16S rRNA基因序列合成引物27F(5'AGAGTTTGATCCTGGCTCAG 3')及1495R(5'CTACGGCTACCTTGTTACGA 3'),引物由金维智有限公司合成。
1.2方法
1.2.1鸡肠道乳酸菌分离及生化反应特性鉴定
将健康鸡处死,体表75%乙醇消毒处理,迅速解剖取十二指肠、空肠、回肠、盲肠,生理盐水灌洗清除内容物,用干净载玻片刮取鸡肠黏膜,约取0.5 g样品,置于装有4.5mL灭菌生理盐水试管中,充分震荡,混合均匀,稀释度为10-1,吸取0.5mL至另一试管中,将样品依次稀释至10-8,再吸取各稀释度样品300μL,滴种到MRS-CaCO3培养基平板上,涂布棒将其涂布均匀,42℃厌氧培养24~48 h,选择其中革兰氏阳性、不运动、无芽孢、杆状细菌做过氧化氢酶、氧化酶和硝酸盐还原活性试验,3者均为阴性初步判定为乳酸杆菌。将得到菌株纯化,直到镜下观察,菌体形态大小均一、无杂菌为止。30%(V/V)甘油保存于-80℃。
1.2.2乳酸杆菌16SrRNA鉴定
分离菌株全部用糖发酵反应管作基于生化反应表型鉴定,鉴定结果与《伯杰氏系统细菌学手册》对比后归类。细菌基因组提取试剂盒提取菌株DNA,以乳酸杆菌属16S rRNA通用引物27F、1495R扩增目的片段确认菌株归类。DNA回收试剂盒纯化回收。将纯化回收PCR产物分别送至生工生物工程(上海)有限公司及金唯智生物科技有限公司序列测定。DNAMAN软件分析测序结果,并通过Blast种属鉴定。
1.2.3乳酸杆菌37和42℃下生长特性测定
分离菌株经鉴定后,归为8类,每一类选择一株作代表测定生长曲线,生长曲线测定具体操作如下:
挑选生长健壮划线复苏菌落接种于5mL液体MRS培养基中,分别于37和42℃孵育过夜。取适量菌液用微量分光光度计测菌液浓度后以1%接种液体MRS,混匀,分装到12支试管,10 mL每管。37℃静置培养,以未接种MRS为对照置于相同温度下。测定菌液初始OD600,记录。每隔2 h取出1只试管测定OD600,以同温度下未接种MRS作对照,连续测24 h,记录数据。
1.2.4抑菌活性检测
打孔法对筛选的8株乳杆菌作4种病原菌抑菌活性测试试验。指示菌包括巴氏杆菌、金黄色葡萄球菌、李氏杆菌及鼠伤寒沙门氏菌。将分离菌株于MRS肉汤中培养,指示菌株于LB肉汤中培养,12~16 h;指示菌菌液用LB液体调整OD600至1.0;将调好OD600指示菌液涂布LB营养琼脂平板,100μL·板-1;待干后,打孔器打孔(9mm·孔-1),4孔·板-1;每孔分别加入8株分离菌,置于42℃静置向上培养,16~24 h后游标卡尺(0.02mm精度)测量抑菌圈直径,以肉眼未见菌落生长为边界,记录结果。
1.2.5乳酸杆菌体外粘附试验
检测分离到的8株乳酸杆菌及实验室保存菌L393(Lactobacillus casei393)在Basement Membrane Matrigel(购自BD公司)上的粘附能力。依说明书准备BMM工作液,参照文献[10]方法作粘附试验。
BMM工作液配制:将BMM于4℃冰箱内过夜融化。预冷基础1640培养基以1ϑ20比例稀释,4℃保存备用。
乳酸杆菌菌液制备:将8株乳酸菌分别接种MRS肉汤,42℃(L393为37℃)静置,厌氧培养至OD600=1.0;菌体培养物4℃低温下3 000 r·min-1离心10min,菌体无菌PBS洗两次;无菌PBS调整菌体浓度为5×106cfu·mL-1备用。
粘附试验步骤:将圆形爬片在无菌条件下放入24孔板内,封闭24孔板,放入4℃冰箱中预冷2 h。预冷枪头将BMM工作液包被于24孔板内爬片上,每孔100μL。室温放置1 h。基础1640培养基轻柔洗去爬片上未成胶BMM工作液。含2%牛血清白蛋白无菌PBS(2%BSA-PBS)包被各孔(每孔200μL),室温放置2 h。将2%BSA-PBS吸净,调整好浓度菌液加入孔中,每孔200μL,每株菌2个平行样,室温孵育2 h。吸去菌液,无菌PBS轻柔清洗1次后结晶紫染液染色粘附细菌。将爬片取出,100倍油镜下观察,每张爬片随机选取5个视野计数。计算各株菌视野下菌数平均值。
1.2.6药物敏感性试验
微生物药敏纸片(8大类24种,购自浙江天合微生物试剂有限公司)测试分离株耐药谱,确定所选菌株药物敏感性。取培养过夜菌液,测其OD600,并取菌液12 000 r·min-1离心5min,离心结束后弃上清,灭菌生理盐水重悬菌体,12 000 r·min-1,离心3min后重复上述步骤1次。灭菌生理盐水调节菌体OD600在0.08~0.1(相当于108cfu·mL-1),取350μL调节好浓度菌液涂布MRS琼脂平板。待干后(约需15min),贴放标准药敏纸片,4片每板,42℃倒置培养18~24 h后游标卡尺测量抑菌圈直径。
2 结果与分析
2.1鸡肠道乳酸菌分离及生化反应特性鉴定
从鸡肠道内共分离到42株菌,经革兰氏染色镜检,挑选其中14株革兰氏阳性杆菌纯化,经纯化5~10代后,获得单一革兰氏阳性杆菌。镜检结果见图1。
图1 革兰氏染色镜检(100×)Fig.1 Gram staining(100×)
对所分离14株革兰氏阳性杆菌作生化反应测试,根据糖发酵反应不同结果,筛选8株表型不同菌株(5-1-1,5-3-2,6-3,N-7,N-11,N-14,N-23及M-11),生化反应结果符合乳酸杆菌特性(见表1)。
2.2乳酸杆菌16S rRNA鉴定
将8株菌作16S rRNA基因扩增和序列测定,以提取基因组为模板,27F和1495R为引物,扩增乳酸杆菌16S rRNA序列,0.8%琼脂糖凝胶电泳检测可见约1 500 bp目的片段,与预期结果符合(见图2)。
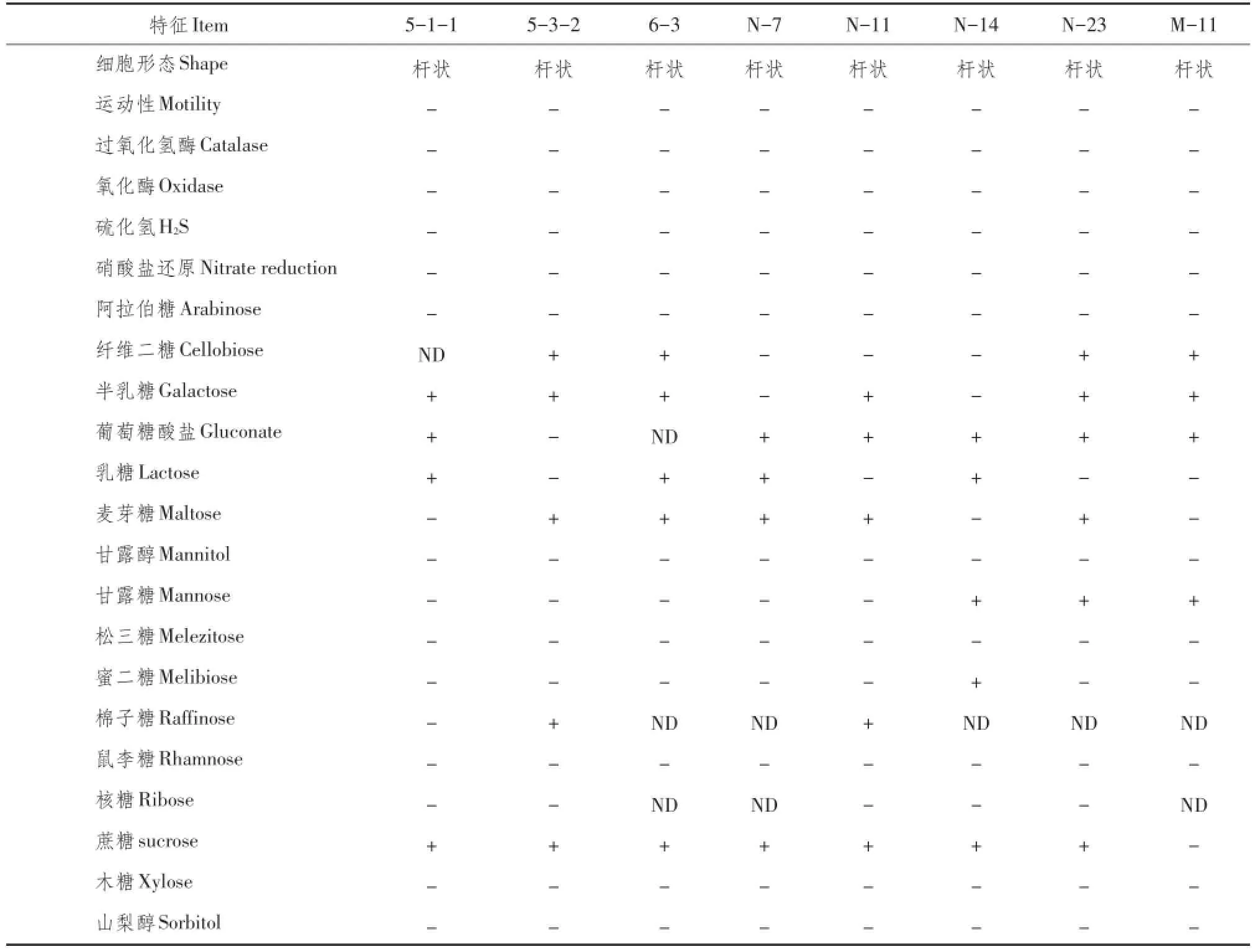
表1 鸡肠道分离菌生化反应结果Table 1 Biochemical characteristics of Lactobacillus species isolated from the intestines of chicken
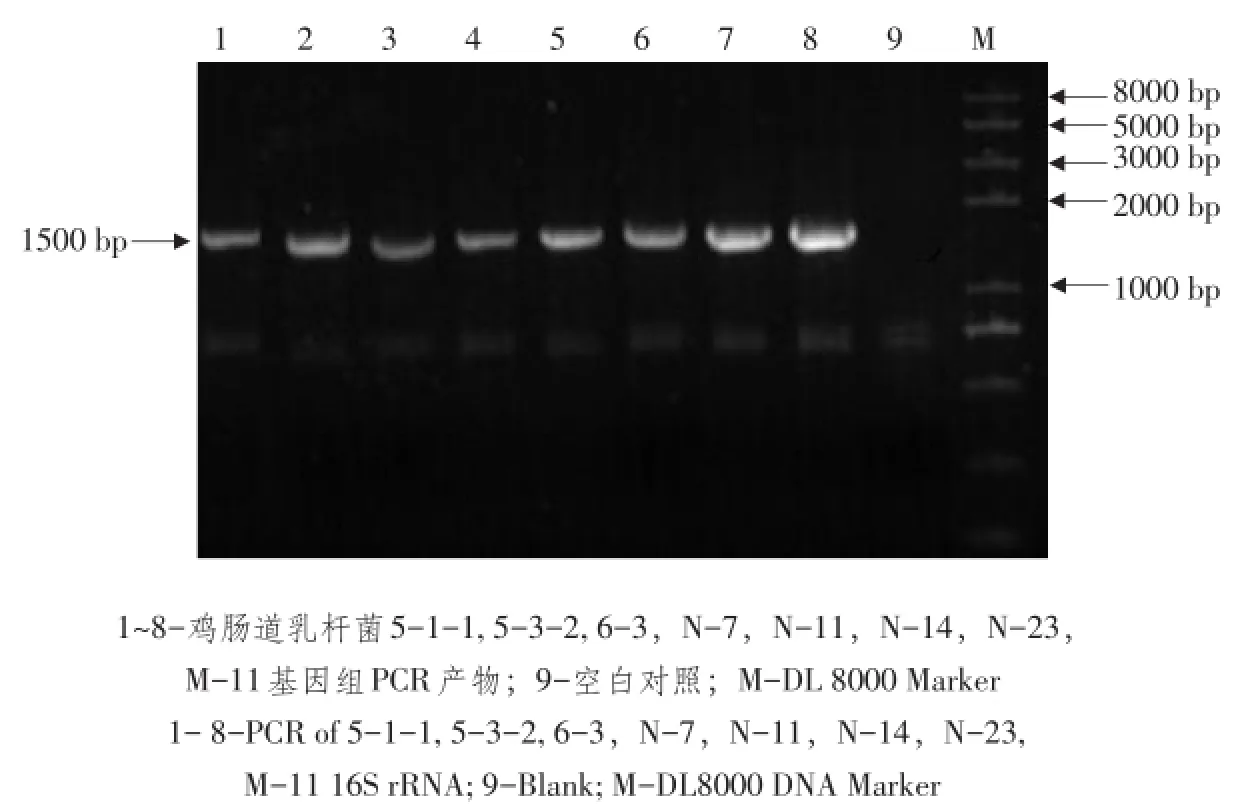
图2 基因组16S rRNA PCR结果Fig.2 PCR amplification of 16S rRNA
将PCR产物纯化测序。测序结果经NCBIBlast比对,进一步确定8株菌分类,将序列上传NCBI GenBank,获取8株菌基因登录号,结果见表2。
2.3乳酸杆菌37和42℃生长特性测定
37及42℃连续测定24 h内生长曲线(见图3、4)表明,所分离8株乳杆菌37和42℃均能生长。42℃下生长速度快于37℃。除5-1-1生长明显缓慢外,其余各株乳酸菌均在0~4 h处于迟缓期,5 h后进入对数生长期,10 h后进入平稳期。
由8株乳酸菌各自生长曲线(见图5)可知,多株菌42℃下生长速度略高于37℃,而平台期总菌数略低于37℃。

表2 鸡肠道乳杆菌鉴定结果及基因登录号Table2 Molecular identification results of Lactobacillus spp.isolated fromchicken intestine and GenBank accession No.
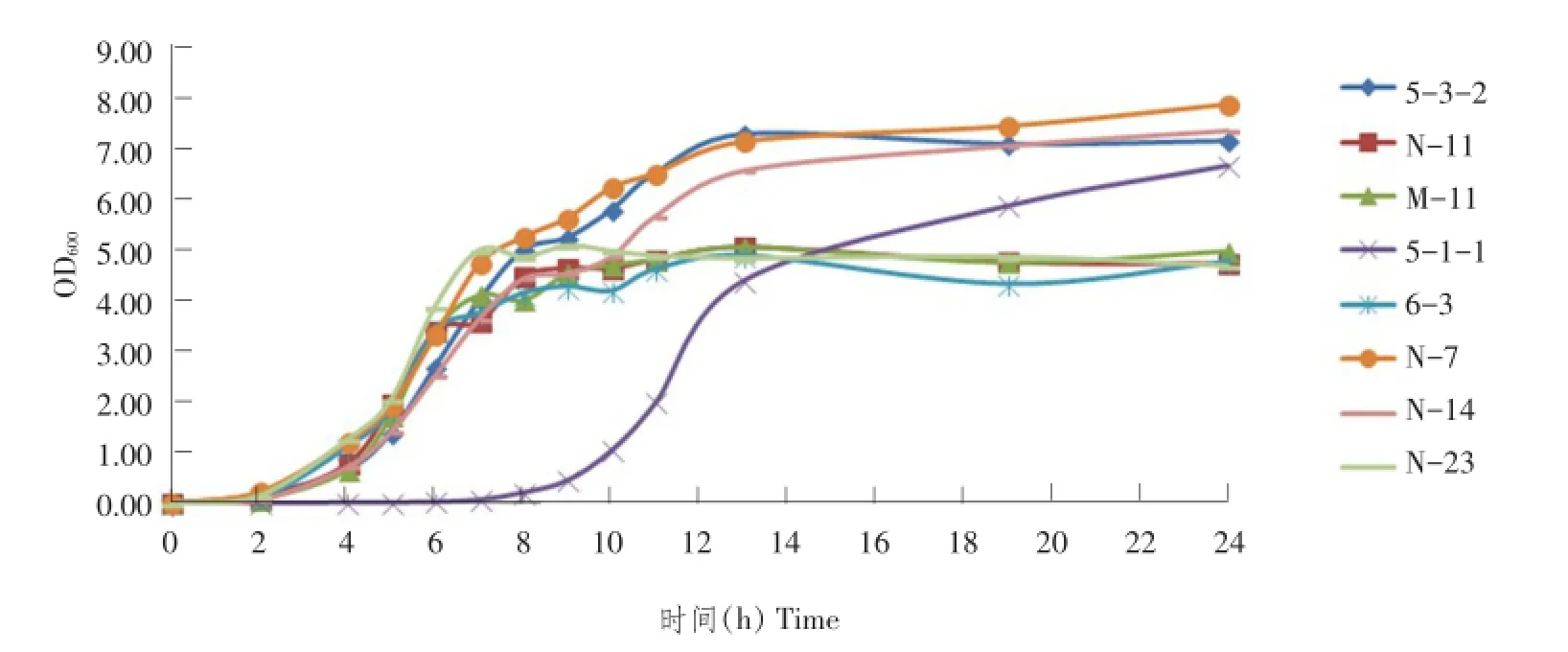
图3 37℃生长曲线Fig.3 Grow th curve in 37℃
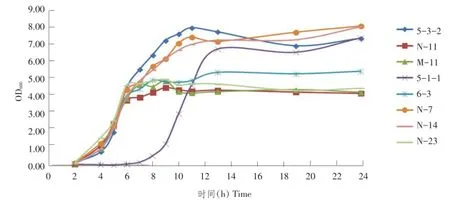
图4 42℃生长曲线Fig.4 Grow th cu rve in 42℃
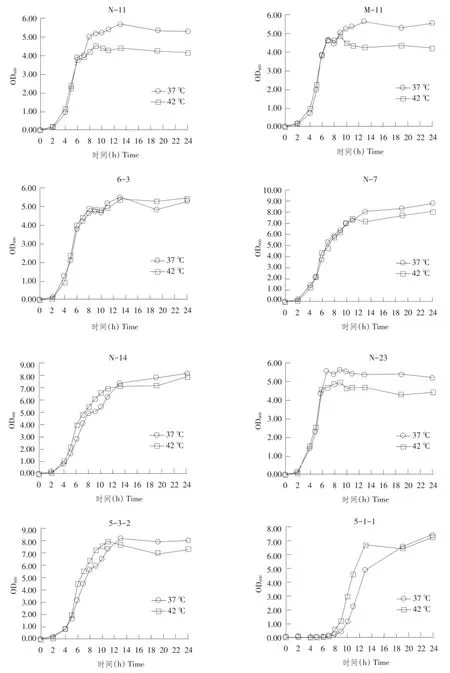
图5 8株乳酸菌生长曲线Fig.5 Grow th curves of eight LAB isolates
2.4抑菌活性检测
所筛选8株乳酸杆菌对4种致病菌抑菌试验结果见表4。所有菌株均对金黄色葡萄球菌、李斯特菌、巴氏杆菌及鼠伤寒沙门氏菌表现一定抑制活性。
2.5乳杆菌体外粘附试验
所筛选8株乳酸杆菌与L393在BMM上粘附试验结果见图6。3株卷曲乳杆菌(Lactobacillus crispa⁃tus)5-3-2、5-1-1和N-11表现较强粘附能力,M-11(Lactobacillus saerimneri)与L393(Lactobacillus ca⁃sei393)粘附能力近似。而6-3和N-23(Lactobacil⁃lus johnsonii)及N-14和N-17(Lactobacillus salivari⁃us)粘附能力较弱。
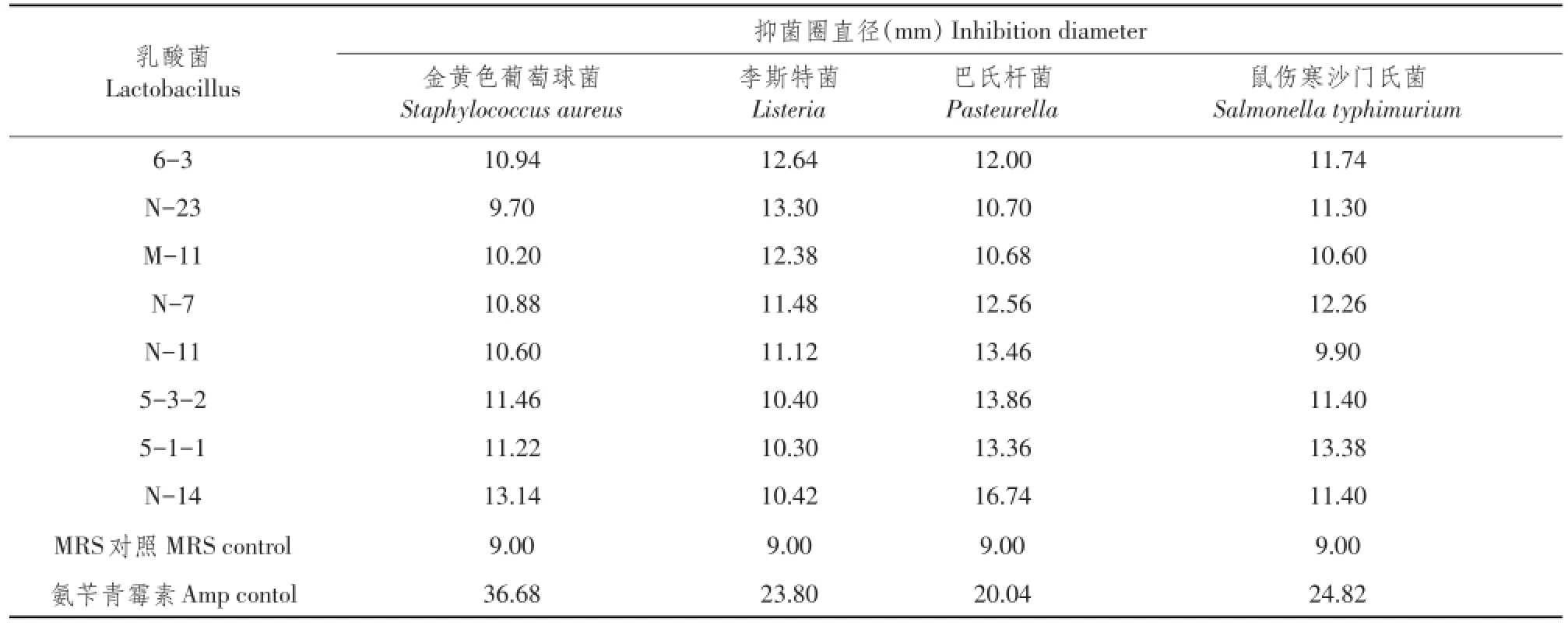
表4 抑菌试验结果Table4 Antibiotic activity of the isolates against pathogenic bacteria
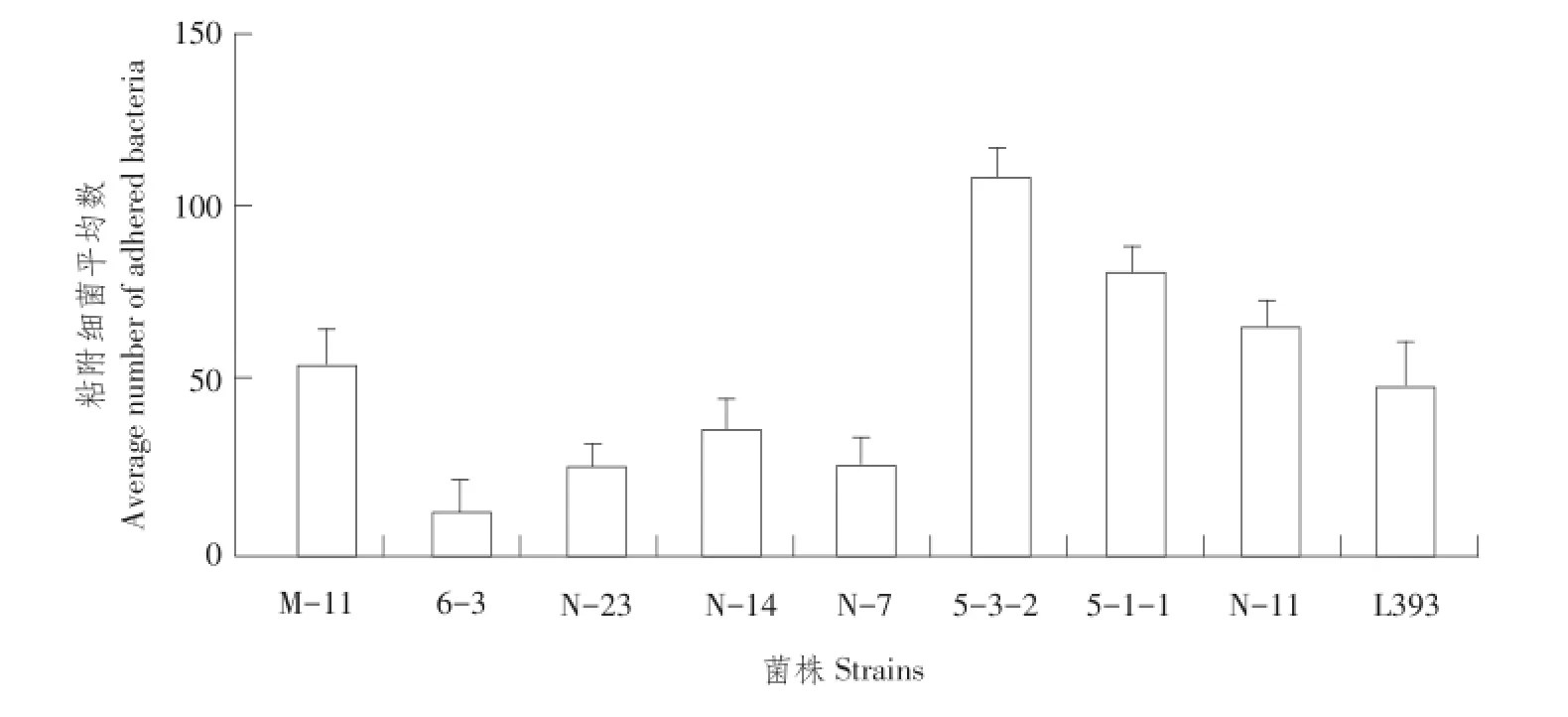
图6 乳酸杆菌BMM粘附试验结果Fig.6 Adhesion of LAB to basement membrane Matrigel
2.6药物敏感性试验
通过8大类24种抗生素微生物药敏纸片(6mm)测试所筛选8株乳杆菌对药物的敏感性。当乳杆菌抑菌圈直径大于相应抗生素临界点时,认为此菌对该种抗生素敏感。试验结果见表5。
由表5可知,6-3与N-23(Lactobacillus johnso⁃nii)及N-7与N-14(Lactobacillus salivarius)4株菌能耐受大部分抗生素(≥13种)。M-11(Lactobacillus saerimneri)及5-3-2、5-1-1、N-11(Lactobacillus crispatus)4株菌则对较少种类抗生素(≤10种)表现耐受性。
所有8个菌株均对庆大霉素(Gentamicin)、氨苄青霉素(Ampicillin)、卡那霉素(Kanamycin)和四环素(Tetracycline)不敏感。
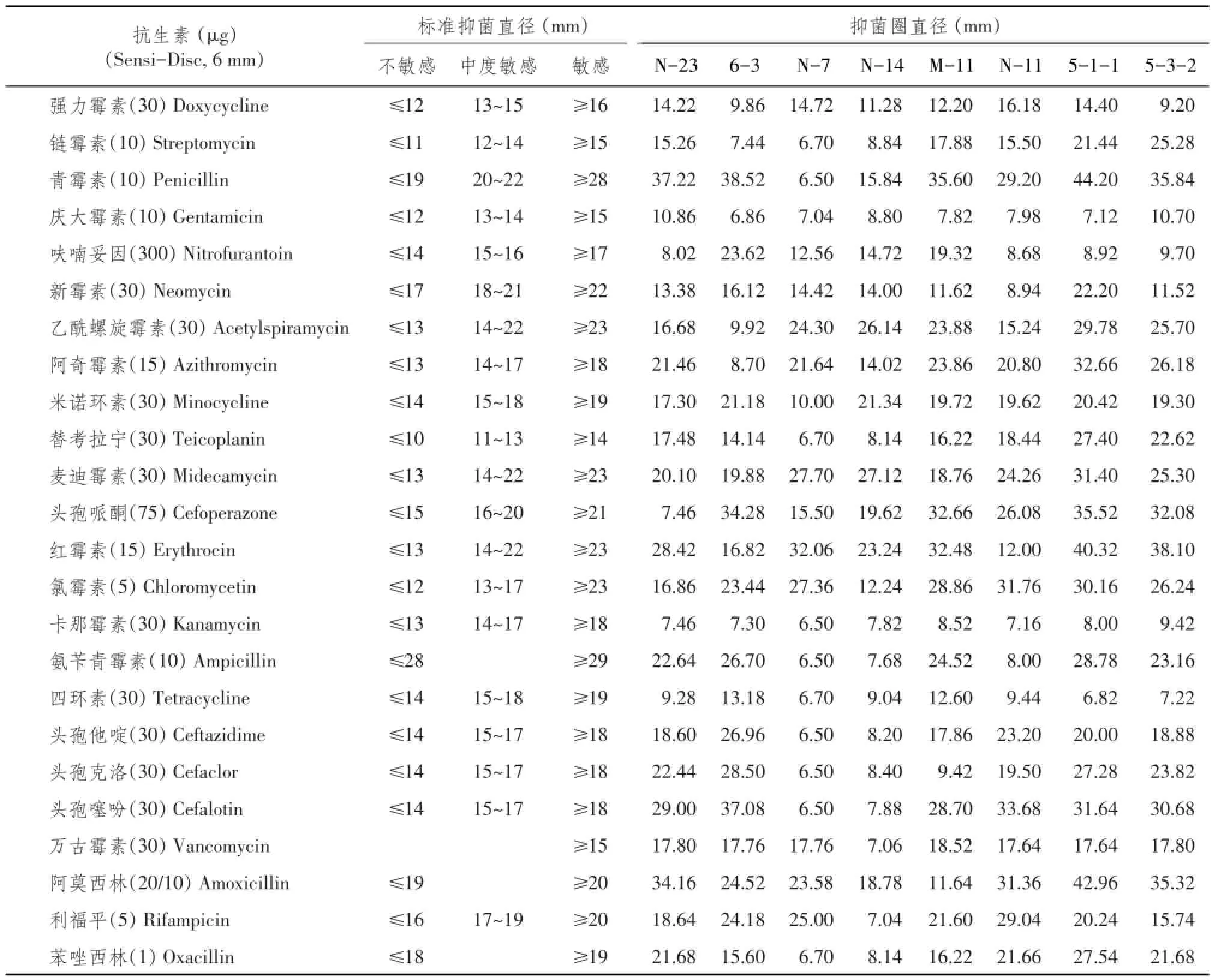
表5 药敏试验结果Tab le 5 Antibiotic sensitivity of the isolates
3 讨论与结论
近年来,益生菌作为微生物添加剂和疫苗载体倍受关注,但益生菌株来源不同应用效果不一致。益生菌株多由体外环境如发酵工业筛选得到,体内外环境差异显著,来自体外环境外源菌难以耐受体内胆汁、胃中低pH作用,无法肠壁定殖。Fuller指出用作益生素的菌株具有生长速度快,易吸附于上皮细胞特性,对胃肠道内抑制因素具有抵抗力,能产生抗菌物质等特点[11]。本试验直接从鸡肠道黏膜分离乳酸菌,筛选及优化乳酸菌株。
试验利用经改良MRS培养基,在原有培养基基础上加入20%碳酸钙,根据厌氧培养环境下菌株产酸分解碳酸钙特性,筛选产酸性能较好乳酸菌。通过表型特征鉴定,筛选乳酸杆菌,根据糖发酵反应分离到的菌株中筛选出8株。由于乳酸杆菌属内,部分种间糖发酵反应差异小,需进一步鉴定[12]。基于16SrRNA序列分析表明8株菌中3株为Lactobacillus crispatus、2株为Lactobacillus johnso⁃nii、2株为Lactobacillus salivarius、1株为Lactoba⁃cillus saerimneri。任大勇、鲍延娥等研究表明,卷曲乳杆菌(Lactobacillus crispatus)、约氏乳杆菌(Lactobacillus johnsonii)和唾液乳杆菌(Lactobacillus salivarius)均有较高肠道粘附能力,是动物消化道内常在菌,已应用于饲粮添加以改善产蛋鸡生产性能和蛋品质,调节机体免疫功能[13-14]。体外粘附试验结果表明,这8株菌均有一定粘附能力,3株卷曲乳杆菌体外粘附能力显著高于其他菌株,与Sun等研究结果一致[15]。粘附能力强有助于细菌在肠道内更好定殖,作为生物工程菌时,可减少免疫次数和免疫量,提高免疫效率。Rodwell研究表明,Lactobacillus saerimneri由哺乳动物消化道内分离所得[16],且Taweechotipatr等也证明,Lactobacil⁃lus saerimneri在人体内具有抗炎症特性并可作为候选益生菌[17]。
乳酸菌可作为抗生素替代品防治疾病。本试验筛选8株乳酸杆菌均对庆大霉素(Gentamicin)、氨苄青霉素(Ampicillin)、卡那霉素(Kanamycin)和四环素(Tetracycline)不敏感。研究表明,多株植物乳杆菌均对庆大霉素(Gentamicin)、氨苄青霉素(Ampicillin)和卡那霉素(Kanamycin)不敏感[18],这可能是多数乳酸菌共同特征。此外,两株约氏乳杆菌与两株唾液乳杆菌均对多种抗生素具有耐药性。乳酸杆菌耐药性机制有待深入研究。
8株分离菌株具有抑菌活性,不仅能抑制革兰氏阳性菌(金黄色葡萄球菌、李斯特菌),对革兰氏阴性菌(巴氏杆菌、鼠伤寒沙门菌)也有较好抑制作用。分离菌株抑菌活性有利于维持肠道正常菌群平衡,是益生菌预期重要特性之一[18]。
8株菌37和42℃均生长良好,表明其在实验室一般培养条件下及鸡体内(鸡正常体温为40~ 42℃)均可生长。
综上,本试验分离8株乳酸杆菌均有作为鸡饲料益生菌制剂和活载体疫苗宿主菌株应用潜力。
[1]Klein G,Pack A,Bonaparte C.et al.Taxonomy and physiology of probiotic lactic acid bacteria[J].International Journal of Food Mi⁃crobiology,1998,41(2):103-125.
[2]Kontula P,SuihkoM L,SuorttiT.et al.The isolation of lactic acid bacteria from human colonic biopsies after enrichment on lactose derivatives and rye arabinoxylo-oligosaccharides[J],Food Micro⁃biology,2000,17(1):13-22.
[3]Kathrin,M,B.Claudia,K.Hans Christian.et al.Lactobacilli-bac⁃teria-host interactions with special regard to the urogenital tract [J].International Journal of Medical Microbiology,2005,295(1): 9-18.
[4]张子仪.中国饲料学[M].北京:中国农业出版社,2000.
[5]黄承凤.饲用益生素[J].中国饲料,1998(2):24-25.
[6]Seegers J F M L.Lactobacilli as live vaccine delivery vectors: Progress and prospects[J].Trends in Biotechnology,2003,20(12): 508-515.
[7]RingøE,Lisbeth Løvmo,Kristiansen M,et al.Lactic acid bacteria vs.pathogens in the gastrointestinal tract of fish:A review[J]. Aquaculture Research,2010,41(4):451-467.
[8]Merrifield D L.Possible influence of probiotic adhesion to intesti⁃nal mucosa on the activity and morphology of rainbow trout(On⁃corhynchus mykiss)enterocytes[J].Aquaculture Research,2010, 41(8):1268-1272.
[9]Olaya R,Lionel F,Maxerue F.et al.A new zebrafish model of orointestinal pathogen colonization reveals a key role for adhesion in protection by probiotic bacteria[J].Plos Pathogens,2012,8(7): 1029-1033.
[10]Bouzaine T,Dauphin RD,Thonart P.et al.Adherence and coloni⁃zation properties of Lactobacillus rhamnosus TB1,a broiler chicken isolate[J].Letters in Applied Microbiology,2005,40(5):391-396. [11]Fuller R.Probiotics in man and animals[J].Journal of Applied Bacteriology,1989,66(5):365-378.
[12]Rahkila R,T Nieminen,P Johansson.et al.Characterization and evaluation of the spoilage potential of Lactococcus piscium isolates from modified atmosphere packaged meat[J].International Journal of Food Microbiology,2012,156(1):50-59.
[13]任大勇,李昌,秦艳青.等.乳酸菌益生功能及作用机制研究进展[J].中国兽药杂志,2011,45(2):47-50.
[14]鲍延娥,汪攀,董艳青.等.约氏乳杆菌对产蛋鸡生产性能、蛋品质和免疫机能的影响[J].动物营养学报,2013,25(3):595-602.
[15]Sun Z,L Huang,J kong.et al.In vitro evaluation of Lactobacillus crispatus K313 and K243:High-adhesion activity and anti-in⁃flammatory effect on Salmonella braenderup infected intestinal ep⁃ithelial cell[J].Veterinary Microbiology,2012,159(S1-2):212-220.
[16]Rodwell,AW.The occurrence and distribution of amino-acid de⁃carboxylases within the genus Lactobacillus[J].Journal of General Microbiology,1953,8(2):224-32.
[17]Taweechotipatr M,Chandra I,Spinler J K,et al.Lactobacillus saerimneri and Lactobacillus ruminis:Novel human-derived probi⁃otic strains with immunomodulatory activities[J].FEMS Microbiol Lett,2009,293(1):65-72.
[18]刘敏,张英,张琳琳,等.虹鳟肠道植物乳杆菌的分离及特性研究[J].东北农业大学学报,2014,45(12):24-30.
Separation and identification of colonized Lactobacillus from chickens intestine and analyzation antibiotics susceptibility/LI Yijing,HAN Lemeng,TANG
Lijie,MA Sunting,Bukarhari M,JIANG Yanping,CUI Wen(School of Veterinary Medicines,Northeast Agricultural University,Harbin 150030,China)
In order to select colonized Lactobacillus from chickens intestine and analyzation antibiotics susceptibility,Lactobacillus were isolated from the intestine of healthy chickens.After using MRS-CaCO3plates,anaerobic culturing in 42℃,bacterias those are Gram-positive,still,no spores and rod-like were tested by oxidase,catalase reaction,and biochemical reactions.Eight strains with different phenotype were carried 16S rRNA sequence analysis by using PCR,and the results showed that three of the eight strains were Lactobacillus crispatus,two strains were Lactobacillus johnsonii,two strains were Lactobacillus salivarius and one strain were Lactobacillus saerimneri.Eight strains were able to grow well in both 37 and 42℃.And all the strains exhibited sensitivity to various antibiotics,inhibited the growth of both Grampositive and Gram-negative bacteria.And the in vitro adherence test showed that all the isolates had the ability to adhere the guts.Antibiotics susceptibility test showed that eight strains were sensitive to many antibitics.
chicken intestine;Lactobacillus;separation and identification;antimicrobial activity;in vitro adherence ability;antibiotic susceptibility
S831
A
1005-9369(2016)06-0051-09
2016-04-05
“十二五”农村领域国家科技计划项目(2015BAD12B01-4)
李一经(1960-),男,教授,博士,博士生导师,研究方向为兽医微生物与免疫学。E-mail:yijingli@163.com
