艾纳香幼苗对夏季干旱胁迫生理响应
2016-10-26李丽霞刘济明廖小锋贵州大学林学院贵阳55005贵州科学院山地资源研究所贵阳55000
李丽霞,刘济明*,池 馨,廖小锋,骆 畅,熊 雪(.贵州大学林学院,贵阳55005;.贵州科学院山地资源研究所,贵阳55000)
艾纳香幼苗对夏季干旱胁迫生理响应
李丽霞1,刘济明1*,池馨1,廖小锋2,骆畅1,熊雪1
(1.贵州大学林学院,贵阳550025;2.贵州科学院山地资源研究所,贵阳550001)
以有性繁殖1年龄艾纳香幼苗为研究对象,研究其水分胁迫响应机理,寻求艾纳香生长最佳栽培条件。于2014年5月开始为期4个月四梯度干旱处理试验,对不同水分胁迫下艾纳香生理指标分析。结果表明,对照组艾纳香长势最好;轻度干旱胁迫下,缺水对艾纳香影响不显著,丙二醛含量虽少量增加,但植株最大程度利用有限水分,通过降低叶绿素、可溶性淀粉含量,增加可溶性糖和游离脯氨酸含量,适当增加抗氧化酶活性,增强根系活力等方式对抗轻度缺水。中度和重度胁迫下,植物细胞受损,丙二醛含量增加,根系活力减弱,植株生长缓慢,艾纳香通过可溶性糖、可溶性淀粉等渗透物质增加维持细胞渗透势平衡,降低水分胁迫造成的细胞受损,通过抗氧化酶清除过氧化氢等有害物质保持细胞活性。中度干旱胁迫下,植株虽可生长,但长势不良;重度胁迫下,艾纳香叶片掉落甚至植株死亡。夏季艾纳香幼苗管理应保证水分供应充足。
艾纳香;干旱胁迫;耐旱性;生理响应
网络出版时间2016-6-17 15:22:23[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160617.1522.022.htm l
李丽霞,刘济明,池馨,等.艾纳香幼苗对夏季干旱胁迫生理响应[J].东北农业大学学报,2016,47(6):18-25.
Li Lixia,Liu Jiming,Chi Xin,et al.Response on physiological of Blumea balsamifera L.DC.seedling to drought in summer [J].Journal of Northeast Agricultural University,2016,47(6):18-25.(in Chinese with English abstract)
干旱是影响植物生长发育和分布主要环境因子之一,危害程度在非生物胁迫中占首位[1-2]。西南喀斯特地区是全国生态区划重点干旱地区[3],干旱持续时间长、分布面积广且不均匀[4]。开展西南喀斯特地区植物与土壤水分状况关系研究具有重要意义。
艾纳香(Blumea balsamifera L.DC.)属菊科艾纳香属多年生木质草本植物,主要分布于贵州、广西、云南、广东、海南、台湾等地[5]。为全草入药的少数民族特色中草药,具有镇痛、发汗、祛风除湿、去痰止咳、通经止血等功效,是提取天然冰片主要来源之一[6]。但艾纳香野生品种冰片提取率极低,人工栽培艾纳香受关注[7]。目前,有关艾纳香研究主要集中在其药理和药用成分分离与鉴定方面[8-11],干旱胁迫对艾纳香生理生化指标和有效成分影响研究尚未见报道。
本试验于2014年5月以1年龄艾纳香为研究对象,设置不同干旱梯度研究艾纳香耐旱潜力。以期探明不同干旱胁迫处理下艾纳香生理响应特性,探求艾纳香生长适宜水分条件,为西南喀斯特干旱地区艾纳香引种驯化和栽培管理提供理论支持和科学依据。
1 实验地概况
1.1野外实验地概况
贵州省罗甸县,主要为山地类型,年平均气温20.35℃,最冷月平均气温8.0~10.45℃,≥10℃年积温5 750~6 500℃,无霜期335~349.5 d,年总日照时数1 297.7~1 600 h,年降雨量1 200mm,有“天然温室”之称。野生艾纳香在罗甸主要生长分布在红水河、罗悃、龙坪、凤亭、逢亭等乡镇。
1.2移栽材料实验地概况
艾纳香移栽试验地位于贵阳市贵州大学南校区林学院苗圃内,海拔约1 020 m。年平均气温15.3℃,年极端最高温度35.1℃,年极端最低温度-7.3℃,最热月(7月下旬)平均气温24℃,最冷月(1月上旬)平均气温4.6℃。年平均相对湿度77%,年平均总降水量1 129.5mm,年平均阴天日数235.1 d,年平均日照时数1 148.3 h,年降雪日数少,平均11.3 d。试验地土壤及盆栽用土由石灰岩发育,呈微碱性,肥力中等。
2 材料与方法
2.1材料
2014年3月在贵州省罗甸县逢亭镇逢亭村选取长势一致1年龄艾纳香幼苗带回贵州大学林学院苗圃。多菌灵对土壤消毒,覆膜杀菌2 d后,去膜晾晒1周以上。烘干法测定土壤田间持水量(FC,31.81%)及土壤含水量(Cs,11.58%),并称量盆重(PZ,0.15 kg),控制移栽时装入盆中土壤重量(TZ,4.50 kg),每盆编号并记录,移栽后统一肥水管理。2014年5月1日,取长势良好、较为一致无病虫害艾纳香盆栽苗移入隔绝降水透明大棚,作干旱胁迫试验材料,此时盆中苗木平均重量(MZ)约0.05 kg。
2.2方法
2.2.1干旱胁迫试验设计
试验为2014年6~9月。根据预试验结果,设置4个土壤水分梯度:土壤含水量分别为田间持水量80%(对照,CK)、60%(轻度胁迫,LD)、40%(中度胁迫,MD)、30%(重度胁迫,SD),每个处理3次重复,每个重复12盆。分别于试验前期(6月中旬)、试验中期(8月初)、试验后期(9月中旬)取样,测定各项指标。
胁迫设计采用盆栽称重控水法[12]。根据前期测量相关数据及控制总重量(ZZ)公式可分别计算CK、LD、MD、SD各处理组盆栽苗控制总重量:
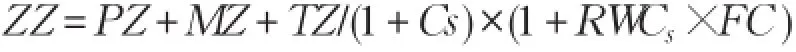
式中,RWCs为土壤相对含水量,即土壤含水量占该土壤田间持水量百分比。
因此,各处理组控制重量分别为:CK 5.266 kg、LD 4.974 kg、MD 4.682 kg、SD 4.536 kg,根据植株长势适当增减控制重量。每天17:00~18:00称重并调节水分状况(电子称,感量5 g),6月1日各处理组均达到设定水分条件,9月20日胁迫处理结束,期间不施肥并随时拔除杂草。
2.2.2测定指标
叶片相对含水量测定采用称重法;光合色素含量测定采用分光光度计法;可溶性糖含量与可溶性淀粉含量采用蒽酮比色法;游离脯氨酸含量采用酸性茚三酮显色法;叶片丙二醛(MDA)含量测定采用TBA显色法;叶片超氧化物歧化酶(SOD)活性测定采用NBT光还原法;过氧化氢酶(CAT)活性测定采用H2O2还原法;过氧化物酶(POD)活性测定采用愈创木酚氧化法;根系活力测定采用氧化三苯基四氮唑(TTC)法[13-14]。
2.2.3数据处理
试验数据利用SPSS 18.0软件分析,图表处理采用Excel2007软件。
3 结果与分析
3.1叶片相对含水量
由表1可知,整个试验过程中,土壤含水量对叶片含水量影响较大,整体表现为叶片相对含水量随土壤水分减少逐渐降低,各处理间差异显著,CK>LD>MD>SD。
试验前期对照组为93.67%,随土壤含水量减少至重度干旱胁迫时仅77.50%。试验中期,叶片相对含水量较前期下降,差异明显,原因是艾纳香叶片较大且为纸质、蒸腾速率较快;而7月份为试验中期,气温比试验前期高,土壤含水量和相应空气湿度降低相同情况下,叶片相对含水量降低。试验后期气温相对较低,但试验中期高温低湿环境对叶片造成部分损伤,导致即使叶片相对含水量较中期回升,但仍低于前期。
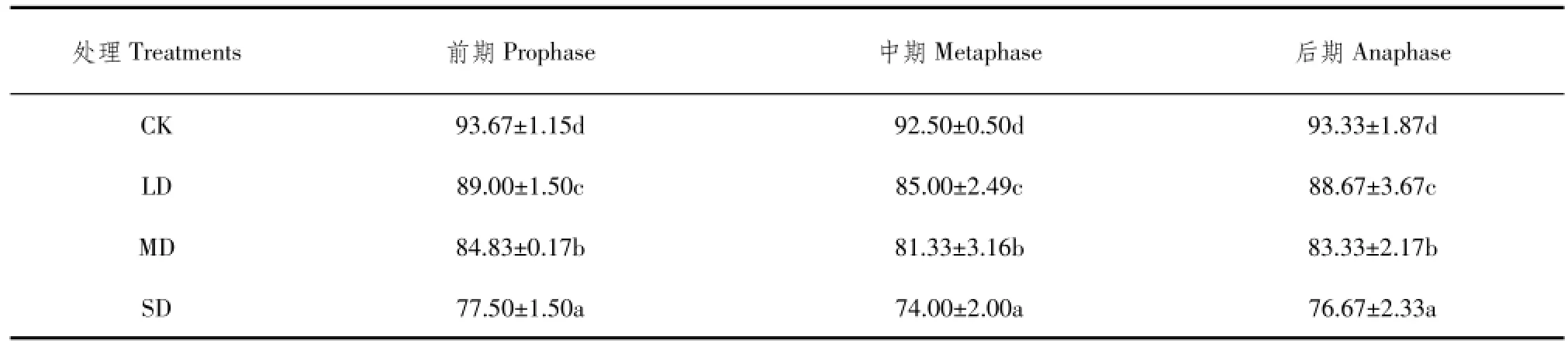
表1 干旱胁迫下艾纳香不同时期叶片相对含水量Tab le1 Leaf relative water content of B.balsamifera at different periods under drought stress (%)
3.2光合色素含量
由表2可知,叶绿素a不同水分梯度处理下整体表现为:随土壤水分含量减少而递增。试验前期各处理差异明显,试验中期叶绿素a含量较前期有不同程度降低,但试验后期MD和SD处理含量又有所回升,对照组变化不大,维持相对稳定含量。说明水分充足情况下,植株生长状况良好,不会受时间和天气影响,而水分胁迫对叶绿素a含量有影响。
随胁迫加剧,叶片枯萎掉落,植株通过增加单位面积内叶绿素a含量保证光合作用,维持植株生长。轻度胁迫下,叶绿素a含量中期(1.56mg·g-1)略低于前期(1.58 mg·g-1),末期(1.05mg·g-1)最低;中度和重度胁迫下,中期含量均最低,前期和后期含量较高。原因可能是试验中期气温较高,叶片为降低叶温,通过降低叶绿素a含量减少红光吸收,保护植物。
由表3可知,叶绿素b不同水分处理下差异显著。试验前期各处理组叶绿素b含量表现为LD> MD>CK>SD,这可能是因为植株刚受到干旱胁迫,尚未适应重度胁迫下土壤含水量极低生长条件,表现显著性反应。试验中期和后期,对照组含量最低,轻度胁迫含量最大,与其他3组处理差异显著。说明轻度干旱胁迫促进叶绿素b合成,但随水分亏缺加剧叶绿素b含量下降。试验中期叶绿素b含量较高,原因可能是试验中期气温较高,叶片为降低叶温,通过降低叶绿素a含量减少红光吸收,为保证光合作用,增加叶绿素b含量。

表2 干旱胁迫下艾纳香不同时期叶绿素a含量Table2Content of B.balsamifera chlorophyll a at different periods under drought stress (mg·g-1FW)
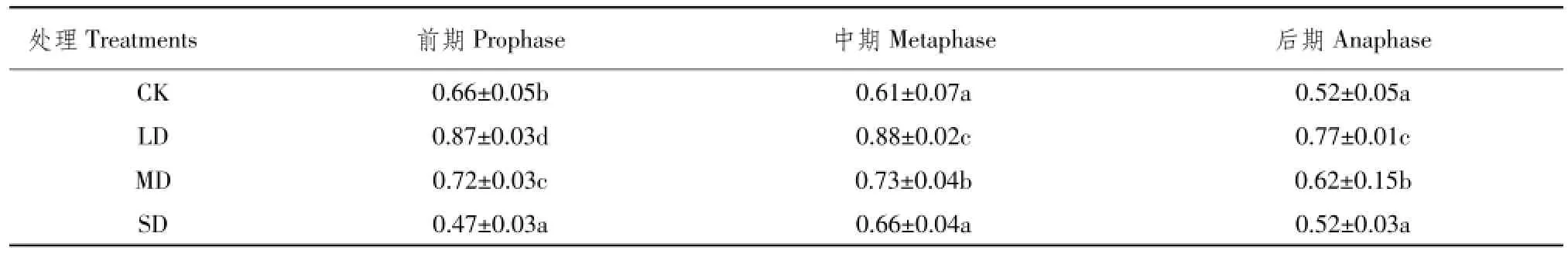
表3 干旱胁迫下艾纳香不同时期叶绿素b含量Table3 Content of B.balsamifera chlorophyll b at different periods under drought stress (mg·g-1FW)
由表4可知,不同水分处理下,试验前期类胡萝卜素含量随土壤水分含量减少而逐渐增多;而试验中期和后期重度水分胁迫下,类胡萝卜素含量降低。原因是类胡萝卜素可将能量运送给叶绿素,具保绿作用,轻度和中度水分胁迫时,植株通过增加类胡萝卜素保证光合作用;而试验中期和后期重度水分胁迫对植物造成严重影响,植株体内产生大量自由基,植株通过消耗类胡萝卜素清除细胞内自由基,保护光合器官免受强光和极端干旱环境破坏。整个胁迫过程中,艾纳香叶片颜色轻度和中度较浅,重度胁迫下颜色较深,与叶绿素总含量值表现一致。

表4 干旱胁迫下艾纳香不同时期类胡萝卜含量Table4Content of B.balsamifera carotenoid at different periods under drought stress (mg·g-1FW)
3.3渗透物质
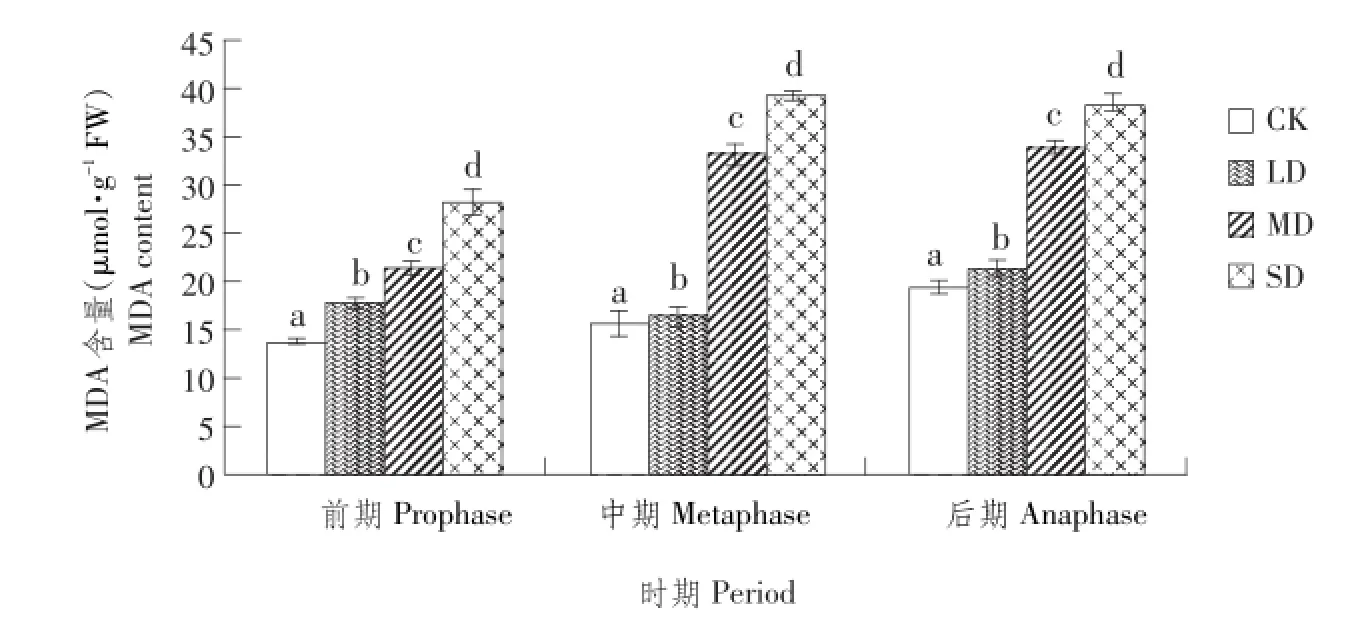
由表5可知,不同水分处理下,可溶性糖与可溶性淀粉含量变化趋势相反。可溶性糖含量随土壤含水量减少逐渐增多,SD>MD>LD>CK。同一处理不同时期变化小,对照组和轻度胁迫可溶性糖含量较小且差异不明显,中度胁迫和重度胁迫下数值较大,差异明显,重度胁迫下数值为对照组3倍以上,说明中度和重度胁迫对植株造成严重伤害,植株产生更多可溶性糖来维持细胞渗透势,缓解由胁迫造成生理代谢不平衡。可溶性淀粉含量随土壤含水量减少而减少,整个试验过程均表现为CK>LD>MD>SD,不同时期差异不显著,可溶性淀粉变化较可溶性糖小,CK和SD相差不足两倍,且变化趋势不明显。植株体内可溶性淀粉含量减小可能与淀粉水解酶、淀粉合成酶有关,淀粉水解产生更多可溶性糖。

表5 干旱胁迫下艾纳香不同时期可溶性糖和可溶性淀粉含量Table 5 Contents of B.balsamifera soluble sugar and soluble starch at different periods under drought stress(m g∙g-1FW)
游离脯氨酸具有较强亲水性,可维持稳定水环境,随水分胁迫加剧,植物体内逐渐增多游离脯氨酸含量,用以维持细胞渗透压平衡,减少水分胁迫伤害。由图1可知,各处理试验过程均表现为CK 3.4MDA和抗氧化系统 由图2可知,水分胁迫整个过程中,MDA不同处理间差异显著,仅胁迫中期和后期,CK组和LD组差异较小,可能是由于叶片经一段时间轻度胁迫处理后,植株已产生抵抗轻度胁迫生理机制。MD和SD处理下,土壤水分状况过低,无法满足植株生长需要,植株产生大量膜脂过氧化物丙二醛,说明植物细胞膜受到严重伤害。整个试验过程对照组和轻度干旱胁迫MDA含量变化较小,而中度和重度胁迫含量变化大,随试验时间延长,各处理值均适当增加,这可能是因为在试验中除水分外,高温胁迫也对植物产生一定影响。 图1 干旱胁迫下不同时期艾纳香游离脯氨酸变化Fig.1 Changes of B.balsamifera Pro at different periods under drought stress 图2 干旱胁迫下不同时期艾纳香MDA含量变化Fig.2 Changes of B.balsamifera MDA content at different periods under drought stress SOD活性变化与植物抗逆反应及衰老进程关系密切,几乎所有环境胁迫均可诱导其活性增加。 由图3可知,SOD活性随土壤水分含量减小而增加,各处理间差异显著,各处理随水分胁迫时间延长变化小。 由图4可知,CAT含量随胁迫程度增加而增加,各处理间差异显著;随水分胁迫时间延长,各处理间数值略有变化,但规律不一致,总体随胁迫时间延长酶活增强。 由图5可知,CK组POD酶活性与MD、SD处理间差异显著,CK和LD差异不显著,说明轻度胁迫对艾纳香叶片POD酶活影响不显著,由POD酶活可解释轻度干旱对艾纳香叶片损伤较小,与丙二醛试验结果一致。 图3 干旱胁迫下不同时期艾纳香超氧化物歧化酶(SOD)活性变化Fig.3 Changes of B.balsamifera SOD activity at different periods under drought stress 图4 干旱胁迫下艾纳香不同时期过氧化氢酶(CAT)活性变化Fig.4 Changes of B.balsamifera CAT activity at different periods under drought stress 图5 干旱胁迫下艾纳香不同时期过氧化物酶(POD)活性变化Fig.5 Changes of B.balsamifera POD activity at different periods under drought stress 3.5根系活力 由表6可知,随土壤含水量减少,胁迫加重,艾纳香根系活力呈先增后减趋势,胁迫初期轻度干旱时根系活力最强,对照组最低,整个干旱过程中两处理值均为最大值和最小值。由于艾纳香植株通过增加根系活力维持轻度缺水状况,保持植物正常生长;但中度和重度胁迫时,根系活力有所下降,因为严重缺水时植株根系受到不同程度破坏,活力降低,无法满足地上部分对水分需求。 表6 干旱胁迫下艾纳香不同时期根系活力Table 6 Root activity of B.balsamifera at different periods under drought stress (mg·g-1FW·h-1) 轻度干旱胁迫下,缺水对艾纳香影响不显著,植株通过可溶性糖和游离脯氨酸含量增加、可溶性淀粉含量减少、抗氧化酶活性增加、根系活力增强等方式缓冲轻度缺水;中度和重度胁迫下,植物细胞受损、根系活力减弱、植株生长缓慢、艾纳香叶片变薄、叶绿素含量增多维持净光合速率,通过增加可溶性糖、可溶性淀粉等渗透物质维持细胞渗透势平衡,降低水分胁迫造成的细胞受损,通过丙二醛和抗氧化酶清除过氧化氢等有害物质保持细胞活性;中度干旱胁迫下,植株虽可生长,但长势不良;重度胁迫下,艾纳香叶片掉落甚至植株死亡。研究发现艾纳香在试验中期各指标反应明显,后期缓和。因为贵阳5~6月份气温较低,并非艾纳香生长旺盛期,雨水充足空气中水分含量较高,对土壤水分要求不严格。进入生长旺盛期后,对土壤水分要求较高,产生应对干旱胁迫机制,防止植物死亡。本研究认为艾纳香作为多年生草本植物,叶面积较大,幼苗耐旱性较差,水分需求量大。 本研究发现艾纳香幼苗耐旱性差,与江维克结论不一致[15],可能与品种不同有关。江维克试验材料是野生成熟艾纳香,而本试验选取人工栽植艾纳香幼苗,对水分生理适应性上不如野生艾纳香,一般植株在幼苗期对环境胁迫适应性较差。本研究结论与邓春暖等关于植物生理生态特征与水分条件相适应结论一致[16],与魏媛等关于植物在水分胁迫时保持较高根系活力是一种抵御干旱生理机制结论一致[17],与黄萍等关于小花山桃草叶绿素总含量随干旱胁迫加剧而增加研究结论一致[18]。植物在干旱胁迫下,CAT、POD、SOD活性变化规律多表现为随胁迫程度和时间增加而增加,艾纳香表现类似结果[19-21]。 艾纳香作为提取天然冰片主要植物,其左旋龙脑成分含量与经济价值直接相关。水分对艾纳香植物影响较大,渗透物质与抗氧化系统均差异显著,而水分差异对艾纳香左旋龙脑化学成分产量与质量影响尚不明确。已有研究显示,不同水分处理会对药用植物有效成分含量产生影响,但不同植物差异显著[20,22-23]。试验发现,艾纳香与烤烟具有多方面一致性,叶片具腺毛,整株植物含分泌细胞,分泌细胞含量与经济价值存在相关性[24-26],今后研究中可借鉴烤烟研究方法进一步完善艾纳香植株特性研究,为艾纳香在贵州大规模栽培种植提供理论支持。 [1]范苏鲁,苑兆和,冯立娟,等.干旱胁迫对大丽花生理生化指标的影响[J].应用生态学报,2011,22(3):651-657. [2]Ricardo A.Plant responses to drought stress-From morphological to molecular features[M].Berlin Heidelberg:Springer-Verlag, 2012. [3]王世杰,李阳兵.喀斯特石漠化研究存在的问题与发展趋势[J].地球科学进展,2007,22(6):573-582. [4]张强,高歌.我国近50年旱涝灾害时空变化及监测预警服务[J].科技导报,2004(7):21-24. [5]中科院中国植物志编辑委员会.中国植物志(第75卷,第1分册)[M].北京:科学出版社,1979. [6]官玲亮,庞玉新,王丹,等.中国民族特色药材艾纳香研究进展[J].植物遗传资源学报,2012,13(4):695-698. [7]王篙,赵永恒,周毅生,等.艾纳香挥发油栓的制备工艺及体外溶出度研究[J].中国中药杂志,2014,39(10):1805-1810. [8]严启新,谭道鹏,康晖,等.艾纳香中的黄酮类化学成分[J].中国实验方剂学杂志,2012,18(5):86-89. [9]黄永林,朱廷春,文永新,等.艾纳香化学成分的分离与鉴定[J].广西植物,2010,30(4):560-562. [10]夏程子,彭金咏,赵智,等.气相色谱法测定艾纳香中左旋龙脑的研究[J].中成药,2011,33(12):2188-2190. [11]梁会,曹佩雪,邱净英,等.艾纳香化学成分的研究[J].时珍国医国药,2011,22(2):308-309. [12]国琳,张劲松,孟平,等.山茱萸光合及水分利用特征对土壤水分胁迫的响应[J].河北农业大学学报,2010,33(1):21-26. [13]邹琦.植物生理学试验指导[M].北京:中国农业出版社,2000. [14]张立军,樊金娟.植物生理学试验教程[M].北京:中国农业大学出版社,2007. [15]江维克,周涛,何平,等.贵州红水河地区艾纳香植物资源调查及其保护策略[J].贵州农业科学,2010,38(8):1-4. [16]邓春暖,章光新,潘响亮.不同淹水周期对芦苇光合生理的影响机理[J].云南农业大学学报,2012,27(5):640-645. [17]魏媛,喻理飞.西南喀斯特地区构树生态经营技术体系初析[J].浙江林业科技,2010,30(3):29-33. [18]黄萍,贾东坡,袁志良,等.外来杂草小花山桃草对干旱胁迫的生理响应[J].东北农业大学学报,2011,42(4):102-106. [19]刘亚丽,王庆成,刘爽,等.水分胁迫对脂松苗木针叶质膜透性和保护酶活性的影响[J].植物研究,2011,31(1):49-55. [20]李霞,阎秀峰,于涛.水分胁迫对黄檗幼苗保护酶活性及脂质过氧化作用的影响[J].应用生态学报,2005,16(12):2353-2356. [21]张雁霞,李萍,刘玉皎.西北地区蚕豆苗期干旱胁迫下表型差异性与抗旱性研究[J].东北农业大学学报,2015(9):30-37. [22]谭勇,梁宗锁,董娟娥.水分胁迫对菘蓝生长发育和有效成分积累的影响[J].中国中药杂志,2008,33(1):19. [23]顾永华,冯煦,夏冰.水分胁迫对茅苍术根茎生长及挥发油含量的影响[J].植物资源与环境学报,2008,17(3):23. [24]木漾,齐绍武,李跃,等.干旱胁迫对烤烟的影响机理研究进展[J].作物研究,2012,26(2):193-196. [25]陈洁宇,周冀衡,邓小刚,等.干旱胁迫对不同育苗方式烤烟生长和生理生化特性的影响[J].烟草科技,2011(8):84-88. [26]尚晓颖,刘化冰,张小全,等.干旱胁迫对不同烤烟品种根系生长和生理特性的影响[J].西北植物学报,2010,30(2):357-361. Response on physiological of Blumea balsamifera L.DC.seedling to drought in summer/LI Lixia1,LIU Jiming1,CHI Xin1,LIAO Xiaofeng2,LUO Chang1,Xiong Xue1(1.School of Forestry,Guizhou University,Guiyang 550025,China;2.Institute of Mountain Resources, Guizhou Academy of Sciences,Guiyang 550001,China) This study investigated the response mechanism of drought of Blumea balsamifera with one-year-old plants,to determine the optimum cultivation conditions suitable for B.balsamifera.Since May 2014 started studying B.balsamifera fourth consecutive months of four drought treatment experiments to analyze the change of physiological indices under different drought stress.The results showed that B.balsamifera grew best in control experiment in spite of MDA content increased slightly.B.balsamifera maximize using limited water instead of being impacted by water shortages excessively under low drought stress, plants against mild water shortage effectively by methods such as increasing soluble sugar and free proline content,decreasing soluble starch slightly,and increasing antioxidant enzyme activity and root vitality.Plant cells had been damaged by increased content of MDA and root activity had been reduced leading to bad and slow growth under moderate and severe stress.On one hand,B.balsamifera increasing osmotic substance of soluble sugar and soluble starch to maintain the balance of cell osmotic potential and to reduce cell damage caused by water stress.On the other hand,plants kept cell activity by antioxidant enzymes remove harmful substances of hydrogen peroxide.In moderate drought stress,although plants could be grown but it had been growing unhealthy phenomenon.B.balsamifera had appeared severe withered and death in severe drought.Adequate moisture should be paid great attention to the process of B.balsamifera seedling management in summer. Blumea balsamifera;drought stress;drought tolerance;physiological response S567.239 A 1005-9369(2016)06-0018-08 2016-03-16 贵州省林业厅重大项目(黔林科合[2010]重大04号);贵州省科学技术基金项目(黔科合J字[2013]2169号) 李丽霞(1992-),女,硕士研究生,研究方向为生态学。E-mail:18798006671@163.com 刘济明,教授,博士生导师,研究方向为野生动植物保护与利用和植物生态学。E-mail:karst0623@163.com

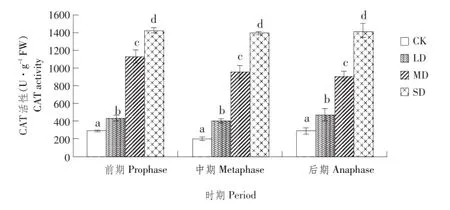
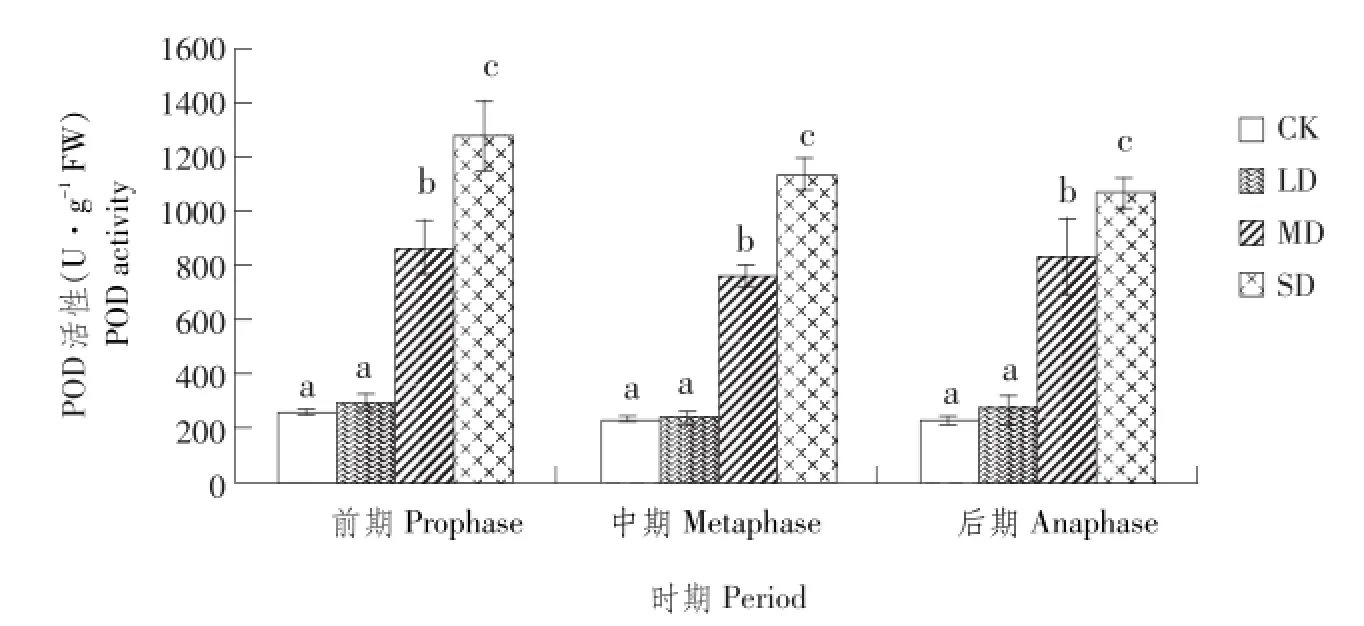
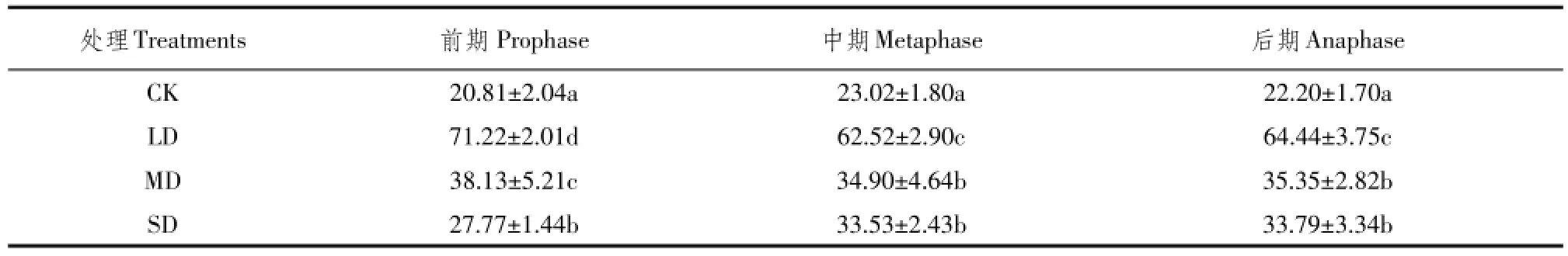
4 讨论与结论
