生殖生长期温度对大豆各器官维生素E及其组分含量影响
2016-10-26刘焕成曹广禄韩英鹏李文滨赵宏伟东北农业大学农学院哈尔滨50030哈尔滨市农业科学院粮食经济作物研究分院哈尔滨5008
刘焕成,曹广禄,韩英鹏,李文滨,赵宏伟*(.东北农业大学农学院,哈尔滨50030;.哈尔滨市农业科学院粮食经济作物研究分院,哈尔滨5008)
生殖生长期温度对大豆各器官维生素E及其组分含量影响
刘焕成1,2,曹广禄2,韩英鹏1,李文滨1,赵宏伟1*
(1.东北农业大学农学院,哈尔滨150030;2.哈尔滨市农业科学院粮食经济作物研究分院,哈尔滨150028)
研究以α-生育酚含量水平不同的两个大豆品种北丰9(高)和龙选1号(低)为试验材料,在大豆生殖生长期利用光照培养箱以三个温度处理(28~34℃、22~28℃、16~22℃),研究不同温度对大豆茎、叶、荚皮、籽粒维生素E含量影响。结果表明,随温度升高,大豆茎中α-生育酚、γ-生育酚和维生素E总含量降低(P<0.01),叶片中α-生育酚和维生素E总含量降低(P<0.01),籽粒中γ-生育酚、δ-生育酚和维生素E总含量降低(P<0.01),而籽粒中α-生育酚增加(P<0.01)。中等温度(22~28℃)更有利于大豆荚皮中δ-生育酚和VE总含量积累,而低温(16~ 22℃)不利于α-生育酚和γ-生育酚积累。高温条件能提高α-生育酚从叶、茎和荚皮向籽粒中转化运输率(P< 0.01),有利于大豆籽粒中α-生育酚含量积累。
大豆;温度;维生素E;影响
网络出版时间2016-6-17 15:21:45[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160617.1521.002.htm l
刘焕成,曹广禄,韩英鹏,等.生殖生长期温度对大豆各器官维生素E及其组分含量影响[J].东北农业大学学报,2016,47(6):8-17.
Liu Huancheng,Cao Guanglu,Han Yingpeng,et al.Effect of temperature during reproductive stages on contents of vitamin E and components in different organs of soybean[J].Journal of Northeast Agricultural University,2016,47(6):8-17.(in Chinese with English abstract)
Key words:soybean;temperature;vitamin E;effect
维生素E(VE)具有维持人和动物正常繁殖生理功能,又称生育酚。维生素E由α-生育酚(αtocopherol/α-Toc)、β-生育酚(β-tocopherol)、γ-生育酚(γ-tocopherol/γ-Toc)、δ-生育酚(δ-to⁃copherol/δ-Toc)及相应生育三稀酚八个异构体组成。生育酚是一种重要抗氧化剂,生物活性顺序为α>β>γ>δ。各生育酚在不同植物中含量不同,在大豆籽粒中含量为γ>δ>α>β,β-生育酚大豆中含量低,一般忽略不计[1]。α-生育酚生物活性是γ-生育酚活性10倍,且更易被稳定吸收并保留在细胞中,维生素E含量目前以α-生育酚含量为标准[2]。维生素E只在光合生物中合成,包括植物、藻类和蓝藻,是人类和动物日常必需营养物质[3-4]。医学证据表明,每日摄入400 IU生育酚可降低动脉粥样硬化、癌症、帕金森症、心脑血管、阿尔茨海默氏病等疾病风险[1,5-6]。
目前,国际上不断扩展维生素E基础理论及其在食品、医药、保健、化妆等领域研究与应用。维生素E有天然和人工合成两种,天然维生素E主要存在于油料作物中,包括大豆、向日葵、油菜等均含有丰富生育酚。研究显示人工合成维生素E生物活性仅为天然的50%~74%[7]。因此,提高油料作物中维生素E含量意义重大。大豆作为油料作物,是天然维生素E主要来源,也成为维生素E研究与应用主要对象。
生育酚存在于高等植物茎、叶、花瓣和种子中[5,8]。其合成一方面受气象条件、土壤养分、海拔等生态因子共同作用[9-11],另一方面,作物栽培管理对生育酚含量有一定影响[12]。大豆生殖生长期是籽粒形成阶段,各类营养物质不断从荚皮、茎、叶等营养器官向籽粒运输,是大豆籽粒形成重要时期。Britz等研究表明,结荚初期至完熟期气温对大豆籽粒α-生育酚含量有显著影响[11-13]。然而,温度对大豆其他器官维生素E含量影响尚未见报道,本研究主要探讨生殖生长期温度对大豆籽粒、荚皮、茎、叶等器官维生素E含量影响,以期为大豆品种区域化种植提供理论依据。
1 材料与方法
1.1供试大豆材料
2014年在哈尔滨市松北区哈尔滨市农业科学院试验田种植大豆,经筛选选取北丰9和龙选1号两个大豆品种,北丰9的α-生育酚、γ-生育酚、δ-生育酚和维生素E总含量分别为43.7、324.4、192.4和560.5μg·g-1,龙选1号分别为13.1、220.9、104.9和338.9μg·g-1。
1.2试验方法
2015年5月10日两品种在室外花盆中各种100盆,20行排列,每行10盆。花盆规格为高13 cm,上沿直径13 cm,底部直径10 cm。始荚初期为避免边际优势影响,选取中央区域繁茂度一致盆栽转移至不同温度光照培养箱,每个温度处理选取15盆。光照培养箱设3个温度梯度,即28~34℃、22~28℃、16~22℃,高温16 h,低温8 h。光照强度15 000 lx,16 h光照,8 h黑暗。每个温度处理分别在始粒期(R5)、鼓粒期(R6)和完熟期(R8)取样,每次取样4株,取样后放置-80℃冰箱保存。试验过程中,北丰9和龙选1号样品全部取回。取样后,分别检测茎、叶、荚皮、籽粒部位α-生育酚、γ-生育酚、δ-生育酚和维生素E总含量。
1.3测定方法
1.3.1样品提取和萃取
大豆茎、叶、荚皮、籽粒65℃温度下烘箱中烘干后磨成粉,称取0.1000 g,加入0.0500 g抗坏血酸和3 m L 80%乙醇,震荡混匀10 s后置于超声波清洗器中提取15min,提取8min时震荡混匀10 s 1次,提取完成后13 000 r·min-1离心15min,上清液经0.45μm滤膜过滤后在设定色谱条件下测定。
1.3.2维生素E定性和定量
利用高压液相色谱技术(HPLC),采用外标法对生育酚各异构体作定性和定量分析。以α-生育酚、γ-生育酚、δ-生育酚标样保留时间定性,以样品生育酚峰面积代入回归方程定量。维生素E总含量为α-生育酚、γ-生育酚和δ-生育酚含量之和。
色谱条件:色谱柱购自DIKMA公司,色谱柱填料为Diamonsil(TM)钻石C18,5μm,柱规格为250 mm×4.6mm;荧光检测器激发波长295 nm,发射波长330 nm;流动相为甲醇,流速1.5 mL·min-1;柱温40℃;进样量20μL;检测时间长度10min[14-15]。
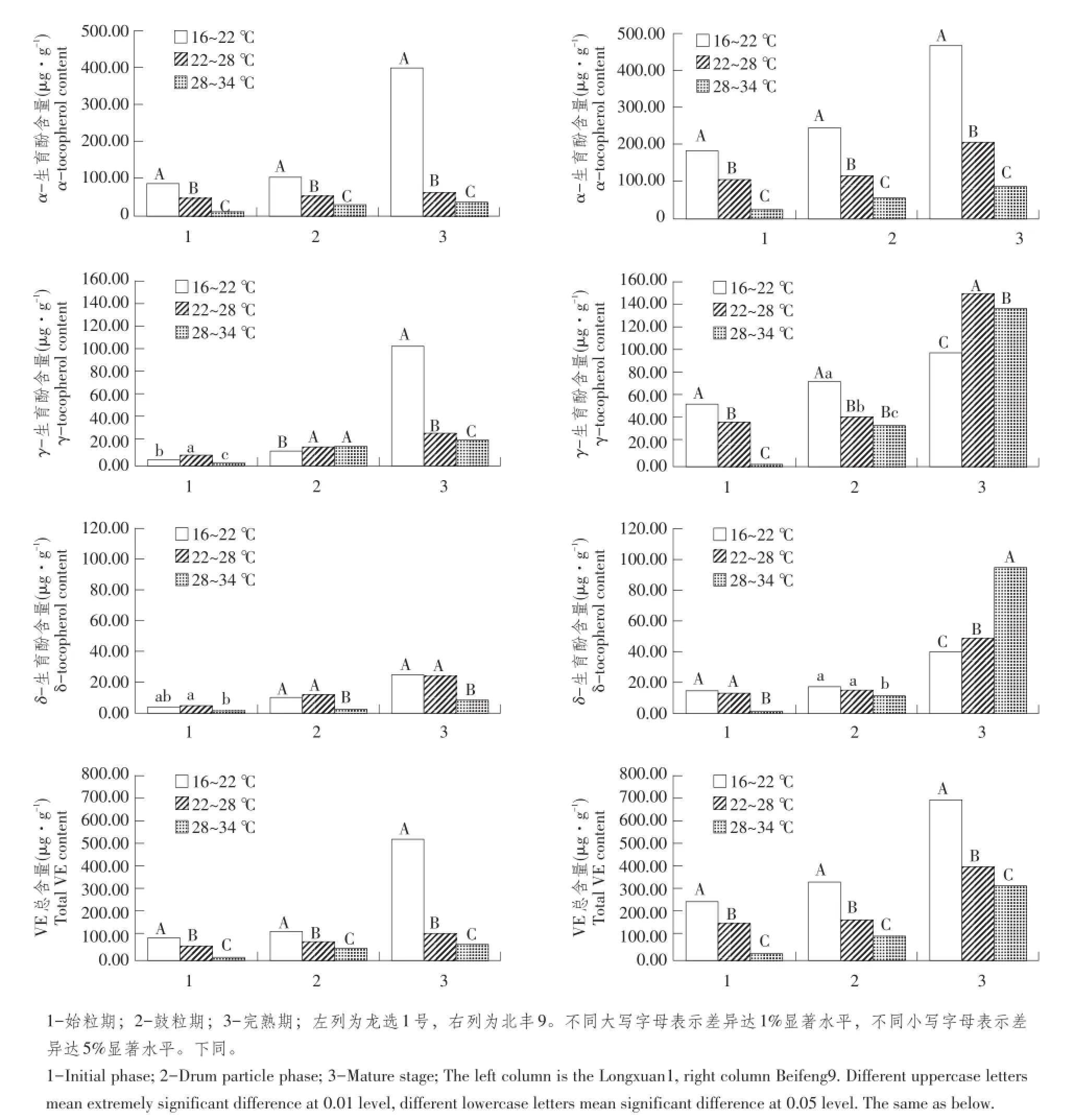
图1 温度对大豆叶片维生素E及其组分含量影响Fig.1 Effects of temperature stress on contents of vitamin E and its components in soybean leaves
1.4数据分析
采用软件DPS 9.50新复极差法作多重比较分析,Excel2010软件绘图。
2 结果与分析
2.1温度对大豆叶总维生素E及其组分含量影响
温度对大豆叶总维生素E及其组分含量影响见图1。
如图1所示,不同温度条件下,两供试大豆品种叶片在始粒期、鼓粒期和完熟期3个不同时期α-生育酚和维生素E总含量均随处理温度升高而降低。多重比较分析显示,不同温度处理间两者含量均差异极显著(P<0.01)。而γ-生育酚和δ-生育酚含量不同生育期表现出品种间差异性,尤其是始粒期差异显著。
始粒期龙选1号γ-生育酚和δ-生育酚含量顺序为中温(22~28℃)>低温(16~22℃)>高温(28~ 34℃),北丰9γ-生育酚含量随温度升高而降低。其中,龙选1号γ-生育酚含量不同温度处理间差异显著(P<0.05),北丰9γ-生育酚含量不同温度处理间差异极显著(P<0.01)。即始粒期两个品种γ-生育酚含量在高温处理(28~34℃)条件下均显著低于其他两个温度(16~22℃和22~28℃)。
鼓粒期龙选1号γ-生育酚含量随温度升高而升高,北丰9γ-生育酚含量随温度升高而降低。北丰9γ-生育酚含量不同温度处理间差异显著(P< 0.05);鼓粒期龙选1号δ-生育酚含量顺序为中温(22~28℃)>低温(16~22℃)>高温(28~34℃),北丰9δ-生育酚含量随温度升高而降低。鼓粒期两个品种在高温处理条件下δ-生育酚含量均显著低于其他两个温度(龙选1号P<0.05,北丰9 P<0.01)。
完熟期龙选1号γ-生育酚和δ-生育酚含量完熟期随温度升高而降低;北丰9γ-生育酚含量顺序为中温(22~28℃)>高温(28~34℃)>低温(16~ 22℃),而δ-生育酚含量随温度升高而升高,龙选1号δ-生育酚含量高温处理极显著低于其他两个温度,且两品种γ-生育酚含量和北丰9δ-生育酚含量3个温度处理间均表现为差异极显著(P<0.01)。
2.2温度对大豆茎总维生素E及其组分含量影响
不同温度条件下,大豆茎中维生素E含量各生育期均较低,各生育酚异构体含量为0.41~15.68 μg·g-1,总维生素E含量为0.64~26.62μg·g-1,完熟期检测含量较高。生育酚含量顺序均为α>γ>δ。3个温度处理下α-生育酚含量均值与γ-生育酚和δ-生育酚含量均值比分别为1.32和3.20。
如图2所示,不同温度处理下,两供试大豆品种茎完熟期α-生育酚、γ-生育酚和维生素E总含量均随温度升高而降低,多重比较分析显示,不同温度处理间含量均极显著(P<0.01)。两供试大豆品种茎完熟期δ-生育酚含量在中等温度处理(22~ 28℃)均最高,并与高温和低温条件处理(28~34℃和16~22℃)差异极显著(P<0.01)。但鼓粒期和始粒期温度影响品种间表现不同。
鼓粒期,两供试大豆品种α-生育酚和维生素E总含量低温处理(16~22℃)均极显著高于其他两个温度处理(P<0.01)。鼓粒期γ-生育酚和δ-生育酚含量受温度影响结果不同。鼓粒期龙选1号γ-生育酚含量顺序为高温>低温>中温(高温与中温间表现显著差异),北丰9则随温度升高而降低,达极显著(P<0.01)。鼓粒期龙选1号和北丰9δ-生育酚含量顺序为低温>高温>中温,其中龙选1号各温度处理间无差异性,北丰9不同温度处理间差异极显著(P<0.01)。
始粒期,两供试品种α-生育酚含量低温处理下最高,极显著高于其他两个温度处理(P<0.01)。此时温度对其他组分影响表现为,高温降低γ-生育酚和维生素E总含量,但增加龙选1号δ-生育酚含量,而对北丰9δ-生育酚含量影响最高和最低温度处理无显著差异。
2.3温度对大豆荚皮总维生素E及其组分含量影响
始粒期和完熟期两供试大豆品种荚皮中维生素E含量较低,α-生育酚、γ-生育酚和δ-生育酚含量范围为0.33~8.31μg·g-1。完熟期后,两供试大豆品种荚皮中α-生育酚、γ-生育酚、δ-生育酚和VE总含量平均为3.57、12.15、9.36和25.08μg·g-1。
如图3所示,两供试品种α-生育酚含量始粒期顺序均为低温>高温>中温,并表现极显著差异(P<0.01)。但始粒期和完熟期温度影响品种间表现不同,即始粒期龙选1号高温处理α-生育酚含量最高,北丰9低温处理最高,并与其他两温度处理达极显著(P<0.01)。完熟期龙选1号α-生育酚含量顺序为中温>低温>高温,处理间达到极显著(P< 0.01)。北丰9低温处理α-生育酚含量极显著低于其他两个温度处理,中、高温处理间差异不显著。两供试品种γ-生育酚含量不同时期也表现品种间差异。γ-生育酚含量总体表现为,两供试品种始粒期高温处理极显著高于其他两个温度处理(P< 0.01)。鼓粒期龙选1号随温度升高γ-生育酚含量增加,且差异极显著(P<0.01)。而鼓粒期北丰9随温度升高γ-生育酚含量降低,差异极显著(P< 0.01)。完熟期,龙选1号γ-生育酚含量顺序为中温>低温>高温,不同温度处理间差异极显著(P< 0.01)。而北丰9γ-生育酚含量低温处理极显著高于其他两个温度处理(P<0.01),中、高温处理间差异不显著。两个供试大豆品种多重比较分析显示,始粒期两个供试品种荚皮δ-生育酚和VE总含量高温极显著高于其他两个温度处理(P<0.01)。完熟期中等温度荚皮δ-生育酚和VE总含量极显著高于其他两个温度(P<0.01)。但在鼓粒期两个供试品种δ-生育酚和VE总含量受温度影响表现品种差异,即龙选1号随温度升高δ-生育酚和VE总含量增加,而北丰9相反,两品种不同温度处理间差异极显著(P<0.01)。
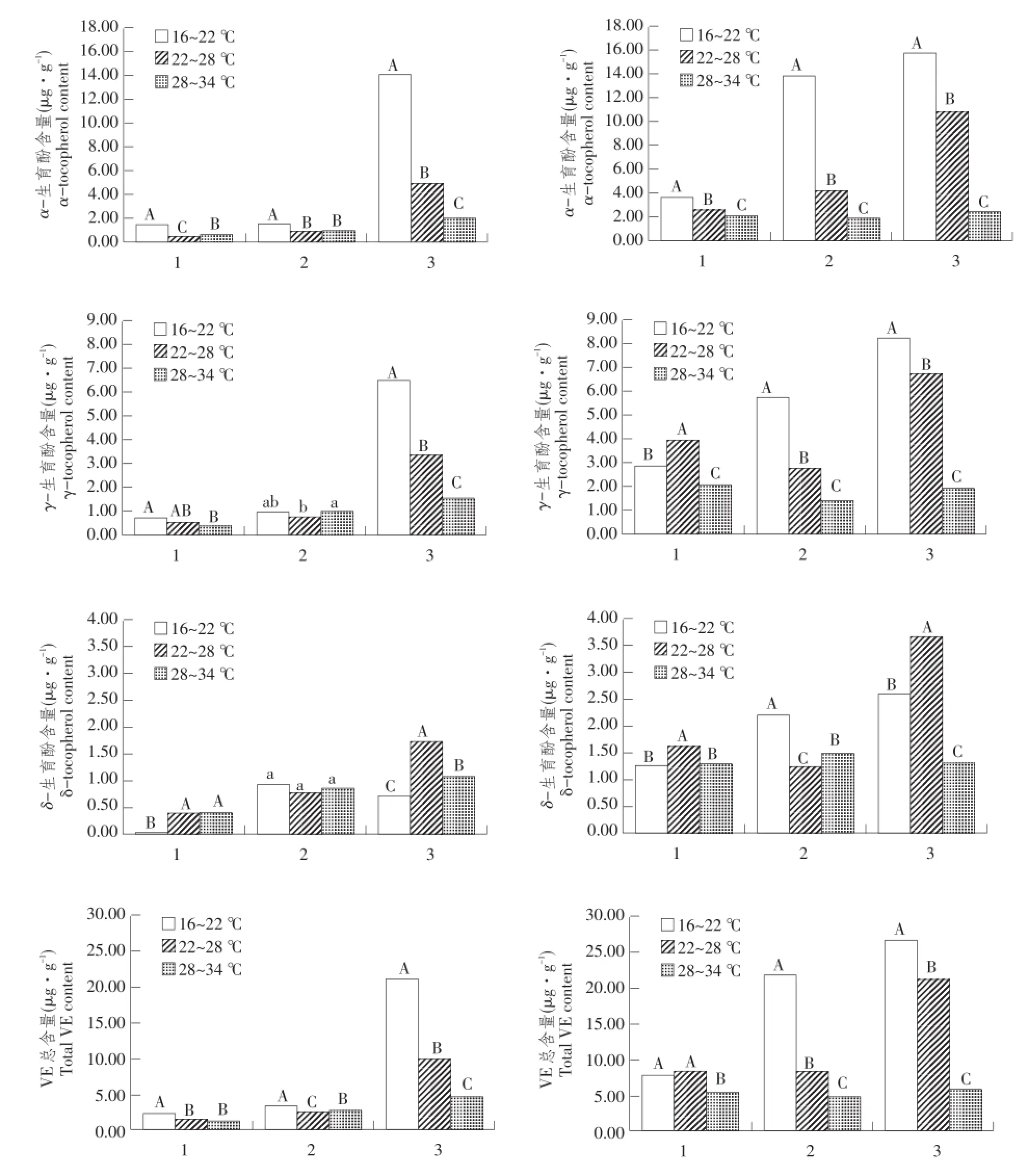
图2 温度对大豆茎维生素E及其组分含量影响Fig.2 Effects of temperature stress on contents of vitam in E and its components in soybean stems
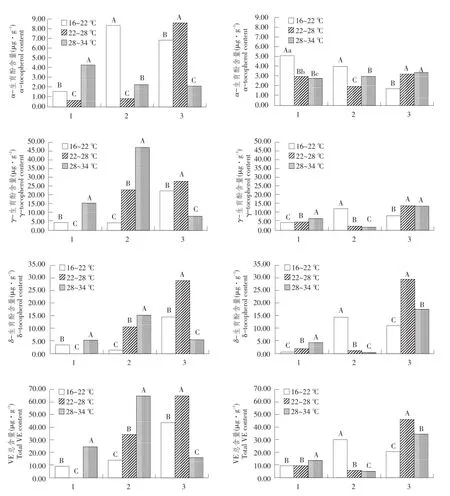
图3 温度对大豆荚皮维生素E及其组分含量影响Fig.3 Effects of temperature stress on contents of vitamin E and its components in soybean pod walls
2.4温度对大豆籽粒总维生素E及其组分含量影响
如图4所示,不同温度处理条件下,两个供试大豆品种籽粒在始粒期、鼓粒期和完熟期3个不同时期α-生育酚含量均随温度升高而增加,多重比较分析显示,完熟期两个品种不同温度处理间α-生育酚含量达极显著(P<0.01),鼓粒期龙选1号不同温度处理间α-生育酚含量达极显著(P<0.01),北丰9达显著(P<0.05),而始粒期龙选1号差异不显著,北丰9在高温与低温处理间达显著差异(P< 0.05)。不同温度处理条件下,两个供试大豆品种籽粒在始粒期、鼓粒期和完熟期3个不同时期γ-生育酚、δ-生育酚和维生素E总含量均随温度升高而降低,多重比较分析显示,始粒期、鼓粒期和完熟期不同温度处理间含量均差异显著(P<0.01)。
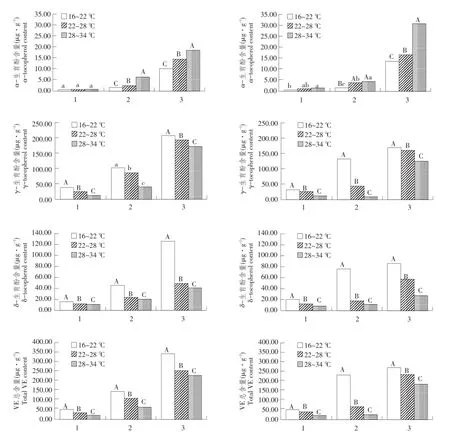
图4 温度对大豆籽粒维生素E及其组分含量影响Fig.4 Effects of temperature stress on contents of vitamin E and its components in soybean seeds
2.5大豆各器官维生素E含量比较
完熟期收获后,大豆各器官维生素E 3个温度处理平均含量水平差异较大。各器官α-生育酚含量顺序为叶>籽粒>茎>荚皮,γ-生育酚和δ-生育酚含量顺序为籽粒>叶>荚皮>茎。如表1所示,叶中α-生育酚含量是籽粒的9.79倍,且叶片与籽粒、茎、荚皮中α-生育酚含量均达极显著(P<0.01)。
为评估大豆植株源到库维生素E转化情况,本研究分析不同温度处理条件下完熟期籽粒与叶片、茎、荚皮α-生育酚含量比值。结果显示(见表2),两品种随处理温度升高籽粒/叶、籽粒/茎、籽粒/荚皮α-生育酚含量比值均升高,多重比较分析显示,不同温度处理间差异水平均达极显著(P<0.01)。
如表3所示,始粒期至完熟期是大豆籽粒维生素E不断积累过程,各生育酚含量不断提高,完熟期达到峰值。α-生育酚、γ-生育酚、δ-生育酚和维生素E总含量平均值3个温度处理不同时期差异极显著(P<0.01)。

表1 大豆各器官维生素E及其组分含量多重比较分析Table1 Multiple comparative analysis on contents of vitamin E and its components in different organs of soybean(μg·g-1)

表2 大豆籽粒/叶、籽粒/茎、籽粒/荚皮α-生育酚含量比值多重比较分析Table 2 Multiple comparative analysis onα-tocopherol ratio in seed/leaf,seed/stem,seed/pod-wall of soybean
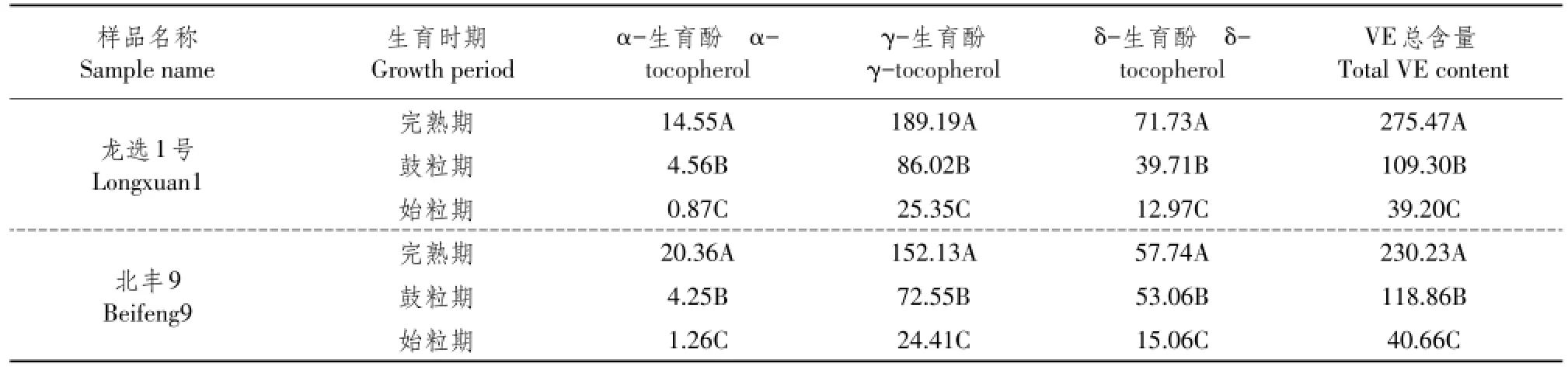
表3 不同生育期大豆籽粒维生素E含量多重比较分析Table 3 Multiple comparative analysis of vitamin E con tent in soybean seeds at different stages(μg·g-1)
3 讨论
维生素E生化合成反应发生在高等植物叶绿体中[16]。大豆叶片作为光合作用器官,是维生素E主要合成场所。本试验结果显示,大豆叶片α-生育酚和维生素E总含量在始粒期、鼓粒期和完熟期3个籽粒形成时期均随温度升高而降低(P<0.01)。鼓粒期,高温处理(28~34℃)条件下δ-生育酚含量显著低于其他两温度处理(16~22℃和22~28℃)。始粒期,高温处理(28~34℃)条件下γ-生育酚显著低于其他两温度处理(16~22℃和22~28℃)。生育酚生化合成途径最后反应中,2-甲基-6-叶绿醇苯醌(MPBQ)在2-甲基-6-叶绿醇苯醌甲基转移酶(MP⁃BQ甲基转移酶)催化下生成2,3-二甲基-6-叶绿醇苯醌(DMPBQ),MPBQ和DMPBQ在生育酚环化酶催化下分别生成δ-生育酚和γ-生育酚,γ-生育酚甲基转移酶催化下分别生成β-生育酚和α-生育酚[17]。α-生育酚是维生素E合成途径最终产物,影响其含量因素相对较少,两供试大豆品种本试验中均易受温度影响。而γ-生育酚和δ-生育酚为维生素E合成途径过程中间产物,除温度外,生化合成过程中影响含量因素复杂,无法评估温度对其在大豆中含量影响。大豆总维生素E及其组分含量是多基因控制的数量遗传性状[18],龙选1号和北丰9分别属于维生素E含量低和高的大豆品种,控制维生素E含量和生化合成酶类相关基因差异较大,造成维生素E含量对温度敏感度差异,所以温度对维生素E含量影响存在品种差异。
茎与荚皮是大豆主要养分运输器官,兼有少量光合作用,生育酚主要来源于叶片输送产物及自身合成,但大豆茎与荚皮中维生素E含量均极显著低于叶片和籽粒。大豆茎和荚皮内生育酚含量也直接或间接受温度影响。完熟期,大豆茎内α-生育酚、γ-生育酚和维生素E总含量均随温度升高而降低(P<0.01),中等温度(22~28℃)有利于大豆荚皮中δ-生育酚和VE总含量积累,而低温(16~ 22℃)不利于α-生育酚和γ-生育酚在荚皮中积累。鼓粒期,大豆茎内低温处理(16~22℃)条件下α-生育酚和VE总含量极显著高于其他两温度处理。大豆荚皮α-生育酚不同温度含量顺序为低温>高温>中温,不同温度处理间差异极显著(P< 0.01)。始粒期,大豆茎内低温处理(16~22℃)条件下α-生育酚含量极显著高于其他两个温度处理,高温处理(28~34℃)有利于γ-生育酚、δ-生育酚和VE总含量积累。本试验中始粒期和鼓粒期未得到与完熟期相同结论,可能是两时期取样时间点人为很难完全准确把握,加之大豆茎与荚皮VE含量较低,不可避免造成不同温度处理间生育酚含量人为误差较大。
大豆籽粒中α-生育酚含量在始粒期、鼓粒期和完熟期随处理温度升高而增加,在鼓粒期和完熟期不同温度处理间均表现为显著差异,但在始粒期无显著差异,原因是籽粒刚形成,即使在成熟籽粒中α-生育酚含量不高,造成数据分析不准确,而对于含量较高的γ-生育酚、δ-生育酚和VE总含量则无影响。结果显示,大豆籽粒中γ-生育酚、δ-生育酚和VE总含量在始粒期、鼓粒期和完熟期均随温度升高而降低。多重分析结果表明,不同温度处理间的γ-生育酚、δ-生育酚和VE总含量差异极显著(P<0.01)。同类研究表明,温度对籽粒中3种生育酚含量影响较大,温度升高促使α-生育酚含量增加,相反会促使γ-生育酚和δ-生育酚含量降低,与本研究结果一致;但温度对VE总含量无显著影响,与本研究结果不同[11,15,19]。
根据源、流、库功能性划分,叶片是主要生育酚合成器官,茎和荚皮是生育酚主要运输器官,大豆籽粒是最终生育酚主要贮藏器官。本试验对大豆籽粒与叶片、茎、荚皮α-生育酚含量比值作比较分析,结果显示,籽粒/叶、籽粒/茎、籽粒/荚皮均随处理温度升高而升高(P<0.01)。结果表明,随处理温度升高,源和流向库的α-生育酚转化率提高。叶片和茎α-生育酚含量随温度升高而降低,大豆籽粒α-生育酚含量随温度升高而增加。另外,大豆叶片α-生育酚含量极显著高于茎和荚皮,叶片对籽粒α-生育酚含量增加可能贡献更大。目前研究显示,植物生长阶段在高光照[20-21]、干旱[19,22]、高盐[23]、重金属[24]和低温[25-26]条件下,生育酚生化合成发生改变。温度升高对生育酚合成有较大影响:一方面,温度升高会促使γ-生育酚和δ-生育酚向下级产物α-生育酚和β-生育酚合成,或抑制上级产物DMPBQ和MPBQ向γ-生育酚和δ-生育酚合成。如果此假设成立,则温度升高造成γ-生育酚和δ-生育酚自身合成减少,并向下级产物合成,致使含量降低,而维生素E总含量减少主要源于γ-生育酚和δ-生育酚自身合成受到抑制。温度对生育酚生化合成影响虽发生在光合作用器官—大豆叶片、茎和荚皮中,但是对籽粒生育酚含量间接影响一致。温度对生育酚合成关键基因表达的影响等假设,需基因表达研究进一步验证。
大豆叶、茎、荚皮和籽粒各器官生育酚含量存在差异。各器官α-生育酚含量顺序为叶>籽粒>茎>荚皮,γ-生育酚和δ-生育酚含量顺序为籽粒>叶>荚皮>茎。其中,α-生育酚是生物活性最高生育酚,具有重要应用价值。本试验通过对完熟期大豆各器官α-生育酚比较分析可知,大豆叶片含有丰富α-生育酚,是维生素E主要异构体形式,含量是γ-生育酚和δ-生育酚2.27和5.17倍,极显著高于其他器官,是籽粒α-生育酚含量9.79倍。
大豆植株进入始粒期后籽粒中各生育酚含量不断提高(P<0.01),籽粒形成时期是α-生育酚、γ-生育酚、δ-生育酚和VE总含量积累关键时期。虽然利用基因工程技术可提高种子中α-生育酚含量[27],但大豆生产管理中,生殖生长阶段保证充足水分、养分和光照等前提下,在高温地区种植或提供高温条件,可能会获得α-生育酚含量较高大豆籽粒。
4 结论
a.温度升高会促使大豆籽粒α-生育酚含量提高,抑制γ-生育酚、δ-生育酚和维生素E总含量在籽粒中积累。
b.温度升高会降低大豆茎中α-生育酚、γ-生育酚和VE总含量,及大豆叶中α-生育酚和维生素E总含量。
c.中等温度(22~28℃)更利于大豆荚皮中δ-生育酚和VE总含量积累,而低温(16~22℃)不利于α-生育酚和γ-生育酚积累。
d.随处理温度升高,源和流向库的α-生育酚转化率提高。因此叶片和茎的α-生育酚含量随温度升高而降低,而大豆籽粒α-生育酚含量随温度升高而增加。
[1]Bramley PM,Elmadfa I,Kafatos A,etal.Vitamin E[J].Journal of the Science of Food and Agriculture,2000,80:913-938.
[2]Kamal E A,Appelqvist LA.The chemistry and antioxidant prop⁃erties of tocopherols and tocotrienols[J].Lipids,1996,31:671-701.
[3]Falk J,Munne BS.Tocochromanol functions in plants:Antioxida⁃tion and beyond[J].Journal of Experimental Botany,2010,61: 1549-1566.
[4]Mene S L,Della P D.Biosynthesis,regulation and functions of tochocromanols in plants[J].Plant Physiology and Biochemistry, 2010,48:301-309.
[5]Buring JE,Hennekens CH.Antioxidant vitamins and cardiovas⁃cular disease[J].Nutrition Reviews,1997,55:53-60.
[6]Christen W G,Gaziano JM,Hennekens CH.Design of physi⁃cians'health studyⅡ-a randomized trial of beta-carotene,vita⁃mins E and C,and multivitamins,in prevention of cancer,cardio⁃vascular disease,and eye disease,and review of results of com⁃pleted trials[J].Ann Epidemiol,2000,10(2):125-134.
[7]Clemente T E,Cahoon E B.Soybean oil:Genetic approaches for modification of functionality and total content[J].Plant Physiology 2009,151:1030-1040.
[8]Munne BS,Alegre L.The function of tocopherols and tocotrienols in plants[J].Critical Reviews in Plant Sciences,2002,21:31-57.
[9]李卫东,卢为国,梁慧珍,等.大豆籽粒维生素E含量与生态因子关系的研究[J].作物学报,2007,33(7):1094-1099.
[10]接伟光,张勇,蔡柏岩,等.磷素对不同大豆品种籽粒维生素E含量的影响[J].农业科学与技术(英文版),2011,12(12): 22237-22239.
[11]Britz S J,Kremer D F,Kenworthy W J.Tocopherols in soybean seeds:genetic variation and environmental effects in field-grown crops[J].Journal of the American Oil Chemists Society,2008,85: 931-936.
[12]Philippe S,Gilles T,Denis P,et al.Soybean tocopherol concentra⁃tions are affected by crop management[J].Agricultural and Food Chemistry,2010,58:5495-5501.
[13]Pratyusha C,Philippe S,Wucheng L.Effects of high temperature stress at different development stages on soybean isoflavone and tocopherol concentrations[J].Agricultural and Food Chemistry, 2011,59:13081-13088.
[14]王丽,宋志峰,纪锋,等.高效液相色谱法测定大豆中的维生素E含量及其与粗脂肪含量的线性回归分析[J].大豆科学,2006, 25(2):113-117.
[15]李国营,范志影,刘方,等.高效液相色谱法测定谷子种质资源中维生素E的研究[J].中国农业科技导报,2009,11(1):129-133.
[16]Li Y,Wang G,Hou R,et al.Engineering tocopherol biosynthetic pathway in lettuce[J].Biologia Plantarum,2011,55(3):453-460.
[17]Munne B S,Falk J.New insights into the function of tocopherols in plants[J].Planta,2004,218:323-326.
[18]张红梅,李海朝,文自翔,等.大豆籽粒维生素E含量的QTL分析[J].作物学报,2015,41(2):187-196.
[19]Steven J,Britz,Kremer D F.Warm temperatures or drought dur⁃ing seed maturation increase freeα-tocopherol in seeds of soy⁃bean(Glycine max[L.]Merr.)[J].Agricultural and Food Chemis⁃try,2002,50:6058-6063.
[20]Maeda H,Della P D.Tocopherol functions in photosynthetic or⁃ganisms[J].Current Opinion in Plant Biology,2007(10):260-265.
[21]Collakova E,Della Penna D.The role of homogentisate phytylt ransferase and other tocopherol pathway enzymes in the regula⁃tion of tocopherol synthesis during abiotic stress[J].Plant Physiol⁃ogy,2003,133:930-940.
[22]Liu X,Hua X,Guo J,et al.Enhanced tolerance to drought stress in transgenic tobacco plants overexpressing VTE1 for increased tocopherol production from Arabidopsis thaliana[J].Biotechnolo⁃gy Letters,2008,30:1275-1280.[23]Yusuf M A,Kumar D,Rajwanshi R,et al.Overexpression of gam⁃ma-tocopherol methyl transferase gene in transgenic Brassica jun⁃cea plants alleviates abiotic stress:Physiological and chlorophyll a fluorescence measurements[J].Biochim Biophys Acta,2010, 1797:1428-1438.
[24]Gajewska E,Skłodowska M.Relations between tocopherol,chloro⁃phyll and lipid peroxides contents in shoots of Ni-treated wheat [J].Journal of Plant Physiology,2007,164:364-366.
[25]Maeda H,Sage T L,Isaac G,et al.Tocopherols modulate extra⁃ p lastidic polyunsaturated fatty acid metabolism in Arabidopsis at low temperature[J].Plant Cell,2008,20:452-470.
[26]Song W,Maeda H,Della PD.Mutations of the ER to plastid lipid transporters TGD1,2,3 and 4 and the ER oleate desaturase FAD2 suppress the low temperature-induced phenotype of Arabidopsis tocopherol-deficient mutant vte2[J].The Plant Journal,2010,62: 4-18.
[27]Shintani D,Della P D.Elevating the vitamin E content of plants through metabolic engineering[J].Science,1998,282:2098-2100.
Effect of temperature during reproductive stages on contents of vitamin E and components in different organs of soybean
LIU Huancheng1,2,CAO Guanglu2,HAN Yingpeng1,LI Wenbin1,ZHAO Hongwei1(1.School of Agriculture,Northeast Agricultural University,Harbin 150030,China;2.School of the Grain and Economic Crops,Harbin Academy of Agricultural Science,Harbin 150028,China)
The paper was conducted to determine the effects of temperature in stems,leaves,pod walls and seeds under three temperature regimes(28-34℃,22-28℃and 16-22℃)with two soybean cultivars,Beifeng9 and Longxuan1,differing inα-tocopherol content.Results showed that with the increase of temperature,α-tocopherol,γ-tocopherol and total vitamin E contents in soybean stems,α-tocopherol and total vitamin E contents in soybean leaves,γ-tocopherol,δ-tocopherol and total vitamin E contents in soybean seeds were decreased(P<0.01),while α-tocopherol content in soybean seeds were increased(P< 0.01).Medium temperature(22-28℃)was the most advantageous for accumulation of δ-tocopherol and total VE contents in soybean pod walls,while low temperature(16-22℃)was not advantageous for accumulation ofα-tocopherol andγ-tocopherol contents.High temperature improved transport rate of theαtocopherol from leaves,stems and pod walls to seeds(P<0.01),which resulted in increasing the accumulation of the α-tocopherol content in soybean seeds.
soybean;temperature;vitamin E;effect
S565.1
A
1005-9369(2016)06-0008-10
2016-02-26
国家自然科学基金项目(31471517)
刘焕成(1978-),男,高级农艺师,博士研究生,研究方向为大豆生物技术。E-mail:liuhuancheng58@163.com
赵宏伟,教授,博士生导师,研究方向为作物生理与高产栽培技术。E-mail:hongweizhao@163.com
