人致病性呼肠孤病毒M3编码蛋白纯化及多克隆抗体制备*
2016-10-22陈江曼李永刚王佳美佟伟任雨舒李新
陈江曼,李永刚,王佳美,佟伟,任雨舒,李新
(1.锦州医科大学,辽宁锦州121000;2.锦州医科大学附属第二医院,辽宁锦州121000)
人致病性呼肠孤病毒M3编码蛋白纯化及多克隆抗体制备*
陈江曼1,李永刚1,王佳美1,佟伟1,任雨舒1,李新2
(1.锦州医科大学,辽宁锦州121000;2.锦州医科大学附属第二医院,辽宁锦州121000)
目的根据构建的人致病性纳尔逊海湾病毒(NBVs)M3基因片段质粒,纯化融合蛋白制备NBVs M3多克隆抗体。方法利用构建的纳尔逊海湾病毒(NBVs)M3基因质粒Pris His MB-M3,转化至大肠埃希菌(E. coil)BL21(DE3)感受态细胞中,异丙基-β-D-硫代半乳糖苷(IPTG)诱导蛋白表达,产物经过镍柱亲和层析法获得Pris His MB-M3融合蛋白;将纯化的融合蛋白作为抗原免疫家兔,获得NBVs M3多克隆抗体;蛋白免疫印迹检测(Western blot)蛋白准确性以及多克隆抗体抗性。结果SDS-PAGE电泳考马斯亮蓝染色检测显示:25℃、IPTG浓度为0.3 mmol/L,诱导12 h,Pris His MB-M3融合蛋白表达量最高;在咪唑浓度为MCAC-20、MCAC-40条件时洗脱下目的蛋白。用纯化的融合蛋白免疫家兔制备抗体,Western blot验证成功制备出NBVs M3多克隆抗体。结论成功获得了灵敏性及特异性较高的纳尔逊海湾病毒(NBVs)M3多克隆抗体,为进一步研究该病毒的致病性提供了很高的应用价值。
Pris His MB-M3质粒;纳尔逊海湾病毒(NBVs);纯化蛋白;多克隆抗体
纳尔逊海湾病毒(Nelson Bay orthoreoviruses,NBVs)属于膜融合正呼肠孤病毒,为具有大中小3类10分段的双链RNA(dsRNA):大基因组(L1~L3),中基因组(M1~M3)和小基因组(S1~S4)。该病毒颗粒近似球形,无囊膜,由直径约70~80纳米的二十面体衣壳双包被[1],可从多种物种中分离出来,例如爬行类动物、鸟类等。NBVs首先从澳大利亚果蝇中分离出来,超过40年以独立形式存在,且不与任何疾病发生关联。然而,最近某些NBVs菌株已确定为人类呼吸道感染的病原体。从一些急性呼吸道疾病患者的体内分离出的致病菌显示,NBVs已经进化为人畜共患病的形式,且可在人类中传播[2-7]。2007年日本学者从印尼巴厘岛返回日本的急性呼吸道感染患者体内分离出NBVs,并命名为Miyazaki-Bali/2007(MB)[8-9]。最近,TAKAHIRO等[10]首次利用质粒的反向遗传学系统,根据cDNA转录出NBVs对应的10个全长的RNA基因组,并进行NBV噬菌斑实验验证。本实验受(日本大孤大学病毒复制实验室)Laboratory of Viral Replication馈赠,并在已测序正确的M3基因片段质粒(Pris HisMB-M3)的基础上,纯化NBVs M3融合蛋白,制备出特异性及灵敏性较高的NBVs M3多克隆抗体,为进一步研究纳尔逊海湾病毒提供了实验基础。
1 材料与方法
1.1实验材料
Pris His MB-M3质粒(由Laboratory of Viral Replication馈赠),(E.coil)DH5α和BL21(DE3)感受态细胞购自大连宝生物工程有限公司,金属螯合亲和层析所用Ni+2-NTA琼脂糖介质购自QIAGEN公司,超滤离心管购自密理博中国有限公司,异丙基-β-D-硫代半乳糖苷(Isopropyl-β-D-1-Thiogalactopyranoside,IPTG)、苯甲基磺酰氟化物(phenylmethyl sulfonylfluoride,PMSF)均购自北京索来宝科技有限公司,弗氏完全佐剂、弗氏不完全佐剂购自Sigma中国有限公司,辣根过氧化物酶标记的羊抗兔、羊抗鼠抗体购自Invitrogen中国分公司。
1.2诱导NBVs M3融合蛋白表达条件
将Pris His MB-M3质粒转化至(E.coil)BL21(DE3)感受态细胞中,蓝白斑筛选,37℃恒温培养过夜,次日挑取单个白色菌落,接种到含氨苄西林(100 mg/ml)的10 ml LB培养基中,37℃200 r/min匀速震荡,待菌液摇至OD600值在0.6~0.8之间,设置不同温度梯度(20℃、25℃、30℃及37℃),不同IPTG诱导浓度(0.1、0.3、0.5、0.7及1.0 mmol/L)的实验组,分别在不同时间段(8~12 h)等量收集菌液,4℃、6 000 r/min离心5min,弃尽上清收集菌体,2ml 1×PBS完全重悬,冰浴超声破碎菌体约2 min,直至菌液清亮,4℃离心,分别取上清及沉淀制样,SDS-PAGE电泳和考马斯亮蓝染色检测。
1.3在大肠杆菌中大量诱导NBVs M3蛋白表达
根据上述实验组结果对比,在25℃,IPTG浓度为0.3mmol/L条件下,诱导600ml OD600值约0.70的菌液12h,离心收集菌体,20ml PBS重悬沉淀,以1∶1 000比例加入苯甲基磺酰氟(PMSF)200μl混匀,冰浴上超声直至菌液清亮,4℃、6 000 r/min离心30 min,弃净上清,用20 ml Gu MCAC-0(20 mmol/L Na3PO3.12H2O,0.5mmol/L氯化钠NaCl,6mol/L盐酸胍,pH=7.9)完全溶解沉淀,4℃过夜,第2天6 000 r/min离心30min,取油性上清液经过0.45μm滤器加入超滤离心管中,4℃、4 000 r/min离心,并用不含咪唑的MCAC-0缓冲液(20mmol/L Na3PO3.12H2O,0.5mmol/L氯化钠NaCl,pH=7.9)逐渐置换,待替换为澄清液体后,应用镍柱亲和层析法纯化NBVs M3融合蛋白,缓慢过柱收集原液,分别用不同浓度的咪唑洗脱液(MCAC-20、MCAC-40、MCAC-60、MCAC-80、MCAC-100、MCAC-200及MCAC-500)缓慢过柱,收集流出液,用SDS-PAGE电泳考染检测蛋白,并用MCAC-0置换咪唑浓缩蛋白至1ml。
1.4蛋白免疫印迹法(Western blot)检测纯化的目的蛋白
分别取不同浓度咪唑洗脱下的融合蛋白,以未诱导的Pris His MB-M3大肠杆菌菌液作为对照,10% SDS-PAGE电泳,半干转至硝酸纤维素(NC)膜上(15 V,2 h),TBST缓冲液洗膜3遍,浸入5%脱脂奶粉4℃封闭过夜,第2天,待膜在TBST缓冲液中清洗3遍后,以5%脱脂奶粉稀释的His抗体为一抗,辣根过氧化物酶标记的羊抗鼠抗体为二抗,分别在摇床上室温孵育1h,ECL发光液显影检测。
1.5动物免疫制备多克隆抗体及抗性检测
常规注射家兔,首次免疫剂量为每只100μg,将蛋白抗原与PBS充分融合后加入等体积的弗氏完全佐剂,于皮下多点注射;免疫两周后加强注射,抗原与初次量相同,加入等体积的不完全佐剂混合,注射方式同上。此后分2次每隔2周加强1次,最后1次免疫10d后,全身取血,4℃离心分离血清,置入-20℃冰箱冷冻保存备用。取浓缩的NBVs M3融合蛋白和未诱导的菌液行10%SDS-PAGE电泳,以制备的NBVs M3多克隆抗体为一抗,辣根过氧化物酶标记的羊抗兔抗体为二抗,方法同1.4,ECL化学发光液显影。
2 结果
2.1SDS-PAGE电泳考马斯亮蓝染色检测NBVs M3融合蛋白
根据美国国立生物技术信息中心(NCBI)提供的核酸序列,NBVs M3蛋白分子量约69Ku。不同梯度实验组菌体超声后SDS-SPAGE电泳检测显示,NBVs M3蛋白多存在于包涵体中,在25℃、诱导12 h、IPTG浓度为0.3 mmol/L时蛋白表达量最多。同时经过NTA树脂柱洗脱后检测显示,在咪唑浓度为MCAC-20、MCAC-40条件下可以洗脱下目的蛋白。见图1~3。
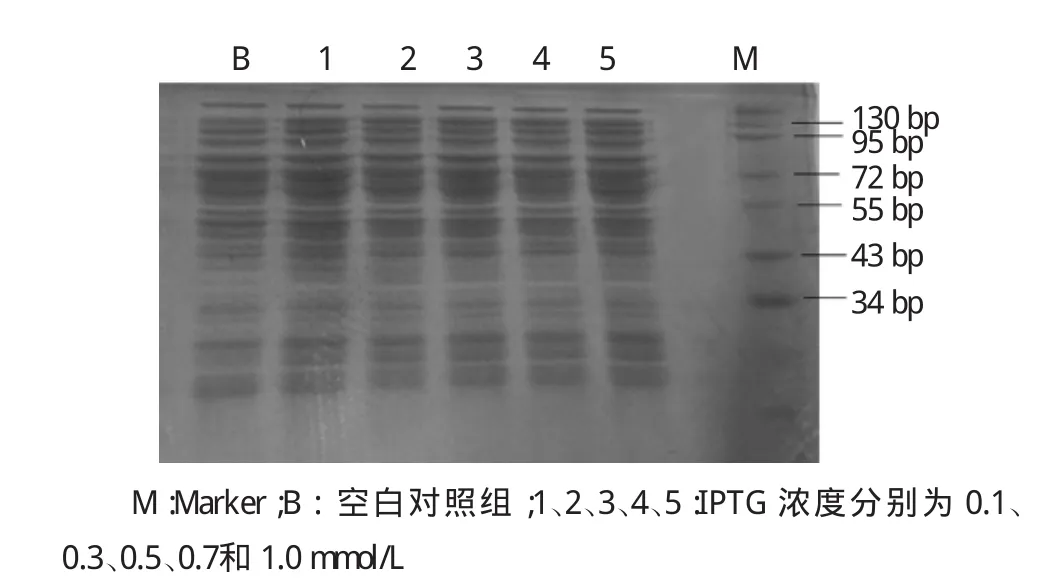
图1 SDS-PAGE电泳显示25℃,超声诱导12 h后NBVs M3融合蛋白少量以可溶形式存在
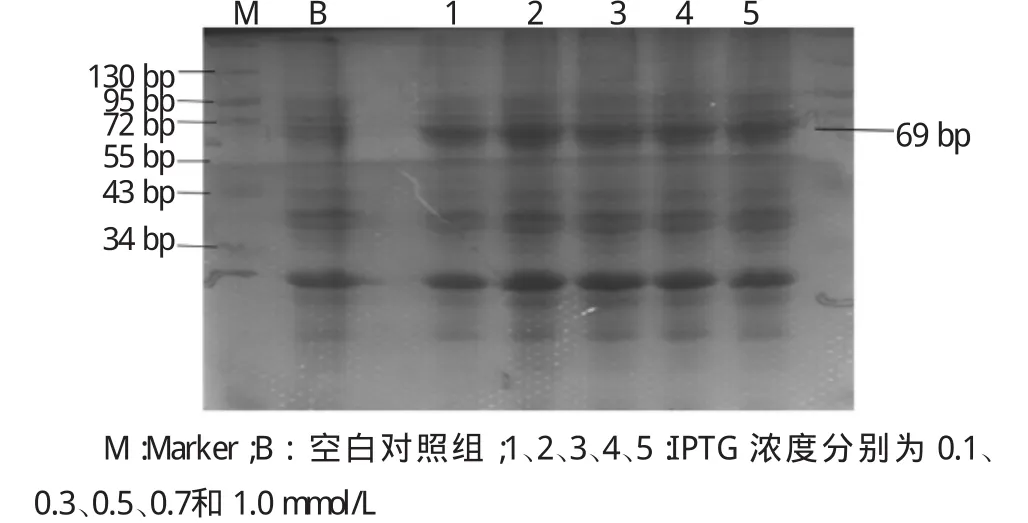
图2 SDS-PAGE电泳显示25℃,超声诱导12 h后NBVs M3融合蛋白主要以非可溶形式存在,在IPTG浓度为0.3 mmol/L时蛋白含量最高
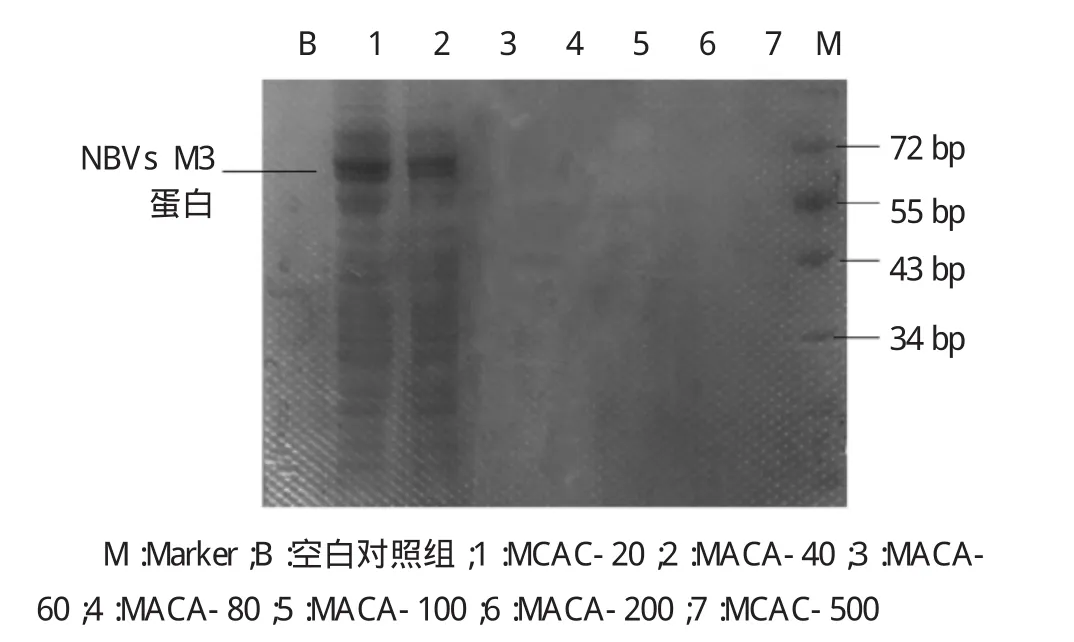
图3 SDS-PAGE电泳检测咪唑洗脱液
2.2Western blot检测浓缩的NBVs M3融合蛋白
SDS-PAGE电泳显示,在69Ku处有一明显的条带,与预期蛋白大小相符。结果证明,本实验成功经过Ni-NTA柱纯化出NBVsM3融合蛋白。见图4。

图4 Western blot检测MB-M3多克隆抗体抗性
2.3Western blot检测NBVs M3多克隆抗体抗性
为了检测多克隆抗体的特异性,采用蛋白免疫印迹方法,以纯化的NBVs M3融合蛋白和未诱导菌液制样进行SDS-PAGE电泳,半干转至硝酸纤维素膜后,以制备的NBVs M3多克隆抗体为一抗,辣根过氧化物酶标记的羊抗兔抗体为二抗,ECL液显影后在69Ku处有一条明显的印记,与NBVs M3蛋白大小预期值符合。见图5。

图5 Western blot检测NBVs M3多克隆抗体抗性
3 讨论
正呼肠孤病毒属广泛存在于自然界的生物中,可从多种生物体内分离,但大部分生物感染该病毒后无明显体征[11],且对人的致病性无法确定。纳尔逊海湾病毒作为膜融合正呼肠孤病毒,最近被证实[2,5],可从急性呼吸道疾病的患者体内分离出来,该致病性呼肠孤病毒的分离引起人类对正呼肠孤病毒潜在的新兴传染病的关注。正呼肠孤病毒根据在细胞中诱导细胞的能力分为促融合正呼和非促融合正呼,该病毒因含有独特的RNA多聚酶,在宿主体内可利用自身RNA逆转录酶合成的新mRNA作为新RNA和病毒蛋白质合成的模板。病毒在复制正链的基础上,通过自身RNA多聚酶翻译成蛋白,合成负链,形成双链RNA分子。此后,双链RNA与蛋白外壳重新组装,形成新的病毒粒子,致细胞破裂,在宿主体内产生大量病毒。有研究表明[12-13],利用反向遗传学系统,已从具有多个节段dsRNA的纳尔逊海湾病毒中克隆出10个全长基因区段的cDNA;同时已证实NBVs可高效的结合多个独立的病毒配体和细胞受体,从而为认识正呼肠孤病毒的生物学提供新的视角。M3是NBVs的基因片段,其编码的非结构蛋白μNS在感染或转染的细胞胞浆中形成包涵体,在病毒颗粒的组装中起着至关重要的作用。
本实验利用构建的His标签M3质粒,转化到大肠杆菌中诱导融合蛋白的表达。其中His标签,即多聚组氨酰,分子量相对较小,可特异性结合镍离子,对融合蛋白的结构影响小,在纯化过程中不需要额外从融合蛋白中切除[14]。所纯化的融合蛋白根据Western blot验证,可直接进行动物免疫。在实验中值得注意是融合蛋白纯化过程中受到多种外界因素的影响,如IPTG浓度、诱导时间及表达温度等,不同的实验梯度分组结果有很大的差异,与其他蛋白比较,此融合蛋白主要以非可溶形式存在,蛋白分子量为69Ku;梯度实验组比较,在12h、25℃、0.3mmol/L IPTG诱导融合蛋白表达量最高;为检测蛋白准确性及多克隆抗体的抗性,利用Western blot进行验证,结果表明与预期相符。
根据以上结果表明,本研究在构建的NBVs基因片段质粒基础上纯化出预期大小的M3融合蛋白;并制备出特异性较高的NBVs M3多克隆抗体,为纳尔逊海湾病毒以及正呼肠孤病毒对人类致病性的研究提供实验基础。
[1]MANBOK K,CHUNG Y H,RANDAL N J.Reovirus and tumor oncolysis[J].J Microbio,2007,45:187-192.
[2]CHUA K B,CRAMERI G,HYATT A,et al.A previously unknown reovirus of bat origin is associated with an acute respiratory disease in humans[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(27): 11424-11429.
[3]PRITCHARD L I,CHUA K B,CUMMINS D,et al.Pulau virus; a new member of the Nelson Bay orthoreovirus species isolated from fruit bats in Malaysia[J].Archives of virology,2006,151(2): 229-239.
[4]CHENG P,LAU C S,LAI A,et al.A novel reovirus isolated from a patient with acute respiratory disease[J].Journal of clinical virology,2009,45(1):79-80.
[5]CHUA K B,VOON K,YU M,et al.Investigation of a potential zoonotic transmission of orthoreovirus associated with acute influenza-like illness in an adult patient[J].PLoS One,2011,6(10): e25434.
[6]WONG A H,CHENG P K,LAI M Y,et al.Virulence potential of fusogenic orthoreoviruses[J].Emerging infectious diseases,2012, 18(6):944-948.
[7]VOON K,TAN Y F,LEONG P P,et al.Pteropine Orthoreovirus infection among out-patients with acute upper respiratory tract infection in Malaysia[J].Journal of medical virology,2015,87(12): 2149-2153.
[8]YAMANAKA A,IWAKIRI A,YOSHIKAWA T,et al.Imported case of acute respiratory tract infection associated with a member of species nelson bay orthoreovirus[J].PLoS One,2014,9(3): e92777.
[9]SINGH H,YOSHIKAWA T,KOBAYASHI T,et al.Rapid whole genomesequencing of Miyazaki-Bali/2007 Pteropine orthoreovirus by modified rolling circular amplification with adaptor ligation-next generation sequencing[J].Scientific Reports,2015,5: 16517.
[10]TAKAHIRO K,YUTA K,HIDEKI-TAN M S,et al.Associated with acute respiratory tract infections in Humans:Role of outer capsid protein σCin viralreplication and pathogenesis[J]. PLOS Pathogens,2016,2:e1005455.
[11]KIM M,GARANT K,NIEDEO N I,et al.Attenuated reovirus displays oncolysis with reduced bost toxieity[J].Br JCancer, 2011,104(2):290-299.
[12]KOBAYASHI T,ANTAR A A,BOEHME K W,et al.A plasmid-based reversegenetics system for animaldouble-stranded RNA viruses[J].Cell hostµbe,2007,1(2):147-157.
[13]KOBAYASHI T,OOMS L S,IKIZLER M,el al.An improved reverse genetics system formammalian orthoreoviruses[J].Virology, 2010,398(2):194-200.
[14]ARNAU J.LAURITZEN C,PETERSEN G E,et al.Current strategies for the use of affinity tags and tag removal for the purification of recombinant proteins[J].Protein Expr Purif,2006, 48(1):1-13.
(张蕾编辑)
Purification of human pathogenic reovirus M3 gene encoded protein and preparation of its polyclonal antibody*
Jiang-man Chen1,Yong-gang Li1,Jia-mei Wang1,Wei Tong1,Yu-shu Ren1,Xin Li2
(1.Jinzhou Medical University,Jinzhou,Liaoning 121000,China;2.The Second Affiliated Hospital of Jinzhou Medical University,Jinzhou,Liaoning 121000,China)
Objective To prepare an anti-NBVs(Nelson Bay orthoreoviruses)M3 polyclonal antibody according to the human pathogenic NBVs M3 gene.Methods NBVs M3 plasmid-Pris His MB-M3 was built and transformed into E.coli BL21(DE3)competent cells.Isopropyl-β-D-thiogalactoside(IPTG)was used to induce protein expression,the NBVs M3 fusion protein was obtained by the method of Ni-NTA agarose;at the same time,the purified fusion protein was utilized as an antigen to immunize rabbits to obtain anti-NBVs M3 polyclonal antibody.The accuracy of the protein and polyclonal antibody resistance were detected by Western blot.Results SDS-PAGE electrophoresis and Coomassie blue staining showed that when the induction was carried out with 0.3 mmol/L IPTG at 25℃for 12 h,the fusion protein expression was the highest.When the imidazole concentration was MCAC-20 and MCAC-40,the fusion protein could be obtained.Western blot showed anti-NBVS M3 polyclonal antibody was successfully prepared with strong specificity when the purified fusion protein was used to immune rabbits.Conclusions A highly sensitive and specific anti-NBVs M3 polyclonal antibody has been successfully obtained.It has a high application value for further study of the pathogenicity of the viruses.
Pris His MB-M3 plasmid;Nelson Bay orthoreoviruses(NBVs);purified protein;polyclonal antibody
R 373.3
A
10.3969/j.issn.1005-8982.2016.18.004
1005-8982(2016)18-0018-04
2016-04-15
辽宁医学院领军人物人畜共患病创新团队(No:173615007);锦州医科大学校长基金-奥鸿博泽研究生科技创新基金(No:AH2015020)
李永刚,E-mail:lygjo@hotmail.com;Tel:0416-4673418
