基于纳米金密度的物理-化学双重梯度构建及其用于神经元轴突响应研究
2016-10-16肖荣荣刘渝宁黄卫华
张 林, 汤 匀, 肖荣荣, 刘渝宁, 谢 敏, 黄卫华*
(生物医学分析化学教育部重点实验室,武汉大学化学与分子科学学院,湖北武汉 430072)
细胞在体内处于非常复杂的胞外基质环境中。胞外基质主要包含物理因素如基质硬度、微纳级形貌等,以及化学因素如多种因子及其浓度等[1],这些因素通过在时间及空间上形成梯度,影响细胞粘附、分化、迁移和生长等行为[2]。作为神经系统结构和功能的基本单位,神经元对这些梯度极其敏感,在神经元极化过程中,生长锥末端伪足(尺寸100~300 nm)[3]能感应纳米级梯度而定向延伸,形成轴突并不断生长[4]。此外,物理和化学梯度在引导轴突向靶细胞延伸[5]以及促进神经修复[6]方面也扮演着重要角色。因此,研究轴突对物理和化学梯度的响应规律具有重要意义。
已有文献报道体外构建微环境研究神经元对物理或化学因素的响应。为了提供接近体内粗糙度的微环境,可采用纳米材料形成纳米结构基底,研究神经细胞响应。结果表明,纳米金颗粒[7]、二氧化硅纳米颗粒[8]、碳纳米管[9]以及特殊设计的结构[10]有利于神经元的生长和导向。为了探究神经元对梯度纳米结构的响应,Li等[11]建立了一种基于微米粒子的粗糙度梯度,并发现了最适合背根神经节(DRGs)细胞生长的粗糙度。对于化学因素,随着微纳加工与制造技术的发展,基于分子扩散[12]、吸附[13,14]和化学反应[15,16]等,各种因子可在二维或三维环境下形成分子梯度,精确调控轴突分化和生长等行为。最近有文献报道在同一基底表面依次或同时形成物理-化学双重梯度,研究其对神经元行为的协同作用。如Gomez等[17]将神经生长因子(NGF)化学键合到微米级的图案基底上,结果表明与未修饰及无图案的基底相比,神经元分化率更高,轴突更长。Dinis等[18]采用静电纺丝技术,建立了一种纤维密度和NGF的同向双重梯度,发现DRGs轴突沿着纤维密度和NGF浓度增加的方向生长。但是基于纳米颗粒密度的物理或物理-化学双重梯度定量研究神经元行为的报道甚少。
本文建立了基于纳米金密度梯度和纳米金-化学因子双重梯度的模型,并定量研究了其对神经元轴突导向和生长的影响。细胞结果表明,轴突更倾向沿着纳米金密度增加的方向生长,且当纳米金密度梯度和化学梯度结合后,这种趋势更为明显。本文建立的纳米金密度梯度及纳米金-化学因子双重梯度模型可用于轴突响应定量化研究,为神经发育和修复研究提供了更多可能和选择。
1 实验部分
1.1 试剂与材料
聚赖氨酸(PLL)和层粘连蛋白(Laminin)购自Sigma公司(美国),IKVAV片段(CSRARKQAASIK-VAVSADR)和FITC-IKVAV(FITC标记的IKVAV)购自中肽公司(常州),重组人肝配蛋白A5嵌合体购自R &D Systems(美国)。用于细胞培养的DMEM/F-12基础培养基购自GIBCO公司(美国),L-谷氨酰胺购自Ameresco公司(美国),用于细胞活性染色的钙黄绿素(calcein-AM)和碘化丙啶(PI)购自Dojindo Laboratory(美国)。玻璃基底购自百斯特公司(常州)。其余试剂均为分析纯,实验用水为超纯水。
1.2 纳米金溶液的合成
纳米金溶液根据之前Frens报道的经典方法[19]合成。首先将50 mL 2.5 mmol·L-1氯金酸溶液加入到干净的100 mL圆底烧瓶中,置于油浴锅中搅拌加热至120 ℃,沸腾后,向其中加入0.75 mL 1%(wt%)的柠檬酸钠溶液,几分钟内颜色发生明显变化,最后稳定为酒红色。然后在温度120 ℃下持续搅拌25 min左右,最后关闭油浴,停止反应,溶液自然冷却,备用。
1.3 玻璃基底上纳米金组装和密度梯度形成
所用玻片基底(0.5 cm×0.5 cm)依次用丙酮、无水乙醇和超纯水超声清洗30 min后,氧等离子体(清洗仪:Harrick Scientific,Ossining,NY,美国)处理80 s后,立即将其浸泡到0.01%(wt%)的PLL溶液中3 h。将包覆有PLL的玻璃基底固定,竖直悬空,伸至装有2 mL纳米金溶液的玻璃称量瓶(25 mm×40 mm o.d.)液面下1 mm位置,然后采用微注射泵(保定兰格恒流泵有限公司)注入方式[20],将1.5 mL超纯水以375 μL·h-1的速度注入到称量瓶中。4 h后液面上升大约1 mm,因此,在玻璃基底0.5 cm×1 mm区域内(图1a)便形成了纳米金密度梯度。组装纳米金的玻璃基底用超纯水冲洗并用氮气吹干,备用。
1.4 化学因子梯度形成
物理-化学双重梯度形成方式与上述纳米金密度梯度类似(图1b)。首先将组装有纳米金密度梯度(梯度范围:0.5 cm×1 mm)的玻片竖直置于离心管中,管中预先加入55 μL IKVAV蛋白(50 μg·mL-1)或ephrin-A5(40 μg·mL-1)溶液,使玻璃底端刚好位于液面以下1 mm位置。再借助微注射泵以5 μL·h-1的速度向其中注入55 μL磷酸盐缓冲溶液(PBS),使液面上升大约1 mm,从而在0.5 cm×1 mm的区域内形成物理-化学同向的双重梯度(图1b-i)。此外,通过将组装有物理梯度的玻璃基底预先旋转90度置入离心管中,可在1 mm×1 mm范围内形成正交双重梯度(图1b-ii)。

图1 基于纳米金密度的物理梯度及物理-化学双重梯度示意图Fig.1 Schematic diagram of forming AuNPs based physical and physical-chemical dual gradients(a) Formation of the AuNPs density gradient on PLL precoated glass via a syringe pump.(b) Formation of the factor gradients on AuNPs density gradient to generate:(i) homodromously dual gradient,(ii) perpendicularly dual gradient,purple and green arrows represent the direction of the AuNPs density(physical) and the factor(chemical) gradients,respectively.
1.5 海马神经元分离与培养
海马神经元按照Kaech报道的方法[21]分离和培养。将怀孕18 d左右的SD大鼠孕鼠(武汉大学中南医院)解剖,取出胎鼠,从其大脑中将海马组织解离,用0.125%(wt%)的胰酶于37 ℃消化8 min,随后用含血清的培养基终止胰酶消化并采用新鲜培养基稀释到所需细胞浓度。在神经元种植前,组装物理或物理-化学双重梯度的玻璃基底于紫外灯下照射1 h灭菌。接着,将密度约为8.0×105cells·mL-1的细胞悬液种植在上述基底上,放入细胞培养箱(37 ℃,5%CO2)中15 min使其贴壁。然后,向已贴壁的细胞中补充新鲜培养基(基础培养基DMEM/F-12中添加100 U·mL-1的青霉素/链霉素,2%B27,3%谷氨酰胺,10 ng·mL-1NGF),将其放入培养箱中培养2 d。
1.6 金纳米颗粒和神经元的电镜表征
采用场发射扫描电镜(FE-SEM,德国ZEISS 公司)表征金纳米颗粒和玻璃基底上神经元形貌。在进行纳米颗粒成像前,纳米金基底首先用氮气吹干,然后在真空环境下喷金30 s。对于神经元成像,细胞首先用2.5%(wt%)的戊二醛于4 ℃固定30 min,然后采用一系列具有浓度梯度的乙醇依次脱水处理,自然干燥,最后于其表面真空溅射喷金50 s。
1.7 显微成像和数据分析
使用Nano measurer 1.2.5软件分析金纳米颗粒粒径,采用倒置荧光显微镜(AxioObserver Z1,德国ZEISS 公司)观察化学因子梯度和海马神经元。ImageJ软件用来分析分子梯度荧光强度,轴突的长度通过ImageJ所带插件Neuron J定量分析,只有具有明显方向且长度超过胞体两倍以上的轴突才被统计。SPSS 19.0软件用来进行数据统计分析(one-way ANOVA),误差棒代表样本的标准偏差(n≥3)。
2 结果与讨论
2.1 纳米金密度梯度形成
首先合成了粒径均一的纳米金颗粒(荷负电,粒径:29±3 nm),并基于其和玻璃基底上荷正电的PLL之间的静电作用[22],将其组装在玻璃基底上。通过调节组装时间及纳米金溶液的浓度形成纳米金密度梯度。如图1所示,向纳米金溶液中低速注入超纯水,液面缓慢上升,PLL包被的玻璃基底从下往上逐渐浸入纳米金溶液中,且溶液浓度逐渐减小,便在玻璃基底上形成了纳米金密度梯度。电镜结果(图2A、2B)表明,在1 mm距离内形成了明显的纳米金密度梯度。经计算物理梯度的分辨率(定义为单位距离内每平方微米纳米金颗粒个数差值)为151 μm-2·mm-1,该值比之前报道的结果[22]高10倍以上。这说明每50 μm 距离纳米金密度的差值约为8 μm-2,该值能被长达数十至数百微米的轴突很好地感应到,从而有助于单根轴突对纳米金密度梯度的响应性研究。
2.2 物理-化学双重梯度形成
类似于纳米金密度梯度形成原理,通过调节化学因子的浓度和吸附时间,从而控制目标分子在组装有物理梯度的基底上吸附量不同(图1b)。分别选用IKVAV(Laminin的活性片段[23],能引导轴突极化和促进神经突修复[24,25])和ephrin-A5(对神经元具有排斥效应[26])两种目标分子,形成物理-化学双重梯度。通过改变物理基底置入方向,可以形成不同角度组合的物理-化学双重梯度,如同向(图1b-i)和正交(图1b-ii)的双重梯度等。本文主要研究了同向双重梯度,FITC-IKVAV荧光照片和和荧光强度曲线分别如图2C、2D所示。

图2 物理和化学梯度的表征Fig.2 Characterization of physical and chemical gradients(A) SEM micrographs of three positions(a,c,e) and(B) AuNPs density statistics of five positions(a-e) on the AuNPs density gradient,a-e represent five positions in 1 mm width region with AuNPs density gradient,respectively,scale bar=1 μm.Fluorescent graph(C) and normalized fluorescence intensity profile(D) of a homodromously AuNPs density-FITC-IKVAV dual gradient,only fluorescent signal could be observed here,scale bar=100 μm.
2.3 海马神经元对纳米金密度梯度的响应
为了探究纳米金颗粒的生物兼容性,将海马神经元培养在组装有均匀纳米金的基底上,培养2 d后,采用荧光探针Calcein-AM/PI表征细胞活力。结果表明,在均匀组装的低密度(54±4 μm-2)和高密度(127±5 μm-2)纳米金颗粒上,神经元生长和分化良好,95%以上的细胞都表现出良好的活力(图3A),说明30 nm粒径的纳米金颗粒具有良好的细胞相容性。另外,SEM结果显示,高密度纳米金上神经元生长锥末端比低密度上的具有更多伪足(图3B、3C),这说明高密度纳米金更有利于神经元分化和生长。两种纳米金密度基底上细胞分化率和轴突长度统计结果显示,高密度基底上两者均明显高于低密度基底结果(图3D、3E)。而当纳米金基底与化学因子Laminin结合后,两种密度基底上分化率和轴突长度均分别得到进一步增加,但两种密度之间仍表现出显著性差异。

图3 海马神经元的活性和实验可行性证明Fig.3 Viability of hippocampal neurons and feasibility of the experiment(A) A fluorescent image of calcein-AM stained neurons cultured on AuNPs substrate with a density of 128 μm-2,scale bar=100 μm.(B) A SEM micrograph of a neuron on an AuNPs substrate with a density of 128 μm-2,scale bar=10 μm.(C) The magnified SEM micrograph of(B),scale bar=1 μm.(D) Differentiation rates of neurons after 2 days cultured in low(52 μm-2) and high(128 μm-2) AuNPs density groups with or without laminin(LN) precoating,the statistical numbers of neurons were 523 and 654 for without and with LN groups,respectively.(E) Mean axonal length of the two groups,the statistical numbers of neurons were 177 and 238 for without and with LN groups,respectively.***p<0.001,**p<0.01,*p<0.05.
我们研究了海马神经元在纳米金密度梯度基底上的响应,将神经元培养在纳米金密度梯度基底上,培养2 d后观察并进行数据分析。统计时,将纳米金密度梯度基底划分为两个区域(一个是平均密度较高区域,另一个是平均密度较低区域,两者由图4A中的虚线分隔),以此比较两区域内轴突的平均长度。图4C结果表明,高密度区域内轴突平均长度(59.31±1.79 μm)明显高于低密度区域(44.64±3.76 μm),这与之前均匀密度基底上结果一致。我们进一步分析了纳米金密度梯度对轴突的导向作用,从细胞显微图片(图4B)可知,轴突更倾向沿着纳米金密度增加的方向(图中红色箭头所示)生长,表明轴突生长锥能灵敏感应纳米颗粒密度差异。统计数据显示,62.21%±4.00%(图4D)的轴突朝向纳米金密度增加的方向生长(p≤0.001),说明纳米金密度梯度有利于轴突导向。这些结果表明在神经系统早期发育过程中,神经元的极化可由物理因素形成的梯度调控。

图4 神经元对纳米金密度梯度的响应Fig.4 Results of neurons responding to AuNPs density gradient(A) Definition of analyzed regions of axonal length(high and low density regions are divided by a dashed line) and axons growing direction(up and down the gradient).(B) A representative phase contrast image of neurons,red and white arrows represent axons growing up and down the gradient respectively,scale bar=50 μm.(C) Mean axonal length of neurons on high and low density regions divided as(A),the statistical number of neurons was 179.(D) Percentage of neurons whose axons grow up and down the gradient,the statistical number of neurons was 235.***p<0.001.
2.4 海马神经元对物理-化学双重梯度的响应
为了研究轴突对同向双重梯度的响应,分别使用吸引性因子IKVAV和排斥性因子ephrin-A5,在组装有物理梯度的基底上形成物理-化学双重梯度,研究神经细胞轴突响应。物理-吸引因子双重梯度基底上细胞统计结果显示,高密度纳米金-高浓度IKVAV区域与低密度纳米金-低浓度IKVAV区域相比,轴突平均长度更长(93.60±4.65 μmvs.73.21±5.64 μm,图5B,统计的两区域划分和图4A类似),并且两区域间的轴突平均长度差值(20.39 μm)明显超过单一物理梯度(14.67 μm)。另外,轴突导向数据也显示,与单一物理梯度相比,更多的轴突朝向双重梯度颗粒密度及因子浓度增加的方向(图5A、5C)。这些结果表明作为一种吸引性因子,IKVAV浓度梯度与纳米金密度梯度,协同促进轴突生长和增强轴突导向作用。
在物理-抑制因子同向双重梯度基底上,培养神经元2 d后发现,高密度纳米金-高浓度ephrin-A5区域与低密度纳米金-低浓度ephrin-A5区域相比,两者轴突平均长度并无明显差别(图5E),表明高密度纳米金对轴突生长的促进作用被排斥性因子ephrin-A5抵消。与此同时,朝向和背向双重梯度颗粒密度及因子浓度增加方向的轴突比例也无明显差别(图5D、5F),这也表明排斥性因子梯度消除了纳米金密度梯度对轴突的导向作用。
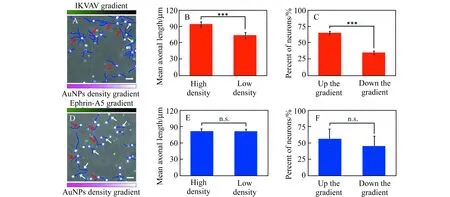
图5 神经元对物理-化学同向双重梯度的响应Fig.5 Results of neurons responding to the homodromously physical-chemical dual gradients(A,B,C) The group of physical-IKVAV homodromously dual gradient.(D,E,F) The group of physical-ephrin-A5 homodromously dual gradient.(A,D) Representative phase contrast images of neurons,red and white arrows in the pictures represent axons growing up and down the gradients respectively,scale bar=50 μm.(B,E) Mean axonal length of neurons on high and low density regions,the statistical numbers of neurons were 190 and 159,respectively.(C,F) Percentage of neurons whose axons grow up and down the gradients,the statistical numbers of neurons were 202 and 128,respectively.***p<0.001;n.s.,not significant.
以上结果表明,物理和化学梯度在影响轴突导向和生长方面具有协同作用,这为体外或体内调控轴突响应提供了更多选择。
3 结论
本文建立了高空间分辨的纳米金密度梯度,随后基于分子吸附形成了物理-化学双重梯度,以此定量研究了神经元轴突在这些梯度基底上的响应规律。初步结果表明,粒径约为30 nm的纳米金颗粒有利于神经元轴突生长,而且其密度梯度对轴突生长具有很好的导向作用,在此基础上结合化学因子梯度,进一步协同调控轴突生长和导向等发育过程。本文建立的基于纳米颗粒密度形成的物理和物理-化学双重梯度模型,可望发展成为一种实用的技术平台,用于神经科学研究。
