香豆素席夫碱的Zn2+识别研究
2016-10-16吴芳辉程立春程源晟黄晓洁
徐 帆, 吴芳辉*, 程立春, 宋 超, 程源晟, 黄晓洁
(安徽工业大学化学与化工学院,安徽马鞍山 243002)
到目前为止,有多种方法识别和检测金属阳离子,其中光学传感法由于具有操作简单、可在线分析、成本低廉、响应快速等优点受到广泛关注。Zn2+是生物体内必需的微量元素之一,在人体中主要存在于大脑、胰腺及精细胞中,它在基因表达、细胞凋亡、酶的调节、神经传递等方面起着非常重要的生理作用[1]。缺少Zn2+将会导致很多疾病,如神经损伤、癫痫症、暂时性全脑缺血、老年痴呆症等疾病[2]。同时,锌矿开采、冶炼加工、机械制造以及镀锌等都会造成环境中Zn2+的污染[3]。因此,实现对Zn2+的有效检测具有重要的意义。近年来,基于喹啉[4]、联吡啶[5]、芘[6]等基团分子探针的光学传感器识别或检测环境和食品中的微量Zn2+已有报道,但是这些分子探针结构较为复杂、合成原料价格昂贵、合成步骤也较为复杂。
席夫碱是一类有着C=N结构的化合物,自身含有N、O等供电子体以及生色团,对金属离子具有较好的亲和性[7]。在席夫碱上修饰具有独特光物理特性,如大的斯托克斯位移、可见区激发和发射的香豆素基团后可以构建出对Hg2+、Ni2+、Cu2+等具有选择性响应的分子探针[8 - 10],但有关香豆素席夫碱分子探针检测Zn2+的文献并不多见[11]。本文使用廉价易得的原料,通过较简单的合成反应制备了一种新型的香豆素席夫碱3-[(5-氯-2-羟基-苯亚甲基)-氨基]-7-羟基香豆素(CHB),并对其进行了必要的表征。研究发现,该分子探针在结合Zn2+之后,颜色发生了明显改变,紫外-可见吸收光谱发生红移,荧光显著增强,并且识别的选择性较高,可用于裸眼识别和在线定量检测Zn2+。
1 实验部分
1.1 仪器与试剂
Nicolet/Nexus-870 FT-IR型红外光谱仪(KBr压片,美国);Bruker Avance III 400MHz型核磁共振仪(TMS为内标,德国布鲁克公司);Perkin-Elmer 2400型元素分析仪(美国,PE公司);Perkin Elmer LS55型荧光光谱仪(美国,PE公司);WinASPECT Plus 2000型紫外-可见吸收光谱仪(美国)。
2,4-二羟基苯甲醛、乙酰甘氨酸和5-氯水杨醛均购自阿拉丁公司;无水乙醇、无水NaAc购自南京化学试剂有限公司;浓HCl购自上海中试化工总公司;乙酸酐购自国药集团化学试剂有限公司。所用化学试剂均为分析纯,使用前未经进一步纯化。实验用水为二次蒸馏水。
1.2 3-氨基-7-羟基香豆素的合成
采用改进的文献方法[12]合成3-氨基-7-羟基香豆素:将2,4-二羟基苯甲醛2.76 g (20 mmol)、乙酰甘氨酸2.34 g(20 mmol)与无水NaAc 4.92 g(60 mmol)加入到装有45 mL乙酸酐的烧瓶中,在温度139 ℃条件下加热回流8 h,然后加入10 mL冰水,生成大量沉淀,过滤,将产物在浓HCl和乙醇(2∶1)混合溶剂中于85 ℃条件下回流3 h,自然冷却,并用30% NaOH溶液调节pH至5~6,析出大量沉淀,抽滤干燥后用无水乙醇重结晶。产率:2.12 g,60%。
1H NMR(400 MHz,DMSO)δ(ppm):9.84(s,1H),7.24(d,J=8.00 Hz,1H),6.71~6.67(m,3H),5.23(s,2H)。
1.3 香豆素席夫碱化合物CHB的合成
将3-氨基-7-羟基香豆素1.77 g(10 mmol)与5-氯水杨醛1.56 g(10 mmol)溶于10 mL无水乙醇中,80 ℃条件下回流4 h,产生大量沉淀,冷却至室温后,抽滤、洗涤、真空干燥,最终产物用无水乙醇重结晶。产率:2.75 g,87%。
1H NMR(400 MHz,DMSO)δ(ppm):12.74(s,1H),10.69(s,1H),9.27(s,1H),8.07(s,1H),7.75(d,J=2.69 Hz,1H),7.59(d,J=8.58 Hz,1H),7.46(dd,J=2.70 Hz,8.83 Hz,1H),7.01(d,J=8.83 Hz,1H),6.87(dd,J=2.25 Hz,8.50 Hz,1H),6.79(d,J=6.79 Hz,1H)。
IR(KBr,cm-1):3 400(AR-OH),1 720(-COOR),1 610(C=N)。
元素分析计算值(%)C16H10ClNO4:C 60.87,H 3.19,Cl 11.23,N 4.44,O 20.27;测定值(%):C 60.96,H 3.11,Cl 11.65,N 4.30,O 19.97。
CHB具体合成路线如下:
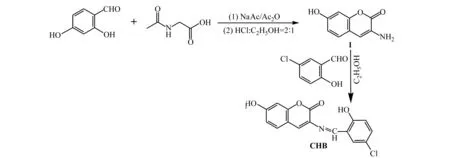
1.4 紫外-可见吸收光谱和荧光光谱测定方法
所有实验均在室温下进行,采用紫外-可见吸收光谱仪测量吸收光谱,采用荧光光谱仪并使用长度为1 cm,容积为3 mL的石英比色皿测量荧光光谱。将一定量的CHB溶于分析纯的溶剂DMF中配制化合物CHB的储备溶液。本文研究的Zn2+和其它金属离子溶液均是采用它们的硝酸盐或乙酸盐配制。紫外-可见、荧光滴定以及选择性实验均是将Zn2+加入到含有其它离子的CHB的DMF中进行测定。CHB与Zn2+之间的结合常数(Ka)采用Benesi-Hilderbrand方程[13]测定,Job图分析[14]用于测定CHB与Zn2+之间的结合比。
2 结果与讨论
2.1 香豆素席夫碱的合成
众所周知,含有C=O和C=N基团的化合物对过渡金属离子的亲和性比对碱金属和碱土金属强[15],因此本文选择具有分子内电荷转移特征的香豆素作为发光体与含有C=N结构的席夫碱键合形成了可对过渡金属离子比色识别的分子探针。实验先采用2,4-二羟基苯甲醛、乙酰甘氨酸和无水NaAc在乙酸酐中通过Pechmann缩合反应制备3-氨基-7-羟基香豆素,该反应对温度要求极为严格,即在139 ℃条件下加热回流8 h后,自然冷却后加入10 mL冰水,使未反应的的乙酸酐分解,在冰水浴中缓慢调节pH,否则会在加入NaOH后溶液表面迅速产生黑色漂浮物,产物最后用无水乙醇重结晶能得到纯净的3-氨基-7-羟基香豆素。合成的3-氨基-7-羟基香豆素与5-氯水杨醛在无水乙醇中进一步缩合形成香豆素席夫碱CHB。CHB的结构分别采用核磁共振谱、红外光谱和元素分析进行表征。
2.2 香豆素席夫碱CHB对Zn2+的识别研究
首先采用紫外-可见吸收光谱研究了CHB的DMF溶液(10 μmol/L)中不断加入Zn2+(其浓度分别为0、20、40、60、80和100 μmol/L)前后的变化,如图1所示。可以发现,在CHB的DMF溶液中不断加入Zn2+之后,CHB自身因为电荷转移在380 nm处的最大吸收峰逐渐下降,而在480 nm处新生成的吸收峰逐渐增强,还可观察到溶液颜色由无色迅速变为橙黄色,表明CHB与Zn2+形成了新的配合物。424 nm处的等吸收点则证实CHB与Zn2+之间形成一定摩尔比的配合物。利用紫外-可见吸收光谱数据并根据Benesi-Hilderbrand方程可以计算出CHB与Zn2+之间的稳定常数Ka= 3.96×104L/mol[13]。
采用荧光光谱进一步研究了Zn2+(100 μmol/L)对CHB的DMF溶液(10 μmol/L)荧光(激发波长为475 nm)的影响,如图2所示。结果表明,当在CHB的DMF溶液中加入Zn2+后荧光显著增强,在365 nm紫外灯下也很容易观测到CHB(50 μmol/L)与Zn2+(100 μmol/L)结合后的荧光现象。由于CHB分子内的电荷转移(ICT)[16]以及C=N双键的顺反异构[17],使得CHB在580 nm处的荧光非常微弱,而加入Zn2+后,CHB与Zn2+之间强烈的配位化作用,抑制了分子探针的C=N异构化作用,减少了非辐射衰减,导致CHB的荧光强度显著增强。

图1 CHB的DMF溶液中加入不同浓度Zn2+后的紫外-可见吸收光谱Fig.1 UV-Vis absorption spectra of CHB in DMF with gradual addition of Zn2+cZn2+(1-6):0,20,40,60.80 and 100 μmol/L.

图2 CHB的DMF溶液中加入Zn2+后的荧光光谱Fig.2 Fluorescence response of CHB to Zn2+ in DMF solution
2.3 其它离子的干扰研究
本文首先研究了100 μmol/L的Na+、 Ca2+、Mn2+、Mg2+、Cu2+、Co2+、Ni2+、Fe3+等常见离子与CHB的DMF溶液(10 μmol/L)作用后的紫外-可见吸收光谱,如图3所示。由图可见,Cu2+、Co2+、Ni2+与Zn2+一样,分别在495、550、560 nm处形成了新的吸收峰,表明它们也与CHB形成了新的配合物。为此,本文进一步采用荧光光谱法研究Na+、Ca2+、Mn2+、Mg2+、Cu2+、Co2+、Ni2+、Fe3+、Cd2+、Hg2+、Ag+和Ru3+12种可能共存的离子对CHB的DMF溶液的荧光强度的影响(激发波长为475 nm),从而验证CHB的选择性。由图4可见,除了Zn2+之外,这12种共存离子对CHB的荧光基本没有增强作用,而在含Zn2+的CHB的DMF溶液中加入其它共存离子也不会影响Zn2+对CHB荧光的增敏作用,表明CHB分子探针对Zn2+的识别选择性较高。
2.4 CHB与Zn2+结合研究
使用荧光滴定的方法测定了580 nm处,CHB的DMF溶液(10 μmol/L)荧光强度在加入不同浓度Zn2+(分别为5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80 μmol/L)后的变化曲线,如图5所示。可以看出随Zn2+的加入,CHB在580 nm处的荧光强度逐渐增强,当加入80 μmol/L Zn2+后,CHB的荧光强度达到最大值。
采用Job图[14]分析了CHB 与Zn2+之间的结合比,如图6所示。当Zn2+的摩尔分数为0.5时,荧光强度达到最大值,证明CHB 与Zn2+之间以1∶1方式配位。

图3 CHB的DMF溶液中分别加入其它金属离子的紫外-可见吸收光谱Fig.3 UV-Vis absorption spectra of CHB with different metal ion in DMF solution
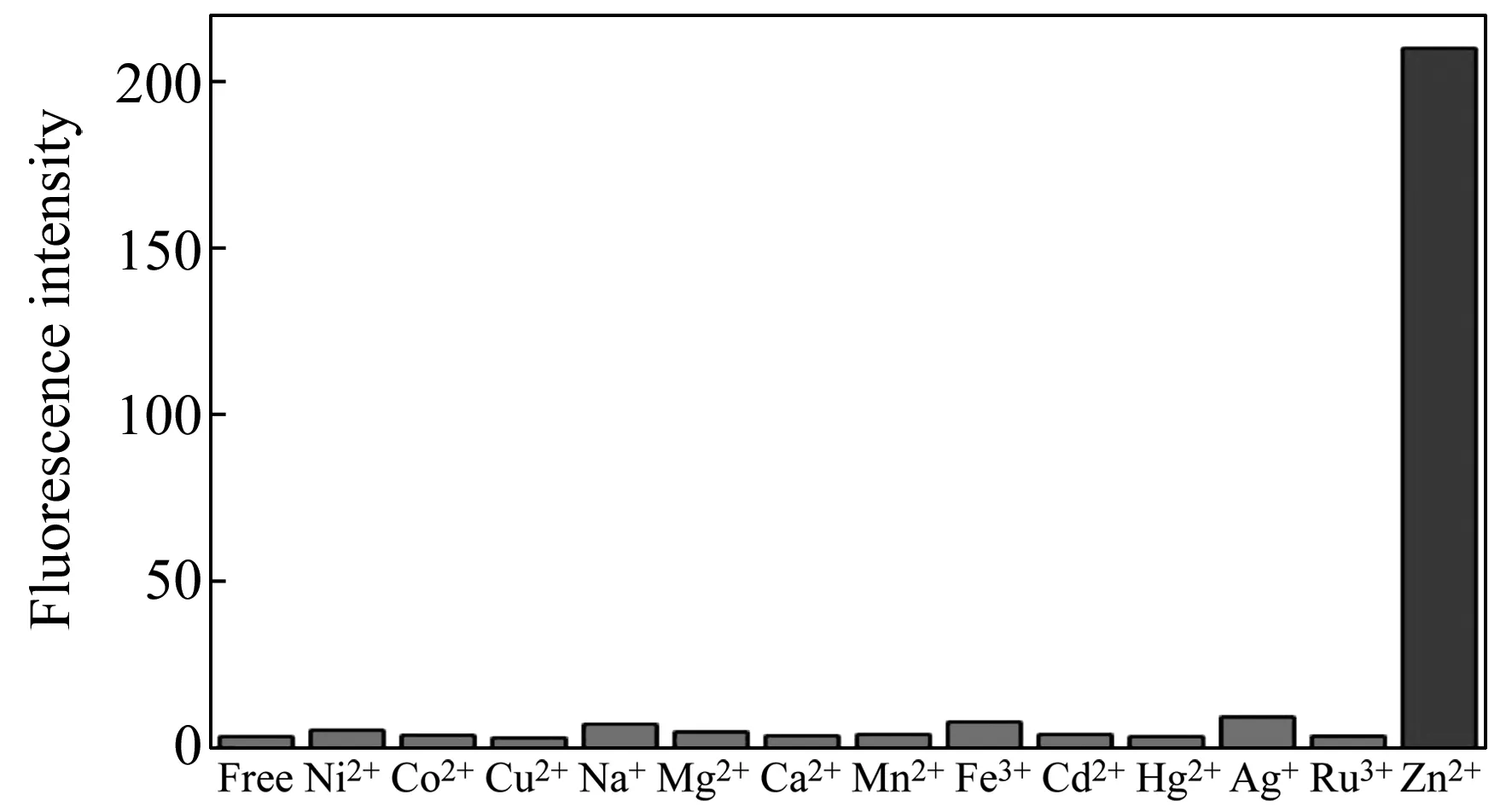
图4 各金属离子对CHB的DMF溶液荧光的改变Fig.4 Selective fluorescence enhancement of CHB in DMF to Zn2+ over other 12 metal ions

图5 CHB的DMF溶液中分别加入Zn2+后荧光强度的变化;内插图:CHB的荧光强度与Zn2+浓度的关系Fig.5 Fluorescence intensity of CHB in DMF in the presence of Zn2+;Inset:fluorescence intensity of CHB as a function of Zn2+ concentration

图6 CHB与Zn2+之间的Job图Fig.6 Job’s plot of CHB with Zn2+ in DMF solution
3 结论
本研究采用价廉易得的原料通过简单的方法合成了一种新的香豆素席夫碱化合物3-[(5-氯-2-羟基-苯亚甲基)-氨基]-7-羟基香豆素(CHB),该分子探针对Zn2+响应灵敏,而且选择性较高。在CHB的DMF溶液中加入Zn2+,其紫外-可见吸收光谱中380 nm处的吸收峰逐渐降低,而在480 nm处新形成的吸收峰逐渐增强,580 nm处的荧光峰强度显著变大,根据Benesi-Hilderbrand方程计算出CHB与Zn2+之间的结合常数Ka为3.96×104L/mol。选择性实验证实其它的金属离子对CHB以及CHB与Zn2+作用后的荧光强度影响不大,Job图分析表明CHB与Zn2+以1∶1的方式配位。
