添加扩增内标的单增李斯特菌PCR检测方法的建立与应用
2016-10-13张德福赵禹宗付绪磊张明仪淑敏徐永霞殷喆李春励建荣
张德福,赵禹宗,付绪磊,张明,仪淑敏,徐永霞,殷喆,李春,励建荣*
1(渤海大学 食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州,121013)2(军事医学科学院微生物流行病研究所,病原微生物生物安全国家重点实验室,北京,100071)3(渤海大学 数理学院,辽宁 锦州,121013)
添加扩增内标的单增李斯特菌PCR检测方法的建立与应用
张德福1, 2,赵禹宗1,付绪磊1,张明1,仪淑敏1,徐永霞1,殷喆2,李春3,励建荣1*
1(渤海大学 食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州,121013)2(军事医学科学院微生物流行病研究所,病原微生物生物安全国家重点实验室,北京,100071)3(渤海大学 数理学院,辽宁 锦州,121013)
以单增李斯特菌inlA基因为靶基因,设计一对特异性引物,以16S rRNA为扩增内标对照,建立了一种含有扩增内标的单增李斯特菌PCR检测方法。优化了PCR反应体系,并对PCR检测方法的特异性、灵敏度、人工污染样品及食品样品检测效果进行了测试。对2株单增李斯特菌、1株英诺克李斯特菌以及19株非李斯特菌菌株进行PCR检测,结果显示,只有2株单增李斯特菌能被检出大小为826 bp的特异性片段,其余20株细菌只能检出1 500 bp的扩增内标片段。灵敏度实验结果显示,基因组DNA和纯培养物的最低检出限分别为1.80×102fg/μL和1.21×102CFU/mL。当人工污染牛乳样品中单增李斯特菌在最低接种量为0.48 CFU/mL时,经8 h增菌培养后可被该方法检出。采用该研究建立的检测方法对36种食品样品进行检测,证实了该检测方法可以指示检测过程中出现的假阴性现象。综上所述,该研究建立的PCR检测方法能特异性的检测单增李斯特菌,并可有效排除检测过程中出现的假阴性现象,提高检测的准确性。
单增李斯特菌;聚合酶链式反应;检测方法;扩增内标;内化素基因
单核细胞增生李斯特菌(Listeriamonocytogenes,LM)是一种革兰氏阳性兼性胞内菌,是目前6种李斯特菌菌株中对人类危害最大的食源性致病菌,能引起人和动物的李氏杆菌病。尽管它在健康人群中的致病率不高,但能引起新生儿和老年人的脑膜炎、败血症以及妊娠期孕妇流产等疾患[1],致死率高达20%~40%[2]。单增李斯特菌普遍存在于自然环境中,主要包括土壤、腐败植物、动物排泄物等[3],极易引起食品加工环境和食品的污染。据估计,高达99%的李氏杆菌病病例是通过食用被单增李斯特菌污染的食品所致[2]。因此建立一种快速而准确的单增李斯特菌检测方法是预防李氏杆菌病和保障食品安全的重要手段。
目前单增李斯特菌的检测方法仍以传统培养检测法为主,操作繁琐,检验周期长,准确率低。基于PCR的检测技术,因其操作简便、检测迅速、灵敏度较高一直是致病性微生物快速检测的研究热点。但是,由于食品检测过程中需要进行增菌培养,而食品样品残渣、培养基以及微生物本身都会带来一些PCR反应抑制因素,影响PCR反应,导致检测结果出现假阴性现象。现有研究表明,在PCR反应体系中添加扩增内标可以有效指示PCR反应过程中出现的假阴性现象[4-5]。扩增内标是PCR反应体系中用以指示假阴性现象的一段人工构建DNA序列或一段致病菌自身的看家基因片段[6-7]。引物27F/1492R是一对扩增细菌16S rRNA的通用引物,能通过PCR反应从大部分细菌中扩增出一条大小约为1 500 bp的核酸片段。在PCR反应体系中添加引物27F/1492R,可以通过以食品样品中的细菌作为模板扩增出一条内标条带,作为PCR检测过程中指示假阴性结果的扩增内标。
内化素(InternalinA,InlA)是单增李斯特菌表面独有的蛋白[8],由基因inlA编码。ALMEIDA等[9]的研究表明inlA基因序列作为单增李斯特菌检测的靶基因具有极高的特异性,能对单增李斯特菌进行有效鉴定。本研究拟以单增李斯特菌inlA基因为靶基因,设计一对检测单增李斯特菌的特异性引物,添加16S rRNA扩增通用引物27F/1492R作为扩增内标,建立一种食品中单增李斯特菌的检测方法,以达到快速检测食品中单增李斯特菌并指示检测过程中可能出现的假阴性现象的目的。
1 材料与方法
1.1实验材料(表1)
1.1.1实验用菌株及来源

表1 实验用菌株及其PCR结果
1.1.2主要仪器及试剂
Taq-PCR Master Mix、细菌基因组DNA提取试剂盒、DNA Marker D2000,生工生物工程(上海)股份有限公司;琼脂糖,Sigma公司;LB培养基,北京奥博星生物技术有限公司;APW培养基、PALCAM琼脂,青岛高科园海博生物技术有限公司。
Mastercycler pro梯度PCR仪、5424R冷冻离心机,德国艾本德股份有限公司;DYY-8C型电泳仪,北京市六一仪器厂;Cheimd Doc XRS型凝胶成像仪,美国Bio-Rad公司;NanoDrop 2000分光光度计,美国赛默飞世尔科技公司;DL-CJ-2N型超级洁净工作台,东联哈尔(北京)仪器制造有限公司;LRH系列生化培养箱,上海一恒科学仪器有限公司;LC-08拍击式均质器,宁波立成仪器有限公司。
1.2实验方法
1.2.1引物设计与筛选
根据GenBank上单增李斯特菌内化素基因inlA(GenBank:CP001604)的核酸序列,使用Primer Primer 5.0软件设计引物,得到一对检测单增李斯特菌的特异性引物inlAF/R。实验所用引物均由生工生物公司合成,将引物稀释至浓度为10 μmol/L的工作液,-20 ℃保存备用。引物序列及扩增片段长度见表2。

表2 引物序列及扩增片段长度
1.2.2菌种培养及基因组DNA提取
实验所用副溶血弧菌、溶藻弧菌、创伤弧菌、哈维弧菌均使用APW固体和液体培养基纯化和培养,其余细菌均使用LB固体和液体培养基纯化和培养。细菌经增菌培养后,使用细菌基因组DNA提取试剂盒提取所有细菌的基因组DNA。
1.2.3单增李斯特菌DNA浓度测定
使用超微量分光光度计测定提取的单增李斯特菌DNA溶液浓度,浓度测定后置于-20 ℃冰箱保存备用。
1.2.4PCR检测方法的建立
根据Taq-PCR Master Mix说明书所提供的PCR反应体系及程序,对PCR反应体系的各组分含量以及扩增程序进行优化。最终确定PCR反应最佳体系为:Taq-PCR Master Mix 12.5 μL,10 μmol/L的引物27F/1492R和inlAF/R各1 μL,DNA模板5 μL,无菌超纯水3.5 μL。PCR反应最佳程序为:94 ℃预变性4 min;40个循环,每个循环94 ℃变性30 s,55.6 ℃退火30 s,72 ℃延伸90 s;最后72 ℃延伸10 min。PCR产物使用1.5%的琼脂糖凝胶进行电泳,凝胶成像仪下观察结果。
1.2.5特异性实验
使用建立的含扩增内标的PCR检测方法对表1中细菌的基因组DNA进行检测,以验证所建立检测方法的特异性。
1.2.6灵敏度检验
1.2.6.1基因组DNA灵敏度检测
将提取的单增李斯特菌基因组DNA用无菌超纯水进行10倍梯度稀释,使用建立的PCR扩增体系对各稀释度的基因组DNA溶液进行扩增检测。PCR产物的电泳结果中,能得到大小约为800 bp肉眼可见条带的最小DNA浓度,视为该检测方法的基因组DNA检测灵敏度。
1.2.6.2纯培养物灵敏度检测
将活化的单增李斯特菌接种于LB液体培养基中,37℃培养12 h,用无菌生理盐水进行10倍梯度稀释,取106、107、108三个稀释度的菌液进行平板计数。单增李斯特菌菌液浓度测定的同时,取1 mL菌液置于1.5 mL离心管中,10 000 g离心5 min收集菌体,加1 mL无菌超纯水重悬菌体,再用无菌超纯水进行10倍梯度稀释。细菌基因组DNA提取采用BILUNG等[10]的方法,取每个浓度梯度的菌液各1 mL置于1.5 mL的离心管中,沸水浴煮10 min后冰浴10 min裂解细菌。将细胞裂解物离心沉淀后,取上清液作为DNA模板进行PCR检测,得到该PCR检测方法的纯培养物检测灵敏度。
1.2.7.1人工污染食品样品制备
取10份新鲜巴氏杀菌牛乳,每份25 mL,取适当稀释度的单增李斯特菌菌液接种于无菌牛乳中,使牛乳中细菌浓度分别为0~1、1~10、10~100 CFU/mL,每组做3个平行实验。另取1份无菌牛乳作为空白对照。
1.2.7.2人工污染样品的增菌及PCR检测
将9份25 mL的人工污染牛乳及1份空白对照牛乳添加到225 mL LB液体培养基中,在37 ℃, 150 r/min摇床培养。每隔2 h取1 mL菌液置于1.5 mL离心管中,连续取样6次。待取样完毕后,将菌液10 000 g离心5 min收集菌体,使用无菌生理盐水离心洗涤1次后,加入100 μL无菌超纯水重悬沉淀。按照纯培养物灵敏度检测中的方法提取样品中细菌的DNA,提取的DNA模板进行PCR检测。
1.2.8食品样品检测
采集新鲜食品样品,每份样品取25 g,加入到盛有225 mL LB液体培养基的无菌均质袋中。使用拍击式均质器拍打2 min后,将均质袋置于37 ℃培养箱培养8 h。每份样品取1 mL置于1.5 mL离心管中,1 000 g离心1 min去除食物残渣,取上清液置于新的1.5 mL离心管中。以1.2.7.2中的实验方法对样品进行检测。
2 结果
2.1基因组DNA浓度
经分光光度计测定,提取的单增李斯特菌DNA溶液浓度为180.25 ng/μL。
2.2特异性实验
对表1中细菌的基因组DNA进行PCR检测。结果如表1所示,只有2株单增李斯特菌能扩增出约为800 bp的特异性条带和1 500 bp的内标对照条带,1株英诺克李斯特菌及19株非李斯特菌菌株只能扩增出约1 500 bp的内标对照条带,表明引物inlA F/R特异性良好。
2.3灵敏度实验
2.3.1基因组DNA灵敏度检测
单增李斯特菌浓度为1.80×106~0.18 fg/μL的基因组DNA溶液PCR检测结果如图1所示。当基因组DNA稀释至1.80×102fg/μL时,仍有大小约为800 bp肉眼可见条带,表明本实验所建立的PCR检测方法对单增李斯特菌基因组DNA的检测灵敏度为1.80×102fg/μL。
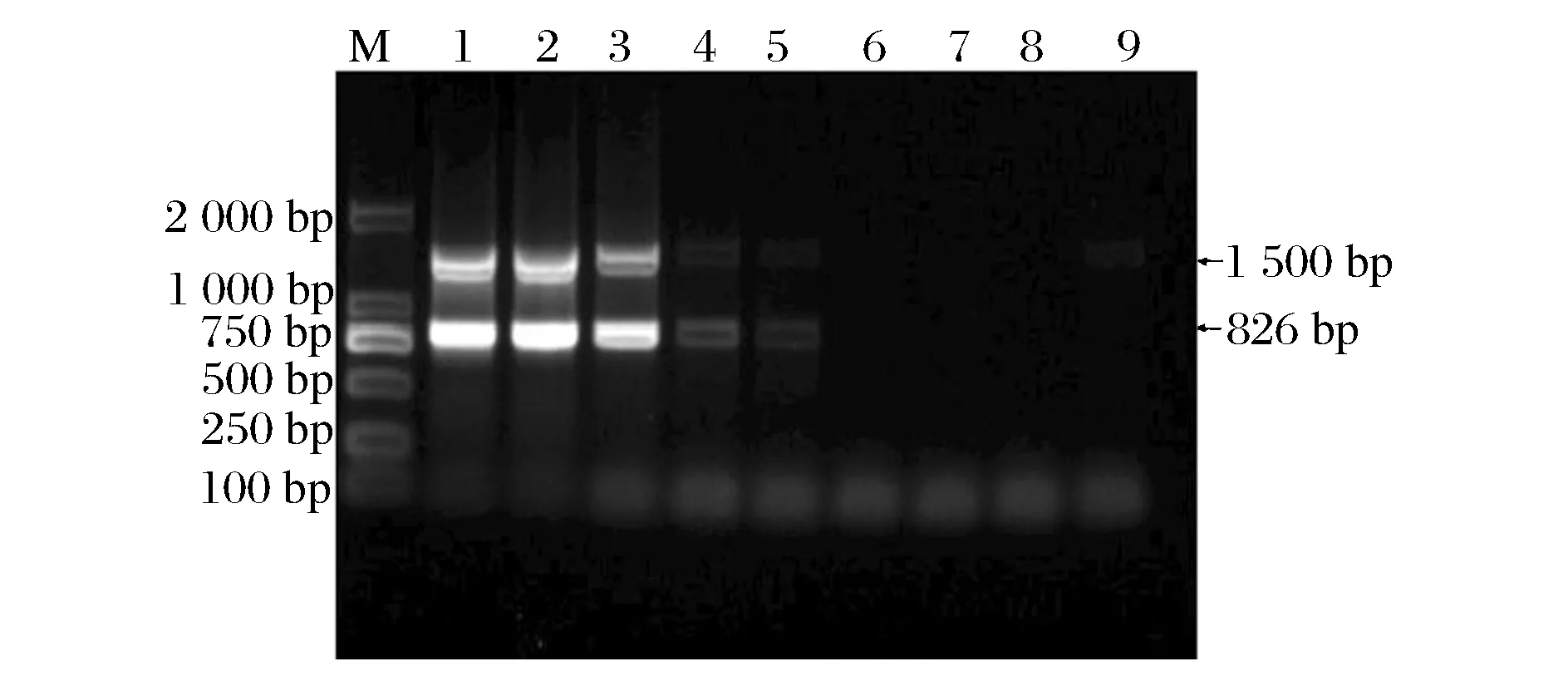
1-8:单增李斯特菌基因组DNA浓度1.80×106~0.18 fg/μL,9:阴性对照图1 单增李斯特菌基因组DNA检测灵敏度Fig.1 Sensitivity evaluation for L. monocytogenes genomic DNA
2.3.2纯培养物灵敏度检测
经平板菌落计数得单增李斯特菌的菌液浓度为1.21×1011CFU/mL。各稀释度单增李斯特菌菌液PCR检测结果如图2所示,当单增李斯特菌菌液浓度稀释至1.21×102CFU/mL时,PCR检测结果仍有大小约为800 bp的肉眼可见条带,因此确定本研究的PCR检测方法对单增李斯特菌纯培养物的检测灵敏度为1.21×102CFU/mL。
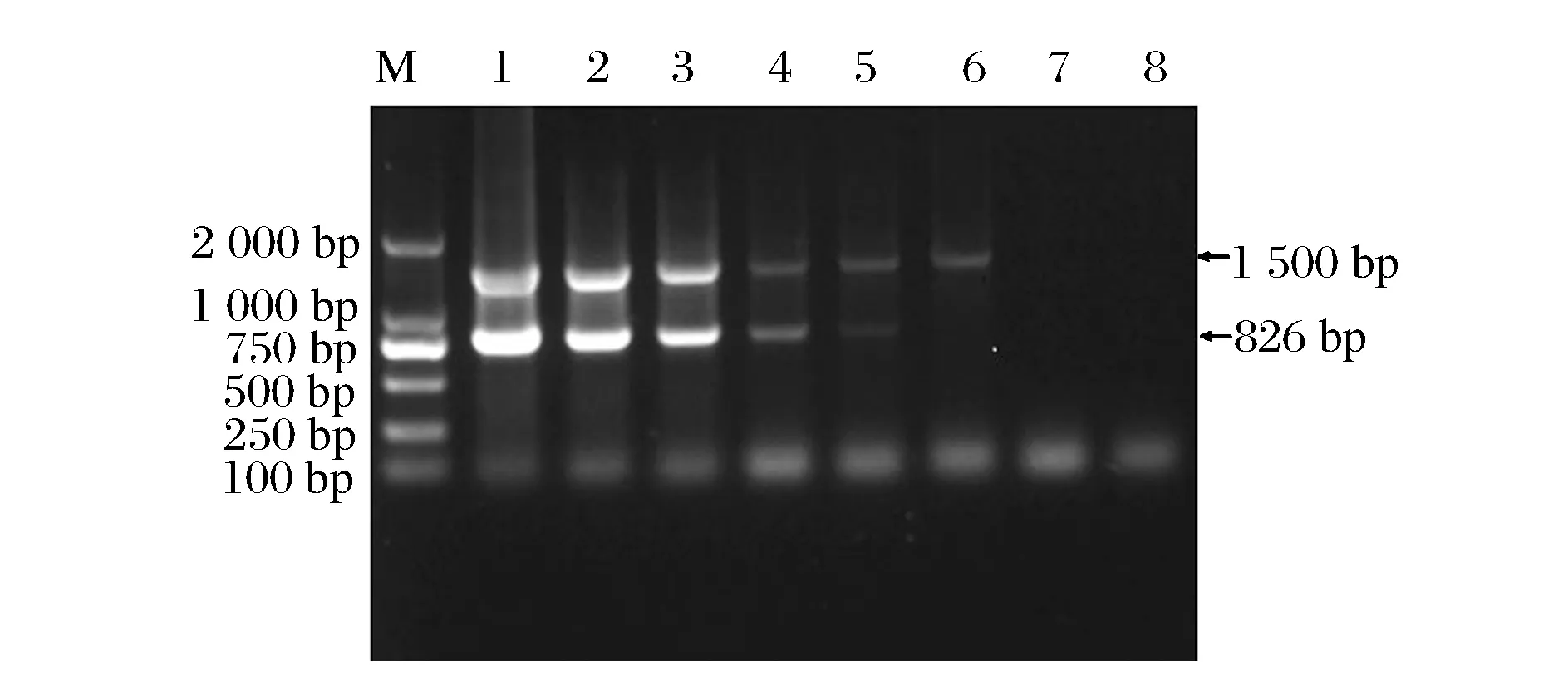
M:D2000 DNA ladder;1-7:单增李斯特菌菌体浓度1.21×106~1.21 CFU/mL;8:阴性对照图2 单增李斯特菌纯培养物检测灵敏度Fig.2 Sensitivity evaluation for L.monocytogenes pure cultures
2.4人工污染样品检测结果
3组人工污染牛乳中接种的单增李斯特菌菌体浓度为:0.48 CFU/mL、4.84 CFU/mL、48.4 CFU/mL。PCR检测结果如表3所示,接菌量为48.4 CFU/mL和4.84 CFU/mL的牛乳样品中,在增菌培养4~6 h后即可检出。接菌量为0.48 CFU/mL的牛乳样品则需要增菌培养8 h才可以检出。这表明,使用该PCR检测方法,样品只需经8 h增菌培养即可鉴定食品样品是否被单增李斯特菌污染。
2.5食品样品检测
实验共采集食品样品36份,其中鸡蛋6份,果蔬16份,水产品4份,豆制品4份,畜肉6份。PCR检测结果显示,36份样品中有32份样品检测出扩增内标条带,其中有1份鸡蛋样品和1份豆制品检测出单增李斯特菌特异性条带。表明,有4份样品检测结果呈现假阴性,有2份样品确认污染单增李斯特菌。对4份检测呈假阴性的样品增菌液稀释后重新进行检测,均能检测出扩增内标条带,未出现单增李斯特菌特异性条带,表明这4份样品增菌液中含有PCR反应抑制因子。

表3 人工污染食品样品检测结果
3 讨论
本研究以细菌自身的16S rRNA为扩增内标,只需向体系中添加16S rRNA扩增通用引物27F/1492,不需向PCR反应体系中另外添加扩增内标片段,避免了因扩增内标与目的基因交联结合导致检测灵敏度下降的现象。研究检测单增李斯特菌基因组DNA检测灵敏度为1.80×102fg/μL,纯培养物灵敏度为1.21×102CFU/mL,与徐义刚等[11]报道的纯培养物检测灵敏度1.51×102CFU/mL相仿。由人工污染牛乳样品检测实验可知,接菌量仅为0.48 CFU/mL的牛乳样品经过8h增菌培养后即可检出。这表明,被单增李斯特菌污染的食品样品,最多经过8h增菌培养,即可被本研究检测方法检出,加上DNA模板提取、PCR扩增和电泳分析过程,整个检测至多需要12 h,远低于传统的培养检测方法。实际样品检测过程中36份食品样品有4份未扩增出内标片段,通过对菌体洗涤、稀释操作后重新进行PCR检测,均能扩增出内标条带。表明,PCR反应中存在抑制因素,本研究建立的PCR检测方法可以指示检测过程中出现的假阴性现象。
综上所述,本研究所建立的添加扩增内标的单增李斯特菌PCR检测方法具有较高的特异性及灵敏度,能有效指示检测过程中出现的假阴性现象,提高检测的准确性,能为单增李斯特菌的检测提供一种快速、高效、准确的方法。
[1]KANKI M, NARUSE H, TAGUCHI M, et al. Characterization of specific alleles inInlA andPrfA ofListeriamonocytogenesisolated from foods in Osaka, Japan and their ability to invade Caco-2 cells[J]. International Journal of Food Microbiology, 2015, 211:18-22.
[2]KOVACEVIC J, ARGUEDAS-VILLA C, WOZNIAK A, et al. Examination of food chain-derivedListeriamonocytogenesstrains of different serotypes reveals considerable diversity ininlA genotypes, mutability, and adaptation to cold temperatures.[J]. Appl Environ Microbiol,2013, 79(6):1 915-1 922.
[3]KATHARIOU S.Listeriamonocytogenesvirulence and pathogenicity, a food safety perspective[J]. Journal of Food Protection, 2002, 65(11): 1 811-1 829.
[4]HOORFAR J, MALOMY B, ABDULMAWJOOD A, et al. Practical considerations in design of internal amplification controls for diagnostic PCR assays[J]. Journal of Clinical Microbiology,2004, 42(5):1 863-1 868.
[5]ZHANG W J, CAI Q, GUAN X, et al. Detection of peanut (Arachishypogaea) allergen by Real-time PCR method with internal amplification control[J].Food Chemistry,2015,174:547-552.
[6]李雪玲, 陈勇, 张健. 添加有扩增内标的PCR技术在食源性致病菌检测中的应用[J]. 食品工业, 2013(4):189-191.
[7]何晓华, 史贤明. 扩增内标及其在食源性致病菌PCR检测中的应用[J]. 微生物学报, 2010,40(2):141-147.
[8]COSSART P, PIZARRO-CERDA J, LECUIT M. Invasion of mammalian cells byListeriamonocytogenes: functional mimicry to subvert cellular functions[J]. Trends in Cell Biology, 2003,13(1):23-31.
[9]ALMEIDA P F, ALMEIDA R C C. A PCR protocol using inl gene as a target for specific detection ofListeriamonocytogenes[J]. Food Control, 2000, 11(2):97-101.
[10] BILUNG L M, RADU S, BAHAMAN A R, et al. Detection ofVibrioparahaemolyticusin cockle (Anadaragranosa) by PCR[J]. Fems Microbiology Letters, 2005, 252(1):85-88.
[11] 徐义刚, 李丹丹, 张柏棋, 等. 基于双启动引物特异性检测单核细胞增生李斯特氏菌的PCR方法[J].食品工业科技,2014,35(10): 86-89.
Development and application of a PCR method with an internal amplification for detection ofListeriamonocytogenes
ZHANG De-fu1,2, ZHAO Yu-zong1, FU Xu-lei1, ZHANG Ming1, YI Shu-min1,XU Yong-xia1, YIN Zhe2, LI Chun3, LI Jian-rong1*
1(College of Food Science and Project Engineering,Bohai University;Food Safety Key Lab of Liaoning Province;National & Local Joint Engineering Research Center of Storage,Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products;Jinzhou 121013,China)2(Institute of Microbiology and Epidemiology,Academy of Military Medical Sciences,State Key Laboratory of Pathogen and Biosecurity,Beijing 100071,China)3(College of Mathematics and Physics,Bohai University,Jinzhou 121013,China)
Aimed to develop a PCR method with an internal amplification control (IAC) for detection ofListeriamonocytogenes, a pair of new specific primers were designed based oninlA gene ofL.monocytogenes, and the 16S rRNA sequence was used as the IAC. In this study, the PCR protocol was optimized, and the specificity, sensitivity, effect of artificially contaminated food and food samples were evaluated. The results of detection for 2 strains ofL.monocytogenes, one strain ofL.innocuaand 19 non-Listeria showed that, amplified fragments from 2 strains ofL.monocytogeneswere 826 bp as desired and the products from other 20 strains were 1465 bp fragment of IAC. From sensitivity detection, the pure genomic DNA is 1.80×102fg/μL, and the pure culture is 1.21×102CFU/mL. If theL.monocytogenesinoculation was 0.48 CFU/mL in artificially contaminated milk,L.monocytogenescould be detected after 8 hours of enrichment culture. Thirty-six food samples were detected by this method established in this study and the results demonstrated that it could effectively eliminate false-negative results. In summary, a novel PCR method was successfully developed in this study, which could specificity detectL.monocytogenesand could especially eliminate false-negative results.
Listeriamonocytogenes;polymerase chain reaction;detection method;internal amplification control;inlA
10.13995/j.cnki.11-1802/ts.201609033
博士,讲师(励建荣教授为通讯作者,E-mail: zhangdf@bhu.edu.cn)。
“十二五”国家科技支撑计划项目(2012BAD29B06);博士后科学基金(2015M582803);病原微生物生物安全国家重点实验室开放课题(SKLPBS1520);辽宁省重点实验室开放课题(LNSAKF2013018);辽宁省高等学校创新团队项目(LT2014024)
2015-12-11,改回日期:2016-04-11
