加强表达3-磷酸甘油醛脱氢酶对谷氨酸棒杆菌产L-丝氨酸的影响
2016-10-13郭雯赖联贺张晓梅史劲松许正宏
郭雯,赖联贺,张晓梅,史劲松,许正宏*
1(江南大学 药学院,制药工程研究室,江苏 无锡,2141222)2(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
加强表达3-磷酸甘油醛脱氢酶对谷氨酸棒杆菌产L-丝氨酸的影响
郭雯1,2,赖联贺1,张晓梅1,史劲松1,许正宏1,2*
1(江南大学 药学院,制药工程研究室,江苏 无锡,2141222)2(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
在谷氨酸棒杆菌(Corynebacteriumglutamicum)中,由3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)催化的反应是糖酵解途径的限速步骤,该反应还直接影响了L-丝氨酸的前体3-磷酸甘油酸的合成。研究首先比较了产L-丝氨酸的野生型菌株C.glutamicumSYPS-062与模式菌株C.glutamicumATCC14067的GAPDH酶活力,发现SYPS-062的GAPDH酶活力比ATCC14067高了55.8%。进一步采用在C.glutamicum33a△SS基因组上增加gapA拷贝数的方法加强表达GAPDH,构建了重组菌C.glutamicum33a△SS-2gapA。重组菌GAPDH转录水平和酶活力分别提高119%和53%,最大比生长速率提高10.6%,总糖耗速率提高4.4%,L-丝氨酸产量提高17.4%,糖酸转化率提高12.2%,生产强度提高17.4%。结果表明,加强表达GAPDH能够提高重组菌的生长和糖耗速率,并能够提高L-丝氨酸的产量、糖酸转化率和生产强度。
3-磷酸甘油醛脱氢酶;谷氨酸棒杆菌;L-丝氨酸
L-丝氨酸作为一种重要的氨基酸,参与很多重要代谢产物的合成,在医药、化妆品和食品添加剂领域具有广泛的应用前景[1-2]。生产方法主要有化学合成法、蛋白质水解法、酶法转化法和微生物发酵法。目前直接利用糖质原料的微生物发酵法受到了广泛的关注。谷氨酸棒杆菌(Corynebacteriumglutamicum)作为一种食品安全级的菌株,拥有成熟的遗传背景,已经广泛应用于生产多种氨基酸[3]。
谷氨酸棒杆菌中L-丝氨酸的合成及降解途径如图1所示。L-丝氨酸以糖酵解途径中间产物3-磷酸甘油酸作为起始物质,通过3-磷酸甘油酸脱氢酶(PGDH)、磷酸丝氨酸转氨酶(PSAT)和磷酸丝氨酸磷酸酶(PSP)3个酶催化生成L-丝氨酸。L-丝氨酸则被丝氨酸羟甲基转移酶(SHMT)或L-丝氨酸脱氨酶(L-serDH)催化降解为甘氨酸或丙酮酸[4]。目前代谢工程改造谷氨酸棒杆菌产L-丝氨酸主要集中在其合成及降解途径。STOLZ等加强表达了C.glutamicumATCC13032L-丝氨酸合成途径中的关键酶,敲除或弱化了降解途径中的酶,菌株产量为345 mmol/L[5]。

图1 谷氨酸棒杆菌中L-丝氨酸的合成及降解途径Fig.1 The biosynthesis and degradation pathway of L-serine in C. glutamicum
本实验室前期对产L-丝氨酸的野生型菌株C.glutamicumSYPS-062进行了随机诱变,得到了L-丝氨酸高产菌株C.glutamicumSYPS-062-33a。进而以其为出发菌株,对L-丝氨酸合成及降解途径进行了改造,解除了L-丝氨酸对PGDH的反馈抑制,敲除了L-serDH,构建的重组菌C.glutamicum33a△SSL-丝氨酸产量为21.27 g/L[6]。目前针对糖酵解途径的L-丝氨酸代谢工程改造策略则鲜有报道[7]。
3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)是糖酵解途径中的关键酶,参与了L-丝氨酸前体3-磷酸甘油酸的合成。YAMAMOTO等通过加强表达GAPDH,提高了GAPDH酶活力,减少了胞内糖酵解途径中3-磷酸甘油醛上游的中间代谢产物积累量,提高了谷氨酸棒杆菌在缺氧条件下的L-丙氨酸产量和糖耗速率[8]。GAPDH酶活力大小也可能会对谷氨酸棒杆菌产L-丝氨酸产生影响。
本文首先通过比较产L-丝氨酸的野生型菌株C.glutamicumSYPS-062与模式菌株C.glutamicumATCC14067的GAPDH酶活力,推测较高的GAPDH酶活力有利于L-丝氨酸的积累。进一步采用在C.glutamicum33a△SS基因组上增加gapA拷贝数的方法加强表达GAPDH,构建了重组菌C.glutamicum33a△SS-2gapA。最后通过比较出发菌和重组菌的发酵性能,评估了加强表达GAPDH对谷氨酸棒杆菌生长和产L-丝氨酸的影响。
1 材料与方法
1.1材料
1.1.1菌种及引物
C.glutamicumSYPS-062为本实验室前期筛选并保藏的直接利用糖质原料产L-丝氨酸的野生型菌株;C.glutamicum33a△SS为本实验室前期构建并保藏的产L-丝氨酸的重组菌;模式菌株C.glutamicumATCC14067、大肠杆菌JM109及穿梭质粒pk18mobsacB均为本实验室保藏;本文所用的引物见表1。

表1 本文所用的引物
注:酶切位点用下划线标注。
1.1.2试剂
质粒小量提取试剂盒、胶回收试剂盒、柱式Trizol总RNA抽提试剂盒、抗生素、PCR引物等购自上海生工生物工程有限公司;PCR相关酶,限制性内切酶SalI、BamHI、NotI等购自TaKaRa公司;酶活测定试剂购自sigma公司;一步法cDNA合成试剂盒、Power qPCR PreMix(SYBR Green)购自上海捷瑞生物工程有限公司;其他试剂为国产分析纯。
1.1.3培养基
(1) LB培养基(g/L):蛋白胨10;酵母粉 5;NaCl 10(固体培养基,琼脂粉 20);灭菌条件:121 ℃,20 min。
(2)种子培养基(g/L):脑心浸液37;葡萄糖 20;(NH4)2SO410;MgSO4·7H2O 0.5;K2HPO40.2;NaH2PO40.3;灭菌条件:115 ℃, 7 min。
(3)发酵培养基(g/L):蔗糖 100;(NH4)2SO430;CaCO360;KH2PO43;MgSO4·7H2O 0.5;FeSO4·7H2O 0.02;MnSO4·H2O 0.02;原儿茶酸0.03;生物素 5×10-5;盐酸硫胺素 4.5×10-4;灭菌条件:115 ℃,7 min。
(4)谷氨酸棒杆菌感受态培养基(g/L):蛋白胨 10;酵母粉 5;NaCl 10;吐温80 1;甘氨酸 25;灭菌条件:121 ℃,20 min。
(6)谷氨酸棒杆菌电转化培养基(g/L):蛋白胨 5;酵母粉 2.5;NaCl 5;脑心浸液 18.5;山梨醇 91;琼脂粉 20;灭菌条件:121 ℃,20 min。
(7)10%蔗糖筛选培养基(g/L):脑心浸液37;蔗糖 100;(NH4)2SO410;MgSO4·7H2O 0.5;K2HPO40.2;NaH2PO40.3;琼脂粉 20;灭菌条件:115 ℃,7 min。
1.2实验方法
1.2.1重组质粒pk18mobsacB-2gapA的构建
在基因组上增加基因拷贝数的重组质粒构建方法参考文献[9]。质粒构建流程图如图2所示。
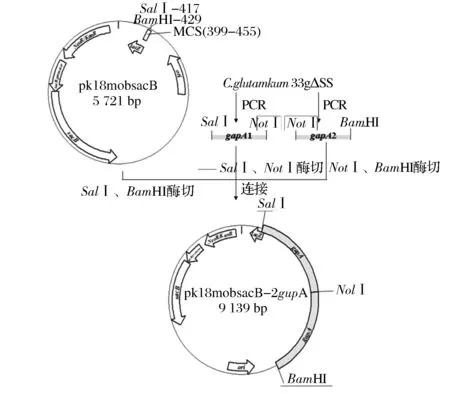
图2 重组质粒pk18mobsacB-2gapA构建流程图Fig.2 The flow chart of the construction of the recombinant plasmid pk18mobsacB-2gapA
以C.glutamicum33a△SS基因组为模板,采用引物P1/P2和P3/P4分别扩增含有不同酶切位点的片段gapA1和gapA2,片段总长度为1 709 bp,片段不仅包括gapA基因编码区(1005 bp)还包括gapA基因与其上下游基因之间的间隔序列(上游间隔序列488 bp,下游间隔序列216 bp),使得扩增的片段涵盖该基因的启动子区和终止子区。将胶回收后的gapA1片段以BamHI和NotI双酶切,gapA2片段以NotI和SalI双酶切,并同时双酶切质粒pk18mobsacB。胶回收酶切后的片段和质粒,T4DNA连接酶过夜连接。将连接产物化转E.coliJM109,提取质粒,采用根据pK18mobsacB多克隆位点上下游序列设计的通用引物P5/P6进行PCR验证,采用限制性内切酶BamHI和SalI进行酶切验证。
1.2.2重组菌33a△SS-2gapA的构建
将成功构建的重组质粒pk18mobsacB-2gapA电转化33a△SS感受态细胞[10],在含50 μg/mL Kan的平板中进行第1次同源重组[11]。挑取重组子在含Kan的种子培养基中过夜培养,稀释涂布于10%蔗糖筛选培养基平板进行第2次同源重组。待长出单菌落后,挑取二次重组子,采用根据gapA上下游基因的编码区设计的引物P7/P8进行菌落PCR验证。
1.2.3GAPDH酶活力的测定
取培养至对数生长期的种子或发酵液10 mL离心,用100 mmol/L Tris-HCl洗涤菌体3次。用1 mL的Tris-HCl重悬菌体,在冰浴条件下超声破碎45 min (破3 s,停7 s)。离心去除细胞碎片得到上清液即为粗酶液,再采用Bradford蛋白定量试剂盒[12]进行蛋白浓度定量。
酶活力测定方法参考文献[8]。GAPDH酶活在25 mmol/L磷酸盐缓冲液(pH 7.5)中进行测定,体系中包括0.2 mmol/L EDTA,5 mmol/L NAD+,5 mmol/L 3-磷酸甘油醛。
1单位酶活力定义:在37 ℃、pH 7.5的反应条件下,每分钟生成1 μmol NADH所需的酶量,(NADH μmol/min)。其中NADH摩尔吸光系数采用6.22×103M-1·cm-1[8]。
比活力=酶液稀释倍数×ΔA340×Vt/(e×Vs×d×C)
式中:ΔA340为吸光度值变化率,min-1;Vt为反应体系总体积,mL;e为摩尔吸光系数,M-1·cm-1;Vs为粗酶液体积,mL;d为比色杯光径,cm;C为蛋白的质量浓度,mg/mL。
1.2.4GAPDH相对转录水平的测定
总RNA提取按柱式Trizol总RNA抽提试剂盒说明书进行。将重组菌和出发菌的RNA定量成相同浓度后进行逆转录。以重组菌和出发菌的cDNA为模板进行RT-qPCR。16S rRNART-qPCR采用引物P9/P10,gapART-qPCR采用引物P11/P12。以16S rRNA的Ct值作为内参计算GAPDH的转录水平。RT-qPCR反应体系如下:2×Power qPCR PreMix 10 μL,ROX Reference Dye(50×) 0.4 μL,cDNA模板2 μL,引物(Forward +Reverse) 4 μL,ddH2O 3.6 μL,总体积20 μL。反应程序如下:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,72 ℃ 45 s,循环40次。每个样品重复3次。RT-qPCR结果采用2-△△Ct方法[13]对基因的Ct值进行定量分析。
1.2.5发酵参数的测定
生物量的测定:紫外分光光度计测定OD562值;DCW (g/L) = 0.192 5×OD562。
糖和氨基酸浓度的测定:采用高效液相色谱法(HPLC)测定[14]。
2 结果与分析
2.1产L-丝氨酸的野生型菌株与模式菌株GAPDH酶活力的比较
取对数生长期的ATCC14067与SYPS-062种子液,测定GAPDH酶活力,测定结果如图3 (A)所示,SYPS-062的GAPDH酶活力为(0.804±0.006) U/mg,比ATCC14067[(0.516±0.005) U/mg]高了55.8%。取同一批种子液,比较SYPS-062与ATCC14067的GAPDH转录水平,结果如图3 (B)所示,SYPS-062的GAPDH转录水平为ATCC14067的91.9%,在转录水平上未见明显差异。

图3 ATCC14067与SYPS-062中GAPDH酶活力和转录水平比较Fig.3 The specific enzyme activity and relative transcriptional level comparisons of GAPDH between ATCC14067 and SYPS-062
进一步比较C.glutamicumSYPS-062(GenBank accession: JXBH00000000)与C.glutamicumATCC14067(GenBank accession: AGQQ00000000)GAPDH的核糖体结合位点(RBS)[15]和编码区序列,发现两者GAPDH的RBS序列一致;在GAPDH编码区存在1个氨基酸序列的差异,第249位氨基酸在ATCCC14067中为苏氨酸,而在SYPS-062中为异亮氨酸。于是推测ATCC14067与SYPS-062的GAPDH酶活力差异可能是由它们GAPDH编码区的氨基酸序列差异所致。鉴于ATCC14067无法积累L-丝氨酸,而SYPS-062能产L-丝氨酸,推测较高的GAPDH酶活力有利于L-丝氨酸积累,拟在菌株C.glutamicum33a△SS上进一步加强表达GAPDH,以期提高L-丝氨酸的产量。
2.2重组菌与出发菌GAPDH相对转录水平的测定
采用1.2.1与1.2.2中的方法,成功构建了重组质粒pk18mobsacB-2gapA与重组菌C.glutamicum33a△SS-2gapA。取对数生长期的重组菌和出发菌发酵液,测定GAPDH相对转录水平,测定结果如图4所示。从图4可以看出重组菌GAPDH转录水平为出发菌的2.19倍。在基因组上增加gapA拷贝数后重组菌GAPDH的转录水平得到了提高。

图4 33a△SS和33a△SS-2gapAGAPDH相对转录水平的测定Fig.4 Therelative transcriptional level of GAPDH in 33a△SS and 33a△SS-2gapA
2.3重组菌与出发菌GAPDH酶活力的测定
取对数生长期的重组菌和出发菌发酵液,测定GAPDH酶活力,测定结果如图5所示。重组菌GAPDH酶活力为(1.052±0.025) U/mg,为出发菌[(0.688±0.005) U/mg]的1.53倍。在基因组上增加gapA拷贝数后重组菌GAPDH的酶活力提高。

图5 33a△SS和33a△SS-2gapA GAPDH酶活力测定Fig.5 The specific activity of GAPDH in 33a△SS and 33a△SS-2gapA
2.4重组菌发酵性能评价
在以100 g/L蔗糖为底物的发酵培养基中比较重组菌和对照菌的发酵性能。菌体的生长曲线如图6 (A)所示,从图6 (A)可以看出,重组菌的生长速率在24 h~60 h期间明显快于出发菌,发酵至84 h重组菌OD达到最大值51.40,其最大比生长速率为0.209 h-1,比出发菌(0.189 h-1)提高了10.6%,可见加强表达GAPDH能够提高重组菌的生长速率。菌体的糖耗曲线如图6 (B)所示,可以看出,在菌体的对数生长期(24 h~48 h)重组菌的糖耗速率明显快于出发菌,发酵至84h重组菌糖消耗完毕,其总糖耗速率为1.18 g/(L·h),比出发菌(1.13 g/(L·h))提高了4.4%,可见加强表达GAPDH能够提高重组菌的糖耗速率。菌体的产酸曲线如图6 (C)所示,从图6 (C)可以看出,发酵至84h重组菌的L-丝氨酸产量达到最大值23.73 g/L,比出发菌(20.21 g/L)提高了17.4%;重组菌糖酸转化率达0.239 g/g 蔗糖,比出发菌(0.213 g/g 蔗糖)提高了12.2%;重组菌生产强度达0.283 g/(L·h),比出发菌[0.241 g/(L·h)]提高了17.4%;可见加强表达GAPDH能够提高重组菌的产量、糖酸转化率和生产强度。重组菌和出发菌84 h时的发酵参数如表2所示。综上所述,加强表达GAPDH的代谢工程策略能够获取更高效合成L-丝氨酸的重组菌株。
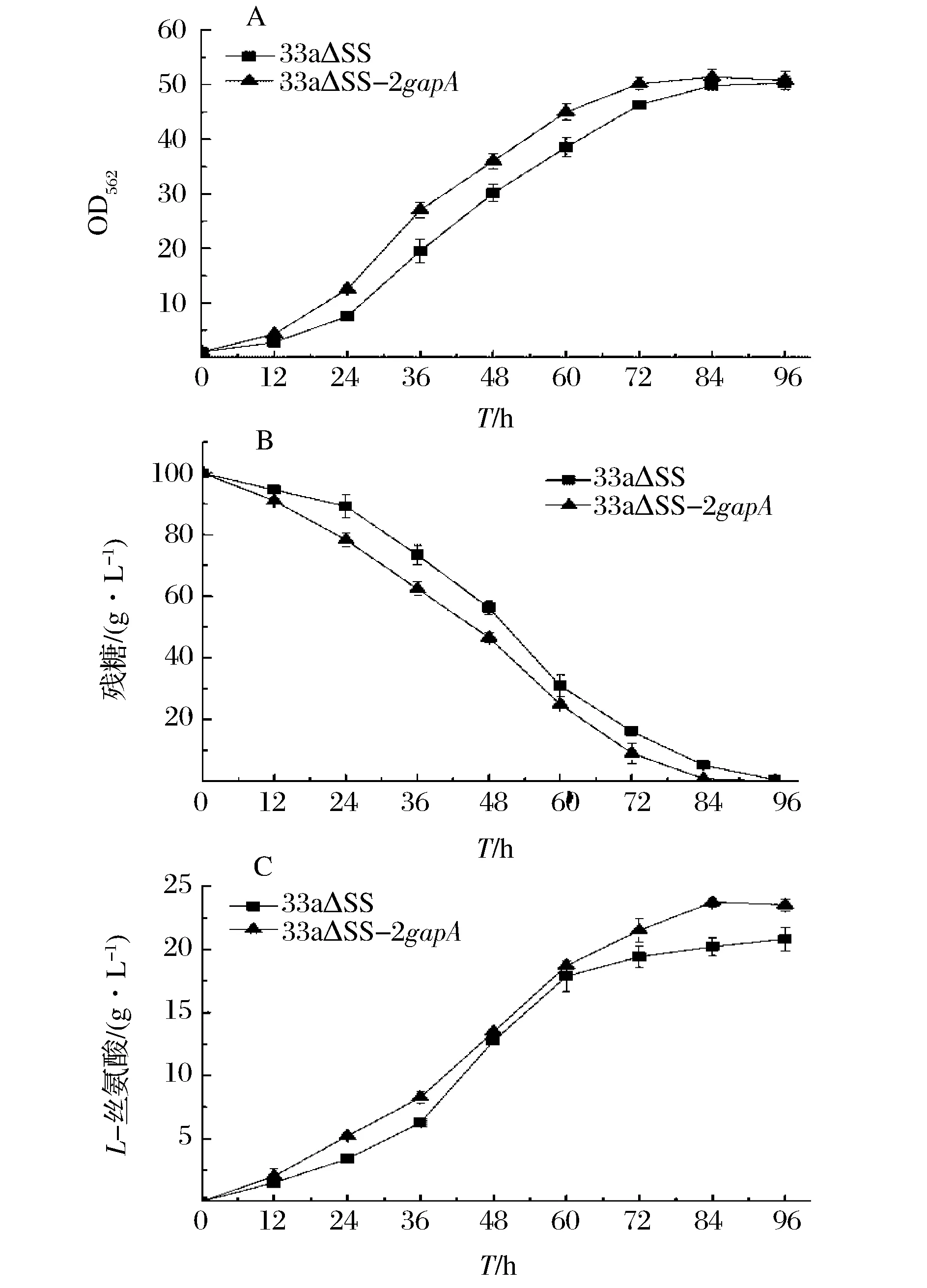
(A) 生长曲线; (B) 糖消耗曲线; (C) L-丝氨酸生产曲线图6 出发菌33a△SS和重组菌33a△SS-2gapA发酵性能比较Fig.6 The fermentation performancecomparison of 33a△SS and 33a△SS-2gapA
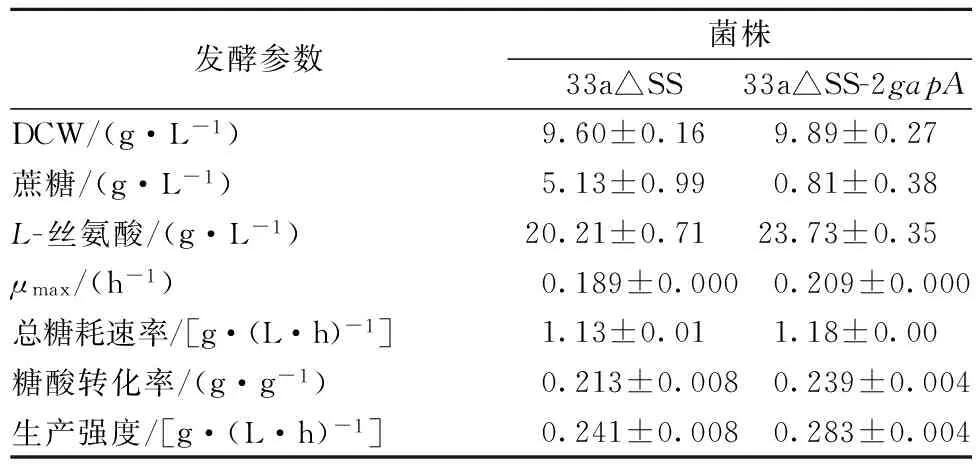
发酵参数菌株33a△SS33a△SS-2gapADCW/(g·L-1)9.60±0.169.89±0.27蔗糖/(g·L-1)5.13±0.990.81±0.38L-丝氨酸/(g·L-1)20.21±0.7123.73±0.35μmax/(h-1)0.189±0.0000.209±0.000总糖耗速率/[g·(L·h)-1]1.13±0.011.18±0.00糖酸转化率/(g·g-1)0.213±0.0080.239±0.004生产强度/[g·(L·h)-1]0.241±0.0080.283±0.004
3 结论
本文首先比较了产L-丝氨酸的野生型菌株C.glutamicumSYPS-062与模式菌株C.glutamicumATCC14067的GAPDH酶活力,发现SYPS-062的GAPDH酶活力比ATCC14067高了55.8%。两者的GAPDH编码区存在一个氨基酸序列差异,推测酶活差异是由该氨基酸序列差异所致,进一步证明还有待后续实验对该酶进行酶学性质研究。鉴于ATCC14067无法积累L-丝氨酸,而SYPS-062能产L-丝氨酸,推测较高的GAPDH酶活力有利于L-丝氨酸积累。进而以C.glutamicum33a△SS为出发菌株,在其基因组上增加了1个gapA的拷贝数,构建了加强表达GAPDH的重组菌C.glutamicum33a△SS-2gapA,并考察了该酶的加强表达对谷氨酸棒杆菌产L-丝氨酸的影响。鉴于质粒加强表达的不稳定性及需要在发酵过程中添加抗生素等缺点,采用在基因组上增加gapA拷贝数的方法加强表达GAPDH。比较重组菌和出发菌中GAPDH的转录水平和酶活力,重组菌GAPDH转录水平和酶活力分别提高119%和53%。发酵实验结果表明,重组菌最大比生长速率提高10.6%,糖耗速率提高4.4%,L-丝氨酸产量提高17.4%,糖酸转化率提高12.2%,生产强度提高17.4%。可见加强表达GAPDH能够提高重组菌的生长和糖耗速率,并能够提高L-丝氨酸的产量、糖酸转化率和生产强度。本文首次报道了加强表达GAPDH的代谢工程策略能够获取更高效合成L-丝氨酸的重组菌株。
[1]GU Peng-fei, YANG Fan, SU Tian-yuan, et al. Construction of anL-serine producingEscherichiacolivia metabolic engineering [J]. Journal of Industrial Microbiology & Biotechnology,2014, 41(9):1 443-1 450.
[2]ZHANG Xiao-mei, XU Guo-qiang, LI Hui, et al. Effect of cofactor folate on the growth ofCorynebacteriumglutamicumSYPS-062 andL-serine accumulation [J]. Applied Biochemistry and Biotechnology,2014, 173(7):1 607-1 617.
[3]VERTES A A, INUI M, YUKAWA H. Postgenomic approaches to using corynebacteria as biocatalysts [J]. Annual Review of Microbiology,2012, 66:521-550.
[4]PETERS-WENDISCH P, NETZER R, EGGELING L, et al. 3-Phosphoglycerate dehydrogenase fromCorynebacteriumglutamicum: the C-terminal domain is not essential for activity but is required for inhibition byL-serine [J]. Applied Microbiology and Biotechnology, 2002, 60(4):437-441.
[5]STOLZ M, PETERS-WENDISCH P, ETTERICH H, et al. Reduced folate supply as a key to enhancedL-serine production byCorynebacteriumglutamicum[J]. Applied Environmental Microbiology,2007, 73(3):750-755.
[6]XU Guo-qiang, ZHU Qin-jian, LUO Yu-chang, ZHANG Xiao-mei, et al. Enhanced production ofL-serine by deletingsdaAcombined with modifying and overexpressingserAin a mutant ofCorynebacteriumglutamicumSYPS-062 from sucrose [J]. Biochemical Engineering Journal,2015, 103:60-67.
[7]LAI Shu-juan, ZHANG Yun, LIU Shu-wen, et al. Metabolic engineering and flux analysis ofCorynebacteriumglutamicumforL-serine production [J]. Sci China Life Sci,2012, 55(4):283-290.
[8]YAMAMOTO S, GUNJI W, SUZUKI H, et al. Overexpression of genes encoding glycolytic enzymes inCorynebacteriumglutamicumenhances glucose metabolism and alanine production under oxygen deprivation conditions [J]. Applied Environmental Microbiology, 2012, 78(12):4 447-4 457.
[9]BECHER J, ZELDER O, HAFNER S, et al. From zero to herodesign-based systems metabolic engineering ofCorynebacteriumglutamicumforL-lysine production [J]. Metabolic Engineering,2011, 13(2):159-168.
[10]VAN DER REST ME, LANGE C, et al.A heat shock following electroporation induces highly efficient transformation ofCorynebacteriumglutamicumwith xenogeneic plasmid DNA [J]. Applied Microbiology Biotechnology, 1999, 52(4):541-545.
[11]SCHAFER A, TAUCH A, JAGER W, et al. Small mobilizable multi-purpose cloning vectors derived from theEscherichiacoliplasmids pK18 and pK19: selection of defined deletions in the chromosome ofCorynebacteriumglutamicum[J]. Gene, 1994, 145(1):69-73.
[12]BRADFORD MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72:248-254.
[13]LIVAK KJ, SCHMITTGEN TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method [J]. Methods, 2001, 25(4):402-408.
[14]ZHU Qin-jian, ZHANG Xiao-mei, LUO Yu-chang, et al.L-Serine overproduction with minimization of by-product synthesis by engineeredCorynebacteriumglutamicum[J]. Applied Microbiology Biotechnology,2015, 99(4):1 665-1 673.
[15]KOICHI T, HARUHIKO T, MASAYUKI I, et al. Involvement of the LuxR-Type transcriptional regulatorramA in regulation of expression of thegapA gene, encoding glyceraldehyde-3-phosphate dehydrogenase ofCorynebacteriumglutamicum[J]. Journal of Bacteriology, 2009, 191(3): 968-977.
Effects of glyceraldehyde-3-phosphate dehydrogenase overexpression onL-serine production inCorynebacteriumglutamicum
GUO Wen1,2, LAI Lian-he1, ZHANG Xiao-mei1, SHI Jin-song1, XU Zheng-hong1,2*
1(Laboratory of Pharmaceutical Engineering, School of Pharmaceutics Science, Jiangnan University, Wuxi 214122, China)2 (The Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, China)
InCorynebacteriumglutamicum, the reaction catalyzed by glyceraldehyde-3-phosphate dehydrogenase (GAPDH) is the rate-limiting step in the glycolysis pathway, also, it influences the biosynthesis of theL-serine precursor 3-phosphoglycerare directly. In this study, firstly, the GAPDH activity of the wild-typeL-serine-producing strainC.glutamicumSYPS-062 and the model strainC.glutamicumATCC14067 were compared. The GAPDH activity in SYPS-062 was 55.8% higher than that in ATCC14067. Then, GAPDH was overexpressed by insertion of an additional gapA copy into genome ofC.glutamicum33a△SS to construct the recombinant strainC.glutamicum33a△SS-2gapA. The transcriptional level and the enzyme activity of GAPDH in the recombinant strain were increased by 119% and 53% respectively. The fermentation experiment showed that the maximum specific growth rate was increased by 10.6%, the sugar consumption rate was increased by 4.4%, theL-serine production was increased by 17.4%, the yield was increased by 12.2%, and the productivity was increased by 17.4% in the recombinant strain. These results demonstrated that overexpression of GAPDH could increase the growth and sugar consumption rate, and improve the production, yield and productivity ofL-serine in the recombinant strain.
glyceraldehyde-3-phosphate dehydrogenase;Corynebacteriumglutamicum;L-serine
10.13995/j.cnki.11-1802/ts.201609003
硕士研究生(许正宏教授为通讯作者,E-mail:zhenghxu@jiangnan.edu.cn)。
2016-03-08,改回日期:2016-03-18
