耐超高温α-淀粉酶的研制
2016-10-13李谢晟高二学生项目研究者张四槐项目指导教师
李谢晟(高二学生,项目研究者)张四槐(项目指导教师)
耐超高温α-淀粉酶的研制
对射线处理后的地衣芽孢杆菌进行筛选,获得一株能耐100℃高温的菌株。对菌株产生的酶进行酶学性质研究表明,该酶在100℃下,酶活力是27500u/mL,耐高温性和酶活力指标均超过国家标准。进行产酶发酵中试和超滤、盐析提取实验,结果是超滤法比盐析法回收率高12.5%,酶的比活力高45.9%,成本低20%。酶制剂在酶活力、热稳定性优于国家优等品标准,具有实用价值。
下文介绍该项目研制的过程。
一、材料与方法
(一)实验材料和药品
1.菌株
地衣芽孢杆菌(B.licheniformis),由湖南农大提供。
2.培养[1]
(1)琼脂平板培养基。培养基配方∶胰蛋白胨1.5g,酵母膏0.7g,NaCl1.0g,琼脂2.0g,可溶性淀粉1.0g,pH值7.0,其余为水,合计总重100g。上述100g配料混匀后分放于培养皿,0.1MPa灭菌30-35min,冷却到室温,制成琼脂复壮培养基备用。
(2)基础培养基。不加琼脂,其他与琼脂平板培养基相同。
(3)筛选培养基:在基础培养基上加入2%琼脂和0.01%曲利本蓝。
(4)扩大培养基配方:胰蛋白胨1.0-1.5%,酵母膏0.5-0.7%,NaCl0.9-1.1%,可溶性淀粉1%,pH值6.5-7.0,其余为水,合计总重5kg,0.1MPa灭菌30-35min,冷却到40℃,制成扩大培养基,备用。
(5)液态发酵培养基配方:(NH4)2SO40.22-0.27%,KH2PO40.30-0.37%,CaCl20.015-0.02%,可溶性淀粉0.25-0.30%,胰蛋白胨0.35-0.45%,玉米粉2.9-3.5%,pH值6.5-7.0,其余为水,合计总重50kg,0.1MPa灭菌30-35min,冷却到40℃,制成液态发酵培养基,备用。
3.主要试剂、材料
硅藻土,原碘液,稀碘液[2],磺化聚砜∶超微滤膜(型号YM-200),20g/L可溶性淀粉溶液,磷酸缓冲液,NaOH溶液(0.5mol/L),盐酸溶液(0.1mol/L)。曲利本蓝。
4.主要仪器
板框压滤机,Unic7200型可见分光光度计,PL303型电子天平,HH-6型恒温水浴锅,电子万用炉,PHS-3C型pH计,离心机,XK96-B型快速混匀器,高压消毒器,超净工作台,培养箱,恒温箱。
(二)实验方法
1.菌株筛选、分离
取活化培养的地衣芽孢杆菌,加入装有45mL无菌水的小三角瓶中,取0.1mL梯度稀释(10-5、10-4、10-3)涂布到筛选平板上,37℃±1℃培养60h,测量D/d(水解圈直径/菌落直径)值,挑选出比值较大的保存。
之后,将筛选得到的菌纯化后进行液体培养。培养60h,取培养液离心后收集上清液,经超滤浓缩得到酶液,在100℃下进行α-淀粉酶活性测定,选取酶活高的菌株进行传代培养。
2.产酶发酵
(1)基础培养:取平板培养后的地衣芽孢杆菌,接种于100mL基础培养基中,180r/min、36℃±1℃恒温培养40h。
(2)扩大培养:取步聚(1)制成的琼脂培养基菌种,按扩大培养基重0.8%的接种量,接种到冷却到40℃的扩大培养基,36℃±1℃恒温培养60-70小时。恒温培养时,不断搅拌通风,搅拌速度为300-320转/分钟,通风量为1.3-1.5立方气体/升培养基/分钟,制成扩大培养液。
(3)液态发酵培养:取(2)步聚的扩大培养液,按液态发酵培养基重2.5-3.5%的接种量,接种到冷却到40℃的液态发酵培养基中,36℃±1℃恒温培养60-70小时。恒温培养时,不断搅拌通风,搅拌速度为300-350转/分钟,通风量为1.3-1.5立方气体/升培养基/分钟,制成液态发酵液。
2.淀粉酶活力的测定
国标法——分光光度计法[2]
方法步骤:吸取可溶性淀粉溶液20.00mL于各具塞试管中→加入缓冲液5.00mL摇匀→控温5min→加入稀释好的待测酶液1.00mL→计时、摇匀、准确反应5min→吸取反应液1.00mL→加稀碘液5.00mL,摇匀→稀碘液作空白,于波长660nm处迅速测定吸光度。
根据其吸光度查表Al,求得测试酶液的浓度(c),再计算酶活力。
X=c×n×16.67。(式中:X—样品的酶活力(u/mL),c—测试酶的浓度,n—样品的稀释倍数,16.67—换算常数)
3.α-淀粉酶最适温度的测定:在磷酸缓冲液(pH值6.0)的反应体系中[2],将反应温度分别控制在50℃、60℃、70℃、80℃、85℃、90℃、95℃、100℃、105℃、110℃、115℃下,分别用1%淀粉溶液作为底物进行酶催化反应,测量酶活力[2]。
4.α-淀粉酶热稳定性的测定[3]:取适量酶液(添加或不添加Ca2+)分别在不同温度(70℃、80℃、90℃、95℃、100℃、105℃、110℃和115℃)下保温1h后,迅速置于4℃冰箱内降温,然后统一在标准条件下测定残余酶活,以未处理的酶液的酶活设为100%。
5.α-淀粉酶最适pH值的测定[2]:配制pH值分别为4.0、4.5、5.0、5.5、6.0、6.5的醋酸盐缓冲液和pH值分别为7.0、7.5、8.0、8.5的Tris-HCl缓冲液,通过改变反应体系的pH值,测定不同pH值下酶活力大小。
6.α-淀粉酶的提取、纯化。
(1)方法1:板框压滤→酶的超滤浓缩及精制。
粗滤:往上述发酵好的液态发酵液中添加液态发酵液重4-6%的硅藻土,混合均匀后装入板框压滤机,以0.6兆帕压力压滤,实现固液分离,收集酶的滤液。工作原理是依靠压紧装置将滤板压紧,再将悬浮液用泵压入滤室,通过滤布来达到将固体颗粒和液体分离的目的。
酶的超滤浓缩及精制[4]:酶的滤液中含有许多无机盐、糖和氨基酸之类的低分子物质,它们对酶制剂的颜色、气味、酶含量等都有很大的影响。α-淀粉酶的分子质量在10000Da-100000Da之间,这个范围恰好在超滤技术应用的范围之内。采用超滤技术过滤粗酶液,低分子物质和盐类可以与水一起经膜孔除去,而酶被浓缩和精制。以微滤膜(磺化聚砜)将步聚4粗滤液过滤浓缩5倍,浓缩液以塑料桶装,在室温(5-25℃)温度下保存即可。
(2)方法2:酶的盐析法浓缩及精制[3]。技术路线:离心→硫酸铵盐析→透析、除盐。具体操作:将发酵液进行离心(40℃,8000r/min,30min),收集上清液取→取上清液,经40%硫酸铵盐析,4℃静置4h,离心(40℃,9000r/min,30min)取上清夜→以80%硫酸铵盐析,4℃静置过夜,离心(40℃,10000r/min,30min)收集沉淀→用少量蒸馏水溶解沉淀,通过透析方法除盐。
二、结果与分析
1.菌株筛选、分离结果
用选择平板进行初筛,以水解圈大小为指标,初筛到5个菌落(分别标号为:ABCDE)对这五个菌落进行3次划线分离、纯化。
把A、B、C、D、E菌分别进行液体培养,收集酶液,在100℃下测α-淀粉酶活性,C、D菌株产生的α-淀粉酶在100℃下有活性,其中D菌株较高,为27500u/mL。
2.酶的作用温度
实验测定温度对α-淀粉酶活性影响的结果如表1。
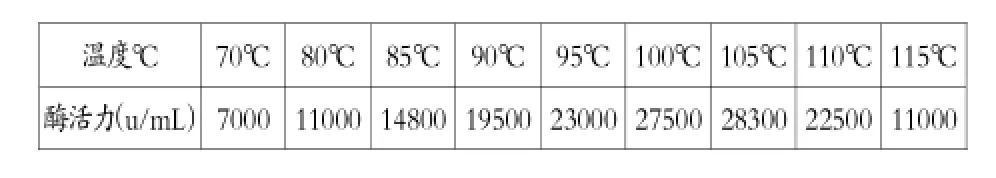
温度℃70℃80℃85℃90℃95℃100℃105℃110℃115℃酶活力(u/mL)7000 11000 14800 19500 23000 27500 28300 22500 11000
数据表明,菌株产生的α-淀粉酶在pH值为6.0时,酶作用的最适温度为105℃左右。105℃时,酶活力为28300u/mL。在110℃仍有81%的酶活力,以国家标准2000u/mL考虑,适宜温度范围92-110℃。从70℃到105℃,随温度升高,活性增长;超过105℃,酶活性随温度升高而降低。
3.酶的热稳定性
酶的热稳定性实验结果如表2。

温度70℃80℃90℃95℃100℃105℃110℃115℃对照组相对酶活力100% 100% 100% 100% 100% 95% 80% 40% 100%
数据表明在最适温度105℃下处理1小时后,酶耐热性存活率95%,100℃以下酶耐热性存活率100%。国家标准[2]为:酶耐热性存活率95℃,60min大于或等于95%。说明此α-淀粉酶热稳定性好,高于国家标准。
4.反应pH值对酶活性的影响
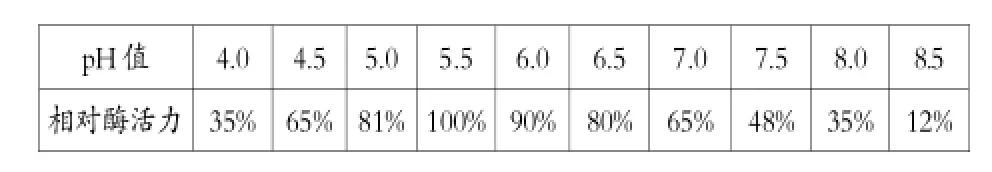
表3反应pH值对酶活性的影响
从表3可以看出,该酶的最适pH值为5.5左右,在pH值5.0-6.5之间,酶活性在80%以上,是一种适合偏酸型的α-淀粉酶。pH值在4.0-5.5时,随pH值升高,酶活性增强。超过5.5,随PH值升高,酶活性降低。
5.α-淀粉酶的提取、纯化
发酵液经两种提取、纯化方法分别得到发酵上清液、硫酸铵沉淀纯化液,板框压滤液、超滤纯化液,对上述四种提取物进行酶活、回收率、纯化倍数进行测定和计算
两种分离纯化结果如表4。
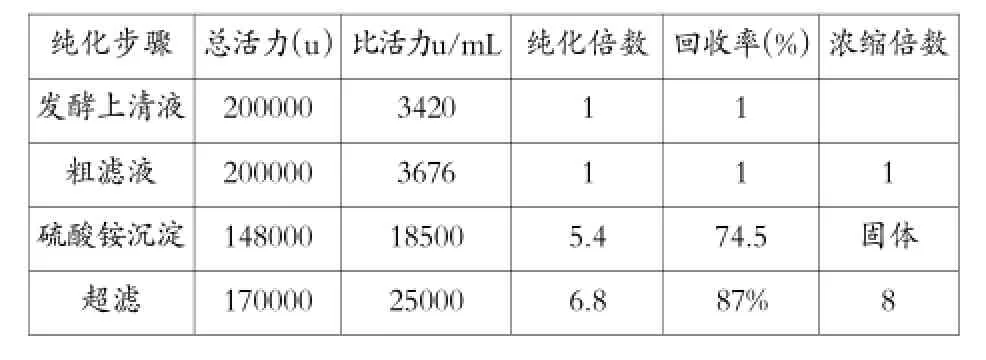
表4α-淀粉酶分离纯化
进行统计分析,方法1与方法2相比,P<0.01,差异显著。数据表明,超滤法比盐析法回收率高12.5%,酶的比活力高45.9%,说明超滤法比盐析法在收到的酶数量、酶活性高,且差异显著。超滤法提取成本低20%。
三、讨论
淀粉的水解过程通常包括两步:液化和糖化。在液化阶段,淀粉颗粒在喷射罐105-110℃经过5min的高温喷射糊化成液状。如果糊化温度低于105℃,则淀粉糊化不完全,将影响后续的过滤过程。但目前使用的α-淀粉酶最适作用条件为90℃,在温度高于100℃时,会使酶失活。因此耐超高温α-淀粉酶成为目前研究的热点。本研究用地衣芽孢杆菌(B. licheniformis)发酵产生的耐超高温α-淀粉酶最适温度为105℃,在110℃仍有81%的酶活力且酶活力超过国家标准,适合理想的液化条件。酶活力为28300u/mL,比国家标准20000提高了41%,催化效率高,降低生产成本,因此该酶有实用价值。
酶制剂的传统生产工艺是发酵、絮凝沉淀、过滤、溶剂萃取、真空蒸发、干燥,其生产过程能耗高、酶失活率高、收率低。膜分离技术具有节约能源、降低损耗、可在常温下连续操作、过程简单、高效、无相变、分离系数较大等优点[5]。实验数据表明,对于α-淀粉酶的提取,超滤法比盐析法回收率高12.5%,酶的比活力高45.9%,成本低,说明超滤法适合α-淀粉酶的分离、提纯。
此酶制剂符合国标,是一种应用广的α-淀粉酶制剂,具有应用推广价值。
(作者单位:娄底市第三中学娄底市第五中学)
[1]陈晨.耐高温α-淀粉酶菌株的筛选、发酵条件优化及酶基因的克隆.2009中南大学硕士论文
[2]中华人民共和国轻工行业标准QB/T2306 -1997,耐高温α-淀粉酶制剂.
[3]王淑军、陆兆新、秦松等.超嗜热古菌耐热酸性α-淀粉酶的发酵条件和酶学性质研究[J],海洋与湖沼,2009年1月.
[4]李香莉,吕莉萍,肖凯军.膜分离技术在酶制剂工业中的应用[J].食品研究与开发.
[5]石方方,焦国宝,丁长河,屈建航,屈凌波,刘仲敏.耐酸耐高温α-淀粉酶的研究进展[J].中国食品添加剂,2014年第4期.
