白藜芦醇的抗肺腺癌作用机制研究
2016-10-13王桂平钟英英李智斌张彦焘
王桂平 叶 云 钟英英 李智斌 张彦焘
(1广州医科大学卫生职业技术学院系统生物与肿瘤研究中心,广东 广州 510180;2广西科技大学生物与化学工程学院,广西 柳州 545006)
·论著·
白藜芦醇的抗肺腺癌作用机制研究
王桂平1*叶云2钟英英2李智斌1张彦焘1
(1广州医科大学卫生职业技术学院系统生物与肿瘤研究中心,广东 广州 510180;2广西科技大学生物与化学工程学院,广西 柳州 545006)
目的:采用生物信息学和系统生物学途径,研究白藜芦醇的抗肺腺癌作用机制。方法:从GEO数据库获取白藜芦醇处理肺腺癌的表达谱数据集(No:GSE9008),经质量分析和标化后,采用dchip软件筛选差异表达基因;采用GO注释工具对差异基因进行生物过程注释;采用Toppgene工具对差异基因进行信号通路富集分析;通过CMAP进行药物作用机制或药理作用预测分析。结果:对比白藜芦醇和乙醇作用于A549细胞的表达谱,获得116个显著差异表达基因,其中上调基因92个,下调基因24个;差异表达基因主要涉及细胞凋亡、黏附等生物学过程;白藜芦醇可能通过调节p53、DNA损伤修复、细胞外基质(ECM)糖酵解过程等信号通路而发挥抗肺腺癌作用;CMAP分析显示,白藜芦醇的抗肺腺癌作用与类雌激素或激素作用、抗炎作用、抑制微生物生长、Hsp90抑制作用等相关。结论:白藜芦醇的抗肺腺癌作用机制复杂,可能与其具有的抗炎、抗微生物、雌激素或激素效应等有关。
白藜芦醇;肺肿瘤;腺癌;系统生物学;基因表达谱
据世界卫生组织数据显示,肺癌已成为严重危害人类健康的第一位恶性肿瘤,肺腺癌则是最为常见的肺癌类型[1]。目前,肺癌的临床疗效仍不理想,5年生存率始终徘徊在10%~15%左右。因此,采用新的高效低毒的治疗药物或化疗增效剂,对改善肺癌的治疗具有重要意义。
白藜芦醇属于多酚类化合物,广泛存在于葡萄(红葡萄酒)、虎杖、桑椹等植物中,特别是红葡萄酒中含量最多。白藜芦醇具有丰富而多样的药理活性,如退烧与止痛、抗癌作用、心血管保护作用、抗血栓功能、抗氧化及抗菌作用等。同时,白藜芦醇已成为国际肿瘤治疗研究领域的热点,它对乳腺癌、胃癌、结肠癌、前列腺癌、白血病等多种恶性肿瘤细胞均有明显的抑制作用[2-3]。相关的研究对白藜芦醇的作用机制有不同解释,但不能从根本上给出一个有说服力的假说,那为什么白藜芦醇能调节如此多样的生物学过程呢?为什么有如此广谱的抗癌作用呢?当前的机理研究仍然停留在简单的实验设计或是半随机模型的研究,因此,作用机制的研究难以深入和缺乏说服力。本项目将采用系统生物学和生物信息学等多种方法,系统的研究白藜芦醇可能的抗肺癌机制,为白藜芦醇的临床应用提供依据。
1 材料与方法
1.1GEO数据集的获取
从Pubmed的GEO数据库(http:www.ncbi.nlm.nih.gov/geo)中获取白藜芦醇处理肺腺癌表达谱数据集(No:GSE9008)。该数据集采用affy公司的HG-133 plus 2芯片平台,含4个基因表达谱数据。纳入研究的生物样本来源于25 mmol/L白藜芦醇或乙醇处理的A549细胞(48 h)。
1.2显著差异表达基因的筛选
dchip 软件分析包(www.dchip.org)是由哈佛大学开发的、基于Windows平台的综合性芯片分析软件[4],可进行差异基因、层次聚类等芯片数据分析。表达谱数据先进行芯片质量分析,合格的数据集被选择进行差异基因分析及后续生物数据分析,具体差异表达基因分析按dchip操作指南进行(http://www.chenglilab.net/software.html),采用2样本t检验方法筛选差异基因,最终选择2-fold差异的基因作为差异表达基因。
1.3GO生物功能聚类分析
Gene Ontology是目前使用最为广泛的蛋白质功能数据库,可对蛋白质的生物学通路和功能进行注释,该数据库包括分子功能(MF),细胞组成(CC)和生物过程(BP)3个部分。本研究采用Gene Ontology对获得的差异表达基因进行生物学功能聚类分析,以期阐明白藜芦醇抗肺腺癌的生物学过程途径。
1.4生物信号通路分析
本项目采用Toppgene(http://toppgene.cchmc.org/)在线分析工具,对获得的差异表达基因进行生物信号通路分析,以探索白藜芦醇抗肺腺癌作用的生物信号通路途径。Toppgene是个有效而方便的基于基因功能相似性的蛋白、基因及生物信号通路富集筛选方法。具体分析方法按在线操作指南进行(https://toppgene.cchmc.org/)[5]。
1.5CMAP数据分析
Connectivity map (CMAP, build 02)数据库含有7 000个表达谱数据,涉及1 309种化合物,可应用于发现具有相似作用的药物、提示药物作用机制等[6]。其原理为比对疾病表达谱与药物表达谱数据,然后以非参数的Kolmogorov-Smirnov统计学方法进行排列,获得正分值的药物表示与输入的药物可能存在相似的作用或作用机制。 为进一步探讨白藜芦醇的作用机制,我们将上述获得的差异上或下调基因分别输入到CMAP中进行表达谱相似比对筛选分析。
2 结 果
2.1芯片数据预处理
本研究从GEO数据库获得白藜芦醇处理肺腺癌表达谱数据集(No:GSE9008),包括对照样本1个和3个实验样本。为对丢失数据进行填补、清除不完整的数据或合并重复数据等,我们采用RMAexpress 软件进行质量分析和数据归一化处理,本研究纳入的样本均具有较高的质量,实验重复性较好,见图1。

876543210876543210AB
注:A:数据没有进行归一化处理;B:归一化处理后的数据
图1芯片数据M-A散点图
2.2白藜芦醇差异显著基因分析
采用dchip软件包对GSE9008数据集芯片样本进行差异基因分析,白藜芦醇处理A549细胞组与乙醇处理组比较共有116个差异表达基因,其中在2~4倍值之间下调表达基因,共18个,4倍以下表达下调的基因,共6个;2~4倍值之间上调表达基因,共86个,4倍以下表达上调的基因,共6个。见图2。
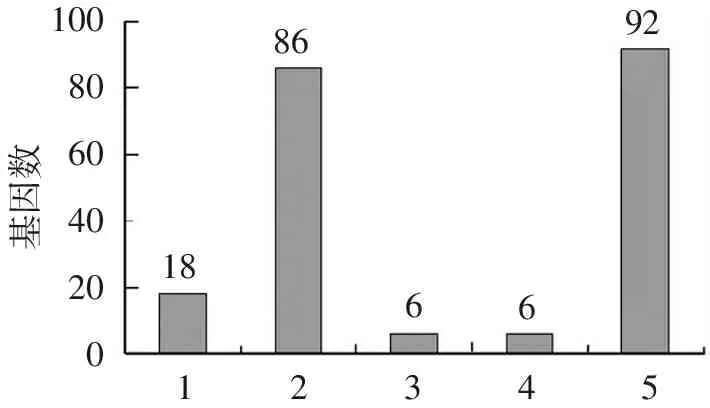
100806040200基因数1886669212345
注:1:2~4倍下调;2:2~4倍上调;3:>4倍下调;4:>4倍上调;5:下调合计
图2差异基因分布图
2.3白藜芦醇差异显著基因功能聚类分析
为获得白藜芦醇作用于肺癌A549细胞差异基因的整体生物学功能,本研究采用Gene Ontology 在线分析工具,主要从生物过程方面分析上调或下调差异表达基因,见表1。差异下调的基因没能获得有统计学意义的生物学过程,而差异上调的92个基因中,共获得12条有统计学意义的生物学过程,主要涉及细胞凋亡、生物调节、生物黏附和代谢过程等生物学过程。
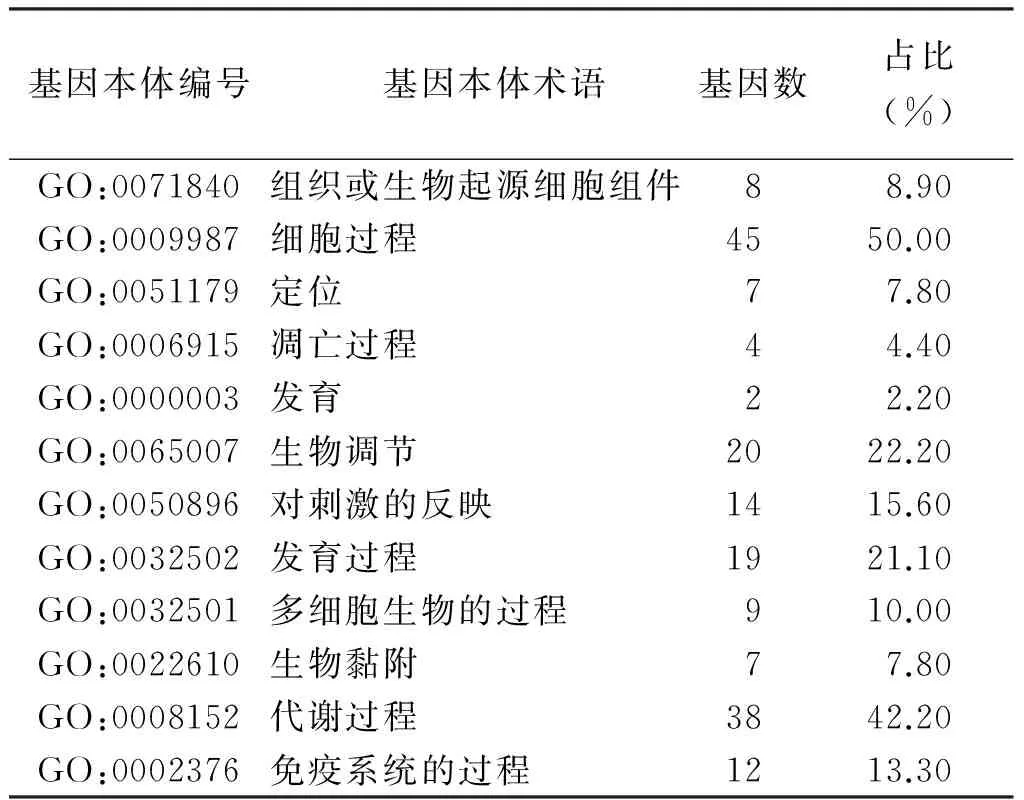
表1 白藜芦醇作用A549细胞差异上调基因的GO分析
2.4信号传导通路生物信号通路聚类分析
信号传导通路紊乱或失调与肿瘤的发生、发展及预后关系密切,为从生物信号传导途径探讨白藜芦醇抗肺癌作用机制,本研究采用Toppgene分析工具,对白藜芦醇作用于A549细胞的差异显著基因进行信号通路分析,在下调的差异基因中,没能获得有统计学意义的信号通路,而在上调的差异表达基因中,获得20条有统计学意义的信号传导通路,主要涉及p53、DNA损伤修复、ECM 糖酵解过程、细胞周期调控等信号传导通路,特别是其中有5条信号通路涉及p53途径,提示白藜芦醇可能主要通过调节p53信号通路,发挥抗肺癌作用。见图3。
进一步对涉及p53信号通路的基因进行分析,白藜芦醇主要上调CDKN1A等11个与p53信号通路相关的基因表达,其中白藜芦醇通过上调CDKN1A、MDM2、GADD45A、FAS、ATF3和VDR等基因的表达,产生抗肿瘤作用已得到实验证实,此也说明本研究方法的可靠性。见表2。

图3白藜芦醇作用A549细胞差异上调基因的信号通路富集分析
2.5相似作用机制药物富集分析
为从宏观基因组学上探索白藜芦醇抗癌作用可能机制,本研究采用CMAP分析工具,通过寻找有相似功能的药物或化合物,以此研究白藜芦醇可能的抗肺癌机制。通过表达谱比对分析,发现白藜芦醇与美雌醇、倍氯米松、萘美酮等10种药物表达谱的变化相似,提示白藜芦醇抗癌作用涉及类雌激素或激素作用、抗炎作用、抗菌作用等。见表3。同时,在CMAP分析结果中,发现白藜芦醇抗乳腺癌或前列腺癌表达谱具有高的富集分数,提示白藜芦醇具有好的抗乳腺腺癌、前列腺癌作用,也说明本项目研究的可靠性,见图4。

表2 白藜芦醇上调p53通路相关基因
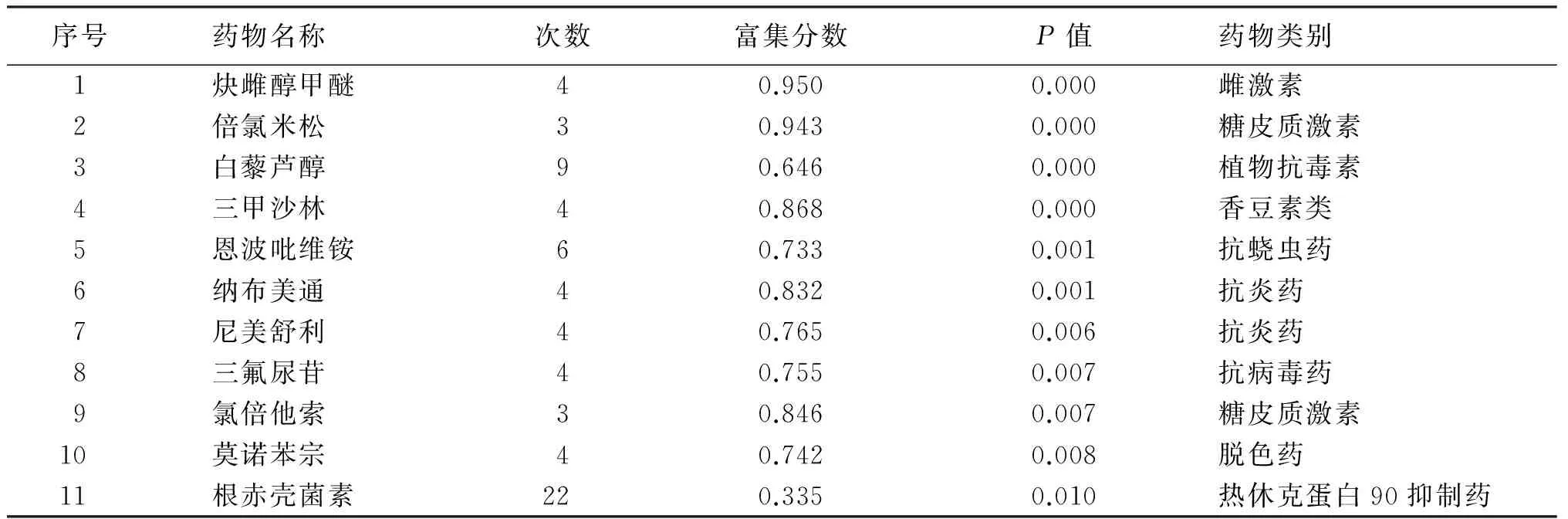
表3 基于CMAP筛选白藜芦醇抗肺腺癌作用的相似药物
注:选择P<0.05的候选药物

注:Resveratrol:白藜芦醇
图4白藜芦醇富集分析
3 讨 论
白藜芦醇是一种生物活性很强的天然多酚类物质,是多种肿瘤的化学预防剂,对肺癌、肝癌、乳腺癌等多种肿瘤细胞具有抑制和杀伤作用,成为抗肿瘤领域新研究热点[7]。虽然,白藜芦醇具有多样而复杂的生物效应,但其作用机制仍不清楚,影响其进一步的临床应用及衍生物的开发。难道白藜芦醇真是一种 “全能神药”,可以解决诸多临床问题?因此,需要采用新的手段和方法系统研究该药的作用机制。本项目采用生物信息学分析方法,对比白藜芦醇和乙醇作用于A549细胞的表达谱变化,获得116个显著差异表达基因,其中上调基因92个,下调基因24个。差异基因的生物过程分析显示,白藜芦醇主要通过上调细胞凋亡、生物调节、生物黏附和代谢过程等生物学过程中相关基因而发挥抗癌作用。
信号转导通路的异常或紊乱是肿瘤发生和发展的重要原因,调节异常信号转导通路已成为癌症治疗的重要策略。白藜芦醇可通过影响凋亡通路、炎症信号通路[核因子(NF)-κB]和p38 丝裂原活化蛋白激酶(MAPK)通路,以及磷脂酰肌醇-3激酶/苏氨酸激酶(PI3K/AKT)等信号通路而发挥抗肿瘤作用[8]。本研究发现,白藜芦醇通过调节p53、DNA损伤修复、ECM糖酵解过程、细胞周期调控等信号传导通路中相关基因而发挥抗癌作用。上调p53信号途径中相关基因的表达可能是白藜芦醇发挥抗肺癌作用的主要机制,此与其他学者的研究相似[9]。白藜芦醇主要上调CDKN1A、MDM2、GADD45A、FAS、ATF3和VDR等11个与p53信号通路相关的基因的表达发挥抗癌作用,这些已在相关的研究中得到证实[8,10-11]。而p53通路中PMAIP1,TGFA,FDXR和BTG2等基因可能是白藜芦醇抗癌作用的新靶基因,此需要进一步的实验研究证实。上述数据表明,白藜芦醇是通过多种途径发挥调节p53信号通路。
基于药物基因表达谱的相似性,可以发现和挖掘具有相似功能或相似作用机制的药物或化合物,从而阐明药物的作用机制[6]。本项目采用CMAP表达谱数据平台,筛选到美雌醇、倍氯米松、萘美酮等10种候选药物,这些候选化合物主要归类为雌激素或激素药物、非甾体抗炎药、抗病原微生物药(细菌、病毒及寄生虫)、Hsp90抑制剂及抗肿瘤药等,提示白藜芦醇的抗肺腺癌作用与类雌激素或激素作用、抗炎作用、抑制微生物生长、Hsp90 抑制作用等相关。同时,在CMAP分析结果中,发现白藜芦醇抗乳腺癌或前列腺癌表达谱具有高的富集分数,提示白藜芦醇具有好的抗乳腺腺癌、前列腺癌作用。现有的研究已证实,白藜芦醇是一种天然的植物雌激素,它可结合不同雌激素受体而表现雌激素激动或拮抗活性,对心血管疾病的防治及激素依赖性肿瘤的治疗有要意义[12-13]。1963年,科学家就已发现白藜芦醇有抗炎症、抗氧化的作用,是一种COX-1选择性抑制剂,具有广泛而强效的抗炎作用[14-15]。本项目的研究也发现,在富集到10种候选药物中,有倍氯米松、纳布美通、尼美舒利和氯倍他索等4种抗炎药物,此不仅说明本研究方法的可靠性,同时也提示白藜芦醇的抗肺腺癌作用与抗炎作用有重要关系。有趣的是,本研究发现一种Hsp90抑制剂——单孢菌素具有较高的富集分数,提示白藜芦醇的抗肿瘤作用可能与抑制Hsp90蛋白功能相关,此前有报道白藜芦醇通过下调Hsp70蛋白功能而发挥抗白血病作用[16-17]。白藜芦醇是否通过热休克蛋白家族而发挥抗肿瘤作用?此仍需要进一步的研究证实。
综上,本项目基于基因表达谱途径,通过多种生物信息学方法,从药物特征性基因表达谱的生物学过程、信号转导通路及相似表达谱富集分析等角度,系统探讨白藜芦醇抗肺癌机制,白藜芦醇主要通过上调p53等信号通路发挥抗肺癌作用,同时,其抗肺癌机制与类雌激素或激素作用、抗炎作用、抑制微生物生长、Hsp90 抑制作用等相关。
[1] 杨柯君. 全球癌症状况最新数据更新[J]. 上海医药,2014,35(2):5.
[2] Aggarwal BB,Bhardwaj A,Aggarwal RS,et al. Role of resveratrol in prevention and therapy of cancer:preclinical and clinical studies[J]. Anticancer Res,2004,24(5A):2783-2840.
[3] Lu M,Cai YJ,Fang JG,et al. Efficiency and structure-activity relationship of the antioxidant action of resveratrol and its analogs[J]. Pharmazie,2002,57:474-478.
[4] Corradi L,Fato M,Porro I,et al. A Web-based and Grid-enabled dChip version for the analysis of large sets of gene expression data[J]. BMC Bioinformatics,2008,13(9):480.
[5] Chen J,Bardes EE,Aronow BJ,et al. ToppGene Suite for gene list enrichment analysis and candidate gene prioritization[J]. Nucleic Acids Res,2009,37:W305-311.
[6] Lamb J,Crawford ED,Peck D,et al. The Connectivity Map:using gene-expression signatures to connect small molecules,genes,and disease[J]. Science,2006,313:1929-1935.
[7] Carter LG,D'Orazio JA,Pearson KJ. Resveratrol and cancer:focus on in vivo evidence[J]. Endocr Relat Cancer,2014,21(3):R209-225.
[8] Kulkarni SS,Cantó C. The molecular targets of resveratrol[J]. Biochim Biophys Acta,2015,1852(6):1114-1123.
[9] Yuan L,Zhang Y,Xia J,et al. Resveratrol induces cell cycle arrest via a p53-independent pathway in A549 cells[J]. Mol Med Rep,2015,11(4):2459-2464.
[10] Kim YA,Lee WH,Choi TH,et al. Involvement of p21WAF1/CIP1,pRB,Bax and NF-kappaB in induction of growth arrest and apoptosis by resveratrol in human lung carcinoma A549 cells[J]. Int J Oncol,2003,23(4):1143-1149.
[11] Wietrzyk J. The influence of isoflavonoids on the antitumor activity of vitamin D3 [J]. Postepy Hig Med Dosw (Online),2007,61:253-260.
[12] Singh B,Shoulson R,Chatterjee A,et al. Resveratrol inhibits estrogen-induced breast carcinogenesis through induction of NRF2-mediated protective pathways[J]. Carcinogenesis,2014,35(8):1872-1880.
[13] Sheth S,Jajoo S,Kaur T,et al. Resveratrol reduces prostate cancer growth and metastasis by inhibiting the Akt/MicroRNA-21 pathway[J]. PLoS One,2012,7(12):e51655.
[14] Das S,Das DK. Anti-inflammatory responses of resveratrol[J]. Inflamm Allergy Drug Targets,2007,6(3):168-173. [15] Szewczuk LM,Forti L,Stivala LA,et al. Resveratrol is a peroxidase-mediated inactivator of COX-1 but not COX-2:a mechanistic approach to the design of COX-1 selective agents[J]. J Biol Chem,2004,279(21):22727-22737.
[16] Banerjee Mustafi S,Chakraborty PK,Raha S. Modulation of Akt and ERK1/2 pathways by resveratrol in chronic myelogenous leukemia (CML) cells results in the downregulation of Hsp70[J]. PLoS One,2010,14,5(1):e8719.
[17] 裴晶,齐志刚,高燕. 基于生物信息学途径研究阿托伐他汀钙与其他药物的相互作用[J]. 中华生物医学工程杂志,2014,20(5):357-361.
(本文编辑:刘新艳)
Effect and mechanism of Resveratrol on lung adenocarcinoma
WangGuiping1*,YeYun2,ZhongYingying2,LiZhibin1,ZhangYantao1
(1SystemsBiologyandCancerResearchCenter,VocationalandTechnicalInstituteofHealthSciences,GuangzhouMedicalUniversity,Guangzhou,Guangdong510180,China;2SchoolofBiologicalandChemicalEngineering,GuangxiUniversityofScienceandTechnology,Liuzhou,Guangxi545006,China)
*Correspondingauthor:Email:docgpwang@163.com
Objective:Using bioinformatics and systems biology,to investigate the effect and mechanism of Resveratrol on lung adenocarcinoma. Methods:The Resveratrol expression profile data on lung adenocarcinoma (NO. GSE9008) was obtained from GEO databank for quality analysis and standardization,and the differentially expressed genes were screened by dchip software. GO annotation tool was used to annotate the biological process of differentially expressed genes. The signal pathway of the differentially expressed genes was determined by Toppgene tool for enrichment analysis. The drug mechanism or pharmacological effect of Resveratrol was determined by CMAP for predictive analysis. Results:The expression profiles of resveratrol and ethanol on A549 cells were compared,and 116 significantly and differentially expressed genes were obtained,including 92 up-regulated genes and 24 down-regulated genes. Differentially expressed genes were mainly involved in the biological process of cell apoptosis and adhesion. Resveratrol may play the role against lung adenocarcinoma through the signaling pathway of regulating p53,DNA damage repair and extracellular matrix (ECM) glycolysis. CMAP analysis showed that the anti-lung adenocarcinoma effect of Resveratrol was correlated with estrogen or glucocorticoid-like actions,anti-inflammatory effects,anti-microbial activity and Hsp90 inhibition. Conclusion:The mechanism underlying the effect of Resveratrol against lung adenocarcinoma is complex,which may be related to its anti-inflammation,anti-microbial,and estrogen or glucocorticoid actions.
Resveratrol; lung neoplasms;adenocarcinoma; systems biology; gene expression profile
10.3969/j.issn.1008-1836.2016.02.001
Email:docgpwang@163.com
R73-35+4
A
2095-9664(2016)02-0001-05
2016-03-21)
