白藜芦醇的抗结肠癌作用及其机制研究
2016-10-13王纯忠杨邵宇肖慧莲刘丽娜王桂平
王纯忠 杨邵宇 肖慧莲 刘丽娜 王桂平*
(1广州市第一人民医院普通外科,广东 广州 510380;2广州医科大学卫生职业技术学院系统生物与肿瘤研究中心,广东 广州 510180)
·论著·
白藜芦醇的抗结肠癌作用及其机制研究
王纯忠1杨邵宇1肖慧莲1刘丽娜2王桂平2*
(1广州市第一人民医院普通外科,广东 广州 510380;2广州医科大学卫生职业技术学院系统生物与肿瘤研究中心,广东 广州 510180)
目的:观察白藜芦醇对结肠癌SW480细胞生长抑制作用,并探讨其作用机制。方法:采用CCK-8试剂盒评价白藜芦醇对SW480细胞的增殖抑制效应;采用流式细胞技术检测白藜芦醇对SW480细胞的细胞周期和细胞凋亡影响;通过TarFisDock分子对接分析工具,对白藜芦醇可能作用靶点进行预测分析。结果:白藜芦醇可明显抑制结肠癌SW480细胞的生长,白藜芦醇作用24 h时,其IC50值为191.5 μmol/L;而48 h时的IC50值为117.6 μmol/L。流式分析显示,白藜芦醇可使SW480细胞阻滞于G1期,并诱导细胞凋亡。靶点预测分析筛选到10个白藜芦醇作用候选靶点,其中基质金属蛋白酶8(MMP8)、人组蛋白脱乙酰化酶2(HDAC2)、乙酰胆碱酯酶等3个靶点可能是白藜芦醇抗结肠癌的新靶点。结论:白藜芦醇具有良好的抗结肠癌效应,可能成为结肠癌治疗的新的候选药物或增敏剂。
白藜芦醇;结肠肿瘤;SW480细胞;生长抑制
结肠癌是胃肠道中常见的恶性肿瘤之一。在西方发达国家,结直肠癌是仅次于肺癌的第二位恶性肿瘤;而在发展中国家,结肠癌发病也居前5。近20年来,由于人们生活方式和饮食结构的改变,结肠癌发病率有明显上升趋势,严重危害人类健康。因此,寻找新的、高效低毒的新型治疗药物或化疗增效剂,对改善结肠癌的治疗具有重要意义[1]。白藜芦醇属于多酚类化合物,广泛存在于葡萄(红葡萄酒)、虎杖、桑椹等植物中,特别是红葡萄酒中含量最多。目前研究发现白藜芦醇具有丰富的药理活性,涉及退烧与止痛、抗癌作用、心血管保护作用、抗血栓功能、抗氧化及抗菌作用等。近些年,白藜芦醇已成为国际肿瘤治疗研究领域的热点,它对乳腺癌、胃癌、结肠癌、前列腺癌、白血病等多种恶性肿瘤细胞均有明显的抑制作用[2-3]。本项目主要观察白藜芦醇对结肠癌细胞株 (SW480)生长的影响,及探讨白藜芦醇的抗癌机制,为白藜芦醇的临床应用提供依据。
1 材料和方法
1.1材料
人结肠癌细胞株SW480由本实验室保存,采用含10%胎牛血清(FBS,杭州四季青)、双抗(青霉素100 U/mL、链霉素100 U/mL)的RPMI1640培养基,置于37℃、5%CO2培养箱中培养。细胞贴壁生长,以0.25%的胰蛋白酶消化传代,约3 d传代 1次。Sunrise酶标仪(美国Tecan)、96孔聚苯乙烯酶标板(美国Corning)、XDS-1B倒置相差显微镜(中国重庆)、二氧化碳培养箱(美国Forma)。白藜芦醇(美国Sigma),采用二甲基亚砜(美国DMSO)进行溶解,配制成320 μmol/L的母液备用,DMSO的浓度小于0.1%。CCK8购自广州安邦生物科技有限公司。
1.2方法
1.2.1细胞培养与细胞毒性实验采用CCK-8试剂盒进行细胞毒性实验。取对数生长期SW480细胞,按5×105/L密度接种于96孔培养板,每孔200 μL(边缘孔用无菌PBS填充),置37 ℃、5% CO2培养箱培养24 h。随机分7组,即DMSO组和不同浓度稀释的白藜芦醇组(10、20、40、80、160和320 μmol/L),每组3个复孔。药物处理24或48 h后,每孔加入CCK8试剂20 μL,37 ℃孵育1 h,采用酶标仪(450 nm波长)测定各孔A值,实验重复3次。计算细胞抑制率[抑制率=(1-处理组A值/对照组A值)×100%],并绘制抑制曲线。
1.2.2细胞周期和细胞凋亡检测取指数生长期的癌细胞,按1×106/mL浓度接种于6孔培养板,置37 ℃,5%班CO2培养箱培养12 h。对照组加入含有DMSO的培养基,实验组加80和160 μmol/L 白藜芦醇,培养24 h。细胞经0.25%胰蛋白酶消化后,加入70%冰乙醇5 mL混匀固定,4 ℃放置24 h以上。最后加入50 mg/L溴化乙啶(PI),100 mg/L RNase A,0.2% Triton X-100,4 ℃避光染色30 min,采用流式细胞仪检测细胞周期。细胞凋亡检测方法同上,在加入5 μL Annexin V-FITC混匀后,再加入5 μL PI,混匀;室温、避光、反应15 min,1 h内采用流式细胞仪分析。实验重复 3次。
1.2.3药物作用靶点预测分析TarFisDock(http://www.dddc.ac.cn/tarfisdock/)是一个基于网络平台的在线药物作用靶点预测分析平台[4]。该数据平台采用的是分子对接原理,是将已知三维结构的分子入到靶标数据库中,通过不断优化受体化合物的位置、构象、分子内部可旋转键的二面角和受体的氨基酸残基侧链和骨架, 寻找检测分子与靶标大分子作用的最佳构象,筛选出最佳的配体。本研究按TarFisDock操作指南,对白藜芦醇的靶点进行预测分析。首先,在drugbank(http://www.drugbank.ca) 获得白藜芦醇的二维或三维结构,并加入电子,将其转变为mol2分子,然后输入到TarFisDock进行靶点预测分析,按结合能量分数排列,筛选排序前2%的靶点,并删除相关疾病的明确的及重复的靶点。
1.3统计学处理
2 结 果
2.1白藜芦醇对SW480细胞的生长抑制作用
在低剂量时(10、20 μmol/L),白藜芦醇对SW480细胞的抑制作用不明显,无统计学意义(均P>0.05)。但在其他剂量点,白藜芦醇对SW480细胞的生长有明显抑制作用,并且在不同时间点(24和48 h),白藜芦醇对SW480的抑制作用也有统计学差异(均P<0.05)。白藜芦醇作用24 h时,其IC50值为191.5 μmol/L;而48 h时的IC50值为117.6 μmol/L。见图1。

100806040200抑制率(%)1020408016032024h48h24h:IC50=191.5μmol/L48h:IC50=117.6μmol/L浓度(μmol/L)
注:与24 h比较,*P<0.05
图1CCK-8法检测白藜芦醇对SW480细胞生长的抑制作用
2.2白藜芦醇对SW480细胞的细胞周期和凋亡影响
与对照相比,白藜芦醇可使 G1期细胞比例升高,特别是高剂量组(200 μmol/L)尤为明显,200 μmol/L 白藜芦醇剂量组的G1期细胞由(68.46±0.44)%提高(87.84±1.67)%,差异有统计学意义(P<0.05)。本项目结果提示白藜芦醇可阻滞SW480细胞G1期进展,见图2。细胞凋亡研究表明,不同剂量白藜芦醇均不同程度诱导SW480细胞凋亡。对照组细胞总凋亡率为(1.85±0.35)%,白藜芦醇处理24 h后,100 μmol/L和200 μmol/L 白藜芦醇剂量组总凋亡率升高至(3.25±0.23)%和(3.92±0.43)%,差异有统计学意义(均P<0.05)。见图3。
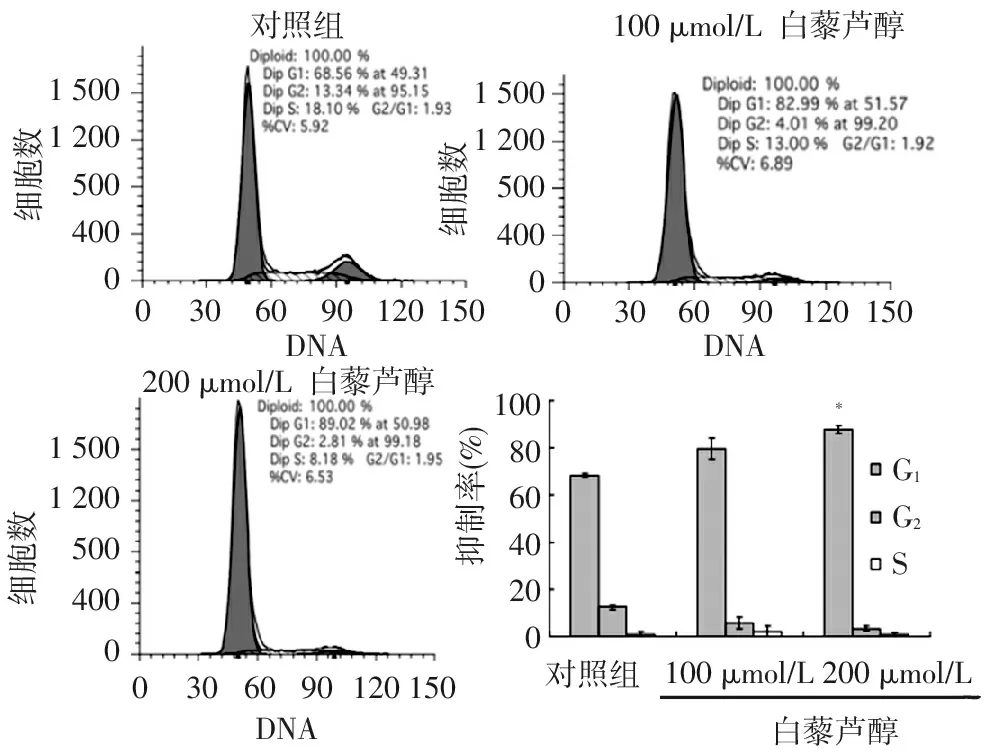
150012005004000150012005004000150012005004000100806040200G1G2S*细胞数30609012015003060901201500DNA3060901201500200μmol/L抑制率(%)细胞数细胞数100μmol/L白藜芦醇对照组DNA200μmol/L白藜芦醇DNA对照组100μmol/L白藜芦醇
图2流式细胞术检测白藜芦醇对SW480细胞周期的影响
2.3白藜芦醇 作用靶位预测分析
TarFisDock由中国科学院上海药物研究所开发,是一个基于网络和蛋白质结构数据库的药物靶位寻找的平台,具有较高的准确性。本项目采用TarFisDock在线分析工具,对白藜芦醇的作用靶点进行初步预测分析,见表1。按结合的能量排序,输入排列前2%的结果,计22个候选靶点,删除相关疾病不明确的及重复的靶点后,最终获得10个靶点,其中基质金属蛋白酶8(MMP8)、人组蛋白脱乙酰化酶2 (HDAC2)、乙酰胆碱酯酶等3个靶点与肿瘤相关。从预测分析表明, HDAC2可能是白藜芦醇抗结肠癌的重要靶点。

100μmol/L白藜芦醇543210细胞凋亡率(%)200μmol/L白藜芦醇对照组对照组200μmol/L100μmol/L**白藜芦醇
注:与对照比较,*P<0.05

图3 流式细胞术检测白藜芦醇诱导SW480细胞凋亡效应
注: 药物候选靶按能量升序排列,仅选取排列位于前2%的靶,删除相关疾病不明确的靶。
3 讨 论
结肠癌是严重危害人类健康的主要恶性肿瘤之一。近年来,结肠癌治疗方法已有较大的发展,但治疗效果仍不理想,术后总体的五年生存率仍为50%~60%。因此,寻求低毒、高效的新型候选药物成为结肠癌治疗的重要热点。近年研究表明,白藜芦醇对肺癌、肝癌、乳腺癌等多种肿瘤细胞具有增殖抑制和促进凋亡作用,它成为抗肿瘤领域新的研究热点[5]。本研究发现,白藜芦醇对结肠癌细胞SW480的生长有良好的抑制作用,白藜芦醇作用24 h时,其IC50值为191.5 μmol/L;而48 h时的IC50值为117.6 μmol/L。同时,发现白藜芦醇可阻滞结肠癌SW480细胞G1期进展,诱导细胞凋亡,提示白藜芦醇对结肠癌也有良好的治疗价值。
白藜芦醇的抗癌机制仍不清楚,细胞周期阻滞是许多抗癌药物的主要抗癌机制。目前,白藜芦醇抗肿瘤细胞增殖作用机制的研究也主要集中在其对细胞周期的影响。有研究表明,白藜芦醇通过抑制CDK7激酶和周期素依赖性激酶 p34(CDC2)而使结肠癌细胞 HT-29 静止在G2期;白藜芦醇也可抑制CDK2和CDK4的活性,从而阻滞结肠癌等多种肿瘤细胞S期进展[6-7]。近期,学者发现白藜芦醇可使结肠癌HCT116和Caco-2细胞产生G1-S期阻滞,其机制与下调CDK2、CDK4、cyclin D1、PCNA和P21的活性有关[8]。本研究也发现白藜芦醇可阻滞结肠癌SW480细胞G1期进展,此与国内刘敏等[9]的研究存在一些差异,其可能原因与白藜芦醇剂量、作用的时间等实验条件等因素有关。白藜芦醇所致的G1期阻滞是否也与抑制CDK2、CDK4等分子活性有关,还是其他机制?此需要进一步研究。
目前,白藜芦醇被发现可通过调节细胞周期、诱导细胞凋亡、抗氧化作用和抗血管形成等多种途径和机制,产生抗结肠癌作用,因此,白藜芦醇肯定通过作用于多种靶点产生抗癌作用。本研究中,我们通过生物信息学方法,筛选到10个白藜芦醇作用候选靶点,其中MMP8、HDAC2、乙酰胆碱酯酶等3个靶点与肿瘤相关。从预测分析表明,HDAC2可能是白藜芦醇抗结肠癌的新型靶点。HDAC是一类蛋白酶,对染色体的结构修饰和基因表达调控发挥着重要的作用。组蛋白去乙酰化酶抑制剂(HDACi)可通过提高染色质特定区域组蛋白乙酰化,从而调控细胞凋亡及分化相关蛋白的表达和稳定性,诱导细胞凋亡及分化,成为一类新的抗肿瘤药物[10-11]。白藜芦醇所致的G1期阻滞或细胞凋亡是否与HDAC2相关?白藜芦醇是否也属于新的HDACi?这些问题需要进一步深入研究。
目前,白藜芦醇对结肠癌的研究相对较少,本研究仅初步探讨白藜芦醇抗结肠癌作用及可能机制,特别是首次发现HDAC2有可能是白藜芦醇抗结肠癌作用的新靶点,但此需要进一步深入探讨,此假说一旦被证实,将极大丰富白藜芦醇的抗癌机制。
[1] Kim JH. Chemotherapy for colorectal cancer in the elderly[J]. World J Gastroenterol,2015 ;21(17):5158-5166.
[2] Aggarwal BB,Bhardwaj A,Aggarwal RS,et al. Role of resveratrol in prevention and therapy of cancer:preclinical and clinical studies[J]. Anticancer Res,2004,24(5A):2783-2840.
[3] Lu M,Cai YJ,Fang JG,et al. Efficiency and structure-activity relationship of the antioxidant action of resveratrol and its analogs[J]. Pharmazie,2002,57:474-478.
[4] Li H,Gao Z,Kang L,et al. TarFisDock:a web server for identifying drug targets with docking approach[J]. Nucleic Acids Res,2006,34:W219-224.
[5] Carter LG,D'Orazio JA,Pearson KJ. Resveratrol and cancer:focus on in vivo evidence[J]. Endocr Relat Cancer,2014,21(3):R209-225.
[6] Liang YC,Tsai SH,Chen L,et al. Resveratrol-induced G2arrest through the inhibition of CDK7 and p34CDC2 kinases in colon carcinoma HT29 cells[J]. Biochem Pharmacol,2003,65(7):1053-1060.
[7] Wolter F,Akoglu B,Clausnitzer A,et al. Downregulation of the cyclin D1/Cdk4 complex occurs during resveratrol-induced cell cycle arrest in colon cancer cell lines[J]. J Nutr,2001,131(8):2197-2203.
[8] Liu B,Zhou Z,Zhou W,et al. Resveratrol inhibits proliferation in human colorectal carcinoma cells by inducing G1/Sphase cell cycle arrest and apoptosis through caspase/cyclinCDK pathways[J]. Mol Med Rep,2014,10(4):1697-1702.
[9] 刘 敏,孟 勇,马清涌,等. 白藜芦醇对人结肠癌 SW 480 瘤株作用的研究[J]. 现代肿瘤医学,2006,14 (5 ):0524 -0526.
[10] Arrighetti N,Corno C,Gatti L. Drug combinations with HDAC inhibitors in antitumor therapy[J]. Crit Rev Oncog,2015,20(1-2):83-117.
[11] 裴晶,齐志刚,高燕. 基于生物信息学途径研究阿托伐他汀钙与其他药物的相互作用[J]. 中华生物医学工程杂志,2014,20(5):357-361.
(本文编辑:刘新艳)
Effect and mechanism of Resveratrol on colon cancer
WangChunzhong1,YangShaoyu1,XiaoHuilian1,LiuLina2,WangGuiping2*
(1DepartmentofGeneralSurgery,GuangzhouMunicipalFirstPeople’sHospital,Guangzhou,Guangdong510380,China;2SystemsBiologyandCancerResearchCenter,VocationalandTechnicalInstituteofHealthSciences,GuangzhouMedicalUniversity,Guangzhou,Guangdong510180,China)
*Correspondingauthor:Email:docgpwang@163.com
Objective:To determine the inhibition of Resveratrol on the cell growth of colon cancer SW480 cells,and to investigate its mechanism. Methods:CCK-8 kit was used to evaluate Resveratrol on the proliferation and inhibition of SW480 cells. Using flow cytometry to determine Resveratrol on the cell cycle and apoptosis of SW480 cells. TarFisDock molecular docking analysis tool was used to predict and analyze the potential targets of Resveratrol. Results:Resveratrol can significantly inhibit the growth of colon cancer SW480 cells. The IC50value of SW480 cells was 191.5 μmol/L and 117.6 μmol/L at 24 h and 48 h under the Resveratrol inhibition,respectively. The flow cytometry showed that Resveratrol could block SW480 cells at G1phase,and induce cell apoptosis. Targets prediction screened out 10 candidate targets of Resveratrol effect,wherein the matrix metalloproteinase 8 (MMP8),human histone deacetylase 2 (HDAC2) and acetylcholinesterase may be the new targets of Resveratrol on colon cancer. Conclusion:Resveratrol shows good effect on colon cancer,which may become a new candidate drug or sensitizer for the treatment of colon cancer.
Resveratrol; colon cancer; SW480 cells; growth inhibition
10.3969/j.issn.1008-1836.2016.02.003
广东省中医药局建设中医药强省项目(20121001)
Email:docgpwang@163.com
R73-35+4
A
2095-9664(2016)02-0009-04
2016-03-09)
