莲黄子复方对裸鼠膀胱癌T24细胞移植瘤的抑制作用*
2016-10-11任瑞锋彭艳军赵文艳赵连梅单保恩
任瑞锋, 彭艳军, 罗 英, 赵文艳, 赵连梅, 单保恩**
(1.华北油田总医院, 河北 任丘 062552; 2.河北医科大学第四医院, 河北 石家庄 050011)
莲黄子复方对裸鼠膀胱癌T24细胞移植瘤的抑制作用*
任瑞锋1, 彭艳军1, 罗英1, 赵文艳1, 赵连梅2, 单保恩2**
(1.华北油田总医院, 河北 任丘062552; 2.河北医科大学第四医院, 河北 石家庄050011)
目的: 研究莲黄子(半边莲、大黄、五加皮、决明子)复方对膀胱癌T24细胞裸鼠移植瘤的抑瘤作用。方法: Nu/Nu裸鼠接种T24细胞构建膀胱癌T24细胞移植瘤模型,15只模型裸鼠随机分为莲黄子复方低剂量治疗组、高剂量治疗组和对照组,每组5只;治疗组裸鼠分别予2.5 mL/kg或5 mL/kg莲黄子复方药液灌胃治疗,对照组予5 mL/kg生理盐水灌胃,治疗当天定义为0天;其后,隔日灌胃,总计7次;治疗后1天开始隔日测量裸鼠移植瘤的体积,末次治疗后第2天处死裸鼠,称量瘤体重量;采用ELISA法检测裸鼠血清肿瘤坏死因子(TNF)-α、粒-巨噬细胞集落刺激因子(GM-CSF)、γ-干扰素(IFN-γ)含量;免疫组织化学法检测裸鼠移植瘤组织凋亡相关蛋白Bcl2和BaX及抑癌基因PTEN的表达。结果: 治疗前各组模型裸鼠移植瘤体积比较,差异无统计学意义(P>0.05);治疗结束时,两种剂量治疗组裸鼠的肿瘤体积和重量均明显小于对照组(P<0.05);同时,相比对照组,两种剂量治疗组裸鼠血清TNF-α含量均明显升高,而GM-CSF、IFN-γ含量则明显降低 (P<0.05);移植瘤组织中Bcl2 表达在高剂量治疗组、低剂量治疗组及对照组间呈现递增的趋势,而Bax和PTEN表达则呈递减趋势,且组间差异均有统计学意义 (P<0.05)。结论: 莲黄子配方对膀胱癌T24细胞裸鼠移植瘤有明显的抑制作用,其机制可能与其诱导PTEN和Bax的表达及抑制Bcl2的表达有关。
莲黄子配方; 膀胱癌; T24细胞; 抑瘤率; 模型; 细胞凋亡
膀胱癌具有高复发率、高转移率的特点,在我国发病率有逐年上升的趋势[1]。临床治疗膀胱癌常采用化学治疗或手术治疗,化学治疗一直使用顺铂类化疗药物,但顺铂单药化疗的副作用较大,而采用手术治疗效果也不理想[2],从中草药中寻找以天然抗癌活性成分为基础的药性强、作用独特、毒性小的治疗膀胱癌的新药显得尤其重要。单一的中药半边莲、大黄,在细胞实验及动物实验中具有一定的抗肿瘤作用 ,决明子可增强机体免疫功能[3]。莲黄子复方(半边莲、大黄、五加皮、决明子)是否能有效抑制膀胱癌T24细胞目前少见报道。本研究通过建立Nu/Nu裸鼠的膀胱癌T24细胞移植瘤模型,并给予不同剂量的莲黄子复方药液灌胃治疗。通过测定裸鼠血清中肿瘤坏死因子(tumor necrosis factor, TNF)-α、粒-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)、γ-干扰素(interferon-γ,IFN-γ)含量,以及瘤体组织中凋亡相关蛋白B淋巴细胞瘤2基因(Bcl-2)、Bcl-2相关X蛋白(BaX)的表达及抑癌基因PTEN的表达,来深入探讨莲黄子复方对裸鼠膀胱癌T24细胞移植瘤的抑瘤效应及机制。
1 材料及方法
1.1主要材料
Nu/Nu裸鼠(雄性,4~6周龄,体质量15~20 g)18只,购自北京大学医学部实验动物科学部。膀胱癌T24细胞株,由中国科学院上海生命科学研究院生物化学与细胞生物学研究所提供。所有裸鼠饲养于河北医科大学第四医院动物实验中心无特定病原体级屏障系统中。莲黄子复方药剂由乐仁堂制备提供(成分主要为半边莲、大黄、五加皮及决明子),常规煎煮水浴浓缩成相当于原生药材2 g/mL的药液,4 ℃冰箱冷藏备有。RPMI 1640培养液购自美国Gibco公司,胎牛清购自杭州四季青工程材料有限公司。兔抗人Bax多克隆抗体、兔抗人Bcl-2多克隆抗体及兔抗人PTEN多克隆抗体购自Santa Cruz公司。
1.2方法
1.2.1细胞培养人膀胱癌癌细胞株T24培养于RPMI 1640培养液(含10%胎牛血清)中,置于37 ℃、5% CO2的培养箱中培养,细胞呈贴壁生长,隔日传代1次。
1.2.2人膀胱癌移植瘤模型构建及分组选取处于对数生长期的T24细胞,常规消化细胞,经磷酸盐缓冲液(PBS)洗涤离心1次后,用无菌生理盐水重悬细胞,并调整细胞密度为1×107/L,取0.2 mL细胞悬液于裸鼠背部行皮下注射,随后继续饲养于SPF环境。每日观察接种部位,待出现质地较硬结节时提示造模成功。本研究共移植裸鼠18只,成功15只。将造模成功的裸鼠按随机数字表法分为3组:对照组、低剂量治疗组及高剂量治疗组,每组裸鼠5只。低剂量治疗组与高剂量治疗组分别给予2.5 mL/kg或5 mL/kg莲黄子复方药液灌胃,对照组以5 mL/kg生理盐水灌胃,灌胃当天定义为0天。其后隔日灌胃1次,共计7次。其间隔日测量裸鼠移植瘤体积。
1.3观察指标
1.3.1瘤体生长情况各组裸鼠在SPF条件下饲养,隔日定时用游标卡尺测量移植瘤最大长径(a)、短径(b),计算肿瘤体积,肿瘤体积=(a2×b)/2,并绘制肿瘤生长曲线。
1.3.2肿瘤抑制率、细胞因子测定末次灌胃次日处死裸鼠,称量瘤体重量。计算抑制率,抑制率(%)= (对照组平均瘤体质量-治疗组平均瘤体质量)/对照组平均瘤体质量)×100%。ELISA检测裸鼠血清中TNF-α、GM-CSF及IFN-γ含量。
1.3.3瘤体组织Bcl-2、BaX及PTEN的表达采用免疫组织化学法检测瘤体组织内Bcl2、BaX及PTEN的表达。瘤体常规取材、制片,分别予兔抗人Bax多克隆抗体、兔抗人Bcl-2多克隆抗体及兔抗人PTEN多克隆抗体(浓度1∶200)4 ℃ 冰箱孵育过夜,经PBS反复漂洗3次后,滴加生物素标记的山羊抗兔IgG(浓度1∶100),于37 ℃孵育1 h,经DBA显色、苏木素复染后,于显微镜下观察。在光学显微镜下观察阳性细胞为细胞质着色,呈棕黄色颗粒状分布。随机选取5 个高倍视野,每个视野计数500 个细胞。以阳性细胞所占百分率进行评分:≤10%为0分,>10%~≤50%为1分,>50%~≤75%为2分,>75%为3分。再按染色强度进行评分:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。上述2项评分相加,0 分为“-”,1~2 分为“+”,3 ~4 分为“++”,5~6 分为“+++”,将“ -”和“+”定义为阴性表达,“++”和“+++”定义为阳性表达。
1.4统计学处理

2 结果
2.1移植瘤的体积、重量
T24细胞移植后4周,裸鼠移植部位可见明显的移植瘤,直径0.4~0.5 cm。在莲黄子复方进行治疗前,各组裸鼠肿瘤体积比较,差异无统计学意义(P>0.05);经莲黄子复方灌胃治疗的第13天,低剂量和高剂量治疗组裸鼠的肿瘤体积和重量均明显小于对照组(P<0.05),提示莲黄子复方对T24细胞得肿瘤生长具有明显抑制作用。见图1和表 1。

对照组 低剂量治疗组 高剂量治疗组图1 用药结束后3组裸鼠移植瘤Fig.1 Comparison of tumor volume in three groups after medication
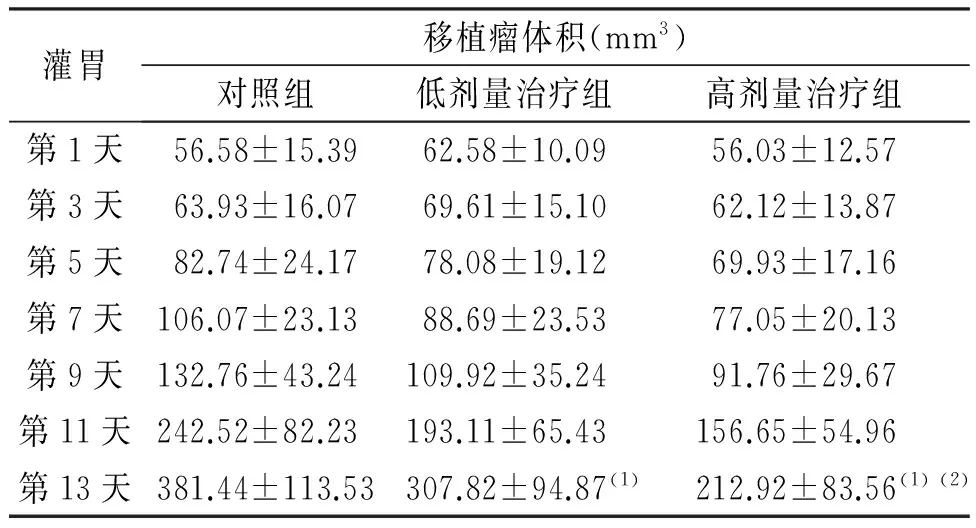
灌胃移植瘤体积(mm3)对照组低剂量治疗组高剂量治疗组第1天56.58±15.3962.58±10.0956.03±12.57第3天63.93±16.0769.61±15.1062.12±13.87第5天82.74±24.1778.08±19.1269.93±17.16第7天106.07±23.1388.69±23.5377.05±20.13第9天132.76±43.24109.92±35.2491.76±29.67第11天242.52±82.23193.11±65.43156.65±54.96第13天381.44±113.53307.82±94.87(1)212.92±83.56(1)(2)
(1)与对照组比较,P<0.05,(2)与低剂量治疗组比较,P<0.05
2.2莲黄子复方对移植瘤抑制率的影响
治疗结束后,低剂量治疗组和高剂量治疗组裸鼠的瘤体重量均明显小于对照组 (P<0.05),并且高剂量治疗组的肿瘤抑制率高于低剂量治疗组。见表2。

表2 3组裸鼠移植瘤瘤重和抑制率比较
(1)与对照组比较,P<0.05
2.3血清TNF-α、GM-CSF、IFN-γ含量及瘤体Bcl-2、Bax、PTEN的表达
与对照组比较, 治疗组裸鼠血清TNF-α含量明显升高,GM-CSF和IFN-γ的含量均明显降低,差异有统计学意义(P<0.05);免疫组织化学结果显示,在高剂量治疗组、低剂量治疗组及对照组移植瘤组织,Bcl-2的表达呈逐渐升高的趋势,而Bax和PTEN的表达则呈逐渐降低的趋势,并且各组间比较,差异有统计学意义(P<0.05)。见图2,表3及表4。

图2 3组裸鼠移植瘤组织中Bcl-2、Bax、PTEN表达Fig.2 The expression of Bcl-2, Bax and PTEN of xenografted tumor tissue in three groups

指标对照组低剂量治疗组高剂量治疗组TNF-α7.5±2.2717.17±6.32(1)17.28±10.60(1)GM-CSF81.63±37.3362.76±10.94(1)60.30±10.42(1)IFN-γ22.5±5.3216.83±3.12(1)17.9±2.83(1)
(1)与对照组比较,P<0.05

表4 3组裸鼠移植瘤组织Bcl-2、PTEN、BaX的阳性表达(n,%)
(1)与对照组比较,P<0.05
3 讨论
膀胱癌是一种常见的泌尿生殖系统肿瘤,占中国恶性肿瘤发病的2.5%,临床上抗肿瘤药物大多通过诱导细胞凋亡而发挥抗癌作用的。作为中药复方制剂的莲黄子复方,其抗癌机制同样有可能与某些凋亡蛋白有关,但目前尚未通过相关研究予以证实。作为促进骨髓细胞增殖和分化的细胞因子,GM-CSF在多种实体瘤中均有表达,可以显著促进肿瘤细胞的生长、侵袭和转移,同时还能够调节巨噬细胞分泌多种细胞因子促进创面的愈合[4-6]。而作为一种能够直接杀伤肿瘤细胞而对正常细胞无明显毒性的细胞因子,TNF-α可以通过介导抗体依赖性的细胞介导的细胞毒作用(ADCC)发挥对肿瘤细胞的杀伤作用。诸多研究提示,中药的某些成份具有加速肿瘤病人的康复[7]。而莲黄子复方中的有效成分即有可能通过促进吞噬细胞中TNF-α的分泌而直接发挥抗膀胱癌的作用,也可能通过促进TNF-α的分泌正反馈促进吞噬细胞的增殖与分化, 间接发挥抗肿瘤的免疫功效[8-9]。本研究结果显示,莲黄子复方灌胃后裸鼠血清中的TNF-α含量明显高于仅使用生理盐水灌胃裸鼠,GM-CSF、IFN-γ含量反而降低(P<0.05),说明莲黄子复方中的中药成分可以提高裸鼠血清中TNF-α含量,降低GM-CSF、IFN-γ含量,从而达到抑制膀胱癌T24细胞裸鼠移植瘤的生长。
莲黄子复方抑制膀胱癌T24裸鼠移植瘤的药理作用和机制是其主要成分半边莲通过提高癌细胞胞内游离钙离子浓度而诱导癌细胞凋亡[10-11]。莲黄子复方中的大黄富含大黄素(emodin),可能产生活性氧(ROS),在多种抗肿瘤药物诱导凋亡的过程中起着介导和调节主要角色[12]。而复方中的五加皮对肿瘤细胞同样具有抑制作用[13]。本课题组前期研究已经明确,五加皮抗肿瘤活性物质是一种分子量大小约64 kDa的蛋白质,而复方中的决明子在免疫方面对巨噬细胞吞噬功能有一定的增强作用[14-15]。本研究发现,高剂量莲黄子复方治疗后裸鼠移植瘤的体积和重量明显低于对照组,高剂量莲黄子复方更明显,这提示,大黄、半边莲、五加皮、决明子的单体和联合作用使得莲黄子配方对膀胱癌T24裸鼠移植瘤的生长有明显的抑制作用。免疫组织化学结果显示,在高剂量、低剂量莲黄子复方治疗组及对照组的裸鼠移植瘤中Bcl-2的表达呈逐渐递增的趋势,而Bax和PTEN表达则逐渐递减 (P<0.05),这表明,莲黄子复方的抗肿瘤作用机制可能是复方中的中药成分在提高了某些促凋亡蛋白和抑癌基因的表达的同时降低了抗凋亡蛋白的表达,从而诱导肿瘤细胞的凋亡,抑制肿瘤细胞的生长。
然而,值得注意的是,癌症的发生本身就是一个非常复杂的病理过程,涉及诸多的诱因及细胞信号通路。尽管本研究初步验证了莲黄子复方对膀胱癌T24细胞的抗肿瘤作用,并对其作用机制进行了浅尝辄止的探索,然而距离其作为一种行之有效的治疗方法在临床广泛应用尚有很远的距离,对此,本课题组将在今后的研究工作中进一步深入探讨。
[1] Kim J, Akbani R, Creighton CJ, et al. Invasive bladder cancer: Genomic insights and therapeutic promise [J]. Clin Cancer Res, 2015(20):4514-4524.
[2] Chou R, Selph SS, Buckley DI, et al. Treatment of muscle-invasive bladder cancer: A systematic review [J]. Cancer, 2016(6):842-51.
[3] 李清媛, 于彩霞, 田宝阁. 中药决明子水提液对小鼠免疫功能的影响[J]. 中国现代药物应用, 2014(9): 32-33.
[4] Morris KT, Khan H, Ahmad A, et al. G-CSF and G-CSFR are highly expressed in human gastric and colon cancers and promote carcinoma cell proliferation and migration [J]. Br J Cancer, 2014(5):1211-1220.
[5] Wang J, Yao L, Zhao S, et al. Granulocyte-colony stimulating factor promotes proliferation, migration and invasion in glioma cells [J]. Cancer Biol Ther, 2012(6):389-400.
[6] 季兴华, 霍建忠. 外源性粒-巨噬细胞集落刺激因子在硬脊膜损伤修复中的实验研究 [J]. 中国药物与临床, 2013(2):168-171.
[7] 刘雪丽, 周学锋, 王君瑜, 等. 中药抗肿瘤作用机制研究进展 [J]. 中国药师, 2016(6):1158-1162.
[8] 翁旭东. 雷公藤红素增强TNF-α对膀胱癌细胞系T24凋亡诱导效应及机制研究 [J]. 浙江实用医学, 2016(1): 4-7.
[9] 丁凯宏. 肿瘤坏死因子在肿瘤研究中的进展 [J]. 吉林医学, 2012(4):823-824.
[10]高东, 刘如玉, 张振林. 半边莲通过钙信号诱导肝癌细胞凋亡的实验研究[J]. 福建中医学院学报, 2006 (6):32-33,49.
[11]胡春萍, 蔡雪婷, 胡婷婷, 等. 木犀草素诱导非小细胞肺癌细胞株A549凋亡和G2周期阻滞 [J]. 中国中药杂志, 2012 (9):1259-1264.
[12]陈青, 李开庭, 田思, 等. 芦荟大黄素复合光动力处理对人乳腺癌细胞抑制增殖和促进凋亡的体外观测[J]. 第三军医大学学报, 2014(21):2162-2166.
[13]刘芳, 杨翠军, 孙黎, 等. 五加皮多糖对人宫颈癌Hela细胞凋亡作用的研究[J]. 时珍国医国药, 2009(5):1178-1179.
[14]单保恩, 斯重阳, 张金忠, 等.中药五加皮抗肿瘤活性成分的分离[J]. 癌变·畸变·突变, 2004(4): 203-205,222.
[15]刘先宁, 朱秀平, 周光荣. 决明子水提液对小鼠腹腔M(φ)吞噬能力的影响[J]. 现代检验医学杂志, 2004 (4):65.
(2016-05-10收稿,2016-08-19修回)
中文编辑: 吴昌学; 英文编辑: 刘华
Inhibitory Effect of Lian-huang zi Compound on Human Bladder Cancer T24 Cells Xenografted Tumor in Nude Mice
REN Ruifeng1, PENG Yanjun1, LUO Ying1, ZHAO Wenyan1, ZHAO Lianmei2, SHAN Baoen2
(1.TheGeneralHospitalofHuabeiOil-fieldsCompany,Renqiu062552,Hebei,China; 2.TheFourthHospitalofHebeiMedicalUniversity,Shijiazhuang050011,Hebei,China)
Objective: To investigate the inhibitory effects of lian-huang zi compound to human bladder cancer T24 cells xenografted tumor in nude mice. Methods: The Nu/Nu nude mice model of xenografted tumor was established by injection of human bladder cancer T24 cells. Fifteen model mice were randomly divided into 3 groups: low dose lian-huang zi compound treatment group, high dose lian-huang zi compound treatment group, and control group. Mice in treatment group received gastric feeding of 2.5 mL/kg lian-huang zi compound(low dose group), 5 mL/kg lian-huang zi compound(high dose group) while mice in control group received gastric feeding of 5 mL/kg 0.9% sodium chloride. The first administration day was termed as day 0. Then, mice received gastric feeding once every two days and totally received 7 times gastric feeding. The tumor volume of mice was measured once every two days from 1 day after administration. The mice were sacrificed after the next day of last administration, and the mice weight and the tumor weight were measured. The serum of mice in each group was collected, and the expression of TNF-α, GM-CSF and IFN-γ were analyzed by ELlSA. The expression of apoptosis associated protein bcl-2 and bax, associated antioncogene PENT in xenografted tumor were detected by immunocytochemistry. Results: There were no difference between the size of xenografted tumor in each group before administration (P>0.05). After treatment, the size or weight of xenografted tumor in the 2 treatment groups were significantly decreased compared with control group (P<0.05). Compared with control group, the content of serum TNF-α significantly increased in the treatment group (P<0.05) while the content of serum GM-CSF and IFN-γ significantly decreased (P<0.05). The expression of apoptosis associated protein Bcl-2 in xenografted tumor increased gradually from the high dose treatment group to the low dose treatment group and control group (P<0.05). The expression of Bax or PTEN in xenografted tumor declined from the high dose treatment group to the low dose treatment group and control group (P<0.05). Conclusions: The lian-huang zi compound can inhibit the growth of human bladder cancer T24 cells xenografted tumor on the nude mice, which may be correlated partly with its induced expression of PTEN and Bax, and its inhibitory effect on the expression of Bcl2.
Lian-huang zi compound; bladder cancer; T24 cells; tumor inhibition rate; models; cell apoptosis
河北省自然科学基金课题(H2015206376)
E-mail:shanbaoen@163.com
R737.14
A
1000-2707(2016)09-1042-05
10.19367/j.cnki.1000-2707.2016.09.012
**
网络出版时间:2016-09-13网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160913.2240.008.html
