大鼠面神经干缺血后面运动核团中嗅觉受体基因的表达*
2016-10-11纪子腾陈慧珍李清斌李爱民
纪子腾, 陈慧珍, 孙 勇, 李清斌, 卓 洋, 李爱民
(徐州医学院附属连云港医院 神经外科, 江苏 连云港 222002)
大鼠面神经干缺血后面运动核团中嗅觉受体基因的表达*
纪子腾, 陈慧珍, 孙勇, 李清斌, 卓洋, 李爱民*
(徐州医学院附属连云港医院 神经外科, 江苏 连云港222002)
目的: 分析大鼠面神经干缺血缺氧对嗅觉受体(OR)基因表达水平的影响。方法: 手术阻断大鼠鼓室段的岩动脉复制大鼠单侧面神经缺血模型,将手术侧作为观察组,对侧作为对照组,分别于术后第1、7及14天取大鼠双侧面运动神经核团,采用基因芯片筛选出观察组表达量高于对照组3倍以上的OR基因,采用RT-PCR法进行验证。结果: 基因芯片扫描筛选出观察组面神经运动核团中表达量高于对照组3倍以上的OR基因为Olr400、Olr358、Olr757、Olr1689及Olr550,术后第1天及第7天,观察组Olr400、Olr757及Olr358的表达量均显著高于对照组,Olr550、Olr1689表达量显著低于对照组(P<0.01);术后第14天,两组Olr400、Olr757、Olr358、Olr550及Olr1689表达量比较,差异无统计学意义(P>0.05);经过RT-PCR法验证,上述5个OR基因在两组面神经运动核团的表达水平与基因芯片检测结果完全一致。结论:OR基因可能参与了面神经损伤的早期修复过程。
面神经损伤; 面神经运动核团; 嗅觉受体基因; 基因芯片; 缺血性损伤; 大鼠,Sprague-Dawley
面神经损伤(facial nerve injury)是神经外科较为常见的疾病之一,可导致损伤区域出现瘫痪症状或面瘫,多由颅脑创伤或医源性损伤引起[1-2]。嗅觉受体(Olfactory Receptor, OR)属于G蛋白偶联受体(G protein-coupled receptor, GPCR)家族,是一种细胞表面受体[3]。哺乳动物的OR一般在鼻腔内嗅觉上皮神经元表面表达,但有研究发现,OR还在特定的非嗅觉组织中表达,因此认为 OR除气味识别功能外,可能还存在更多的生物学功能[1]。OR在人的中枢神经系统表达广泛,人的大脑皮层、丘脑、小脑的浦肯野细胞等部位均有OR表达[4]。但关于OR基因在面神经的表达尚未见报道,本研究通过手术阻断大鼠鼓室段的岩动脉复制大鼠单侧面神经缺血模型,观察手术前后OR基因表达水平的改变。
1 材料与方法
1.1实验动物与试剂
18只7~8周龄雄性SD大鼠(徐州医学院动物中心提供),体质量260~290 g,饲养于SPF环境下,每日光照12 h,自由饮水。总RNA提取试剂为RNAiso Plus#9109(TAKARA)、RNA试剂为RNeasy micro kit (Cat#74004、 QIAGEN、 GmBH及Germany)和RNase-Free DNase Set (Cat#79254、 QIAGEN、GmBH及 Germany),OR基因芯片Agilent Whole Rat Genome Oligo Microarray(4×44K,上海伯豪生物科技有限公司),M-MLV试剂盒(凯基生物,南京)。
1.2方法
1.2.1单侧面神经缺血模型的建立及分组SD大鼠适应性喂养1周后,参照文献[5]复制大鼠单侧面神经缺血模型,采用10%的水合氯醛腹腔注射麻醉大鼠,常规消毒,沿耳廓外上缘做弧形切口,在显微镜下阻断大鼠鼓室段的岩动脉血流,局部采用生理盐水冲洗,彻底止血后缝合手术切口。于术后第1、7及14天时分别处死大鼠,取双侧面神经运动核团,以手术侧(缺血侧)面神经运动核团作为观察组,以对侧作为对照组。
1.2.2OR基因的表达采用基因芯片检测,使用RNAiso Plus#9109提取面神经运动核团的总RNA,采用RNeasy micro kit和RNase-Free DNase Set纯化RNA;应用Agilent Whole Rat Genome Oligo Microarray基因芯片检测OR基因表达,对芯片进行扫描,所得数据采用GeneSpring Software GX 12.6.1 (Agilent technologies, Santa Clara, CA, US)软件分析,筛选出观察组表达量高于对照组3倍以上的OR基因,分别为Olr400、Olr358、Olr757、Olr1689及Olr550;采用RT-PCR法进行验证。
1.2.3基因芯片检测结果的验证采用RT-PCR法,使用1.2.2提取的总RNA,采用一步法进行RT-PCR扩增,实验步骤按照试剂盒说明书进行。RT-PCR的引物序列见表1。PCR反应按照各自最适的条件进行扩增,以GAPDH作为内参,检测OR基因在面神经运动核团中的表达。

表1 OR基因引物序列
1.3统计学方法

2 结果
基因芯片扫描筛选出观察组面神经运动核团中表达量高于对照组3倍以上的OR基因为Olr400、Olr358、Olr757、Olr1689及Olr550;术后第1天及第7天,观察组Olr400、Olr757及Olr358的表达量均显著高于对照组,Olr550、Olr1689表达量显著低于对照组,差异有统计学意义(P<0.01);术后第14天,两组Olr400、Olr757、Olr358、Olr550及Olr1689表达量比较,差异无统计学意义(P>0.05)。见图1。经过RT-PCR法验证,上述5个OR基因在2组面神经运动核团的表达水平与基因芯片检测结果完全一致。见图2。
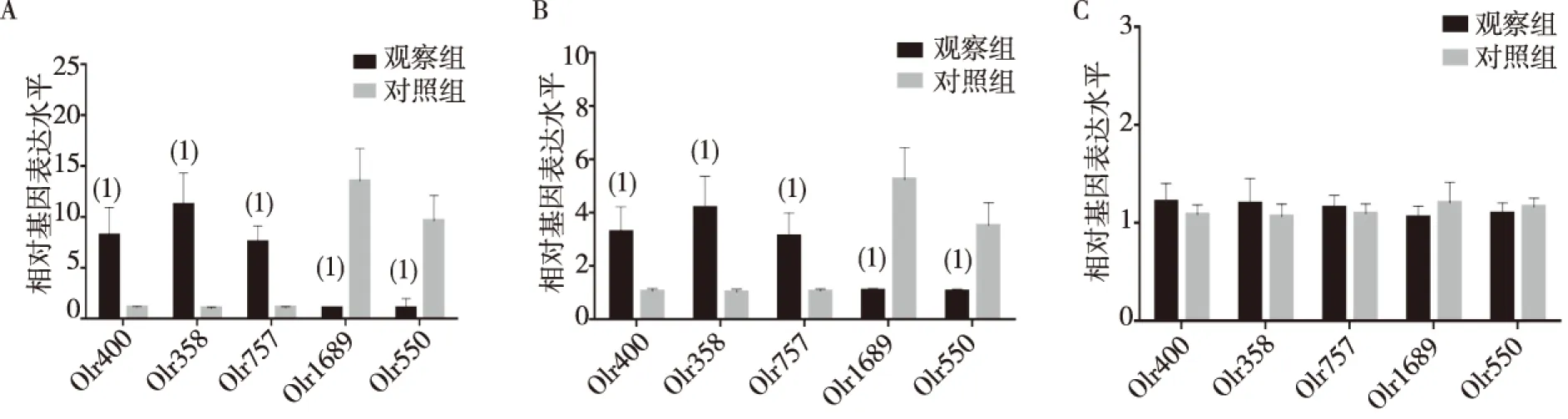
注:A为术后第1天,B为术后第7天,C为术后第14天;(1)与对照组比较, P<0.01图1 基因芯片检测两组面神经运动核OR基因表达Fig.1 Gene chip detection of OR gene expression in facial nerve motor nucleus of two groups
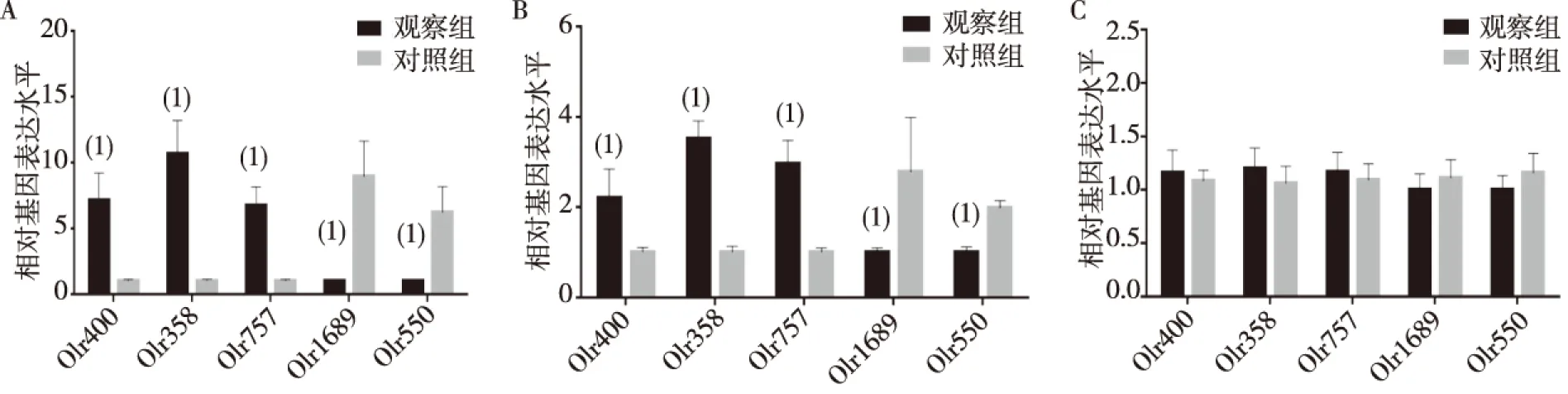
注:A为术后第1天,B为术后第7天,C为术后第14天;(1)与对照组比较, P<0.01图2 RT-PCR验证OR基因表达Fig.2 The expression of OR gene verified by RT-PCR
3 讨论
面神经损伤作为临床较为常见的神经系统疾病,可显著影响患者正常生活。神经损伤后伴随着一系列复杂的修复及代偿过程,但机制尚未明确[6]。分析面神经损伤修复过程中基因表达的改变有望为该疾病的诊疗提供新的思路。OR属于G蛋白偶联受体(G-protein coupied receptor)家族,哺乳动物的OR主要分布在鼻腔后上部的嗅觉神经元的嗅纤毛,发挥识别气味分子的功能。研究发现,OR基因除在人的中枢神经系统表达广泛外,还存在于哺乳动物的其他组织,如睾丸、前列腺、肠道、心脏、皮肤等[7-8]。目前,人们对于OR在非嗅觉组织中所发挥的功能尚不明确,但其广泛的生物学功能提示该基因可能具有多重生物学功能。本研究尝试分析面神经损伤后,OR基因家族在面神经运动核团中的表达改变,以期深入认识OR基因在面神经损伤修复中的作用。
本研究首先建立面神经缺血损伤的大鼠模型,采用单侧手术对侧对照的比较方式,采用两种独立的检查方法分析面神经损伤后OR基因家族在面神经运动核团中的表达改变。基因芯片扫描筛选出观察组面神经运动核团中表达量高于对照组3倍以上的OR基因为Olr400、Olr358、Olr757、Olr1689及Olr550,术后第1天及第7天,观察组Olr400、Olr757及Olr358的表达量均显著高于对照组,Olr550、Olr1689表达量显著低于对照组(P<0.01);术后第14天,两组Olr400、Olr757、Olr358、Olr550及Olr1689表达量比较,差异无统计学意义(P>0.05)。经过RT-PCR法验证,上述5个OR基因在2组面神经运动核团的表达水平与基因芯片检测结果完全一致。提示OR基因在面神经损伤后2周内可能参与面神经运动核团内的病理生理改变,但其具体发挥的功能及相关机制尚需进一步探索以明确。既往研究显示大鼠面神经缺血性损伤模型动物在术后2~3周即可出现面神经功能的部分恢复[9]。面神经并不参与嗅觉传导通路,已有的研究也并未发现面瘫大鼠伴有明显的嗅觉缺失,这些表达差异性的OR基因在面神经中的具体功能还有待蛋白水平上的进一步研究[10]。但这提示OR基因可能参与面神经损伤后的早期神经修复过程,但具体机制不详。OR基因的多功能性越来越受到关注。研究这些OR具体功能的难点在于目前可使用的特异性的OR抗原较少,它们在非嗅觉组织中所对应的配体也难以确定。在基因水平上,非嗅觉组织表达的OR基因正陆续被发现,但对于这些OR基因的调控方式尚有待研究。OR基因在嗅上皮表达的特点是单个嗅觉神经元在接受气味信号后仅表达一个OR基因;当一种OR基因开始表达其他的OR基因立即会被沉默[11]。但人们在睾丸和肌肉等组织中发现单一细胞表达多种OR基因的现象,说明这种“One neuron-one receptor”原则在嗅觉系统以外的组织中可能并不适用[12]。深入对OR基因的研究有望给神经损伤修复的治疗带来新的靶点。
综上,面神经缺血后OR基因在面神经运动核团中发生表达改变,且在术后2周内恢复,提示OR基因可能参与了面神经损伤的早期修复过程。
Malhotra V, Dayashankara RJK, Arya V, et al. Assessment of facial nerve injury with "House and Brackmann facial nerve grading system" in patients of temporomandibular joint ankylosis operated using deep subfascial approach[J]. Natl J Maxillofac Surg, 2015 (2):194-199.
Wang TV, Delaney S, Pepper JP. Current state of stem cell-mediated therapies for facial nerve injury[J]. Curr Opin Otolaryngol Head Neck Surg, 2016 (4):285-293.
Dibattista M, Reisert J. The odorant receptor-dependent role of olfactory marker protein in olfactory receptor neurons[J]. J Neurosci, 2016 (10):2995-3006.
Garcia-Esparcia P, Schlüter A, Carmona M, et al. Functional genomics reveals dysregulation of cortical olfactory receptors in Parkinson disease: novel putative chemoreceptors in the human brain[J]. J Neuropathol Exp Neurol, 2013 (6):524-539.
Chao X, Xu L, Shang H, et al. The injury of marginal mandibular branch unexpectedly promotes the repair of buccal branch of facial nerve in a rat model[J]. Acta Otolaryngol, 2016 (9):956-963.
Sun D, Zhou R, Dong A, et al. Nicotine effects on muscarinic receptor-mediated free Ca level changes in the facial nucleus following facial nerve injury[J]. J Integr Neurosci, 2016 (2):175-190.
Pitts RJ, Liu C, Zhou X, et al. Odorant receptor-mediated sperm activation in disease vector mosquitoes[J]. Proc Natl Acad Sci USA, 2014 (7):2566-2571.
Busse D, Kudella P, Grüning NM, et al. A synthetic sandalwood odorant induces wound-healing processes in human keratinocytes via the olfactory receptor OR2AT4[J]. J Invest Dermatol, 2014 (11):2823-2832.
胡弘毅, 严敏, 郁丽娜, 等. 颈交感神经阻滞对大鼠面神经损伤修复的影响[J]. 中华医学杂志, 2014 (36):2847-2851.
[10]Yabuki Y, Koide T, Miyasaka N ,et al. Olfactory receptor for prostaglandin F2α mediates male fish courtship behavior[J]. Nat Neurosci, 2016 (7):897-904.
[11]Calfún C, Domínguez C, Pérez-Acle T, et al. Changes in olfactory receptor expression are correlated with odor exposure during early development in the zebrafish (Danio rerio)[J]. Chem Senses, 2016 (4):301-312.
[12]Rodriguez I. Singular expression of olfactory receptor genes[J].Cell, 2013 (2):274-277.
(2016-05-25收稿,2016-08-30修回)
中文编辑: 吴昌学; 英文编辑: 刘华
Expression of Olfactory Receptors in Facial Motor Nucleus in Rats' Facial Nerve Ischemia
JI Ziteng, CHEN Huizheng, SUN Yong, LI Qingbin, ZHUO Yang, LI Aiming
(DepartmentofNeurosurgery,theLianyungangAffiliatedHospitalofXuzhouMedicalCollege,Lianyungang222002,Jiangsu,China)
Objective: To analyze the effect of facial nerve ischemia and hypoxia on expression of olfactory receptors(OR). Methods: The rats model of single side nerve ischemia was established by surgical interruption of rock artery in tympanic segment. The operation side was adopted as observation group and the other side as control group. Bilateral motor nuclei of the rat were taken at the 1st, the 7thand the 14thday after operation, respectively. The gene chip was adopted to scan and screen theORgene whose expression level of observation group was 3 times higher than that of control group, and RT-PCR method was used to verify theORgene. Results: TheORgene whose expression level of observation group was 3 times higher than that of control group in face nerve motor nuclei were Olr400, Olr358, Olr757, Olr1689 and Olr550. At the 1st and the 7th day after operation, the expression level of Olr400, Olr757 and Olr358 in observation was significantly higher than that of control group while the expression level of Olr1689 and Olr550 was significantly lower that that of control group (P<0.01). At the 14thday, there was no statistically significant difference in the expression level of Olr400, Olr358, Olr757 and Olr1689 (P>0.05). RT-PCR result showed that the expression level of the 5ORgene in in face nerve motor nuclei of the two groups was completely consistent with the gene chip detection results. Conclusion:ORgene may be involved in the early repair of facial nerve injury.
facial nerve injury; facial nerve motor nucleus; olfactory receptor; microarray; ischemic injury; rats,Sprague-Dawley
E-mail:liaimin6529@hotmail.com
R741
A
1000-2707(2016)09-1053-04
10.19367/j.cnki.1000-2707.2016.09.014
网络出版时间:2016-09-13网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160913.2240.038.html
