pH敏感磁靶向纳米给药系统的构建及其对HepG2肿瘤细胞的作用*
2016-10-11马红岩乔桂红
马红岩, 乔桂红
(商丘医学高等专科学校 临床医学系, 河南 商丘 476005)
pH敏感磁靶向纳米给药系统的构建及其对HepG2肿瘤细胞的作用*
马红岩, 乔桂红
(商丘医学高等专科学校 临床医学系, 河南 商丘476005)
目的: 构建一种新型的磁性靶向pH敏感控释纳米给药系统并考察其对HepG2肿瘤细胞的抑制作用。方法: 将四氧化三铁(Fe3O4)衍生至碳纳米管(CNTs)表面,使用聚乙烯亚胺/聚乙二醇对载体进行修饰,利用聚乙烯亚胺具有的丰富的氨基末端与阿霉素(DOX)结合,通过具有pH敏感的腙键相连构建CNTs-Fe3O4-PEI/PEG-DOX给药系统;分别使用透射电镜(TEM)、X射线衍射仪(XRD)、傅里叶红外光谱仪(FT-IR)、磁强计(VSM)对给药系统进行相关表征分析,考察给药系统热疗升温、载药及pH敏感释放情况;将培养的HepG2肿瘤细胞分为空白对照组、CNTs-Fe3O4-PEI/PEG组、PTT热疗组、DOX组、DOX联合PTT热疗组、CNTs-Fe3O4-PEI/PEG-DOX组、CNTs-Fe3O4-PEI/PEG-DOX联合PTT热疗组、CNTs-Fe3O4-PEI/PEG-DOX磁性靶向联合PTT热疗处理组,使用MTT法检测以上8组中HepG2细胞的抑制率。结果: 成功构建CNTs-Fe3O4-PEI/PEG-DOX纳米给药系统,DOX的载药率为65.04%,pH值降低时,DOX的累计释放率明显迅速升高;该给药系统的磁化强度为19.92 emu/g,具有明显的磁性靶向性;CNTs-Fe3O4-PEI/PEG-DOX在近红外光照射下可在5 min内迅速升温至(58.7±2.5)℃,具有明显的热疗升温作用;给药系统联合热疗对肿瘤细胞具有明显的抑制作用。结论: CNTs-Fe3O4-PEI/PEG-DOX是一种新型的具有磁性靶向、pH敏感控释以及热疗作用的多功能智能化的给药系统,对HepG2肿瘤细胞有较强的抑制率。
磁靶向; 碳纳米管; pH敏感; 阿霉素; 热疗
阿霉素(doxorubicin,DOX)是一种临床上常用的广谱抗癌药物,但其治疗过程中伴随的心脏毒性限制了它的应用[1]。通过纳米载体构建一种可以有效输送DOX到达病变部位,且能在靶向部位控释的给药系统是该类研究的新思路[2]。研究表明,肿瘤部位较正常组织pH值低,利用肿瘤组织与正常组织pH值的差别,构建一种具有pH敏感的控释系统是降低化疗药物毒性的有效途径[3]。近年来,多功能智能化肿瘤靶向纳米给药系统逐渐成为科学家研究的新方向[4-5]。碳纳米管(carbon nanotubes,CNTs)是一种纳米材料,具有多种独特的物理化学性能,可作为多种药物及生物大分子的载体,但单纯的载药并不能满足治疗的需求,给药系统的靶向性是药物能够有效到达靶向部位的关键[6-7]。含有四氧化三铁(Fe3O4)的抗肿瘤给药系统可以通过磁靶向作用将药物准确靶向到肿瘤部位,提高药物的治疗效果,减轻毒副作用[8]。本研究将Fe3O4对CNTs进行衍生化,使用聚乙烯亚胺(PEI)和聚乙二醇(PEG)对载体进行功能化,从而改善CNTs的生物相容性,降低其毒性,提高其体内长循环特性。
1 材料与方法
1.1仪器与材料
盐酸DOX(上海晶纯生化科技股份有限公司),RPMI1640培养基、胎牛血清(美国Hyclone公司),羧基化聚乙二醇2000(distearoyl phosphoethanolamine-PEG2000,COOH-PEG2000,国药集团化学试剂有限公司),羧基苯肼(4-hydrazinobenzoic acid,HBA)、聚乙烯亚胺(polyethyleneimine,PEI,MW=25 000)、1-3-二甲氨基丙基-3-乙基碳二亚胺盐酸盐[N-Ethyl-N′-(3-dimethylaminopropyl)carbodiimide hydrochlorid,EDC]、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS,)、二环己基碳二亚胺(dicyclohexylcarbodiimide,DCC,)及其他试剂均购自美国Sigma公司,人乳腺癌MCF-7细胞系(上海复祥生物科技有限公司)。透射电镜(TEM,Tecnai G2 20型,荷兰FEI公司)、X射线衍射仪(XRD,7000S/L型,日本岛津公司)、傅里叶红外光谱仪(FT-IR,FTIR-7600型,澳大利亚Lambda公司)、磁强计(VSM,型号BHV-55,日本理研电子公司)。
1.2羧基化CNTs(CNTs-COOH)的制备
称取多壁CNTs-COOH 120 mg,置于250 mL圆底烧瓶中,加入混酸溶液(V浓硫酸∶V浓硝酸=3∶1)120 mL,并加入30%过氧化氢12 mL,超声波清洗4 h后,用超纯水稀释,使用0.45 μm微孔滤膜和布氏漏斗抽滤,超纯水冲洗至pH为中性为止,放入烘箱中80 ℃恒温干燥,即得CNTs-COOH。
1.3磁性碳纳米管(CNTs-Fe3O4-COOH)的制备
称CNTs-COOH 20 mg置于100 mL圆底烧瓶中,加入乙二醇-二甘醇混合溶液(V乙二醇∶V二甘醇=1∶19)20 mL,并使CNT均匀的分散在混合溶液中,然后依次缓慢加入醋酸钠0.3 g和FeCl3·6H2O 0.108 g。将上述液体转入聚四氟乙烯内衬高压反应釜并置于200 ℃干燥箱中,保温10 h后自然冷却至室温。将反应釜内产物用无水乙醇和超纯水反复洗涤,真空干燥12 h,即得CNTs-Fe3O4-COOH。
1.4CNTs-Fe3O4-COOH的功能化
将 CNTs-Fe3O4-COOH 200 mg溶于二氯甲烷中50 mL,加入过量PEI及DCC,超声30 min后,冷凝回流反应48 h。使用磁铁收集反应成功的CNTs-Fe3O4-PEI,超纯水洗涤3次,冷冻干燥。将 CNTs-Fe3O4-PEI 50 mg溶于PBS缓冲液50 mL中(pH 7.4),加入 PEG-COOH 1 mg、EDC 50 mg及NHS 25 mg,室温搅拌反应24 h,使用磁铁吸附CNTs-Fe3O4-PEI/PEG,超纯水洗涤3次,冷冻干燥备用。
1.5CNTs-Fe3O4-COOH负载DOX
将CNTs-Fe3O4-PEI/PEG 50 mg和HBA 50 mg加入PBS缓冲液50 mL 中(pH 7.4),然后加入EDC 50 mg及NHS 25 mg,室温下搅拌反应48 h。使用磁铁收集CNTs-Fe3O4-PEI/PEG-HBA,乙醇洗涤3次,冷冻干燥备用。称取CNTs-Fe3O4-PEI/PEG-HBA 50 mg与DOX 80 mg一同加入到DMSO中,室温搅拌避光反应24 h。使用磁铁吸附CNTs-Fe3O4-PEI/PEG-DOX,除去未反应完成的杂质,超纯水洗涤吸附物3次,冻干备用。CNTs-Fe3O4-PEI/PEG的FT-IR图中出现的明显的C-H(2 885 cm-1,3 450 cm-1)振动峰,表明其合成成功[9]。CNTs-Fe3O4-PEI/PEG-HBA出现了新的酰胺特征峰(1 654 cm-1,1 375 cm-1),-NH2弯曲振动峰(1 600 cm-1),表明HBA已被连接至CNTs表面。1 654 cm-1和1 375 cm-1处的特征峰表明DOX已通过腙键连接至CNTs-Fe3O4-PEI/PEG[10]。
1.6给药系统的表征
分别使用TEM、XRD、FT-IR、VSM对制备好的给药系统进行表征,并考察给药系统在808 nm近红外光下产热情况。
1.7给药系统载药量及pH敏感释放性质考察
使用Lambda 35型可见光-紫外扫描仪(美国Perkin-Elmer公司),在490 nm波长处对DOX的载药情况进行考察。同时,通过透析法考察给药系统在不同pH值(pH 5.5和pH 7.4)时释放DOX的情况。
1.8给药系统细胞抑制率考察
HepG2细胞培养于10%胎牛血清及1%青链霉素双抗的RPMI-1640培养液中常规培养,细胞分为空白对照组、CNTs-Fe3O4-PEI/PEG组、PTT热疗组、DOX组、DOX联合PTT热疗组、CNTs-Fe3O4-PEI/PEG-DOX组、CNTs-Fe3O4-PEI/PEG-DOX联合PTT热疗组、CNTs-Fe3O4-PEI/PEG-DOX磁性靶向联合PTT热疗处理组。取对数生长期的HepG2细胞,以0.6×104个每孔接种到96孔板中。培养24 h后,空白对照组加入新鲜培养液,其他组分别加入对应制剂,每组设6个复孔。其中,每组中含有的DOX终浓度为5.2 mg/L(IC50浓度),CNTs-Fe3O4-PEI/PEG为8 mg/L。磁性靶向处理使用永磁铁放置于培养板下相应孔部位。近红外热疗组处理方法为加入制剂6 h后,使用808 nm波长的近红外激光照射,每孔照射2 min。继续培养48 h后弃去培养液,每孔加入新鲜配制的MTT溶液(0.5 g/L),37 ℃孵育4 h,加入二甲基亚砜并振荡,通过酶标仪测定490 nm波长处的吸光度(OD)值,计算各组HepG2细胞抑制率。以上过程重复3次。细胞抑制率=(1-实验组OD值/对照组OD值)×100%。
1.9统计学方法

2 结果
2.1CNTs载体的TEM及XRD分析
单纯CNTs的TEM结果显示,CNTs表面光滑,呈管状(图1A)。CNTs-Fe3O4-COOH的TEM与单纯CNTs相比,管壁表面出现了明显的纳米粒(图1B)。使用XRD法对CNTs-Fe3O4-COOH进行物质结构分析,结果显示在26.32°的2θ角处出现CNTs 002(JCPDS:41-1487)晶面的特征衍射峰,并且出现了220、311、400、422、511、440峰,均为Fe3O4的晶面特征衍射峰(JCPDS:19-0629)(图1C)。
2.2给药系统的FT-IR光谱分析
FT-IR光谱结果表明CNTs(图2A)可被PEI及PEG共同功能化,且DOX可通过腙键被连接至CNTs表面。位于1 715 cm-1的-COOH特征峰表明CNTs已被成功羧基化(图2B),568 cm-1的Fe-O特征峰表明Fe3O4已衍生至CNTs表面(图2C)。图2D中出现的C-N(1 108 cm-1)、N-H(1 635 cm-1,1 560 cm-1,3 450 cm-1)和C-H(2 924 cm-1)特征峰表明PEI修饰成功。以上结果表明CNTs-Fe3O4-PEI/PEG-DOX已成功合成。
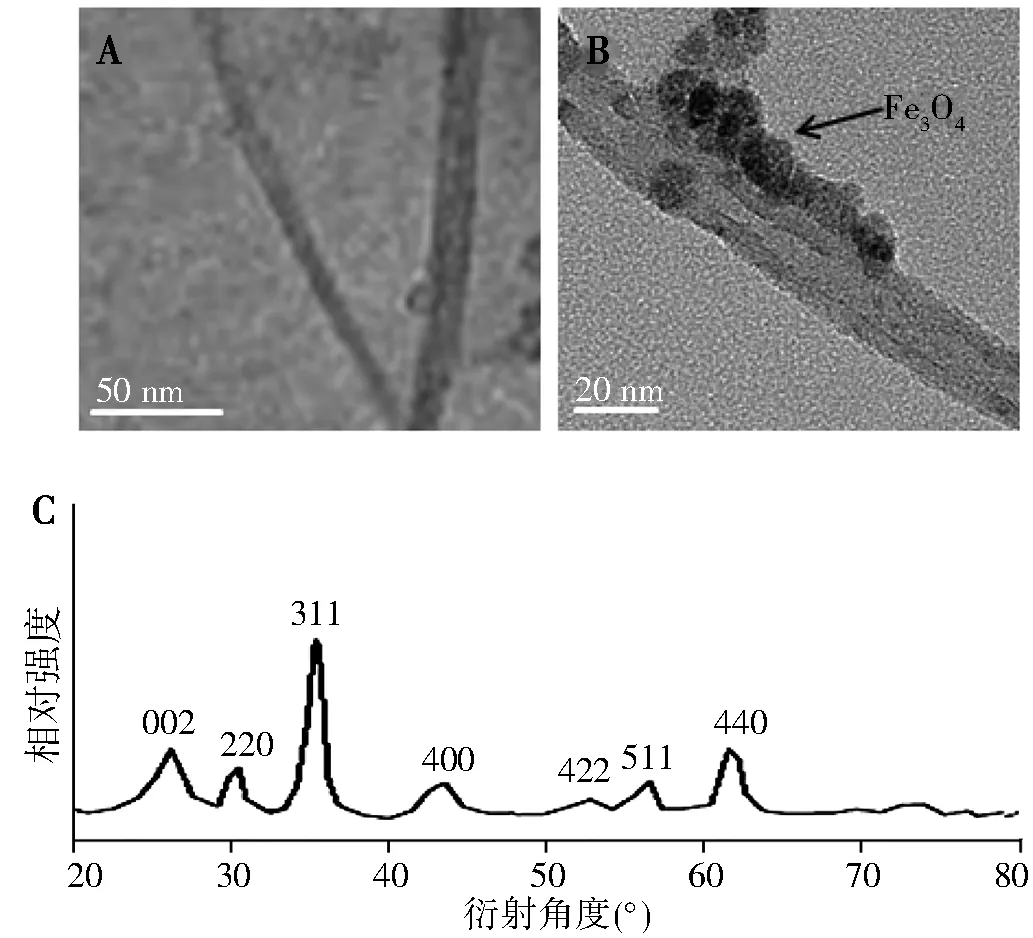
注: A为CNTs的TEM,B为CNTs-Fe3O4-COOH的TEM,C为CNTs-Fe3O4-COOH的XRD图谱图1 CNTs、CNTs-Fe3O4-COOH的TEM以及XRD图谱Fig.1 TEM and XRD spectrum of CNTs and CNTs-Fe3O4-COOH
2.3给药系统的磁性分析
图3A和B中的水溶液明显不同,CNTs-Fe3O4-PEI/PEG-DOX肿瘤靶向纳米药物递送系统在永磁铁的作用下迅速收拢至永磁铁范围内。磁滞曲线分析结果表明,CNTs-Fe3O4-PEI/PEG-DOX的磁化强度为19.92 emu/g(图3C)。以上结果均证明该系统具有明显的磁性靶向作用。
2.4给药系统的载药率及体外pH敏感释放分析
最终测定的DOX载药率为65.04%(WDOX:WCNTs-Fe3O4-PEI/PEG)。图4显示,在pH为5.5时,DOX的释放明显加快,终累计释放率高于80%,表明在120 h的考察期间DOX并没有完全释放,这和DOX与CNTs表面结构的π-π堆积作用有一定的关系。在pH为7.4的环境中,DOX最终的累计释放率为18%。以上结果表明,CNTs-Fe3O4-PEI/PEG-DOX具有明显的pH敏感控释特性。
2.5给药系统的近红外升温考察
CNTs-Fe3O4-PEI/PEG-DOX在近红外光照射下的升温考察结果表明,该给药系统具有明显的近
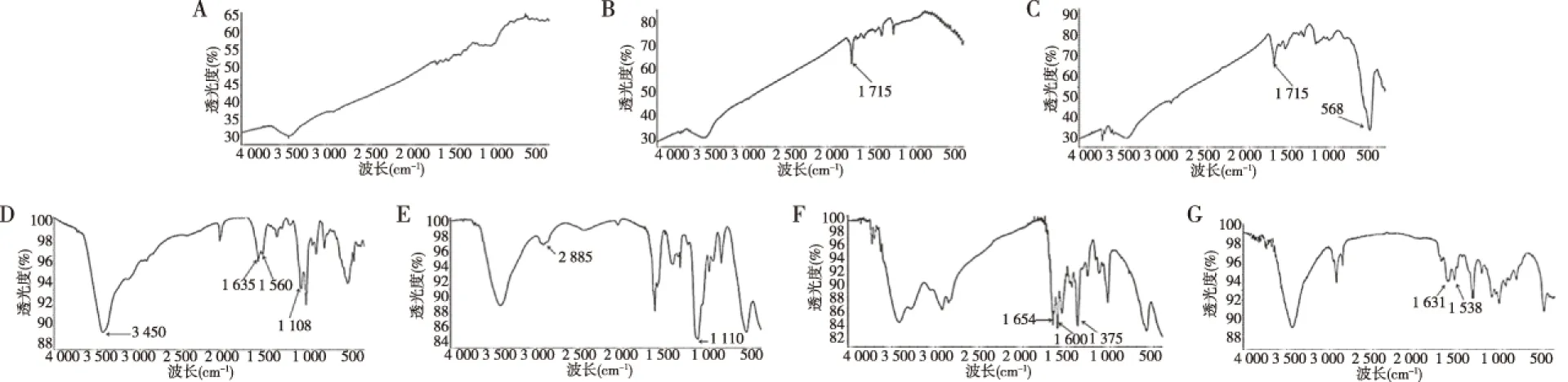
注:A为CNTs,B为CNTs-COOH,C为CNTs-Fe3O4-COOH,D为CNTs-Fe3O4-PEI,E为CNTs-Fe3O4-PEI/PEG,F为CNTs-Fe3O4-PEI/PEG-HBA,G为CNTs-Fe3O4-PEI/PEG-DOX图2 给药系统的FT-IR光谱分析Fig.2 FT-IR spectrum analysis of drug delivery system
红外热疗增敏效果。CNTs-Fe3O4-PEI/PEG-DOX水溶液可在5 min内升温至58.7度,在后期研究中可将其联合近红外热疗,达到更好的抗肿瘤效果。见图5。
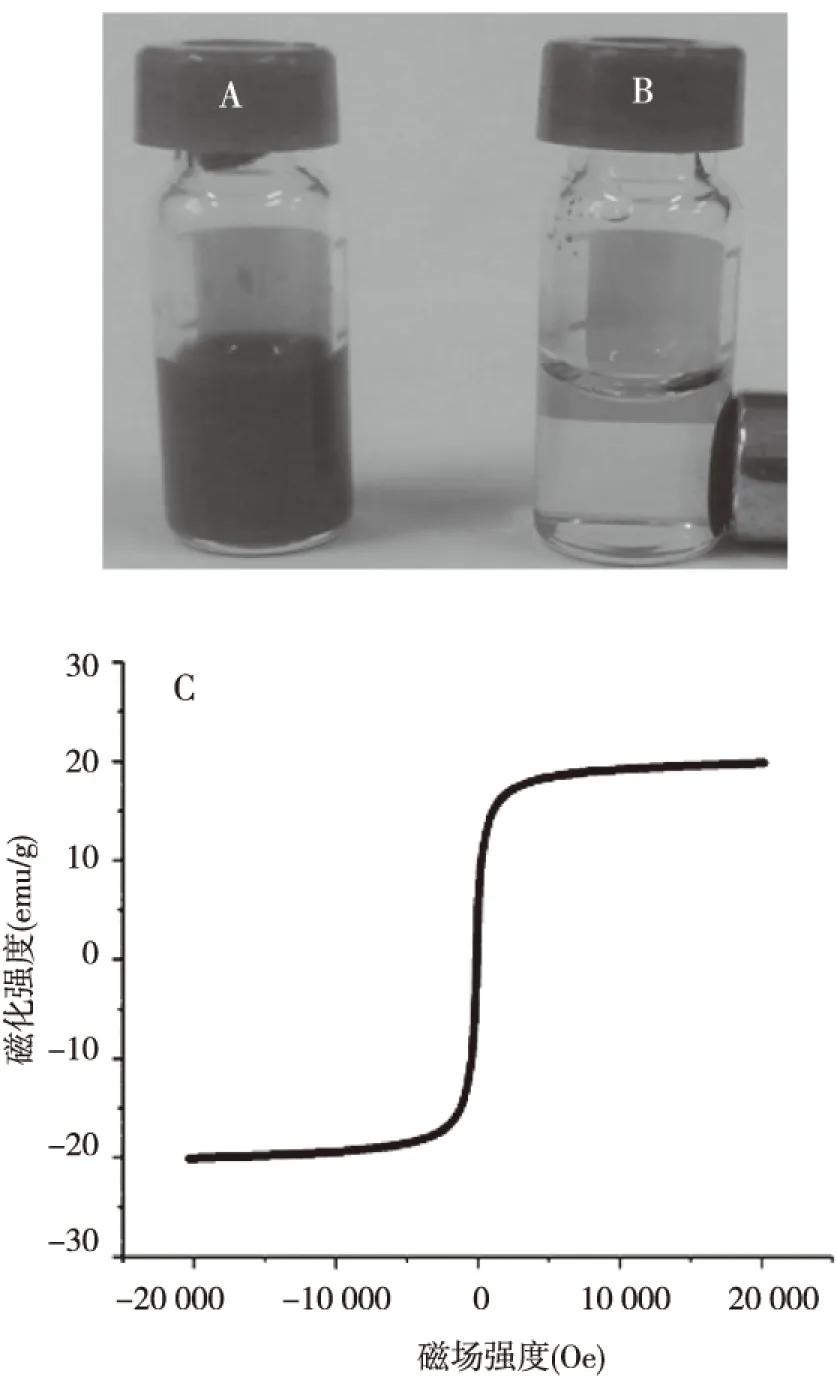
注: A为未放置永磁铁的CNTs-Fe3O4-PEI/PEG-DOX水溶液,B为将永磁铁放置于CNTs-Fe3O4-PEI/PEG-DOX水溶液侧方,C为CNTs-Fe3O4-PEI/PEG-DOX的磁滞曲线图3 给药系统的磁性分析Fig.3 Magnetic analysis of drug delivery system
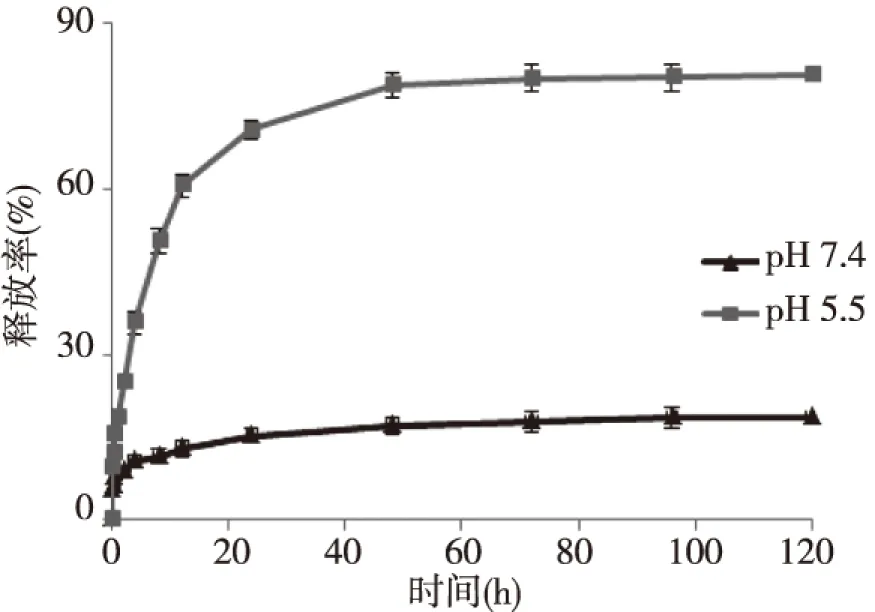
图4 不同pH值环境下CNTs-Fe3O4-PEI/PEG-DOX的累计释放率Fig.4 DOX cumulative release profiles of DOX in different pH environments
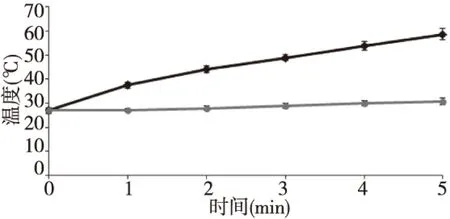
图5 近红外光照射下CNTs-Fe3O4-PEI/PEG-DOX溶液温度变化曲线Fig.5 Temperature changes of CNTs-Fe3O4-PEI/PEG-DOX (black) and water (gray) solution with NIR irradiation treatment at different times
2.6HepG2细胞抑制率
MTT实验结果显示,CNTs-Fe3O4-PEI/PEG-DOX磁性靶向联合PTT热疗组的细胞抑制率与DOX组、CNTs-Fe3O4-PEI/PEG-DOX和DOX联合PTT热疗组相比,差异有统计学意义(P=0.001、0.012、0.003),CNTs-Fe3O4-PEI/PEG-DOX磁性靶向联合PTT热疗组的肿瘤细胞抑制率明显高于CNTs-Fe3O4-PEI/PEG-DOX 联合PTT热疗组,差异有统计学意义(P=0.011)。
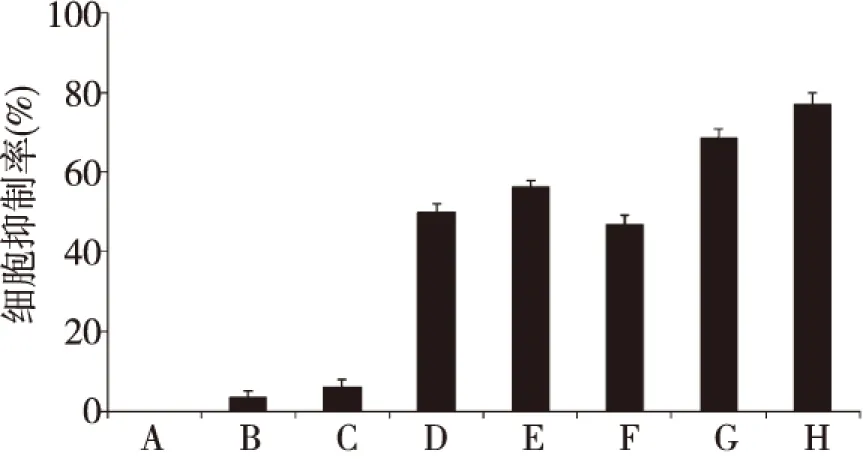
注:A为空白对照组,B为 CNTs-Fe3O4-PEI/PEG组,C为PTT热疗组,D为 DOX组,E为DOX联合PTT热疗组,F为 CNTs-Fe3O4-PEI/PEG-DOX组,G为CNTs-Fe3O4-PEI/PEG-DOX 联合PTT热疗组,H为 CNTs-Fe3O4-PEI/PEG-DOX磁性靶向联合PTT热疗图6 HepG2细胞的抑制率Fig.6 Cellular inhibition rate of HepG2 cells
3 讨论
目前,肿瘤的主要治疗手段除了手术治疗外,还有最常见的化学疗法。作为常用的抗癌化疗药物,DOX的使用常伴有严重的器官毒性,限制了它的应用,其对病人造成了极大的痛苦,所以限制了它的应用[11]。因此,改善DOX的生物毒性及耐药性成为相关领域的研究热点。
肿瘤靶向和定点控释是改善DOX毒性的有效途径。研究表明,肿瘤部位的pH值明显低于正常组,可利用靶向基团将给药系统递送至肿瘤部位,然后通过pH敏感型化学键对DOX控释[3,12]。Shi等[10]通过pH敏感键构建了富勒烯肿瘤靶向给药系统,证明该系统在肿瘤环境下可迅速释放。Wang等[13]构建pH敏感型的CNTs荷载DOX给药系统,但是该课题使用物理吸附的方式荷载DOX,仅利用DOX本身的pH敏感性进行缓控释,在体内较复杂的生物环境中较难完全控制DOX的释放。本研究将具有磁靶向性的Fe3O4纳米粒衍生至CNTs表面,并将具有pH敏感的腙键将DOX与载体连接,使给药系统具有磁性靶向性及pH敏感控释特性。结果表明,本课题组制备的CNTs-Fe3O4-PEI/PEG-DOX肿瘤磁性靶向药物传递系统在低pH值的环境中,腙键可有效断裂导致DOX的大量释放,同时该给药系统具有磁性寻靶功能。这种靶向释放模式,有望降低DOX对正常组织的毒性,同时在磁性靶向引导下的定点部位快速大量释放也可降低肿瘤对于药物的耐药性。
CNTs的功能化是其有效应用于生物治疗的关键,适当的功能化可降低生物毒性、提高生物相容性,并且新的化学基团的引入可使其具有更多衍生化的可能[14]。本研究使用PEI和PEG对CNTs载体进行修饰,并通过FT-IR光谱证明PEI/PEG修饰成功。其中PEI的树枝状结构和其具有的丰富氨基基团可连接更多的药物,并对药物其到一定的保护作用。而PEG具有体内长循环作用,除了可以提高给药系统的生物相容性,还可以使药物更长时间的滞留于体内发挥药效[15]。
作为一种新兴的肿瘤治疗辅助手段,热疗逐渐进入临床的研究及应用。将传统化疗与热疗联合,将达到更加强力的抗肿瘤作用[16]。恶性肿瘤的血液循环差,导致其散热性能变差,肿瘤对热疗十分敏感。42 ℃~45 ℃时即可杀伤肿瘤细胞,而正常组织器官血液循环良好,热量能够被及时扩散,从而不易被热疗损害。研究证实,CNTs具有明显的近红外光热治疗效应,可用于肿瘤化疗及热疗联合应用[17]。本构建的CNTs-Fe3O4-PEI/PEG-DOX给药系统可在近红外光的照射下明显升温,并对肿瘤细胞产生明显杀伤作用。将CNTs-Fe3O4-PEI/PEG-DOX具有的磁靶向性与热疗、化疗联合抑制HepG2细胞增殖实验表明,该组抑制率可达(77.2±2.5)%。
综上所述,CNTs-Fe3O4-PEI/PEG-DOX给药系统具有肿瘤磁性靶向、体内长循环、pH敏感控释以及热疗作用,是一种潜在的多功能智能化的给药体系,在后期的研究中该给药系统可将多种治疗机制联合用于肿瘤细胞的深入治疗研究及体内研究。
[1]Gonzalez-Fajardo L, Mahajan LH, Ndaya D, et al. Reduced in vivo toxicity of doxorubicin by encapsulation in cholesterol-containing self-assembled nanoparticles [J]. Pharmacological research : the official journal of the Italian Pharmacological Society, 2016 (107):193-101.
[2]Pawar S, Shevalkar G, Vavia P. Glucosamine-anchored doxorubicin-loaded targeted nano-niosomes: pharmacokinetic, toxicity and pharmacodynamic evaluation [J]. Journal of drug targeting, 2016(24):730-734.
[3]Koren E, Apte A, Jani A, et al. Multifunctional PEGylated 2C5-immunoliposomes containing pH-sensitive bonds and TAT peptide for enhanced tumor cell internalization and cytotoxicity [J]. Journal of controlled release : official journal of the Controlled Release Society, 2012 (160):264-273.
[4]Liu F, He X, Lei Z, et al. Facile preparation of doxorubicin-loaded upconversion@polydopamine nanoplatforms for simultaneous in vivo multimodality imaging and chemophotothermal synergistic therapy [J]. Advanced healthcare materials, 2015 (4):559-568.
[5]Yang G, Wang J, Wang Y, et al. An implantable active-targeting micelle-in-nanofiber device for efficient and safe cancer therapy [J]. ACS nano, 2015 (9):1161-1174.
[6]Lee PC, Peng CL, Shieh MJ. Combining the single-walled carbon nanotubes with low voltage electrical stimulation to improve accumulation of nanomedicines in tumor for effective cancer therapy [J]. Journal of Controlled Release, 2016 (225):140-151.
[7]Sajid MI, Jamshaid U, Jamshaid T, et al. Carbon nanotubes from synthesis to in vivo biomedical applications [J]. Int J Pharmaceut, 2016 (501):278-299.
[8]Rejinold NS, Thomas RG, Muthiah M, et al. Breast tumor targetable Fe3O4 embedded thermo-responsive nanoparticles for radiofrequency assisted drug delivery [J]. Journal of biomedical nanotechnology, 2016 (12):43-55.
[9]Wang L, Shi J, Hao Y, et al. Magnetic multi-walled carbon nanotubes for tumor theranostics [J]. Journal of biomedical nanotechnology, 2015 (11):1653-1661.
[10]Shi J, Liu Y, Wang L, et al. A tumoral acidic pH-responsive drug delivery system based on a novel photosensitizer (fullerene) for in vitro and in vivo chemo-photodynamic therapy [J]. Acta biomaterialia, 2014 (10):1280-1291.
[11]Wu R, Wang HL, Yu HL, et al. Doxorubicin toxicity changes myocardial energy metabolism in rats [J]. Chemico-biological interactions, 2016 (244):149-158.
[12]Gu YJ, Cheng J, Jin J, et al. Development and evaluation of pH-responsive single-walled carbon nanotube-doxorubicin complexes in cancer cells [J]. International journal of nanomedicine, 2011 (6):2889-2898.
[13]Wang L, Shi J, Jia X, et al. NIR-/pH-Responsive drug delivery of functionalized single-walled carbon nanotubes for potential application in cancer chemo-photothermal therapy [J]. Pharm Res, 2013 (30):2757-2771.
[14]Gopee V, Thomas O, Hunt C, et al. Carbon nanotube interconnects realized through functionalization and sintered silver attachment [J]. ACS Appl Mater Interfaces, 2016 (8):5563-5570.
[15]Iversen F, Yang C, Dagnaes-Hansen F, et al. Optimized siRNA-PEG conjugates for extended blood circulation and reduced urine excretion in mice [J]. Theranostics, 2013 (3):201-209.
[16]Nishimura S, Saeki H, Nakanoko T, et al. Hyperthermia combined with chemotherapy for patients with residual or recurrent oesophageal cancer after definitive chemoradiotherapy [J]. Anticancer research, 2015 (35):2299-2303.
[17]Zhang P, Huang H, Huang J, et al. Noncovalent ruthenium(II) complexes-single-walled carbon nanotube composites for bimodal photothermal and photodynamic therapy with near-infrared irradiation [J]. ACS Appl Mater Interfaces, 2015 (7):23278-23290.
(2016-05-25收稿,2016-08-28修回)
中文编辑: 文箐颍; 英文编辑: 刘华
Construction of A pH-sensitive Magnetic Targeting Nano-drug Delivery System and Its Effect on HepG2 Tumor Cells
MA Hongyan, QIAO Guihong
(DepartmentofClinicalMedicine,ShangqiuMedicalCollege,Shangqiu476005,Henan,China)
Objective: To construct a new type of magnetic-targeting and pH-sensitive controlled release drug delivery system and investigate its inhibitory effect on HepG2 tumor cells. Method: Fe3O4nanoparticles were loaded onto the surface of carbon nanotubes (CNTs). Then, polyethyleneimine (PEI) and poly (ethylene glycol) (PEG) were used to functionalized the carrier. Finally, doxorubicin (DOX) was conjugated to the amino groups of PEI through pH-sensitive hydrazone bonds to construct the CNTs-Fe3O4-PEI/PEG-DOX drug delivery system. Transmission electron microscope (TEM), X-ray diffractometer (XRD), fourier transform infrared spectrometer (FT-IR) and magnetometer were adopted to analyze the characteristics of this drug delivery system. The hyperthermia effect, drug loading rate and pH-sensitive controlled release in vitro were investigated. The HepG2 tumor cells were divided into control group, CNTs-Fe3O4-PEI/PEG group, PTT hyperthermia group, DOX group, DOX PTT combined with hyperthermia group, CNTs-Fe3O4-PEI/PEG-DOX group, CNTs-Fe3O4-PEI/PEG-DOX combined with PTT hyperthermia group, and CNTs-Fe3O4-PEI/PEG-DOX magnetic targeting combined with PTT hyperthermia group, and MTT method was used to detect the inhibitory rates of HepG2. Results: The CNTs-Fe3O4-PEI/PEG-DOX drug delivery system was constructed successfully, and DOX loading rate was 65.04% (WDOX:WCNTs-Fe3O4-PEI/PEG). When the pH value was decreased, the cumulative release rate of DOX was increased significantly, which proved that the drug delivery system had pH sensitive controlled release properties. The magnetic investigation results showed that the magnetization of the drug delivery system was 19.92 emu/g, showing obvious magnetic targeting. The drug delivery system can rapidly heated up to (58.7±2.5)℃ in 5 minutes with the near infrared light treated, showing obvious hyperthermia warming effect. The combination of chemotherapy and photothermal therapy had significant inhibitory effects on growth of HepG2 tumor cells. Conclution: CNTs-Fe3O4-PEI/PEG-DOX is a new type of multifunctional intelligent drug delivery system with magnetic-targeting, pH-sensitive controlled release and hyperthermia effects, which has significant inhibitory effects on growth of HepG2 tumor cells.
magnetic targeting; carbon nanotubes; pH-sensitive; doxorubicin; photothermal therapy
商丘市科技发展计划项目(153051)
R943
A
1000-2707(2016)09-1047-06
10.19367/j.cnki.1000-2707.2016.09.013
网络出版时间:2016-09-13网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160913.2240.054.html
