两种血管外膜成纤维细胞培养方法的比较与经验总结
2016-10-11罗丽敏张勇刚党书毅丁文惠北京大学第一医院心内科北京000湖北医药学院附属太和医院心内科湖北十堰00中国医科大学第一附属医院皮肤科辽宁沈阳北京大学第一医院风湿免疫科北京000汕头大学第二附属医院心内科广东汕头
李 军 罗丽敏 樊 勇 张勇刚 党书毅 丁文惠.北京大学第一医院心内科,北京 000;.湖北医药学院附属太和医院心内科,湖北十堰 00;.中国医科大学第一附属医院皮肤科,辽宁沈阳 0;.北京大学第一医院风湿免疫科,北京 000;.汕头大学第二附属医院心内科,广东汕头 0
两种血管外膜成纤维细胞培养方法的比较与经验总结
李军1,2罗丽敏3樊勇4张勇刚5党书毅2丁文惠1
1.北京大学第一医院心内科,北京100034;2.湖北医药学院附属太和医院心内科,湖北十堰442005;3.中国医科大学第一附属医院皮肤科,辽宁沈阳110122;4.北京大学第一医院风湿免疫科,北京100034;5.汕头大学第二附属医院心内科,广东汕头515041
目的比较两种血管外膜成纤维细胞(AFs)培养方法的差异并总结经验。方法 获取大鼠主动脉血管外膜组织,切成小块,一部分采用组织贴块法进行原代培养,另一部分使用消化酶消化获取细胞,使用相差显微镜观察细胞形态、免疫组化鉴定细胞内特定蛋白表达、细胞计数计算生长曲线等实验手段,并比较两种方法之间的差异。结果 贴块法和消化法均能成功获得AFs;经免疫组化检测,两种方法所获的细胞波形蛋白(Vimentin)表达阳性/a-平滑肌肌动蛋白(a-SMA)表达阴性,证实培养的细胞为AFs。两种方法获得的细胞在细胞增殖期、对数生长期和平台期的时间大致相同,二者的生长、增殖比较,差异无统计学意义(P>0.05)。结论 贴块法和消化法均能成功培养AFs,所获得的细胞性状稳定、存活率高,可在体外稳定地传代培养,在血管重构研究领域具有应用价值。
血管外膜成纤维细胞;组织贴块法;消化法;经验总结
[Abstract]Objective To compare the differences of two methods in adventitial fibroblasts culture and summarize the experience.Methods Aortic vascular adventitia were separated from 6 specific pathogen free wistar rats,and cut into small pieces.Half of adventitial fibroblasts were isolated and cultured using tissue explants adherent method,others by digestion method.Phase contrast microscope was used to observe the cell morphology,immunohistochemistry was used to identify the expression of vimentin and a-smooth muscle actin,and cell counts to determine rate of cell growth and proliferation.The differences between two groups were compared.Results Massive adventitial fibroblasts were obtained successfully by both tissue explant adherent method and digestion method.All of them were confirmed to be Vimentin(+)/a-SMA(-)cells by immunohistochemistry,which represented adventitial fibroblasts.The rate of cell growth and proliferation were comparable between two groups and showed no statistically significant difference(P>0.05).Conclusion Adventitial fibroblasts can be obtained and cultured successfully both by tissue explants adherent method and digestion method.Stability and high survival rate of adventitial fibroblasts gained from both two methods make it valuable in the future study of vascular remodeling.
[Key words]Adventitial fibroblasts;Tissue explants adherent method;Digestion method;Experience summary
血管外膜在血管重构的发生、发展过程中起到了重要的作用,是多种心血管疾病发病的结构基础,针对血管外膜的研究是当前心血管领域研究热点之一[1-2]。AFs是血管外膜的主要组成部分,它在体内血管活性物质作用下,通过分泌活性因子,参与细胞表型转化、增殖、凋亡、迁移及胶原的合成和分泌,从而参与血管的功能调节和修复过程[3-5],AFs已成为治疗心血管疾病的新靶点[6-8]。选择合适的方法获得AFs对于开展血管重构研究领域具有重要意义,本项目组在前期试验中[9-11],通过组织贴块法和消化法均能在短期内获得大量纯度较高、生长状态良好的AFs,现在对两种方法进行比较并总结经验。
1 材料与方法
1.1一般材料
4~6周龄(120~150 g,SPF级,屏障环境中饲养,普通饮食)健康雄性Sprague-Dawley大鼠由北京大学第一医院实验动物中心提供,许可证号:SYXK(京)2016-0001;DMEM/F12培养基、I型胶原酶和木瓜蛋白酶购自Gibco公司;胎牛血清(fetal bovine serum,FBS)购自Hyclone公司;免疫组化用小鼠抗大鼠α-SMA和Vimentin单克隆抗体购自武汉博士德公司,辣根过氧化物酶(horseradish peroxidase,HRP)和异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的二抗购自碧云天公司,胰酶细胞消化液购自北京普利莱公司;超净工作台为Thermo公司产品(Heraguard ECO 1.5)、倒置相差显微镜为日本Olympus公司出品(BIO500-PH)、CO2培养箱为日本SANYO公司产品(MCO-18AC)、荧光显微镜为 Leica公司产品(AF6000)。
1.2大鼠AFs的原代培养
1.2.1大鼠血管外膜的获取取雄性Sprague-Dawley大鼠,麻醉后断颈处死,立刻浸泡于75%酒精中,5 min后转移至无菌手术台上,沿正中线剪开大鼠胸腔和腹腔,可见胸腹主动脉沿脊柱左侧缘走形,剪取胸腹主动脉,浸泡于Hanks缓冲液中,无菌条件下转移至超净工作台。先用含青链霉素的灭菌磷酸盐缓冲液(phosphate-buffered saline,PBS)冲洗血管内外残留的血液,钝性分离血管周围的结缔组织,然后用眼科剪将血管纵向剖开,使内膜面向上,用眼科弯镊自上而下轻轻刮除内膜后,再小心撕下近内膜面的中膜平滑肌层,剩余的絮状乳白色组织即为血管外膜[3,12-13]。
1.2.2贴块法获得Afs 将血管外膜组织用眼科剪剪成大小约1 mm×1 mm×1 mm的组织块,均匀平铺在25 cm2培养瓶的底部。轻轻翻转培养瓶使瓶底面向上,向培养瓶中加入约6 mL含20%FBS的DMEM/ F12培养基,务必不要将组织块冲掉。将培养瓶置入37℃、含5%CO2细胞培养箱中直立静置2~4 h后,慢慢翻转培养瓶,使培养液缓慢覆盖组织块,继续培养约72 h后,可见AFs自组织块周围爬出。此时,不常规换液,仅向培养瓶中补加3 mL含 20%FBS的DMEM/F12培养基,既保证细胞生长所需的营养成分,又不会对培养液的PH值、温度等造成大的影响。4~6 d后,待细胞生长达到70%~80%融合状态时即可按1∶4传代,取2~3代细胞进一步实验[14]。
1.2.3消化法获得Afs取血管外膜组织,剪成小块后,加入 1 mL消化液(消化液配方[15-16]:I型胶原酶0.5%、木瓜蛋白酶0.05%、牛血清白蛋白0.2%、二硫苏糖醇1 mmol/L,使用不含氯化钙的Hanks平衡盐溶液溶解),37℃水浴15~30 min,然后经200目不锈钢滤网过滤消化液,加入2 mL培养液终止消化,1000 r/min离心2 min,弃掉上清液,加入5 mL含20%FBS的DMEM/F12培养基重悬,将细胞接种于60 mm的培养皿中,置于37℃、含5%CO2细胞培养箱中培养,24 h后换液。此后每隔48 h换液一次,直至消化传代。
1.3AFs的鉴定
盖玻片泡酸并高压消毒灭菌后,置于培养皿中,将AFs悬液种植于培养皿,待细胞生长至50%融合状态时,倒掉培养液,PBS冲洗,4%多聚甲醛固定20min,用含0.3%Triton X-100、1%牛血清白蛋白的PBS透化处理,加封闭血清室温封闭60 min后,倒掉封闭血清,加小鼠抗大鼠α-SMA抗体及Vimentin抗体,37℃孵育2 h,PBS冲洗3 min×3次。免疫荧光法:滴加FITC标记的山羊抗小鼠二抗,避光孵育60 min,倒置荧光显微镜下观察结果,拍片。二氨基联苯胺(diaminobenzidine,DAB)显色法:滴加HRP标记的山羊抗小鼠二抗,室温孵育60 min后,PBS冲洗3 min×3次,滴加DAB显色液,在显微镜下观察控制反应速速,1~5 min即可,自来水充分冲洗,苏木素复染,盐酸酒精溶液浸泡返蓝,中性树胶封片,显微镜下观察结果,拍片。
1.4细胞生长曲线测定
分别将贴块法和消化法两种培养方法获得的第2代AFs消化,细胞计数后,用含10%FBS的DMEM/ F12培养基调整细胞浓度为2×104个/mL,每孔1 mL接种于12孔培养板,放置培养箱内培养,每隔24 h收集每组3孔细胞并计数,取平均值,连续计数7 d后绘制生长曲线[17]。
1.5统计学方法
采用GraphPad Prism 5.0软件进行数据分析,计量资料采用均数±标准差(x±s)表示,两组之间均数的比较采用t检验,多组间比较用方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1AFs的原代培养
血管外膜组织块在培养72 h后,可见少量成纤维细胞自组织块边缘爬出,渐向外生长形成细胞晕,进而形成细胞簇(图1a)。刚长出的细胞呈圆形,后变为椭圆形,随后细胞逐渐展开,伸出伪足,形态多样,呈梭形、多角形、星形或不规则形,大小略有差异(图1b)。细胞逐渐围绕组织块呈放射性生长,聚集成片(图1c),传代后80%~90%的细胞可重新贴壁生长,其生长方式及形态特点同前一致。消化法得到的细胞散在、成片分布,细胞形态和贴块法一致(图1d)。
2.2AFs的鉴定
取第2代AFs进行鉴定,待细胞长至50%融合状态时,固定细胞,加入α-SMA及Vimentin一抗抗体孵育后,再滴加FITC/HRP标记的二抗,显微镜下观察、拍片。可见α-SMA在细胞中基本没有表达(图2a、2c),而Vimentin在AFs中高表达(图2b、2d),证实培养的细胞为典型的AFs。

图1 原代培养的AFs形态图
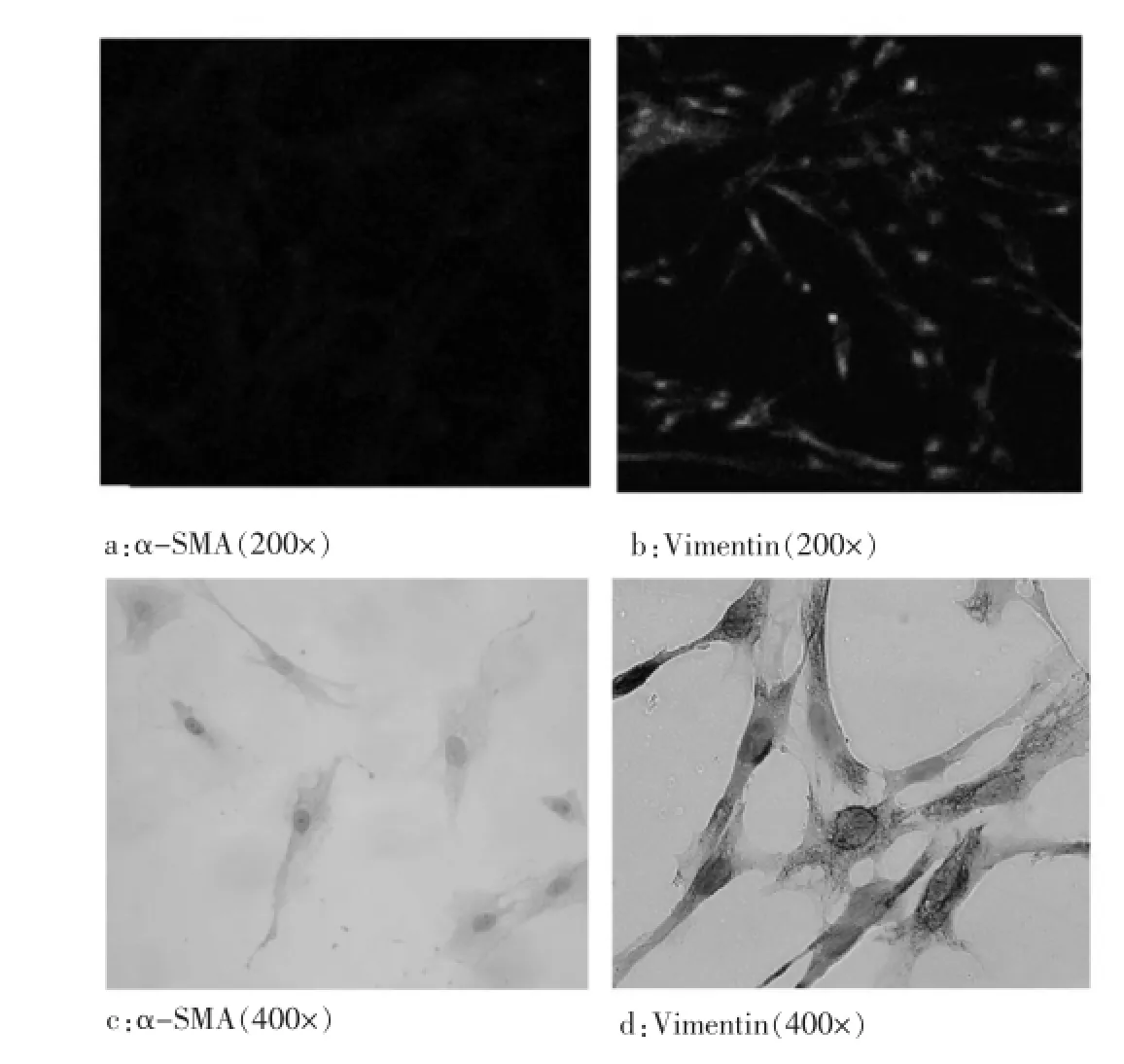
图2 鉴定体外培养的AFs
2.3两种方法获得的细胞生长曲线比较
传代后AFs悬浮于培养液中,在重力的作用下逐渐下沉至培养板底,散在分布于培养板中,初始形态为圆形,后逐渐变成纺锤形、梭型、不规则性,细胞逐渐增大,3~6 h即完全贴壁,细胞伸出伪足并相互交织成网,逐渐形成细胞单层,铺满瓶底。AFs的倍增时间较短,在一段时间内AFs数量与时间呈正相关,1~3 d为细胞增殖期、3~6 d为对数生长期、6~7 d为平台期,与人皮肤成纤维细胞类似[17]。本项目中贴块法和消化法所得细胞在细胞增殖期、对数生长期和平台期的时间大致相同,二者的生长、增殖比较差异无统计学意义(P>0.05)。
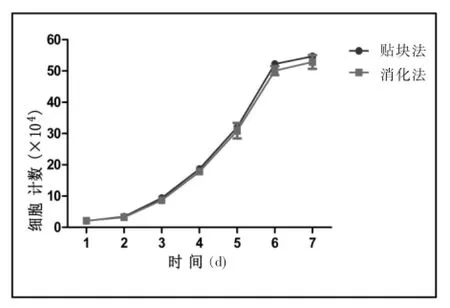
图3 第二代贴块法和消化法培养的AFs生长曲线
3 讨论
贴块法是将组织剪成小块,贴附在培养瓶上,加入培养液浸没组织块,让细胞从组织块中爬出的一种方法,其优点在于操作简单、步骤少、成本低、影响因素少、细胞爬出时间固定,便于实验者把控时间[3];缺点在于部分组织细胞爬出慢、耗时长。消化法常采用胶原酶、胰酶、弹力酶、透明质酸酶及链霉蛋白酶等酶将组织消化分散,使细胞从组织中脱落出来。优点在于培养时间短,短期内可以获得大量细胞;缺点在于操作复杂、不同组织消化时间长短不固定、不同种类的消化酶对细胞状态影响较大、步骤繁琐带来污染概率增加,且消化酶昂贵,因而消化法的应用受到一定限制。本项目参考北京大学第一医院风湿免疫科博士生高兰、樊勇等人的经验[15-16],采用组合酶消化法,消化时间控制在0.5 h以内,可以短时间内获得大量活细胞。一般而言,贴块法从获取组织到细胞传代需要7~10 d,而消化法只需要5~6 d。细胞在传代以后,两种方法获得AFs在增殖期、对数生长期和平台期的时间大致相同,因而两种培养方法在这一阶段相比没有差异。
AFs原代培养时难免混杂少量的其他细胞,包括平滑肌细胞、内皮细胞、脂肪细胞等,利用AFs生长速度快、数优的特点,在传代培养过程中能排斥其他细胞而优先增殖,经过几代的传代生长后,能达到自然纯化的效果,得到较高纯度的AFs[18]。Vimentin是细胞骨架中间纤维家族成员,主要在成纤维细胞中表达;α-SMA主要表达于平滑肌细胞,所以可根据Vimentin表达阳性/a-SMA表达阴性来鉴定成纤维细胞。本项目中两种方法培养的细胞,使用免疫组化方法鉴定,可见Vimentin表达阳性/a-SMA表达阴性,故而可以确定所培养的细胞为AFs。
原代培养第一次传代时机的掌握非常重要,一般认为选取细胞接近或完全融合成片时进行传代。贴块法原代培养时由于组织块的分布不均匀,且活性不一,导致细胞生长也不均匀,经常是一些区域已长成致密细胞层,一些区域仍未见细胞爬出,这种情况下,当整瓶细胞达亚融合时,致密细胞层已“老化”,功能状态不佳。所以可根据细胞生长状况在细胞未达80%融合时进行“原瓶”传代,使细胞能均匀贴壁生长及避免局部细胞“老化”。在细胞传代消化以细胞成片收缩、变圆变亮、细胞间隙增大时为宜,若消化过度、时间过长,易严重损伤细胞膜,细胞难以贴壁成活,影响后续实验,经验是胰酶定量、时间固定、操作迅速、动作轻柔、及时终止消化。
综上所述,组织贴块法和消化法均能成功培养AFs,两种方法获得的细胞性状稳定、存活率高,为从细胞水平研究血管重构性疾病的发病机制提供了可靠的模型。
[1]李军,丁文惠,唐朝枢.血管外膜与血管稳态和重构[J].中国循环杂志,2016(1):101-103.
[2]路丹,丁文惠.外膜炎症在血管重构中的作用[J].生理科学进展,2015(2):126-128.
[3]Zhang YG,Li J,Li YG,et al.Urotensin II induces phenotypic differentiation,migration,and collagen synthesis of adventitial fibroblasts from rat aorta[J].J Hypertens,2008,26(6):1119-1126.
[4]Chen WD,Chu YF,Li XD,et al.Angiotensin II induces expression of inflammatory mediators in vascular adventitial fibroblasts[J].Sheng Li Xue Bao,2015,67(6):603-610.
[5]Yuan W,Liu W,Li J,et al.Effects of BMSCs interactions with adventitial fibroblasts in transdifferentiation and ultrastructure processes[J].Int J Clin Exp Pathol,2014,7(7):3957-3965.
[6]Stenmark KR,Yeager ME,El KKC,et al.The adventitia:essential regulator of vascular wall structure and function[J]. Annu Rev Physiol,2013,75:23-47.
[7]Meijles DN,Pagano PJ.Nox and Inflammation in the Vascular Adventitia[J].Hypertension,2016,67(1):14-19.
[8]El KKC,Pugliese SC,Riddle SR,et al.Adventitial fibroblasts induce a distinct proinflammatory/profibrotic macrophage phenotype in pulmonary hypertension[J].J Immunol,2014,193(2):597-609.DOI:10.4049/jimmunol.1303048.
[9]Zhang Y,Bao S,Kuang Z,et al.Urotensin II promotes monocyte chemoattractant protein-1 expression in aortic adventitial fibroblasts of rat[J].Chin Med J(Engl),2014,127(10):1907-1912.
[10]Zhang YG,Hu YC,Mao YY,et al.Transforming growth factor-β1 involved in urotensin II-induced phenotypic differentiation of adventitial fibroblasts from rat aorta[J]. Chin Med J(Engl),2010,123(24):3634-3639.
[11]Zhang YG,Kuang ZJ,Mao YY,et al.Osteopontin is involved in urotensin II-induced migration of rat aortic adventitial fibroblasts[J].Peptides,2011,32(12):2452-2458.DOI:10.1016/j.peptides.2011.10.018.
[12]Dong X,Ye X,Song N,et al.Urotensin II promotes the production of LTC4 in rat aortic adventitial fibroblasts through NF-κB-5-LO pathway by p38 MAPK and ERK activations[J].Heart Vessels,2013,28(4):514-523.DOI:10.1007/s00380-012-0291-0.
[13]Song N,Ding W,Chu S,et al.Urotensin II stimulates vascularendothelialgrowthfactorsecretionfrom adventitial fibroblasts in synergy with angiotensin II[J]. Circ J,2012,76(5):1267-1273.
[14]Zhao J,Ding W,Song N,et al.Urotensin II-induced collagen synthesis in cultured smooth muscle cells from rat aortic media and a possible involvement of transforming growth factor-β1/Smad2/3 signaling pathway[J].Regul Pept,2013,182:53-58.
[15]Yuan P,Gao L,Jing ZC.Complexities of oestradiol pharmacology in pulmonary arterial hypertension[J]. Eur Respir J,2013,41(6):1466-1467.DOI:10.1183/ 09031936.00176212.
[16]Yuan P,Wu WH,Gao L,et al.Oestradiol ameliorates monocrotalinepulmonaryhypertensionviaNO,prostacyclin and endothelin-1 pathways[J].Eur Respir J,2013,41(5):1116-1125.DOI:10.1183/09031936.00044112.
[17]王林林,杜为,张健,等.优化贴壁法人皮肤成纤维细胞的原代培养[J].南京医科大学学报:自然科学版,2014(1):124-126.
[18]马彦军,林家冲,杨絮,等.大鼠胸主动脉外膜成纤维细胞的培养方法初探[J].汕头大学医学院学报,2011,24(1):51-52,57.
Comparison and experience of two methods for the culture of adventitial fibroblasts
LI Jun1,2LUO Limin3FAN Yong4ZHANG Yonggang5DANG Shuyi2DING Wenhui1
1.Department of Cardiology,Peking University First Hospital,Beijing100034,China;2.Department of Cardiology,Taihe Hospital,Hubei University of Medicine,Hubei Province,Shigyan442005,China;3.Department of Dermatology,the First Affiliated Hospital of China Medical University,Liaoning Province,Shenyang110122,China;4.Department of Rheumatology and Clinical Immunology,Peking University First Hospital,Beijing100034,China;5.Department of Cardiology,the Second Affiliated Hospital,Shantou University Medical College,Guangdong Province,Shantou 515041,China
R322.1
A
1674-4721(2016)08(b)-0004-05
2016-04-20本文编辑:赵鲁枫)
湖北省自然科学基金项目(2011CDC049);太和医院2014年国家级科研项目培育基金计划(2014PY03)。
李军(1981.9-),男,博士;研究方向:血管活性物质在血管稳态和重构中的作用机制。
丁文惠(1954.4-),女,教授,主任医师,博士生导师;研究方向:血管重构与心衰。
