Gli1在髓母细胞瘤中的表达及其靶向抑制的研究
2016-10-11许尚虞林中啸盛汉松弩温州医科大学附属第二医院育英儿童医院神经外科浙江温州325027
许尚虞 杨 涛 林中啸 蔡 铭 盛汉松 张 弩温州医科大学附属第二医院育英儿童医院神经外科,浙江温州 325027
Gli1在髓母细胞瘤中的表达及其靶向抑制的研究
许尚虞杨涛林中啸蔡铭盛汉松张弩
温州医科大学附属第二医院育英儿童医院神经外科,浙江温州325027
目的 研究Gli1在髓母细胞瘤(MB)中的表达和作用。方法 用不同浓度(正常对照组、10 μmol/L组、20 μmol/L组、40 μmol/L组)的Gli1特异性抑制剂GANT61作用Daoy细胞,采用细胞增殖法检测Daoy细胞在GANT61作用下的增殖活性的变化;Real-time PCR法和Western blot法分别检测不同组Daoy细胞中Gli1和Bcl-2 mRNA表达量和蛋白表达量的差异。结果 GANT61作用细胞后,细胞间隙增大,异常突起增多,细胞增殖活性明显下降,与对照组相比,GANT61作用组的Daoy细胞增殖数显著降低(P<0.05),并且随着浓度的增加,增殖数显著降低(P<0.05),提示具有浓度依赖性;不同浓度GANT61组的Gli1和Bcl-2 mRNA表达量均较对照组明显下降(P<0.05),下降程度随着GNAT61浓度的增加而增加(P<0.05);不同浓度GANT61组的Gli1和Bcl-2蛋白表达水平较对照组明显下降(P<0.05),下降程度随着GANT61浓度的增加而增加(P<0.05)。结论GANT61能通过抑制Gli1的表达,进而下调下游靶基因Bcl-2的表达,从而明显抑制MB细胞的增殖活性,达到促进MB细胞凋亡的作用。
髓母细胞瘤;GANT61;Gli1;Bcl-2蛋白;凋亡
[Abstract]Objective To investigate the expression and potential effect of Gli1 in medulloblastoma(MB)cell.Methods Daoy cells were grouped according to the concentration,the control group,which was stimulated by culture medium;three GANT61 stimulated groups:10 μmol/L group,20 μmol/L group and 40 μmol/L group,which were stimulated by GANT61,a specific antagonist of Gli1.The inhibitory effect of GANT61 on cell proliferation was determined by cell proliferation bioassay.The expression of Gli1 and Bcl-2 were detected by Real-time PCR and Western blot.Results After stimulated by GANT61,there were obvious pathologic changes in Daoy cells such as the increased cell gap and the abnormal cell processes.Compared with the control group,the cell proliferation activity in the GANT61 stimulated groups was suppressed by GANT61(P<0.05).Moreover,the cell proliferation activity was suppressed by GANT61 in a concentration-dependent manner(P<0.05).The expressions of Gli1 and Bcl-2 mRNA in the GANT61 stimulated groups were significantly decreased when compared with the control group(P<0.05),and the expression decreased with a concentration-dependent manner(P<0.05).The expressions of Gli1 and Bcl-2 protein in the GANT61 stimulated groups were also suppressed by GANT61(P<0.05),the inhibitory effects were increased with the increasing GANT61 concentration(P<0.05).Conclusion GANT61 can suppress the MB cells proliferation and promote apoptosis,which results from the inhibitory effect on Gli1 and its downstream target gene Bcl-2.
[Key words]Medulloblastoma;GANT61;Gli1;Bcl-2;Apoptosis
髓母细胞瘤(medulloblastoma,MB)是一种儿童较为常见的胚胎源性肿瘤,目前多项研究表明MB的形成和发展与Sonic hedgehog(SHH)信号通路的异常激活有密切关系。作为SHH信号通路下游中Gli1转录因子的抑制剂,GANT61能够结合Gli1的DNA,通过抑制Gli1锌指蛋白活性,进而对Gli1下游中的多种基因进行转录调控,达到抑制MB细胞的增殖和促进MB细胞凋亡的作用。本研究使用GANT61作用细胞,观察细胞形态的变化,RT-PCR法和Western blot法检测Doay细胞中Gli1和Bcl-2 mRNA表达量及蛋白表达水平的差异,探讨髓母细胞瘤发生发展中Gli1的表达及其靶向抑制剂的作用及意义。
1 材料与方法
1.1材料
1.1.1细胞系人髓母细胞株Daoy细胞,购自American Type Culture Collection。
1.1.2主要试剂GANT61(英国Abcam公司),1640培养基 (美国Gibco公司),RT-PCR引物 (日本Takara公司),逆转录试剂盒PrimeScriptTMRT(日本Takara公司),RT-PCR试剂盒SYBR®RPremix EX TaqTM(日本Takara公司),Gli1兔多克隆抗体 (英国 Abcam公司),Bcl-2鼠单克隆抗体(英国Abcam公司)。
1.1.3仪器及设备超净工作台(安泰空气技术公司),恒温二氧化碳培养箱 (美国Thermo Forma公司),三目倒置生物显微镜 (美国Thermo Forma公司),NanoDrop2000超微量分光光度计(常州中捷公司),CFX96 touch real-time PCR检测系统 (美国Thermo scientific公司),基因扩增仪(北京乾明公司),自动酶标仪(美国Bio-rad公司)。
1.2方法
1.2.1Daoy细胞培养将细胞置于常规培养箱中培养,使用含10%FBS、1%双抗的1640培养基。根据细胞的生长情况、培养基颜色及酸碱度进行换液,细胞生长到70%~80%时进行1∶2或者1∶4传代培养。
1.2.2实验分组细胞在常氧条件下培养24 h后按进行分组。正常对照组:培养液中加0.1%DMSO,为使实验条件一致,保持各组的DMSO终浓度为0.1%;10、20、40 μmol/L GANT61组:分别加入10、20、40 μmol/L GANT61。
1.2.3细胞增殖法检测细胞增殖数、细胞形态取对数生长期的Daoy细胞,制成细胞悬液,在6孔板内分别予每孔1000个细胞密度接种,培养24 h后按分组加入不同浓度药物继续培养。培养1周后结晶紫染色于倒置显微镜下观察,拍照并计数每个视野的细胞增殖数,计数5个视野取平均值。
1.2.4Real-time PCR检测细胞Gli1和Bcl-2 mRNA表达Trizol法提取总RNA,用NanoDrop2000测量RNA浓度,行常规反转录,反转录体系见说明书。引物设计见表1。反应条件:37℃30 min,75℃10 min,4℃冷却,共1个循环。将引物行PCR反应,反应体系总量20 μL:cDNA模板2.0 μL,上下引物各0.4 μL,2×Taq PCR Master MIX 10 μL,最后加入双蒸水补足至20 μL。反应条件:97℃15 s;95℃ 5 s,65℃30 s,72℃1 min,40个循环;72℃10 min。采用2-ΔΔCT方法计算目的基因mRNA的相对表达量,△△CT计算公式:△△CT=(CT目的基因-CT内参基因)实验组-(CT目的基因-CT内参基因)对照组。

表1 目的基因和内参引物序列
1.2.5Western Blot检测Gli1和Bcl-2蛋白表达细胞用4℃PBS洗2次,在4℃裂解30 min,离心15 min,收集上清液,BCA法测定蛋白浓度,用10% SDS-PAGE分离,转到NC膜上,分别加入1∶1000 Gli1、Bcl-2单抗 2 h后用PBS和 TBST洗各2次,1∶1000辣根过氧化物酶标记的二抗IgG孵育1 h,TBST洗 2次,将膜置于 ChemiDocTMMp Imaging System内操作Image Lab 4.1软件自动曝光。使用Quantity one 4.6.2分析软件分析图片,读取每个条带灰度值,并计算。
1.3统计学方法
使用SPSS 17.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1髓母细胞瘤Daoy细胞增殖形态观察
显微镜下示正常对照组中,Daoy细胞贴壁后呈片状聚集增殖,形态规则,基本呈球形,细胞间隙紧密(图1a)。Daoy细胞在GANT61作用后,细胞增殖数目减少,异常突起增多(箭头所示),随着GANT61浓度升高,细胞增殖数愈发减少,甚至少于接种细胞数,间隙不断增大(图1b~d)。

图1 显微镜下正常Daoy细胞和GANT61作用后细胞增殖形态观察(40×)
各组细胞增殖数比较显示,GANT61能够抑制Daoy细胞的增殖(P<0.05),并且随着GANT61浓度增加,细胞增殖数较前一浓度组下降(P<0.05),提示具有浓度依赖性(图2)。

图2 不同浓度GANT61对Daoy细胞增殖数的影响(n=3)
2.2各组Gli1和Bcl-2 mRNA表达情况
本实验发现不同浓度GANT61组Gli1和Bcl-2 mRNA表达明显低于正常对照组(P<0.05),GANT61能够显著抑制Gli1和Bcl-2 mRNA表达,且具有明显的浓度依赖性(P<0.05)。见图3、表1。

图3 Real-time PCR检测Daoy细胞内Gli1和Bcl-2 mRNA表达

表1 不同浓度GANT61作用下Daoy细胞内Gli1和Bcl-2 mRNA表达情况(x±s,n=3)
2.3各组Gli1和Bcl-2蛋白表达情况
本实验发现,不同浓度GANT61组Gli1和Bcl-2蛋白表达量明显低于正常对照组(P<0.05),且具有明显的浓度依赖性(P<0.05)。见图4、表2。
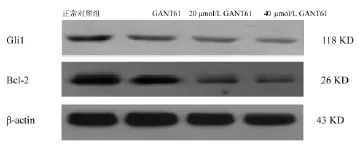
图4 GANT61作用下Daoy细胞内Gli1和Bcl-2蛋白表达水平

表2 GANT61作用下Daoy细胞内Gli1和Bcl-2蛋白表达情况(x±s,n=3)
3 讨论
MB是一种儿童较为常见的胚胎源性肿瘤,目前临床上的治疗方法主要是手术为主放化疗为辅,但是治疗效果仍然不够令人满意[1-2]。目前多项研究表明,MB的形成和发展与SHH信号通路的异常激活有密切关系[3-4]。在MB中,由于存在Gli1的高表达,可导致相应的Bcl-2启动子依赖因子活跃,从而促使了Bcl-2高表达,而高表达的Bcl-2能通过限制细胞色素C、改变线粒体膜通透性等方式来限制Caspase的活化,达到促进细胞增殖、对抗凋亡的作用[5-6]。
GANT61作为SHH信号通路下游中Gli转录因子的抑制剂,它能够结合Gli1的DNA,抑制Gli1锌指蛋白活性,拮抗Gli1等转录因子的转录活性[7],从而对Gli1下游中包括Bcl-2、Cyclin D1和Ptched1等在内的多种基因进行转录表达调控[8-9],达到阻断SHH通路信号和促进MB细胞凋亡的作用。在SHH通路中,Gli1存在于细胞核和细胞浆中,是通路中的转录激动因子。研究表明,人类多种肿瘤的发生发展和侵袭转移中广泛存在Gli1的高度活化,当Gli1异常活化时,常与肿瘤的增殖分化、细胞凋亡、血管新生、侵袭转移以及预后不良密切相关[10-11]。目前研究认为,Gli1的持续异常激活是肿瘤细胞增殖生长的重要条件,能促使下游目的基因的持续激活而导致肿瘤,如MB、基底细胞癌、横纹肌肉瘤、胰腺癌、卵巢癌、结肠癌等的形成[12-14]。本实验结果也证实GANT61能够抑制Doay细胞Gli1 mRNA和蛋白的表达,抑制Doay细胞的增殖,同时具有浓度依赖性。
细胞凋亡的发生受到细胞内凋亡调节蛋白的调控,这些凋亡调节蛋白分为促凋亡蛋白和抗凋亡蛋白两大类,细胞凋亡的发生是这两类相互拮抗的蛋白之间平衡丧失的结果[15-16]。Bcl-2基因是位于Gli1下游的一种抑制细胞凋亡的原癌基因,其转录表达受上游的Gli1调控,是细胞凋亡信号转导途径中较为关键的凋亡调节因子[17-18]。根据Bcl蛋白家族功能和结构的不同,可将其分为抑制细胞凋亡和促进细胞凋亡两大类蛋白。Bcl-2是抗凋亡的典型代表,为线粒体膜的整合蛋白,主要存在于线粒体、内质网和核膜上[19],表达水平较高时,其能够通过稳定线粒体膜阻止细胞色素C的释放,限制Caspase的活化,从而对线粒体凋亡途径起负调控作用[20]。在本实验中,GANT61抑制剂作用于MB,能引起Bcl-2 mRNA和蛋白表达水平明显下降,促进MB细胞的凋亡。
综上所述,本研究细胞增殖实验结果发现GANT61能够明显抑制MB细胞增殖生长,降低Gli1和Bcl-2基因及蛋白表达。推断在MB中,GANT61作为SHH通路中Gli1的特异性抑制剂,可拮抗Gli1的转录表达,抑制下游Bcl-2基因表达,下调Bcl-2蛋白,从而促使MB细胞凋亡。
[1]Moxon-Emre I,Bouffet E,Taylor MD,et al.Impact of craniospinaldose,boostvolume,andneurologic complications on intellectual outcome in patients with medulloblastoma[J].J Clin Oncol,2014,32(17):1760-1768.
[2]Piscione PJ,Bouffet E,Mabbott DJ,et al.Physical functioning in pediatric survivors of childhood posterior fossa brain tumors[J].Neuro Oncol,2014,16(1):147-155.
[3]Archer TC,Weeraratne SD,Pomeroy SL.Hedgehog-GLI pathway in medulloblastoma[J].J Clin Oncol,2012,30(17):2154-2156.
[4]Kieran MW.Targeted treatment for sonic hedgehogdependent medulloblastoma[J].Neuro Oncol,2014,16(8):1037-1047.
[5]Lau GJ,Godin N,Maachi H,et al.Bcl-2-modifying factor induces renal proximal tubular cell apoptosis in diabetic mice[J].Diabetes,2012,61(2):474-484.
[6]Farhadi F,Jahanpour S,Hazem K,et al.Garlic(Allium sativum)Fresh Juice Induces Apoptosis in Human Oral Squamous Cell Carcinoma:The Involvement of Caspase-3,Bax and Bcl-2[J].J Dent Res Dent Clin Dent Prospects,2015,9(4):267-273.
[7]Fu J,Rodova M,Roy SK,et al.GANT-61 inhibits pancreatic cancer stem cell growth in vitro and in NOD/ SCID/IL2R gamma null mice xenograft[J].Cancer Lett,2013,330(1):22-32.
[8]Wang X,Venugopal C,Manoranjan B,et al.Sonic hedgehog regulates Bmi1 in human medulloblastoma brain tumorinitiating cells[J].Oncogene,2012,31(2):187-199.
[9]Manoranjan B,Venugopal C,Mcfarlane N,et al.Medulloblas toma stem cells:where development and cancer cross pathways[J].Pediatr Res,2012,71(4 Pt 2):516-522.
[10]Gurung B,Feng Z,Hua X.Menin directly represses Gli1 expressionindependentofcanonical Hedgehog signaling[J]. Mol Cancer Res,2013,11(10):1215-1222.
[11]CarpenterRL,LoHW.HedgehogpathwayandGLI1isoforms in human cancer[J].Discov Med,2012,13(69):105-113.
[12]Zinke J,Schneider FT,Harter PN,et al.beta-Catenin-Gli1 interaction regulates proliferation and tumor growth in medulloblastoma[J].Mol Cancer,2015,14(3):17-26.
[13]Sahebjam S,Siu LL,Razak AA.The utility of hedgehog signalingpathwayinhibitionforcancer[J].Oncologist,2012,17(8):1090-1099.
[14]Rimkus TK,Carpenter RL,Qasem S,et al.Targeting the Sonic Hedgehog Signaling Pathway:Review of Smoothened and GLI Inhibitors[J].Cancers(Basel),2016,8(2):1-23.
[15]Mohammad RM,Muqbil I,Lowe L,et al.Broad targeting of resistance to apoptosis in cancer[J].Semin Cancer Biol,2015,35(Suppl):S78-S103.
[16]Kondratskyi A,Kondratska K,Skryma R,et al.Ion channels in the regulation of apoptosis[J].Biochim Biophys Acta,2015,1848(10 Pt B):2532-2546.
[17]Delbridge AR,Grabow S,Strasser A,et al.Thirty years of BCL-2:translating cell death discoveries into novel cancer therapies[J].Nat Rev Cancer,2016,16(2):99-109.
[18]Gibson CJ,Davids MS.BCL-2 Antagonism to Target the IntrinsicMitochondrialPathwayofApoptosis[J].ClinCancer Res,2015,21(22):5021-5029.
[19]秦婧,洪莉.表没食子儿茶素没食子酸酯对人宫颈癌细胞系HeLa细胞凋亡及bcl-2/bax表达的影响[J].中国医药导报,2014,11(24):29-32.
[20]Morishita N,Tsukahara H,Chayama K,et al.Activation ofAktisassociatedwithpoorprognosisand chemotherapeutic resistance in pediatric B-precursor acute lymphoblastic leukemia[J].Pediatr Blood Cancer,2012,59(1):83-89.
Expression of Gli1 in medulloblastoma and its targeted inhibition
XU ShangyuYANG TaoLIN ZhongxiaoCAI MingSHENG HansongZHANG Nu
Department of Neurosurgery,the Second Affiliated Hospital&Yuying Children's Hospital of Wenzhou Medical College,Zhejiang Province,Wenzhou325027,China
R739.4
A
1674-4721(2016)08(b)-0008-04
2016-05-12本文编辑:程铭)
浙江省医药卫生科技计划项目(2012RCA043)。
许尚虞(1981.12-),男,硕士;研究方向:神经肿瘤、脑血管病、重型颅脑损伤诊治。
张弩(1966.10-),男,博士,主任医师,温州医科大学附属第二医院育英儿童医院神经外科主任;研究方向:神经肿瘤、脑血管病、重型颅脑损伤诊治。
