人脐带源间充质干细胞移植对再生障碍性贫血小鼠免疫保护的研究
2016-10-10张英杰郝晓娜郝艳梅李玉云
张英杰 郝晓娜 郝艳梅 李玉云
蚌埠医学院医学检验系 安徽蚌埠 233030
人脐带源间充质干细胞移植对再生障碍性贫血小鼠免疫保护的研究
张英杰郝晓娜郝艳梅李玉云
蚌埠医学院医学检验系安徽蚌埠233030
①目的探讨人脐带源间充质干细胞(umbilical cord-mesenchymal stem cells,UC-MSCs)对免疫介导的再生障碍性贫血 (AA) 小鼠模型的治疗作用及其发挥免疫抑制作用的机制。 ②方法自然贴壁法分离、纯化 UC-MSCs 并进行体外培养和扩增; 制备免疫介导的 AA 小鼠模型。模型制成后,将培养的 UC-MSCs以1×106/kg的剂量经尾静脉注入模型鼠体内。RT-PCR法检测UC-MSCs对AA小鼠外周血及骨髓中单个核细胞γ-干扰素(IFN-γ) mRNA表达的影响,MTT法测定UC-MSCs对异基因淋巴细胞增殖效应的影响,进一步探讨其发挥免疫抑制作用的机制。③结果输注UC-MSCs后AA小鼠外周血象、骨髓病理学特征等明显改善;UC-MSCs对异基因淋巴细胞增殖有明显抑制作用; 与模型组比较, 输注UC-MSCs 可明显降低造血负调控因子 IFN-γ mRNA 表达水平(P<0.05),恢复造血。④结论AA小鼠输注UC-MSCs可使其骨髓造血衰竭情况明显改善;其机制与UC-MSCs可抑制T淋巴细胞的增殖及抑制造血负调控因子IFN-γ mRNA表达有关。
脐带源间充质干细胞再生障碍性贫血免疫保护
再生障碍性贫血(aplastic anemia,AA,简称再障)是血液系统常见疾病,其治疗仍是一世界性难题。AA发病原因十分复杂,目前认为与造血干细胞内在增殖缺陷、造血微环境紊乱、免疫功能亢进等因素有关,且免疫机制介导的免疫功能亢进在AA发病机制中起主要作用[1]。有研究进一步证明,多数 AA的发病与骨髓及外周血中 T 细胞异常活化与增殖有关[2]。脐带间充质干细胞(umbilical cord-mesenchymal stem cells,UC-MSCs)是干细胞的一种类型,具备干细胞的共同特征,即高度的自我更新能力和多向分化潜能,在不同环境、条件下分化为不同种类的细胞。MSCs是骨髓造血微环境的重要成分,可以分泌白细胞介素、白血病抑制因子、集落刺激因子、干细胞因子等,这对造血干细胞的增殖和分化起到重要作用[3,4]。近年来的研究发现,MSCs对机体免疫还具有负向调节作用,可抑制同种异体免疫反应的发生,从而减轻移植物抗宿主病(GVHD),减轻移植排斥反应[5,6]。因此,本实验立足于AA免疫机制的研究,将UC-MSCs输入急性AA模型小鼠体内,通过小鼠骨髓造血功能恢复情况及生存率,观察其对AA的治疗作用,并进一步探讨其免疫负调节作用,为AA的治疗提实验基础。
1 材料与方法
1.1实验动物SPF级DBA/2小鼠3只(中国科学院上海斯莱克实验动物中心),用于制备胸腺与淋巴结混合细胞悬液。SPF级BALB/C小鼠30只(扬州大学比较医学中心),8~12周龄,随机分为正常对照组(5只)、造模组(25只)。
1.2脐带标本蚌埠医学院附属第一医院妇产科足月妊娠分娩胎儿脐带(经家属及产妇知情同意,且脐带为废弃物,无伦理学问题)。
1.3主要试剂DMEM 培养液( Invitrogen 公司),10%胎牛血清(Hyclone公司),胰蛋白酶(宝泰克生物技术有限公司),PBS缓冲液(自制),Ficoll淋巴细胞分离液(天津灏洋生物公司),Trizol试剂(Invitrogen公司),Taq酶(Sigam)。
1.4主要仪器超净工作台(SANYO公司),CO2恒温细胞培养箱(YAMATO公司),相差倒置光学显微镜(Olympus),T780C60Co治疗机(T780C)等。
1.5UC-MSCs的分离培养将无菌条件下取得的足月妊娠分娩胎儿脐带充分洗涤后,剔除脐带动静脉,刮取Wharton's Jelly(间质组织)层,剪碎成约1mm3大小的组织块,用DMEM冲洗,冲洗液接种于含10%胎牛血清的DMEM培养基中,当细胞融合时,用胰蛋白酶消化传代。
1.6UC-MSCs的鉴定细胞传至第4代后,用消化液消化细胞,PBS洗涤2次(1000 r/min),流式细胞术检测CD34、CD29、CD31的表达情况。
1.7免疫介导AA小鼠模型的建立参考赵忻等[7]免疫介导AA小鼠模型的改进法,25只BALE/C小鼠经60Co-γ射线5.5Gy全身照射,源皮距80cm,剂量率为123Gy/min,照射时间为5.39分钟。4小时内尾静脉输入密度为5×106/mL的DBA/2小鼠胸腺与淋巴结混合细胞悬液0.2mL。AA小鼠模型建立7天后,小鼠出现食欲下降、体重减轻、反应速度迟钝,14天时外周血各项指标显著降低。随机抽取3只做骨髓细胞形态检查,显示骨髓多部位增生不良,骨髓脂肪化,造模成功,造模过程中无动物死亡。将造模成功的22只小鼠随机分为模型组和UC-MSCs移植组,各11只。
1.8UC-MSCs对异基因淋巴细胞增殖的影响
1.8.1异基因淋巴细胞的制备健康成人全血(AB血型)加入淋巴细胞分离液,密度梯度离心法分离,取白膜层单个核细胞洗涤,调整细胞终浓度为1×109/L。
1.8.2实验分组。UC-MSCs组:UC-MSCs+异基因淋巴细胞;空白对照组:培养液;阴性对照组:淋巴细胞;阳性对照组:淋巴细胞+植物血凝素(PHA)。
1.8.3实验操作。UC-MSCs组选取状态稳定的第4~5代UC-MSCs以浓度为1×109/L、1×108/L、2×107/L、1×107/L接种于96孔板,每孔100μL,待细胞贴壁后每孔加入能去除细胞增殖分化能力的丝裂霉素C 5μL,丝裂霉素的终浓度为1g/L,30分钟后移去,然后加入异基因淋巴细胞100μL(即与UC-MSCs的数量比值分别为1:1,10:1,50:1和100:1),加入终浓度为10mg/L的PHA刺激淋巴细胞增殖。阳性对照组于96孔板内加入淋巴细胞200μL和PHA。空白对照组和阴性对照组加入相对应的成分。
1.8.4MTT测定。共同培养细胞72小时后每孔加入MTT试剂 20μL,37℃再培养4小时,离心,吸出上清100μL,每孔再加入100μL的 DMSO,缓慢振荡10分钟。酶联免疫检测仪在波长为490nm处测定其吸光度,并计算淋巴细胞增殖率(%)。增殖率=(实验组吸光度-阴性对照组吸光度)/(阳性对照组吸光度-阴性对照组吸光度)×100%。
1.9输注UC-MSCs对AA小鼠模型的影响
1.9.1UC-MSCs输注对AA小鼠模型造血恢复情况的影响。移植组在造模14天时,将培养的 UC-MSCs以浓度为2×106配制细胞悬液。经尾静脉注射,注射量为1×106细胞/kg。模型组在相同时间注射等量生理盐水。各组小鼠分别饲养,28天时眼眶静脉取血处死小鼠,收集全部血液,全自动血液分析仪检查红细胞(RBC)、白细胞(WBC)、血红蛋白(Hb)、血小板(PLT)、血沉(RET)。取各组小鼠股骨,由蚌埠医学院附属第一医院病理科进行切片、染色。HE染色后在显微镜下观察骨髓造血组织增生情况。
1.9.2输注UC-MSCs对AA小鼠模型IFN-γ mRNA表达影响。收集各组小鼠的长骨,生理盐水冲洗骨髓腔,收集骨髓液并与其剩余的血液混合,将其层叠于淋巴细胞分离液上,2000r/min离心30分钟,收集白膜层细胞。参照Trizol试剂说明书提取细胞总RNA,引物由上海生工合成,IFN-γ引物上游序列为5' -CTT TAA CAG CAG GCC AGA CA-3', 下游序列为5'-GCG AGT TAT TTG TCA TTC GG-3';产物144 bp。GAPDH引物上游序列为5'-TGA ACG GGA AGC TCA CTG G-3' , 下游序列为5'-TCC ACC ACC CTG TTG CTG TA-3',产物307 bp,随机引物法合成cDNA,再以此cDNA 2μL为模板, PCR扩增。按36个反应循环数进行扩增,扩增条件为:95℃预变性3分钟,94℃变性30秒,56℃退火30秒,72℃延伸30秒,循环36次,最后72℃延伸5分钟,4℃保存。产物上样于1.5%琼脂糖凝胶进行电泳,电泳图谱经Smartview图像软件进行灰度扫描分析处理。
1.10统计学分析数据应用SPSS 16.0软件处理,多组均数比较采用方差分析,两两均数比较采用q检验,检验水准取双侧α=0.05。
2 结果
2.1UC-MSCs的培养培养1周后,倒置显微镜下观察可见培养瓶底部有散在分布贴壁细胞生长,细胞形态类似成纤维样细胞,呈长梭形(图1A);14天时细胞贴满瓶底,此时细胞排列略整齐呈鱼群样、辐射状(图1B)。此后细胞增殖迅速,2~3天可传代1次。

图1 培养的UC-MSCs(×400)
2.2UC-MSCs的鉴定选取第4~5代UC-MSCs,流式细胞术分析,结果显示,UC-MSCs均强表达整合素粘附分子CD29(96.32±3.97)%,干细胞标志物CD73(93.01±2.56)%,而造血干细胞的标记C34表达率仅为(1.11±0.46)%,内皮细胞标记CD31仅为(2.47±0.54)%,符合UC-MSCs的表达。
2.3UC-MSCs对异基因淋巴细胞增殖的影响MTT法观察共培养体系中UC-MSCs对异基因淋巴细胞增殖情况显示:阳性对照组淋巴细胞增殖率为(86.3±2.8)%,在与淋巴细胞数量比值为 1:1,1:10,1:50时,淋巴细胞增殖率分别为(26.7±3.8)%、(38.3±4.8)%、(55.6±4.2)%,与阳性对照组比较淋巴细胞的增殖率显著降低(P<0.05);当与淋巴细胞数量比值为1:100时,淋巴细胞增殖率明显升高为(79.1±4.1)%,与阳性对照组比较差异无统计学意义(P>0.05),见表1。
2.4UC-MSCs输注前后AA小鼠各项指标的变化UC-MSCs输注14天时眼眶静脉取血处死小鼠,收集全部的血液,全自动血液分析仪检查RBC、WBC、Hb、PLT、RET水平,结果显示UC-MSCs移植组各项血象指标较模型组均有明显好转(P<0.05),见表2。
2.5UC-MSCs输注前后AA小鼠骨髓象变化HE染色后骨髓组织形态特点:正常对照组小鼠骨髓有核细胞增生非常活跃,造血组织丰富(图2A);模型组骨髓有核细胞增生重度减低,骨髓脂肪化(图2B);而UC-MSCs移植组细胞增生活跃,脂肪组织比模型组减少,造血细胞明显增多(图2C),见图2。
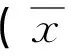
表1 UC-MSCs对淋巴细胞增殖率的影响±s)
注:与阳性对照组比较,*P<0.05
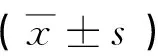
表2 MSCs输注14天后小鼠各项指标比较
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05
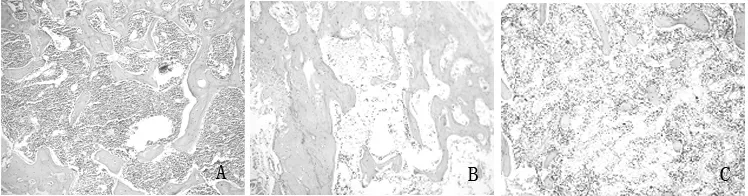
注:图A正常小鼠骨髓切片:造血组织丰富,造血细胞增生活跃;图B模型组小鼠骨髓切片:脂肪组织明显增生,骨髓脂肪化,有核细胞少见;图C移植组小鼠骨髓切片:脂肪组织仅少量存在,造血组织明显增生,造血恢复。
图2各组骨髓组织形态(HE染色,×100)
2.6RT-PCR法检测输注UC-MSCs对AA小鼠IFN-γ mRNA表达的影响正常对照组IFN-γ mRNA表达水平为(0.69±0.09),模型组、移植组分别为(1.19±0.11)和(0.82±0.13),明显高于正常对照组(P<0.05),提示骨髓抑制依然存在;但移植组表达水平较模型组已有明显减低(P<0.05),提示骨髓抑制因子表达减少,骨髓抑制减弱。见图3、表3。

注:1.模型组;2.正常对照组;3.移植组

图3 小鼠血和骨髓有核细胞IFN-γ mRNA变化表3 小鼠血和骨髓有核细胞IFN-γ mRNA变化
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05
3 讨论
MSCs作为干细胞的一种,除多向分化潜能[8~11]外,还具有支持造血及免疫调节功能,其中类似免疫抑制剂的负向调节能力逐渐进入到我们的视野[12~14]。通过对AA的深入研究我们发现,免疫介导的T淋巴细胞异常是导致AA造血功能衰竭的关键,因此我们将免疫抑制剂引入到AA的治疗中,发现免疫抑制治疗是治疗AA的最有效方法。密度梯度离心法得到的单个核细胞主要包括淋巴细胞和单核细胞,因单核细胞数量较少且不具备体外增殖能力,因此,体外培养增殖的细胞主要是淋巴细胞。研究表明,MSCs通过直接接触抑制或分泌细胞因子抑制T淋巴细胞增殖。Maitra等[15]发现当MSCs与自体淋巴细胞混合培养时具有促进淋巴细胞激活的作用,而与异体淋巴细胞混合培养时则具有较强的抑制淋巴细胞活化的作用,且在培养液中找不到抑制T淋巴细胞增殖的细胞因子,由此认为MSCs是通过细胞与细胞的直接接触来抑制异基因T淋巴细胞的增殖。Nicola[16]在体外异基因淋巴混合培养时发现,MSCs能够抑制淋巴细胞的增殖并分泌一些细胞因子,这种抑制效应随着MSCs数量的增多而逐渐加大,且是由MSCs所分泌的可溶性因子产生。我们的实验中也发现,MSCs与异基因单个核细胞共同培养,随着MSCs浓度的增加,其对异基因淋巴细胞增殖的抑制作用更加明显,这表现了其良好的抑制异基因T淋巴细胞增殖的作用。
IFN-γ与AA的免疫发病密切相关,大量实验证明骨髓造血微环境中的IFN-γ过度表达在AA发病机制中起重要作用,AA患者T淋巴细胞高分泌IFN-γ等造血负调控因子,使CD34+细胞靶细胞凋亡[17],造血干细胞数目减少,导致造血衰竭[18],Sloand[19]、陈峋[20]等研究认为外周血及骨髓中有核细胞IFN-γ表达水平可预测AA治疗的疗效,从治疗层面揭示了IFN-γ是导致AA的重要因素。因此本实验采用RT-PCR法检测UC-MSCs输注对AA小鼠IFN-γ mRNA表达的影响,研究发现AA模型组小鼠IFN-γ mRNA表达较正常对照组小鼠明显增高,而移植组,IFN-γ mRNA表达虽高于正常对照组,但与模型组比较已有明显降低(P<0.05)。表明UC-MSCs可通过抑制IFN-γ mRNA表达保护造血。
基于以上机制,我们在对AA小鼠模型的治疗中发现UC-MSCs输注14天后,小鼠的血象、骨髓象较模型组均有明显好转,具有统计学意义,显示UC-MSCs对AA小鼠治疗具有良好效果。
MSCs作为干细胞的一种,除具有多向分化潜能外还具有免疫调节作用,可明显减低GVHD的发生,因此在组织工程、器官移植领域有着广泛的应用前景。但我们也应看到,MSCs治疗AA的研究尚处于起步阶段,MSCs培养后的安全性、输注数量与间隔时间、副作用等都是我们在今后研究中亟待解决的问题。
[1]Zeng W,Kajigaya S,Chen G,et al.Transcript profile of CD8+T Cell from marrow of acquired aplastic anemia patients[J]. ExpHemato,l,2004,32(9):806-814
[2]Brodsky RA,Jones RI Aplastic anemia[J].Lancet,2005,365(9471):1647-1656
[3]Campagnoli C, Roberts IA, Kumar S,et al. Identification of mesenchymal stem/progenitor cells in human first-trimester fetal blood,liver, and bone marrow[J].Blood,2006,98:2396
[4]Susanne K,Hermann E,Johannes S,et al.Comparative analysis of mesenchymal stem cells frombone marrow,umbilical cord blood,or adipose tissue[J].Stem Cells,2006,24:1294
[5]Groh ME,Maitra B,Szekely E,et al.Human mesenchymal stem cells require Monocyte mediated activation to suppress alloreactive T cells[J].Exp Hematol,2005,33(8):928-934
[6]Corcione A,Benvenuto F,Ferretti E,et al.Human mesenchymal stem cells modulate B-cell functions[J].Blood,2006,107(1):367-372
[7]赵忻,汪明春,廖继东,等.免疫介导小鼠再障模型办法的改进[J].中国病理生理杂志,2002,18(6):716-717
[8]Kim J,Park S,Kim YJ,et al.Monolayer Graphene-Directed Growth and Neuronal Differentiation of Mesenchymal Stem Cells[J].J Biomed Nanotechnol,2015,11(11):2024-33
[9]Jiang Y,Jahagirdar BN,Reinhardt RL,et al.Pluripotency of mesenchymal stem cells derived from adult marrow[J].Nature,2002,418: 41-9
[10]Joachim O,Sabine B.Mesenchymal Stem Cells Can Be Differentiated Into Endothelial Cells In Vitro[J].Stem Cells,2004,22:377-384
[11]Zuk PA,Zhu M,Ashjian P,et al.Human adipose tissue is a source of multipotent stem cells[J].Mol Bio Cell,2002,13:4279-4295
[12]Kim SN,Lee HJ,Jeon MS,et al.Galectin-9 is Involved in Immunosuppression Mediated by Human Bone Marrow-derived Clonal Mesenchymal Stem Cells[J]. Immune Netw,2015, 15(5):241-51
[13]El Reine O,Yu X,Gabriel D,et al.Immunomodulation of endothelial differentiated mesenchymal stromal cells:impact on T and NK cells[J].Immunol Cell Biol,2015,10:1038
[14]Lee MW,Ryu S,Kim DS,et al.Strategies to improve the immunosuppressive properties of human mesenchymal stem cells[J].Stem Cell Res Ther,2015,6:179
[15]Maitra B, Szekely E, Gjini K, et al. Human mesenchymal stem cells suppor tunrelated donor hematopoietie stem cells and suppress T-cell aetivation[J]. Bone Marrow TransPlant, 2004, 33:597-604
[16]Di Nieola M,Carlo-Stella C, Magni M, et al. human bone marrow stromal cells suppressor lymphocyte proliferation indices by cellular or nonspecific mitogenic stimuli[J]. Blood, 2002, 99:3838-3843
[17]袁烨,邵宗鸿. 获得性再生障碍性贫血发病机制的研究进展[J]. 国外医学输血及血液学分册,2006, 29(3): 200-202
[18]Geissler K, Kabona E, Kollars M, et al. Interleukin-10 inhibits in vitro hematopoietic suppression and production of interferon-gamma and tumor necrosis factor-alpha by peripheral blood mononuclear cells from patients with aplastic anemia[J]. Hematol J, 2002, 3(4): 206-213
[19]Sloand E, Kjm S, Maciejewski JP, et al .Intracellular interferon-gamma in circulating and marrow T cell detected by flow cytometry and the response to immunosuppressive therapy in patients with aplastic anemia[J]. Blood, 2002, 100: 1185-1191
[20]陈昀,徐从高,郭农建,等. 多变量模型预测再生障碍性贫血免疫抑制疗法疗效的初步研究[J].中华血液学杂志,2007, 28(9): 583-586
(2016-04-03收稿)(张爱国编辑)
Immune protection effect of transplanting human umbilical cord -mesenchymal stem cells to aplastic anemia mice
ZHANGYingjie,HAOXiaona,HAOYanmei,etal
(LaboratorydepartmentofBengbumedicalcollege,Bengbu233030,China)
ObjectiveTo explore the treatment effect of transplanting human umbilical cord-mesenchymal stem cells(UC-MSCs)to aplastic anemia mice and mechanism of the immune protection effect.MethodsThe UC-MSCs derived from human umbilical cord were isolated,purified and cultivated in vitro.Immune-mediated aplastic anemia models were established in mice.UC-MSCs were infused through the caudal vena.Allogeneic lymphocytes proliferation was detected by MTT assays.Expression of IFN-γ mRNA was detected by RT-PCR method to study the mechanism of treatment.ResultsIn UC-MSCs transplanting group,the quantity of WBC,RBC,Hb and Ret had been increasing than Model group.Compared with the control group,UC-MSCs transplanting could reduce the proliferation of lymphocyte,and could reduce the expression level of IFN-γ mRNA.ConclusionUC-MSCs transplanting can reduce bone marrow failure of aplastic anemia mice by inhibiting the proliferation of lymphocyte and decreasing the expression level of IFN-γ mRNA.
Umbilical cord-mesenchymal stem cells.Aplastic anemia.Immune protection
安徽省教育厅自然科学重点项目(编号:KJ2012A198),安徽省教育厅自然科学一般项目(编号:KJ2015B050by)。
张英杰(1979- ),男,硕士,讲师。研究方向:间充质干细胞的相关研究。
R 329
A
2095-2694(2016)04-253-06
