D-101大孔吸附树脂纯化玉米须总黄酮工艺研究
2016-09-19包京姗韩凤波
包京姗,韩凤波,毕 博*
(1.吉林农业大学中药材学院,吉林长春130118;2.吉林农业科技学院,吉林吉林132101)
D-101大孔吸附树脂纯化玉米须总黄酮工艺研究
包京姗1,韩凤波2,毕博2*
(1.吉林农业大学中药材学院,吉林长春130118;2.吉林农业科技学院,吉林吉林132101)
通过超声波提取玉米须总黄酮,采用D-101大孔树脂进行分离纯化,得到最佳工艺参数:5 g大孔吸附树脂,玉米须总黄酮上样液质量浓度7 mg/m L,体积1 m L,以HCl调节pH=3,体积分数60%乙醇洗脱,洗脱体积5 BV,流速1.0 m L/m in。在此条件下,玉米须总黄酮的纯度由41.35%提高到69.20%。
D-101大孔吸附树脂;玉米须;总黄酮;纯化
玉米须(Stigma maydis)为禾本科植物玉蜀属植物玉米(Zea mays L.)的花柱与柱头[1]。其味淡、性平,归阳明经,现代药理研究证明,玉米须有显著的利尿、降血糖、降压、抑菌、抗癌、增强免疫等功效,用于治疗肾炎、胆结石、糖尿病、黄疸、乳糜血尿、麻疹、血崩等症,玉米须在民间常用于药茶、药膳中,作为糖尿病、高血压的辅助治疗药物[2-5]。刘璐等[6-7]研究表明玉米须总黄酮具有抗氧化活性;王燕[8]研究结果显示玉米须总黄酮对四氯化碳诱使肝损伤的保护作用;景怡等[9]研究显示:玉米须总黄酮可有效降低糖尿病高脂血症大鼠血糖及血脂水平,提高抗氧化能力。黄晓巍等[10]研究玉米须总黄酮能减降低糖尿病合并心肌缺血大鼠血清中乳酸脱氢酶(lactic dehydrogenase,LD)、糖化血红蛋白(haemoglobin Alc,HbAlc)含量,达到治疗糖尿病的效果,可见玉米须具有开发前景。
黄酮类化合物是玉米须中主要成分之一,本实验采用超声波提取玉米须总黄酮,大孔树脂分离纯化,考察纯化率。通过考察D-101上样液pH值、上样浓度、洗脱剂浓度、洗脱体积、流速[11-13],确定优化分离纯化工艺,研究结果为工业化生产及进一步开发利用玉米须提供一定的理论参考和指导,具有重要的现实意义。
1 材料与方法
1.1材料与试剂
玉米须采自吉林农业大学试验田;D-101大孔树脂:河北祥泰蓝星精细化工有限公司;芦丁标准品:中国药品生物制品检定所;Al(NO3)3、NaNO2、NaOH、HCl、石油醚、乙酸乙酯、甲醇、乙醇等(均为分析纯):北京化工厂。
1.2仪器与设备
AUW 120D电子天平:日本岛津公司;SY-180超声波清洗器:上海宁商超声仪有限公司;EYEAL N-1100旋转蒸发仪:日本东京理化公司;U-2900紫外可见分光光度计:日本日立有限公司;TS-100C恒温摇床:上海善志仪器设备有限公司。
1.3方法
1.3.1样品液制备
鲜玉米须去杂,60℃干燥至质量恒定。取体积分数50%乙醇,料液比1∶30(g∶m L),超声温度60℃,超声时间30 m in,超声功率400 W[14-17]条件下超声提取,旋转蒸发浓缩至棕褐色浸膏,石油醚萃取,重复至石油醚层无色,取脱脂后水层,用乙酸乙酯萃取,重复上述操作3次。合并乙酸乙酯萃取液,用旋转蒸发仪浓缩至浸膏状,60℃恒温烘干,得玉米须总黄酮粗提物。
1.3.2检测波长的确定以及芦丁标准曲线的制备
精密称取干燥至质量恒定的芦丁标准品5.25 mg置于25 m L的容量瓶中,用体积分数50%乙醇定容,制得质量浓度0.21 mg/m L的对照品溶液。取芦丁对照品溶液1 m L,置于10 m L容量瓶中并加入5%NaNO20.3 m L摇匀,放置6 m in后,再加入0.3 m L 10%Al(NO3)3,摇匀,静置6 min后再加入3 m L 1 mol/L NaOH,混匀,用体积分数50%乙醇定容至刻度,放置15 min。取体积分数50%乙醇1 m L同上操作作为空白对照溶液。在波长200~800 nm的范围内扫描吸收曲线。结果表明,在波长506 nm处吸光度值达到最大。精密量取芦丁对照品溶液1.0 m L、1.5 m L、2.0 m L、2.5 m L、3.0 m L、3.5 m L、4.0 m L分别放置于10 m L容量瓶中,按上述总黄酮检测方法,在波长506 nm处测定其吸光度值,以芦丁质量浓度-吸光度值作图,绘制芦丁标准曲线。
1.3.3玉米须总黄酮含量测定
精密称取玉米须总黄酮粗提物0.594 4 g,置于10 m L容量瓶中,用体积分数50%乙醇定容,取1 m L溶液在波长506 nm处测定吸光度值A,稀释适宜倍数,按照标准曲线回归方程计算玉米须总黄酮的含量。玉米须中总黄酮纯度计算公式如下:
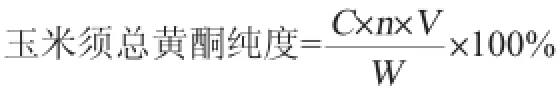
式中:C为测出的吸光度值对应的黄酮质量分数,mg/g;n为稀释倍数;V为样品的体积,mL;W为样品质量,g。
1.3.4大孔树脂吸附率测定
取玉米须总黄酮上样液6份,每份各1 m L,以HCl调节pH,分别加入装有5 g D-101大孔树脂的磨口锥形瓶中,置于恒温摇床中振摇24 h后过滤,采用1.3.3方法测定吸光度值,重复3次,计算吸附率,其计算公式如下:
吸附率=[初始质量浓度(mg/m L)-吸附后质量浓度(mg/mL)]×溶液体积(mL)/树脂质量(g)×100%
1.3.5D-101大孔树脂纯化工艺优化
D-101大孔树脂,用蒸馏水充分淋洗干净,除去表面杂质,用无水乙醇浸泡24 h,充分泡胀后,弃无水乙醇,用蒸馏水洗涤至无醇味,以5%HCl溶液浸泡,用蒸馏水洗至中性,再以5%NaOH溶液浸泡,蒸馏水洗至中性,备用。
(1)上样液pH值的考察:取玉米须总黄酮上样液6份,每份各1 m L,以HCl调节pH=1、2、3、4、5、6,分别加入装有5 g D-101大孔树脂的磨口锥形瓶中,置于恒温摇床中振摇24 h后过滤,采用1.3.3方法测定吸光度值,重复三次,计算吸附率,确定适宜pH。
(2)洗脱液浓度的考察:取玉米须总黄酮上样液6份,各1 m L,以HCl调节pH至1.3.5(1)确定的pH条件,加入装有5 g D-101大孔树脂的磨口锥形瓶中,置于恒温摇床中振摇24 h后,分别加入体积分数分别为50%、60%、75%、90%的乙醇振摇24 h,过滤,测定吸光度值,确定最佳洗脱液浓度值。
(3)上样液质量浓度的考察:取按照纯度核算后的总黄酮提取液,稀释成10mg/m L、9mg/m L、8mg/m L、7mg/m L、6 mg/m L、5 mg/m L(按照黄酮质量浓度计算)的玉米须总黄酮溶液1 m L,以HCl调节pH至1.3.5(1)确定的pH条件,加入装有5g D-101大孔树脂的磨口锥形瓶中,置于恒温摇床中振摇24 h后,滤出上清液,以盐酸-镁粉反应检测,确定上样液质量浓度。
(4)洗脱流速的考察:取1.3.5(3)确定的上样液浓度,调节pH至1.3.5(1)确定的pH条件,13.4(2)确定的体积分数乙醇洗脱,吸取1 m L样液,加入装有5 g D-101大孔树脂柱,流速分别设为0.5 m L/m in、1.0 m L/m in、2.0 m L/m in、3.0 m L/min,收集洗脱液,测定吸光度值,确定最佳流速。
(5)洗脱液体积的考察:取1.3.5(3)确定的上样液浓度,调节pH至1.3.5(1)确定的pH条件,1.3.5(2)确定的体积分数乙醇洗脱,吸取1 m L样液,加入装有5 g D-101大孔树脂柱,流速按照1.3.5(4)确定最佳流速,分别用体积为2 BV、3 BV、4 BV、5 BV、6 BV、7 BV、8 BV的洗脱液洗脱,取最后洗脱液约1 m L,计算总黄酮含量,确定最佳洗脱液体积。
2 结果与分析
2.1芦丁标准曲线的绘制
以芦丁质量浓度(x)为横坐标,波长506nm处的吸光度值(y)为纵坐标绘制芦丁标准曲线,结果见图1。由图1可知,标准曲线回归方程为y=8.605 4x-0.001 4,相关系数R2= 0.999 6。表明吸光度值与芦丁质量浓度之间线性关系良好。
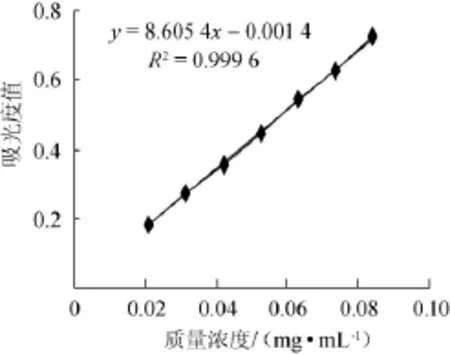
图1 芦丁标准曲线Fig.1 Standard curve of rutin
2.2D-101大孔树脂纯化工艺优化结果
2.2.1上样液pH值的考察
取玉米须总黄酮提取物以体积分数50%乙醇稀释,经检测为12.492 mg/m L,吸取6份作为上样液,每份各1 m L,以HCl调节pH=1、2、3、4、5、6,分别加入装有5 g D-101大孔树脂的磨口锥形瓶中,置于恒温摇床中振摇24 h后过滤,采用1.3.2方法测定吸光度值,重复三次,按1.3.4(1)计算吸附率。结果见图2。
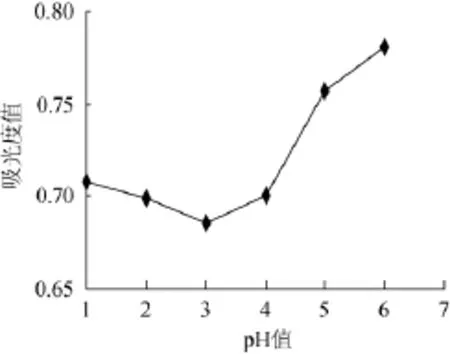
图2 不同pH值对吸光度值的影响Fig.2 Effects of d ifferent pH on absorbance value
由图2可知,不同的pH条件对于黄酮类存在形式有影响,且会导致D-101大孔树脂对于黄酮类成分的吸附性能改变,pH=3的吸光度值最低,被吸附的黄酮成分最多,经过计算,吸附率达到90.3%,黄酮类成分以更易于大孔树脂吸附的形式存在,故确定上样液的pH=3。
2.2.2洗脱液浓度的考察
取12.492 mg/m L的上样液6份,各1 m L,以HCl调节pH=3,加入装有5 g D-101大孔树脂的磨口锥形瓶中,置于恒温摇床中振摇24 h后,分别加入体积分数为50%、60%、75%、90%的乙醇振摇24 h,过滤,测定吸光度值,确定最佳乙醇体积分数,结果见图3。
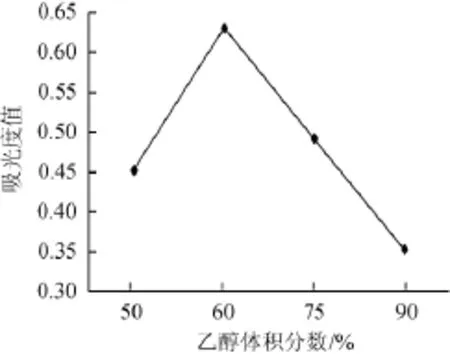
图3 不同乙醇体积分数对吸光度值的影响Fig.3 Effects of different ethanol concentration on absorbance value
由图3可知,以不同体积分数的乙醇洗脱树脂,60%乙醇洗脱液吸光度值最大,故选择体积分数60%的乙醇作为洗脱剂。
2.2.3上样液质量浓度的考察
取按照纯度核算后的总黄酮提取液,稀释成10 mg/m L、9 mg/m L、8 mg/m L、7 mg/m L、6 mg/m L、5 mg/m L(按照总黄酮质量浓度计算)的玉米须总黄酮溶液1 m L,以HCl调节pH=3,加入装有5 g D-101大孔树脂的磨口锥形瓶中,置于恒温摇床中振摇24 h后,滤出上清液,以盐酸-镁粉反应检测,确定上样浓度,结果见表1。
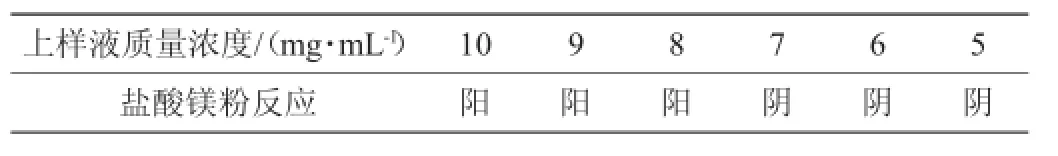
表1 最佳上样浓度的确定Table 1 Determination o f loading concentration
由表1可见,1 m L溶液含有玉米须总黄酮8 mg时,盐酸镁粉反应阳性,显示未完全吸附,7mg时阴性反应显示完全被吸附,吸附量在7~8 mg之间,为了减少损失,确定D-101大孔吸附树脂的最佳上样浓度以总黄酮核算为7 mg/m L。
2.2.4洗脱流速的考察
取7 mg/m L上样液,调节pH=3,体积分数60%乙醇洗脱,吸取1 m L样液,加入5 g D-101大孔树脂柱,流速分别设为0.5 m L/min、1.0 m L/min、2.0 m L/min、3.0 m L/min,收集洗脱液,测定吸光度值,确定最佳流速,结果见图4。
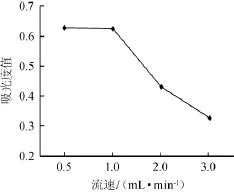
图4 不同解吸流速对吸光度值的影响Fig.4 Effects of different desorption velocity on absorbance value
由图4可知,吸光度值随着流速的增加反而减小,也就是洗脱率随着流速的增加而减小,但是流速为0.5 m L/m in和1.0 m L/m in时,吸光度值没有明显变化。考虑到流速过慢,会影响实验进程和生产效率,所以确定1.0 m L/min作为最佳流速。
2.2.5洗脱液体积的考察
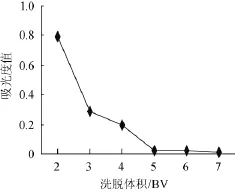
图5 不同洗脱体积对于吸光度值的影响Fig.5 Effects of different elution volume on absorbance value
以上述优化条件,取7 mg/m L上样液,调节pH=3,体积分数60%乙醇洗脱,吸取1 m L样液,加入装有5 g D-101大孔树脂柱,流速分别设为1.0 m L/min,分别用体积为2 BV、3 BV、4 BV、5 BV、6 BV、7 BV、8 BV的洗脱液洗脱,取最后洗脱液约1 m L,测定总黄酮含量,考察洗脱程度,确定最佳洗脱液体积,结果见图5。
由图5可知,随着洗脱液体积增多,总黄酮含量逐渐减少,当洗脱液体积从5 BV增加到7 BV时,黄酮含量几乎为0,说明在洗脱体积5 BV条件下洗脱基本完全。为减小浪费,故选择洗脱液体积为5 BV。
2.3验证试验
确定的纯化工艺为:按5 g D101大孔吸附树脂计算,取质量浓度为7 mg/m L的玉米须总黄酮溶液(以玉米须总黄酮计)1 m L,用HCl调节pH=3,以5 BV体积分数为60%乙醇洗脱,流速1.0 m L/min,可以达到纯化目的。按照确定工艺的四倍放大,进一步考察工艺的稳定性,取处理好的D-101大孔树脂20 g,按照确定的最佳工艺纯化,烘干洗脱液至质量恒定,测定总黄酮含量,计算纯度,重复3次,考察工艺稳定性,计算相对标准偏差(relativestandard deviation,RSD),结果见表2。
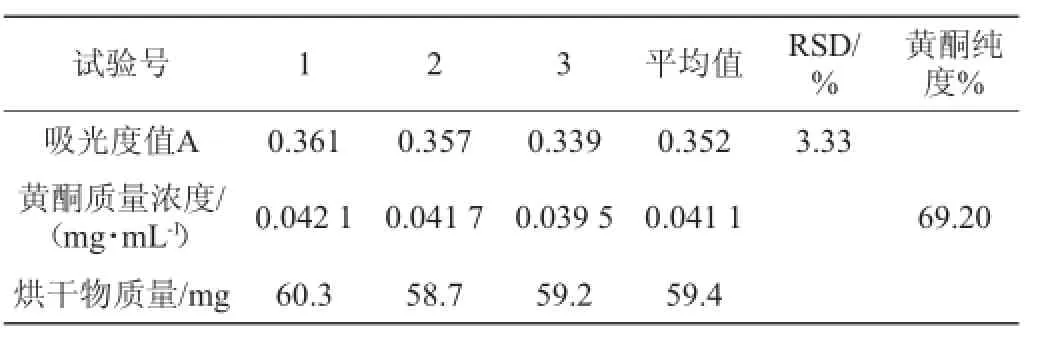
表2 验证试验及稳定性考察结果Table 2 Results o f verification test and stability test
由表2可知,在优化的工艺条件下,通过D-101大孔树脂对玉米须总黄酮进行纯化,玉米须总黄酮纯度由41.35%提高到69.20%,统计结果结果显示:三次平行试验RSD偏差小,条件比较稳定,工艺可行。
3 结论
玉米须提取后,经石油醚脱脂,乙酸乙酯初步纯化后,D-101型大孔吸附树脂可以用于玉米须总黄酮的分离纯化。确定了纯化最佳工艺参数为:玉米须总黄酮提取液上样液质量浓度为7 mg/m L(以玉米须总黄酮计),用HCl调节pH=3,以5 BV体积分数为60%乙醇洗脱,流速1.0 m L/m in,可以达到纯化玉米须总黄酮的目的,纯化后玉米须总黄酮的纯度由41.35%提高到了69.20%。D-101型大孔吸附树脂作为纯化手段现已普遍应用到大生产中,本研究结果简便易行,纯度有所提高,达到69.20%,分离量大,条件可控,适于工业化生产。
[1]南京中医药大学.中药大辞典(第二版)[M].上海:上海科学技术出版社2005.
[2]叶盛英,高文远.中药玉米须研究进展[J].中成药,2008,30(5):745.
[3]纪丽莲,范怡梅.玉米须提取物对食品腐败菌及致病菌抑制作用的研究[J].食品科学,2002,23(12):131-134.
[4]龙春,高志强,陈凤鸣,等.黄酮类化合物的结构-抗氧化活性关系研究[J].重庆文理学院学报,2006,5(2):13-17.
[5]程佳.玉米须提取物降血糖活性研究[D].长春:吉林大学硕士论文,2014.
[6]刘璐,廖李,胡建中,等.玉米须总黄酮的抗氧化性研究[J].食品工业科技,2014,35(15):116-120.
[7]刘璐,乔宇,胡建中,等.玉米须总黄酮粗提物对油脂的抗氧化作用研究[J].湖北农业科学,2013,52(24):6142-6144.
[8]王燕.玉米须总黄酮对四氯化碳诱使肝损伤的保护作用研究[J].现代中药研究与实践,2015,29(3):33-36.
[9]景怡,景荣琴,胡天惠.玉米须总黄酮对糖尿病高脂血症大鼠血脂、血糖水平的影响及抗氧化作用[J].中药药理与临床,2011,27(2):85-86.
[10]黄晓巍,王晓婷,衣春光,等.玉米须总黄酮对糖尿病合并心肌缺血大鼠血清中乳酸及糖化血红蛋白含量的影响[J].吉林中医药,2009,29(1):75-76.
[11]宋小妹,王会鑫,张宁.大孔吸附树脂在中药研究中的应用[J].陕西中医学院学报,2002,25(6):39.
[12]张玉超,李娜,乔东东,等.D-101大孔树脂分离纯化葛根异黄酮的工艺探讨[J].西北农林科技大学学报:自然科学版,2009,37(11):161-167.
[13]刘志祥,曾超珍,张明.AB-8大孔树脂分离纯化枸骨叶总黄酮的工艺研究[J].食品科学,2010,31(12):76-79.
[14]张胜帮,赵玲玲.黄酮类化合物的提取纯化研究进展[J].温州大学学报:自然科学版,2007,28(5):25-27.
[15]黄晔,龙光锦,姜林华,等.玉米须总黄酮的提取及鉴别[J].时珍国医国药,2006,17(6):1008-1009.
[16]杜若源,谢晶,王婷,等.超声波辅助提取银杏叶中总黄酮的工艺优化[J].食品与机械,2015,31(1):167-170.
[17]王丽霞,刘坤.超声波辅助提取玉米须黄酮工艺[J].北方园艺,2014(6):137-139.
Purification process of total flavonoid from Stigma maydis by D-101 macroporous adsorption resins
BAO Jingshan1,HAN Fengbo2,BI Bo2*
(1.College of Traditional Medicine,Jilin Agricultural University,Changchun 130118,China;2.Jilin Agricultural Science and Techno logy University,Jilin 132101,China)
Total flavonoids were extracted from Stigma maydis by ultrasonic extraction,and then they were separated and purified by D-101 macroporous adsorption resin.The optimal extraction condition was that D-101 macroporous adsorption resin 5 g,samples concentration 7.0 mg/m l,volume 1 m l,then adjust to pH 3 w ith HCl,elute w ith concentration 60%ethanol,w ith elute colume 5 BV and velocity 1.0 m l/min.The purification degree of total flavonoids in S.maydis increased from 41.35%to 69.20%.
D-101 macroporous adsorption resin;Stigma maydis;total flavonoids;purification
R284.2
0254-5071(2016)05-0171-04
10.11882/j.issn.0254-5071.2016.05.036
2015-11-21
吉林农业科技学院中药学省级重点学科培育资助项目(吉农院合字2014第z016号)
包京姗(1982-),女,实验师,博士,研究方向为药用植物提取与分离。
毕博(1982-),男,讲师,博士,研究方向为药用植物提取、分离、分析。
