水提醇沉法提取苦瓜多糖条件研究
2016-09-19李士杰肖连冬
李士杰,肖连冬*
(1.南阳市基础教育教学研究室,河南南阳473000;2.南阳理工学院生物与化学工程学院,河南南阳473000)
水提醇沉法提取苦瓜多糖条件研究
李士杰1,肖连冬2*
(1.南阳市基础教育教学研究室,河南南阳473000;2.南阳理工学院生物与化学工程学院,河南南阳473000)
该文对苦瓜多糖的浸提、醇析条件进行研究。考察了料水比、浸提温度和浸提时间对苦瓜多糖浸出率的影响,在单因素试验的基础上进行正交试验确定了浸提的最佳条件;通过醇析体系中乙醇浓度对苦瓜多糖醇析效果的影响,确定了适宜乙醇沉淀体积分数。结果表明,苦瓜多糖最佳浸提条件是料液比1∶30(g∶m L),浸提温度100℃,浸提时间0.5 h,在此条件下,多糖浸出率达3.58%;乙醇体积分数80%时醇沉多糖效果最好,水提醇沉后粗多糖提取率达3.12%。
苦瓜;多糖;提取;醇析
多糖(polysaccharide)又称多聚糖,是由单糖缩合成的天然大分子聚合物,广泛分布于自然界中,是一类重要的活性物质。目前已有报道的天然多糖化合物约有300多种,广泛存在于植物、动物和微生物组织中[1]。多糖与人类生活紧密相关,对维持生命活动起着至关重要的作用,和蛋白质、核酸、脂类构成了最基本的4类生命物质[2]。大量药理和临床试验证明,多糖作为一种几乎无毒副作用的天然提取物,在治疗肿瘤、免疫力低下、高血糖、衰老、病毒性疾病等方面疗效独特[3-4]。苦瓜又名凉瓜,是传统的药食同源瓜果。苦瓜多糖是由鼠李糖、阿拉伯糖、甘露糖、葡萄糖和半乳糖组成的杂多糖,具有降血糖、抗氧化、抗菌、抗辐射、降血脂和免疫调节活性,能够增强机体巨噬细胞、淋巴细胞等免疫系统的功能及激活或促进抗体、补体的生成和干扰素的诱生[5-8],具有很好的发展前景。因此,探索苦瓜多糖最佳提取条件在开发功能食品、营养保健食品及医药临床治疗方面意义重大。
目前苦瓜多糖的提取方法主要包括热水浸提法、稀酸提取法、稀碱提取法、微波提取法、超声波提取法、双酶水解法等[8]。热水浸提方法最简单,易于操作,不需特殊设备,利用热水溶出多糖;稀酸提取法采用酸溶液对苦瓜多糖提取,得率较低,产生酸废水;稀碱提取法是采用NaOH水溶液提取苦瓜多糖,易降解,且碱废水需处理;微波提取法能加速组织裂解和细胞破裂,促进多糖快速溶出,但投入大;超声波提取法利用超声波的空化效应及机械剪切作用来破坏细胞壁结构,强化传质,以达到提高有效成分收率的目的,但投入较大;双酶法采用纤维素酶-果胶酶协作用,使苦瓜细胞壁分解,促进苦瓜多糖的溶出,条件温和,减少能耗,但酶解时间长,成本较高[8-9]。杨税等[10]以新鲜苦瓜为原料,在相同环境下,以苦瓜多糖提取率为考察指标,比较常规水浸法、超声波提取法、双酶水解法、微波萃取法等不同提取方法,结果显示热水浸提法最好,操作简单、提取条件温和、绿色环保。本试验采用水提醇析法,研究热水浸提、醇析获取水溶性苦瓜多糖的工艺条件,确定各项主要技术参数,以期为苦瓜多糖的开发利用提供理论依据。
1 材料与方法
1.1材料与试剂
苦瓜:市售;蒽酮、丙酮、硫酸、无水乙醇、无水乙醚、D-葡萄糖、硫酸铜、酒石酸钾钠、氢氧化钠等均为市售分析纯。
1.2仪器与设备
FW-100高速万能粉碎机、HH·S11-4电热恒温水浴锅:北京中兴伟业仪器有限公司;R-201旋转蒸发仪、W 201D恒温水浴锅:上海申顺生物科技有限公司;TDL-40B飞鸽牌系列离心机:上海安亭科学仪器厂制造;721分光光度计:上海精密科学仪器有限公司;BS110S电子天平:德国Sartorius公司;DH6-9146A电热恒温鼓风干燥箱:上海精密试验设备有限公司;SHB-3循环多用途真空泵:郑州杜甫仪器厂。
1.3实验方法
1.3.1苦瓜多糖制取工艺
鲜苦瓜去瓤、切片、干燥、粉碎过60目筛得苦瓜粉,用体积分数为80%的乙醇回流,除去苦瓜中的单糖、低聚糖、甙类等水溶性杂质[11]。经过回流处理风干后的苦瓜粉,按照一定的料液比,采用热水浸提苦瓜多糖,抽滤得浸提液,于60℃条件下用真空浓缩至原体积的20%,醇析沉淀多糖,离心分离出沉淀物,分别用无水乙醇、丙酮、乙醚洗涤,真空干燥后得苦瓜粗多糖。
1.3.2多糖的测定
(1)总糖的测定方法
采用硫酸-蒽酮比色法[12]。葡萄糖标准曲线的绘制:准确称取恒质量的D-葡萄糖20 mg,加蒸馏水溶解后定容到100 m L,制成200 μg/m L的标准葡萄糖。准确称取1 g蒽酮以乙酸乙酯定容至50 m L。取6支试管,分别加入200 μg/m L的葡萄糖溶液0、0.2 m L、0.4 m L、0.6 m L、0.8 m L、1.0 m L,然后分别加入蒸馏水2.0 m L、1.8 m L、1.6 m L、1.4 m L、1.2 m L、1.0 m L配制一系列不同的葡萄糖溶液,并在每支试管中立即加入蒽酮试剂0.5 m L,再用刻度吸管加入浓硫酸5 m L,摇匀,反应10 min,在波长620 nm条件下比色。以葡萄糖含量(x)作横坐标,以吸光度值(y)作纵坐标,绘制葡萄糖标准曲线。
(2)还原糖的测定方法
采用斐林试剂比色法[12]。葡萄糖标准曲线的绘制:准确称取80℃条件下烘干至恒质量的葡萄糖0.100 0 g,加蒸馏水溶解,并定容至100 m L,配成0.1%葡萄糖标准溶液。取7支试管,分别在各管中加入4 m L斐林试剂,然后分别加入0.1%葡萄糖标准液0、1 m L、2 m L、3 m L、4 m L、5 m L、6 m L,并分别加蒸馏水补足至10 m L,每管含葡萄糖各为0、1 mg、2 mg、3 mg、4 mg、5 mg、6 mg,混合摇匀后加塞,于沸水浴中加热15 m in。取出后在流水中冷却,再经1 500 r/m in离心5 min。取上清液在波长590 nm条件下比色,以葡萄糖含量(x)作横坐标,以吸光度值(y)作纵坐标,绘制葡萄糖标准曲线。
1.3.3多糖含量和多糖提取率的计算
先采用硫酸-蒽酮比色法测出苦瓜中总糖的含量,再用斐林试剂比色法测出还原糖的含量,总糖减去还原糖即为苦瓜中多糖的含量[13]。

1.3.4苦瓜多糖浸提条件的确定
准确称取一定量经乙醇回流风干后的苦瓜粉,用蒸馏水进行苦瓜多糖的提取,过滤得浸提液,测定其吸光度值A620nm,计算出多糖浸出率[14-16]。
(1)单因素试验
在其他条件相同时,分别研究不同的料水比(1∶15、1∶20、1∶25、13∶30、1∶35、1∶40(g∶m L))、浸提温度(60℃、70℃、80℃、90℃、100℃)和浸提时间(0.5 h、1.0 h、1.5 h、2.0 h、2.5 h)对苦瓜多糖浸出率的影响。
(2)苦瓜多糖浸提的正交试验
根据单因素试验结果,选取料液比(A)、浸提温度(B)和浸提时间(C)3个因素,进行L9(34)正交试验,以苦瓜多糖浸出率为评价指标,确定苦瓜多糖提取的最优工艺条件。正交试验设计因素与水平见表1[17]。

表1 苦瓜多糖提取条件优化正交试验因素与水平Table 1 Fac tors and levels of orthogonal experim ents for extrac tion conditions optim ization o f balsam pear polysaccharide
1.3.5苦瓜多糖醇沉条件的确定[18]
分别称取经乙醇回流干燥后的苦瓜粉4份,每份均为1.00 g,按1∶25(g∶m L)的料水比加入蒸馏水,在温度为100℃的水浴锅上浸提0.5 h,收集滤液,并浓缩至原体积的20%,分别加入乙醇,使体系中乙醇体积分数分别为60%、70%、80%、90%,摇匀,室温下醇析12 h,沉淀洗涤干燥后称质量,测定其多糖含量,计算出粗多糖提取率。
2 结果与分析
2.1葡萄糖标准曲线
采用硫酸-蒽酮比色法测定不同含量的葡萄糖在波长620 nm处的吸光度值,以葡萄糖含量(x)为横坐标,吸光度值(y)为纵坐标,绘制出葡萄糖标准曲线,结果如图1所示。

图1 葡萄糖标准曲线(蒽酮比色法)Fig.1 Standard curve of glucose(anthrone colorimetry)
由图1可知,在葡萄糖含量0~200 μg范围内,标准曲线线性回归方程为y=0.003 3x+0.013 3,拟合系数R2=0.997 9。结果表明,葡萄糖含量与吸光度值呈良好的线性关系。
采用斐林试剂比色法测定不同含量的葡萄糖在波长590 nm处的吸光度值,以葡萄糖含量(x)为横坐标,吸光度值(y)为纵坐标,绘制出葡萄糖标准曲线,结果见图2。
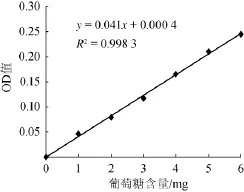
图2 葡萄糖标准曲线(斐林试剂比色法)Fig.2 Standard curve of glucose(F ehling reagent colorim etry)
由图2可知,在葡萄糖含量0~6 mg范围内,葡萄糖标准曲线线性回归方程为y=0.041 0x+0.000 4,拟合系数R2=0.998 3。结果表明,葡萄糖含量与吸光度值呈良好的线性关系。
2.2苦瓜多糖浸提条件的优化
2.2.1苦瓜多糖浸提的单因素试验
(1)料液比对多糖提取效果的影响
分别选取料液比1∶15、1∶20、1∶25、1∶30、1∶35、1∶40(g∶m L),在温度为90℃条件下浸提1 h,考察不同料液比对多糖浸出率的影响。其结果见图3。
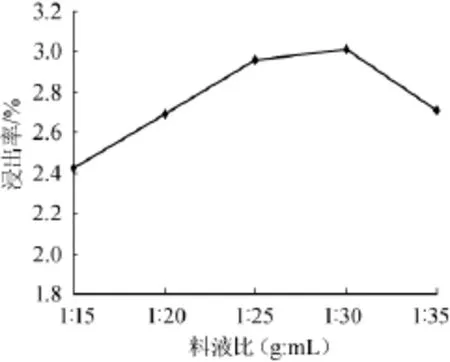
图3 料液比对苦瓜多糖浸出率的影响Fig.3 Effect of material-water ratio on extraction rate of ba lsam pear polysaccharides
由图3可知,料液比对浸出率影响很大。料液比在1∶15~1∶25(g∶m L)时,随着料液比升高,多糖浸提充分,浸提液中多糖的含量迅速升高,当料液为1∶30(g∶m L)时,多糖浸出率达到最大值3.01%,继续再加大料液比,多糖浸出率略有降低,这可能是因为多糖含量很低时对温度的抵抗能力降低而致使其结构有所破坏。结果表明。苦瓜多糖在料液比1∶30(g∶m L)的条件下已基本溶出,此时多糖浸出率较高。故料液比选择1∶30(g∶m L)较为适宜。
(2)浸提温度对多糖提取效果的影响
选取料液比1∶25(g∶m L),分别在温度60℃、70℃、80℃、90℃、100℃条件下浸提1 h,过滤,分别测定其吸光度值,考察不同料液比对多糖浸出率的影响。其结果见图4。
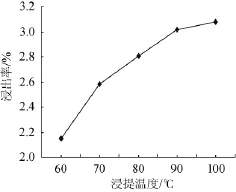
图4 浸提温度对苦瓜多糖浸出率的影响Fig.4 Effect of extraction tem perature on extraction rate of balsam pear polysaccharides
由图4可知,浸提温度为60~90℃时,浸提液中多糖的含量随着温度的升高而升高,浸提温度>90℃后,多糖浸出率升高变缓,当温度升至100℃时,多糖浸出率达到最大值3.08%。较高的温度易使细胞壁膨胀破裂,多糖溶解充分,浸出较完全,多糖的浸出率就高。因此,最佳浸提温度为100℃。
(3)浸提时间对多糖提取效果的影响
称取1.000 0 g预处理苦瓜粉,在料液比1∶25(g∶m L)、浸提温度90℃条件下,分别浸提0.5 h、1.0 h、1.5 h、2.0 h和2.5 h,过滤,分别测定其吸光度值,计算多糖浸出率。不同浸提时间对多糖浸出率的影响结果见图5。
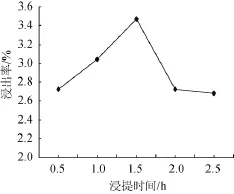
图5 浸提时间对苦瓜多糖浸出率的影响Fig.5 Effect of extraction time on extraction rate of balsam pear polysaccharides
由图5可知,浸提时间在0.5~1.5 h时,随浸提时间的延长,苦瓜多糖浸出率逐渐增大,并在提取时间为1.5 h时,多糖浸出率达最大3.47%,浸提时间>1.5 h之后,粗多糖浸出率呈迅速下降趋势,这可能是由于苦瓜多糖在长时间的高温影响下,导致其结构发生改变[19]。因此,最佳浸提时间为1.5 h。
2.2.2苦瓜多糖提取的正交试验
根据单因素试验结果,以多糖浸出率为考察指标,料液比、浸提温度及浸提时间各因素分别选择3个水平进行正交试验。结果与分析见表2,方差分析结果见表3。
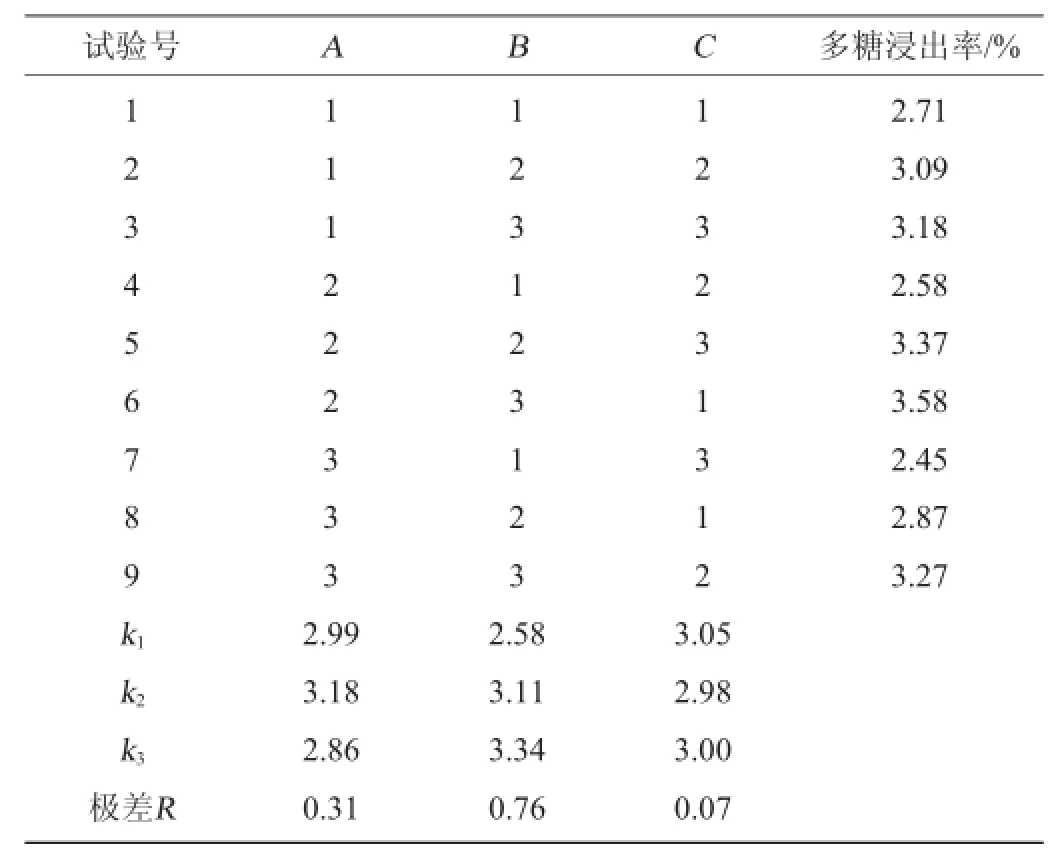
表2 多糖提取工艺优化正交试验结果与分析Table 2 Results and analysis of orthogonal experim ents for extraction conditions o f balsam pear polysaccharide optim ization
由表2可知,各因素影响苦瓜多糖浸出率的主次关系顺序:浸提温度(B)>料液比(A)>浸提时间(C),最佳工艺条件为A2B3C1,即料液比为1∶30(g∶m L),提取温度100℃,提取时间0.5 h。在此最佳条件下,苦瓜多糖浸出率为3.58%。
由表3可知,在影响提取苦瓜多糖浸出率的3个因素中,浸提温度影响极显著(P<0.01),料液比、浸提时间对多糖的浸出率影响不显著(P>0.05)。
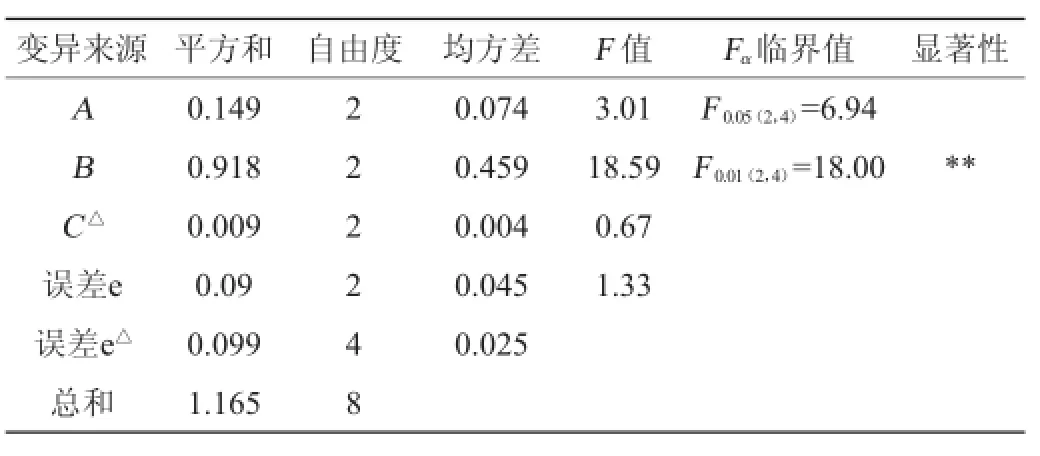
表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal experim ents resu lts
2.3苦瓜多糖醇沉淀条件的确定
不同乙醇体积分数体系下沉析苦瓜多糖,对最终苦瓜粗多糖提取率影响结果见表4。其方差分析结果见表5。
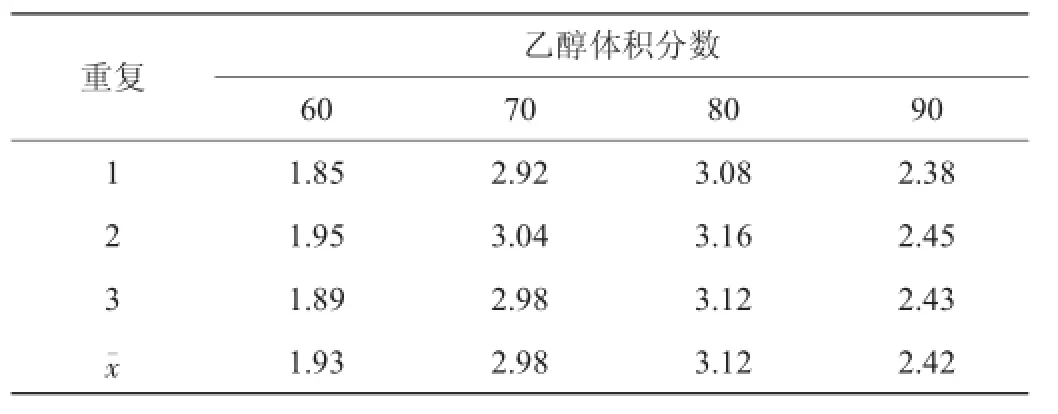
表4 乙醇体积分数对苦瓜粗多糖提取率的影响Table 4 Effect of ethanol concentration on extraction rate of balsam pear polysaccharides %
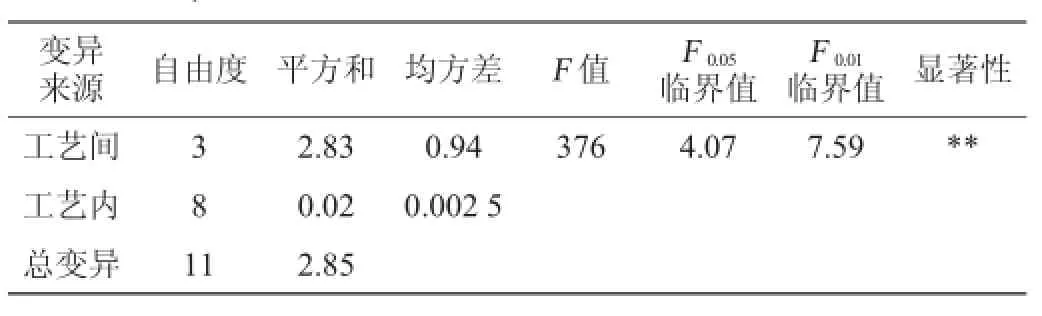
表5 多糖醇沉试验结果方差分析Table 5 Variance analysis of polysaccharides alcohol precipitation experiments results
由表4可知,当醇析体系中乙醇体积分数升高,粗多糖提取率也随着升高,当体系中乙醇体积分数达到80%时,苦瓜粗多糖提取率达最大值3.16%,平均值为3.12%。
由表5可知,F=376>F0.01,说明不同乙醇体积分数对多糖提取率有极显著(P<0.01)的影响,为了确定各个乙醇体积分数之间的提取率差异是否显著,需要进行多重比较。这里采用最小显著差数法(least significant difference,LSD)进行检验。本试验中,各组内观测次数相同都为3次,而且组内方差为0.002 5,故任何两组的比较可用最小显著差LSD0.05=0.094及LSD0.01=0.137 0比较,结果见表6。
由表6可知,各个乙醇体积分数之间苦瓜粗多糖提取率差异都极显著(P<0.01),因此,本试验所选乙醇沉淀最佳条件为乙醇体积分数80%,粗多糖平均提取率为3.12%。
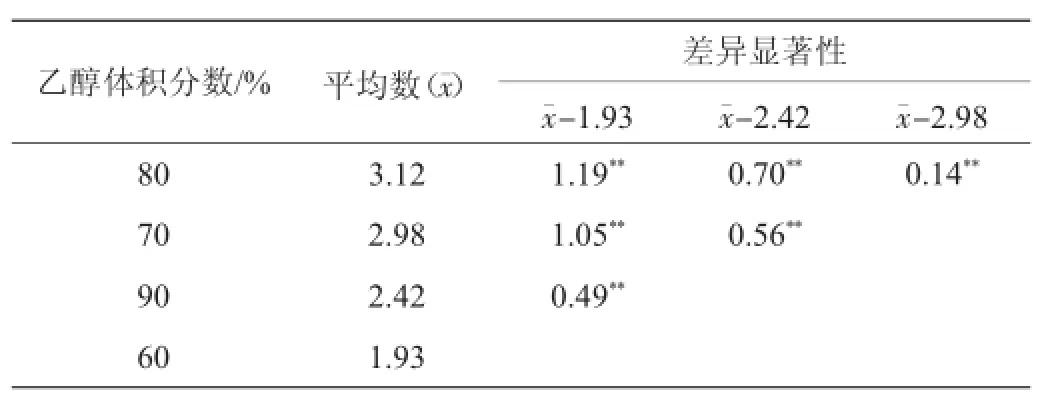
表6 不同乙醇体积分数多糖提取率差异显著性比较Table 6 Com parison of significance difference of extrac tion rate by different ethanol concentration
3 结论
苦瓜多糖为一种具有多种生理活性的物质,研究其提取、醇析的条件提高提取率具有重要价值。通过单因素试验和正交试验,对水浸提苦瓜多糖的工艺进行了优化,得到的最佳提取工艺条件为料液比1∶30(g∶m L),浸提温度100℃,浸提时间0.5 h,在此条件下,苦瓜多糖浸提率为3.58%;通过研究苦瓜多糖醇析条件得知,将原浸出液浓缩至原体积的20%,在室温条件下用乙醇醇沉苦瓜多糖12 h,醇沉的最佳乙醇体积分数为80%,此时苦瓜多糖提取率最高,达3.12%。试验利用高温短时提取苦瓜多糖具有浸出率高,节约时间,操作简便,提取效率高等优点,可为大规模工业化生产苦瓜多糖提供理论依据。
[1]申利红,王建森,李雅,等.植物多糖的研究及应用进展[J].中国农学通报,2011,27(2):349-352.
[2]LOWE J B,MARTH J D.A genetic approach to mammalian glycan function[J].Annu Rev Biochem,2003,72(1):643-691.
[3]谢明勇,聂少平.天然产物活性多糖结构与功能研究进展[J].中国食品学报,2010,10(2):1-8.
[4]林俊,李萍,陈靠山.近5年多糖抗肿瘤活性研究进展[J].中国中药杂志,2013,38(8):1116-1125.
[5]蔡寅,刘敏,吴勋贵,等.苦瓜多糖抗肿瘤及免疫增强活性的研究[J].药学与临床研究,2010,18(2):131-134.
[6]陈红漫,李寒雪,阚国仕,等.苦瓜多糖的抗氧化活性与降血糖作用相关性研究[J].食品工业科技,2012,33(18):349-354.
[7]何庆峰,刘金福,尤玲玲,等.苦瓜多糖与皂苷对高血糖协同预防作用机制研究[J].食品与机械,2010,26(5):91-93.
[8]陈敬鑫,张子沛,罗金凤,等.苦瓜保健功能的研究进展[J].食品科学,2012,33(1):271-275.
[9]龚斌,申明月,何陵玲,等.苦瓜多糖的提取、结构及生物活性研究进展[J].食品科学,2015,36(21):279-283.
[10]杨税,吴梦婷,孙锋,等.苦瓜多糖提取方法的比较[J].内蒙古中医药,2014,33(26):62-63.
[11]薛美香,黄国波.苦瓜多糖的工艺研究[J].延边大学学报,2012,38(4):307-310.
[12]张彩莹,肖连冬.生物化学实验[M].北京:化学工业出版社,2009.
[13]陈丹红.鸡腿菇多糖的醇析工艺研究[J].福建轻纺,2010(10):35-37.
[14]王锋,罗丽兰,张秀清.灵芝多糖的超声辅助碱提工艺优化[J].中国酿造,2015,34(7):129-133.
[15]王杉杉,马韵升,姚刚,等.超声波辅助复合酶法提取枸杞多糖工艺研究[J].中国酿造,2015,34(7):134-137.
[16]单斌,张卫国,谢建华,等.响应面法优化超声辅助提取苦瓜多糖工艺的研究[J].食品与机械,2009,25(1):76-80.
[17]李云雁,胡传荣.实验设计与数据处理[M].北京:化学工业出版社,2008.
[18]桂志远,王学东.响应面法优化麦胚多糖的醇析工艺[J].粮食科学与经济,2011,36(1):54-56.
[19]吕雅.苦瓜中黄酮和多糖的提取及生物活性研究[D].广州:广东工业大学硕士论文,2014.
Extraction conditions of balsam pear polysaccharides by water-extraction and alcohol-precipitation method
LI Shijie1,XIAO Liandong2*
(1.Nanyang Basic Education Teaching and Research Section,Nanyang 473000,China;2.College of Biology and Chem ical Engineering,Nanyang Institute of Technology,Nanyang 473000,China)
The process parameters for balsam pear polysaccharide extraction and alcohol precipitation were researched.The effects of material-water ratio,extraction tem perature and time on extraction rate of balsam pear polysaccharides were investigated.On the basis of single factor experiments,the optimum extraction conditions were determ ined by orthogonal experiments.Through the effect of ethanol concentration on the ethanol precipitation of balsam pear polysaccharides in ethanol precipitation system,the optimum ethanol precipitation concentration was determ ined.Results indicated that the optimum extraction conditions of balsam pear polysaccharides were as follows:material-water ratio 1∶30(g∶m l),extraction temperature 100℃and time 0.5 h.Under the conditions,the extraction rate of polysaccharide was up to 3.58%.W hen the ethanol concentration was 80%,the alcohol precipitation effect of polysaccharide was the optimal.The extraction rate of polysaccharide extracted by alcohol-precipitation was up to 3.12% by water extraction.
balsam pear;polysaccharide;extraction;alcohol precipitation
R286
0254-5071(2016)05-0166-05
10.11882/j.issn.0254-5071.2016.05.035
2016-03-15
南阳市科技局计划项目(No.2010GG024)
李士杰(1965-),男,高级教师,本科,主要从事生物学教学研究工作。
肖连冬(1964-),女,教授,硕士,研究方向为食品生物技术。
