食用菌发酵液体外对白色念珠菌生长和生物被膜形成影响
2016-09-18窦会娟畅灵丽孙连海郭文涛漯河医学高等专科学校基础医学部河南漯河462002
窦会娟,畅灵丽,孙连海,郭文涛(漯河医学高等专科学校 基础医学部,河南 漯河 462002)
食用菌发酵液体外对白色念珠菌生长和生物被膜形成影响
窦会娟,畅灵丽,孙连海,郭文涛
(漯河医学高等专科学校 基础医学部,河南 漯河 462002)
该文研究食用菌液体发酵液体外对白色念珠菌(Candidaalbicans)生长及生物被膜形成的影响。采用纸片扩散法测定食用菌液体发酵液中白色念珠菌的抑菌活性;甲基四氮盐(XTT)减低法测定其对白色念珠菌生物被膜形成的影响。结果表明,各种食用菌发酵液对白色念珠菌均有不同程度的抑制作用,其中对发酵液抑菌作用从强到弱依次为香菇发酵液、鸡腿菇发酵液,抑菌圈直径分别为(2.967±0.160)mm、(2.433±0.214)mm。对白色念珠菌生物被膜形成的抑制作用强弱依次为鸡腿菇发酵液和香菇发酵液,其相对抑菌率分别为(39.25±1.87)%、(28.72±2.59)%。鸡腿菇和香菇均对白色念珠菌在培养12 h时形成的生物被膜的抑制作用最强,相对抑菌率分别达到(46.37±3.14)%和(42.86±3.38)%。香菇及鸡腿菇发酵液对白色念珠菌生长及其生物被膜的形成有一定的抑制作用,有进一步的开发价值。
食用菌;液体发酵;白色念珠菌;生物被膜;抑制
随着广谱抗生素、糖皮质激素和免疫抑制剂等的广泛应用,免疫受损人群不断增加,条件致病真菌中念珠菌的感染率日渐升高[1-2]。白色念珠菌(Candidaalbicans)是临床最常见的致病真菌,在机体免疫功能低下时,可引起黏膜和全身性的感染[3]。随着抗真菌药物的广泛应用,白色念珠菌的耐药现象越来越严重[4]。该菌对传统抗菌药物产生耐药性是治疗此类感染的难点。研究显示,真菌的耐药性与生物被膜有着密切关联[5]。念珠菌的耐药性与其形成生物被膜密切相关,以生物被膜状态存在的念珠菌对抗菌药物的敏感性要下降几十倍甚至上千倍[6]。白色念珠菌生物被膜活性随培养时间延长而增加,48 h后代谢活性相对稳定[7]。故本研究中对生物被膜的培养时间的选择,确定为48 h。CHANDRA J等[8]发现白色念珠菌生物被膜的形成分为3个阶段:早期(0~11 h),中期(12~30 h)和成熟期(38~72 h)。早期的黏附尤为重要,随着培养时间的延长,生物被膜逐渐发育成熟,故抑制黏附是抗白色念珠菌生物被膜感染的关键措施。近几年,食用菌的抑菌作用逐渐受到研究者的关注。我国食用真菌资源丰富,而且大型食用真菌可以较方便地通过菌丝体或孢子发酵培养[9],但食用菌液体发酵液对白色念珠菌的生长和生物被膜形成的影响,相关研究较少。
本研究采用液态发酵的方法制备金针菇(Flammulinavelutipes)、香菇(Lentinula edodes)、茶树菇(Agrocybe aegerita)、鸡腿菇(Coprinuscomaus)、杏鲍菇(Pleurotus eryngi)、猴头菇(Hericium erinaceus)、木耳(Auricularia auricula)的液态发酵液。Kirby-Bauer(K-B)纸片扩散法测定发酵液对白色念珠菌的抑菌活性,甲基四氮盐(XTT)减低法测定其对白色念珠菌生物被膜形成的影响,为更好地解决白色念珠菌的感染和耐药问题提供新的思路。
1 材料与方法
1.1料与试剂
1.1.1用菌与指示菌
供试7种食用菌(金针菇、香菇、茶树菇、鸡腿菇、杏鲍菇、猴头菇、木耳):本实验室保存菌种;白色念珠菌(Candida albicans)ATCC10231:中国普通微生物菌种保藏管理中心。
1.1.2养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基及食用菌一级摇瓶液体培养基分别按照参考文献[10-11]配制。
食用菌液体发酵培养基:蔗糖30 g,玉米粉20 g,麸皮40 g,加水至1 000m L,调节pH值为7.0。
沙氏琼脂(Sabouraud'sagar,SDA)培养基:葡萄糖40 g,蛋白胨10 g,琼脂20 g,加水至蒸馏水1 000m L,调节pH值为4.0~6.0。
RPM I-1640培养基:赛齐(上海)生物工程有限公司。
1.1.3学试剂
KH2PO4(分析纯):天津市风船化学试剂科技有限公司;硫酸铵(分析纯):郑州辰尼化学试剂厂;MgSO4·7H2O、葡萄糖(分析纯):天津市科密欧科技有限公司;甲基四氮盐(超纯级):上海宝曼生物科技有限公司;CountessC10227自动血细胞计数仪:南京贝登生物科技有限公司。
1.2器与设备
DHZ-CA大容量恒温振荡器:江苏太仓市实验设备厂;LRH-250-HS恒温恒湿培养箱:广东省医疗器械厂;DG3022A酶标仪:南京华东电子医疗装备有限公司。
1.3法
1.3.1用菌液体发酵液的制备
参照文献[12]中食用菌菌种活化方法和液体种子制备方法进行菌种活化和液体种子制备,然后按照香菇液体发酵产抑菌物质活性最高的发酵条件[13],发酵液初始pH值为5,装液量为100m L/300m L,接入7%的液体菌种,于28℃、180 r/m in摇床培养8 d,即得食用菌液体发酵液。
1.3.2同食用菌液态发酵产物抑菌活性的测定
取200μL发酵液加于制备好的6mm灭菌纸片,同时制作蒸馏水纸片作为空白对照。37℃干燥后分装于小瓶中,-20℃保存备用。采用K-B纸片扩散法[14],取菌悬液200μL均匀涂于SDA固体培养基。取制备好的药敏纸片5片贴于琼脂培养基表面,并放置空白对照纸片于正中心,25℃培养24 h,十字交叉法测量抑菌圈直径。
发酵液抑菌圈直径(mm)=待测发酵液抑菌圈直径-6(灭菌纸片直径)
1.3.3色念珠菌菌悬液的配制
将白色念珠菌接种于SDA液体培养基中,35℃摇床培养48 h,用RPM I-1640培养基稀释,血细胞计数板计数,调整菌悬液浓度为1×106~5×106CFU/m L。
1.3.4色念珠菌生物被膜制备
以100μL/孔菌液接种于96孔细胞培养板中,37℃培养2 h后弃去RPM I-1640培养基,用pH 7.4、0.01 mol/L磷酸缓冲液(phosphatebuffer saline,PBS)洗3次,加入100μL RPM I-1640培养基,作为培养的零点,37℃继续培养,每24 h更换1次培养基。
1.3.5同食用菌液体发酵液对白色念珠菌生物被膜形成的影响
在生物被膜培养的零点,加入食用菌液体发酵液100μL,空白对照孔加入200μL培养基,37℃继续培养48 h后,弃去培养基,聚丁二酸丁二醇酯(poly butylenes succinate,PBS)洗涤3次,用XTT减低法测量各孔在波长490 nm处的OD490nm值。每组设3个重复孔,根据OD490nm值计算相对抑制率[15-16]。相对抑制率计算公式如下:

1.3.6用菌液体发酵液对不同生长阶段白色念珠菌生物被膜的影响
将100μL白色念珠菌液接种于96孔细胞培养板中,分别在生物被膜培养的0、4 h、8 h、12 h、24 h和48 h时弃去培养基,加入食用菌液体发酵液100μL,空白对照组仅加入培养基,37℃继续培养24 h。XTT法测量各孔在波长490 nm处的OD490nm值,根据OD490nm值计算相对抑制率。
1.3.7计学分析
所有数据均应用SPSS 17统计软件进行统计处理。
2 结果与分析
2.1同食用菌发酵液对白色念珠菌的生长抑制作用
采用K-B纸片扩散法测定不同食用菌发酵液对白色念珠菌的生长抑制作用,结果如表1所示。

表1 不同食用菌发酵液对白色念珠菌的抑菌作用Table 1 Inhibition effect of diffe rent edible fungus ferm entation liquid on C.albicans
由表1可知,7种食用菌液体发酵液对白色念珠菌的生长均有不同程度的抑制作用,其中香菇、鸡腿菇对白色念珠菌的抑菌作用最强,抑菌圈直径分别是(2.967±0.160)mm和(2.433±0.214)mm,杏鲍菇发酵液的抑菌作用最弱,抑菌圈直径只有(0.233±0.107)mm。
2.2同食用菌液体发酵液对白色念珠菌生物被膜形成的影响
调节发酵液初始pH值为5,在300m L三角瓶中装入液体发酵培养100m L,接入7%的液体菌种,于28℃、180 r/min摇床培养8d,即得食用菌液体发酵液。不同食用菌液体发酵液对白色念珠菌生物被膜形成的影响,结果如表2所示。
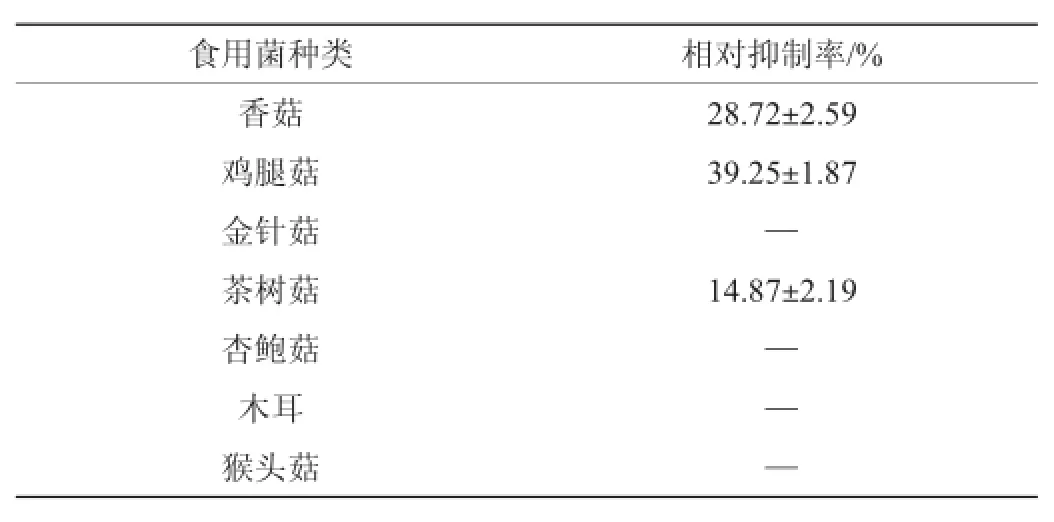
表2 不同食用菌液体发酵物对白色念珠菌生物被膜的影响Table 2 Effect of different edible fungus ferm entation liqu id on biofilm formation of C.albicans
由表2可知,鸡腿菇发酵液对白色念珠菌生物被膜形成的抑制作用是最强的,相对抑制率达到了(39.25±1.87)%,香菇的抑制作用次之,相对抑制率为(28.72±2.59)%。金针菇、杏鲍菇、木耳和猴头菇对白色念珠菌生物被膜形成的抑制作用不明显。生物被膜是一种黏附于非生物或生物表面的微生物菌落,生物被膜中菌的生物学特性与浮游菌显著不同[7]。虽然香菇发酵液对白色念珠菌的抑菌活性是最高的,但对白色念珠菌的生物被膜来说,鸡腿茹发酵液的抑制作用是最强的。
2.3腿菇及香菇发酵液对不同生长阶段白色念珠菌生物被膜的影响
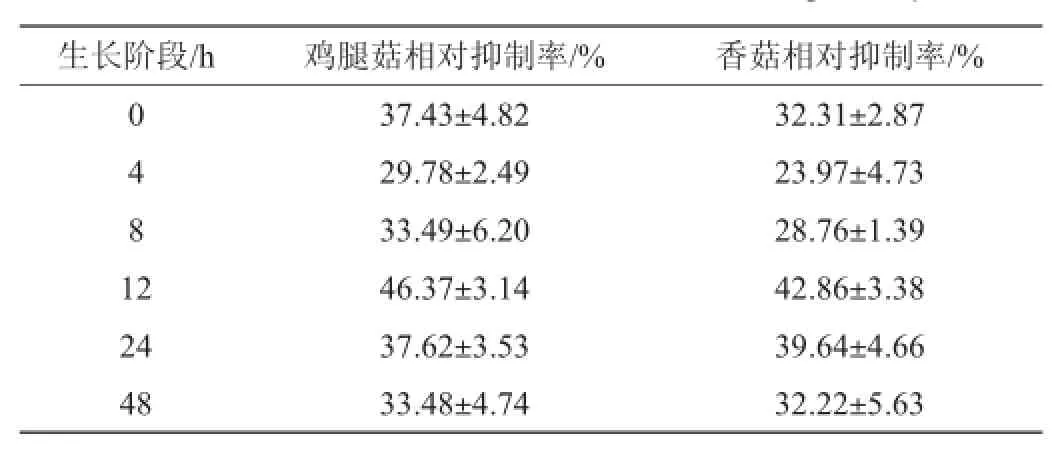
表3 鸡腿菇及香菇液体发酵液对不同生长阶段白色念珠菌生物被膜形成的影响Tab le 3 Effec t of C.com aus and L.edodes ferm entation liqu id on biofilm formation of C.albicans at differentgrow th phases
结合食用菌发酵液对白色念珠菌的抑菌作用和对生物被膜形成的影响,选定鸡腿菇、香菇发酵液为对白色念珠菌生物被膜抑制效果较好的菌种,进一步测定了其发酵液对不同生长阶段生物被膜的影响,结果如表3所示。
由表3可知,随着生物被膜形成时间的延长,鸡腿菇和香菇对其抑制率增强,到12 h时,相对抑制率达到最高值,分别为(46.37±3.14)%和(42.86±3.38)%,随后逐渐降低。表明鸡腿菇和香菇发酵液对白色念珠菌生物被膜形成的早中期有较强的抑制作用。
3 结论
本研究选取具有较强生物被膜形成功能的白色念珠菌(ATCC10231)为标准菌株,研究食用菌液体发酵液体外对白色念珠菌生长及生物被膜形成的影响。采用纸片扩散法测定食用菌液体发酵液对白色念珠菌的抑菌活性;甲基四氮盐(XTT)减低法测定其对白色念珠菌生物被膜形成的影响。结果表明,各种食用菌发酵液对白色念珠菌均有不同程度的抑制作用,其中香菇发酵液抑菌作用最强,抑菌圈直径为(2.967±0.160)mm;鸡腿菇发酵液对白色念珠菌生物被膜形成的抑制作用最强,相对抑菌率为(39.25±1.87)%,香菇发酵液对白色念珠菌生物被膜形成的抑制作用次之,相对抑菌率为(28.72±2.59)%。鸡腿菇和香菇对白色念珠菌培养12 h时形成的生物被膜的抑制作用最强,相对抑制率分别达到(46.37±3.14)%和(42.86±3.38)%。对于抑制白色念珠菌感染,香菇、鸡腿菇发酵液有进一步的开发价值。
[1]PERLROTH J,CHOIB.Nosocom ial fungal infections:epidem iology,diagnosis,and treatment[J].M ed M ycol,2007,45(4):321-346.
[2]W ILSON D,THEWES S,ZAKIKHANY K,et al.Identifying infection-associated genes of Candida albicans in the postgenomic era[J]. FEMSYeast Res,2009,9(5):688-700.
[3]SENEVIRATNE C J,WANG Y,JIN L,etal.Candida albicans biofilm formation is associated with increased anti-oxidative capacities[J].Proteomics,2008,8(14):2936-2947.
[4]王晓丽,白丽.白色念珠菌耐药的研究进展[J].中国病原生物学杂志,2009,4(12):946-947.
[5]DONLAN R M,COSTERTON JW.Biofilms:Survialmechanisms of clinically relevantm icroorganisms[J].C lin M icrobiol Rev,2002,15(2): 167-193.
[6]张梦翔,施高翔.姜黄素对5种非白念珠菌菌丝及生物被膜形成的抑制作用[J].中草药,2015,46(4):549-553.
[7]王丹敏,靳颖.白色念珠菌生物被膜生长动力学分析和形态学观察[J].武警医学院学报,2010,19(9):698-700.
[8]CHANDRA J,KUHND.Biofilm formation by the fungal pathogen Candidaalbicans:development,architectureand drug resistance[J].Bacteriol,2001,183(18):5385-5394.
[9]潘春磊,盛春鸽.食用菌保健功能及产品开发技术研究进展[J].北方园艺,2014,15(8):197-200.
[10]李阜棣.农业微生物学实验技术[M].北京:中国农业出版社,1999.
[11]金红,杨孝丽.食用菌深层发酵物中生物活性物质含量的比较[J].食品研究与开发,2015,36(2):93-96.
[12]窦会娟,孙连海.食用菌发酵液对耐药菌的抑菌活性研究[J].中国酿造,2015,34(7):40-42.
[13]窦会娟,张群芝.香菇产抑菌活性物质液态发酵条件优化[J].中国酿造,2014,33(9):45-48.
[14]徐叔云,卞如濂.药理实验方法学[M].北京:人民卫生出版社,2002.
[15]尉玲芬.八角茴香提取液抑菌效果的药理研究[J].海峡药学,2011,23(4):45-47.
[16]张晓玲,于翠香.盐酸小檗碱、黄芩苷与抗菌药物联用对多重耐药鲍曼不动杆菌作用研究[J].中南药学,2014(5):411-414.
Effectofedible fungus fermentation liquid on grow th and biofilm formation of Candidaalbicans in vitro
DOU Huijuan,CHANG Lingli,SUN Lianhai,GUOWentao
(Faculty ofBasic Medicine,Luohe Medical Co llege,Luohe462002,China)
The effect of edible fungus fermentation liquid on grow th and biofilm formation of Candida albicans in vitro was researched in the paper. The bacteriostatic activity of C.albicans in fermentation liquid was determined by Kirby-Bauer,and the biofilm formation of C.albicans was determ ined by XTT reductionmethod.The resultsshowed thatallkindsof edible fungus fermentation liquid had a certain inhibiting effecton C.albicans. The bacteriostasisof Lentinus edodes fermentation liquid was the strongest,and the antibacterial circle diameterwas(2.967±0.160)mm,followed by thatof Coprinus comatus was(2.433±0.214)mm.The inhibiting effectof C.comatus fermentation liquid on biofilm formation of C.albicans was the strongest;the relative bacteriostatic ratewas(39.25±1.87)%,followed by that of L.edodes was(28.72±2.59)%.C.comatus and L.edodes had the strongest inhibitory effecton biofilm formation of C.albicans at12 h,the relative bacteriostatic rate reached to(46.37±3.14)%and(42.86±3.38)%,respectively.The fermentation liquid of C.comatus and L.edodes had a certain inhibiting effect on grow th and biofilm formation of C.albicans,which had furtherdevelopmentvalue.
edible fungus;submerged fermentation;Candidaalbicans;biofilm;inhibition
TS261.9
0254-5071(2016)01-0086-04
10.11882/j.issn.0254-5071.2016.01.019
2015-11-18
河南省科技发展计划基础与前研科研课题(142300410430)
窦会娟(1977-),女,副教授,硕士,研究方向为微生物资源开发及微生物生态学。
