γ-聚谷氨酸高黏发酵液中细菌总核糖核酸提取方法的比较
2016-09-18陈桂光梁智群韦宇拓广西大学亚热带农业生物资源保护与利用国家重点实验室广西南宁50004广西大学微生物及植物遗传工程教育部重点实验室广西南宁50004广西大学生命科学与技术学院广西南宁50004
唐 真,王 骏,陈桂光,梁智群,韦宇拓,曾 伟(1.广西大学 亚热带农业生物资源保护与利用国家重点实验室,广西 南宁 50004;2.广西大学 微生物及植物遗传工程教育部重点实验室,广西 南宁 50004;.广西大学 生命科学与技术学院,广西 南宁 50004)
γ-聚谷氨酸高黏发酵液中细菌总核糖核酸提取方法的比较
唐真1,2,3,王骏1,2,3,陈桂光3,梁智群1,2,3,韦宇拓1,2,3,曾伟1,2,3*
(1.广西大学 亚热带农业生物资源保护与利用国家重点实验室,广西 南宁 530004;2.广西大学 微生物及植物遗传工程教育部重点实验室,广西 南宁 530004;3.广西大学 生命科学与技术学院,广西 南宁 530004)
高黏度发酵液具有菌体不易分离的特点。为了从γ-聚谷氨酸高黏发酵液中提取细菌总核糖核酸,利用磷酸缓冲液稀释发酵液、离心收集、焦碳酸二乙酯水洗涤以及溶菌酶处理的四步法收集菌体并制备核糖核酸待分离样品,进而分别采用RNAiso plus提取法,EZ-10 RNAM iniprep kit试剂盒及PureLink RNAM inikit试剂盒法提取总核糖核酸,并通过琼脂糖凝胶电泳、核酸浓度检测仪和反转录聚合酶链式反应比较了三种方法提取总核糖核酸的效果。结果表明,四步法获得的菌体样品可以满足后续总核糖核酸提取的要求,三种方法提取的核糖核酸均能满足一般反转录聚合酶链式反应的要求,其中PureLink和RNAiso提取的核糖核酸A260nm/A230nm>2.0,纯度较好,PureLink具有快速提取的优势而RNAiso则适用于大量样品的提取。
高黏度发酵液;枯草芽孢杆菌;菌体分离;总核糖核酸提取;反转录聚合酶链式反应
γ-聚谷氨酸(poly-γ-glutam ic acid,PGA)是一种由L-谷氨酸和D-谷氨酸通过α-氨基和γ-羧基聚合而成的生物高分子化合物,因其具有良好的生物兼容性、保水性、可降解和可塑性,被广泛用于食品、医药、化妆品以及肥料添加剂等领域[1]。过去的研究主要集中在优良菌种选育[2]、发酵工艺开发和产物分离纯化等方面[3],但随着相关研究的不断深入,人们对微生物发酵法生产PGA的合成代谢机制等理论研究越来越感兴趣[4]。但是,PGA分子质量可达1.0×106u以上,其发酵液黏稠,造成菌体收集十分困难。因此,如何从这类高黏发酵物系中快速收集菌体用于获取高质量的核酸或蛋白质样品,对于相关理论研究显得尤为重要。
高质量的总核糖核酸(ribonucleic acid,RNA)是进行反转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)、Northern杂交、RNA-seq、cDNA文库构建等分子生物学实验的前提[5]。目前,对总RNA提取的研究主要集中在真核生物上,如血液等高等生物的组织[6],富含多酚多糖的植物材料[7-8],也有针对特殊条件下细菌总RNA提取的研究(如活性污泥[9]、泥沙[10]、Bacillus subtilis 168休眠和发芽的孢子等[11]),且建立了很多成熟的操作方法。然而,针对PGA等高黏性发酵液中细菌总RNA提取的研究少有报道。
目前,虽然自动化核酸和蛋白质提取系统已经广泛应用于临床和大规模测序方面[12],但是在普通实验室使用较多的仍是商业化试剂盒及传统的试剂提取方法。本研究利用四步法快速收集PGA高黏发酵液中的菌体并制备总RNA待分离样品,在此基础上采用RNAiso plus提取法、EZ-10 RNA M iniprep kit试剂盒及PureLink RNA M inikit试剂盒法对高黏发酵液细菌总RNA的提取进行了比较,分析讨论了各种方法的优缺点,希望给类似研究条件下的研究者提供参考。
1 材料与方法
1.1料与试剂
1.1.1种
Bacillus subtilis GXA-28:本实验室自主选育获得,保藏编号CCTCCM 2012347,用于制备PGA高黏度发酵液[13]。
1.1.2养基[14]
种子培养基:葡萄糖10 g/L,酵母膏5 g/L,谷氨酸钠5 g/L,KH2PO40.5 g/L,MgSO4·7H2O 0.1 g/L,pH 6.5。
斜面培养基:组分同种子培养基,加琼脂粉15 g/L,pH 6.5。
发酵培养基:葡萄糖30 g/L,酵母膏2.5 g/L,谷氨酸钠20 g/L,KH2PO40.5 g/L,MgSO4·7H2O 0.1 g/L,pH 6.5。
1.1.3要试剂
焦碳酸二乙酯水(diethy pyrocarbonate,DEPC):用去离子水配制成体积分数0.1%,用磁力搅拌器搅拌过夜,高温高压处理。
磷酸缓冲液(0.2mol/L,pH 6.5):取68.5m L 0.2mol/L NaH2PO4·2H2O,31.5m L 0.2mol/LNa2HPO4·2H2O,混匀。
TBE缓冲液(5×):Tris5.4 g,硼酸2.72 g,乙二胺四乙酸二钠0.37 g,定容至100m L。
RNAisoplus:日本Taraka公司;EZ-10RNAM iniprep kit:生工生物工程(上海)股份有限公司;PureLink RNA M ini kit、DNaseI、RevertAid First Stand cDNA Synthnesis kit:赛默飞世尔科技公司;QuantiTaqTMThermostable DNA Polymerase:美国GeneCopoeia公司;氯仿、异丙醇(分析纯):天津博迪化工股份有限公司;无水乙醇(分析纯):成都科龙化工试剂厂。
所有溶液均用DEPC水配制;所用玻璃、金属制品等用0.1%DEPC水处理,121℃高温处理30min后烘干备用。所用塑料制品均为RNase-free。
1.2器与设备
SPX-250型生化培养箱:上海跃进医疗仪器厂;SKY-211C型摇床:上海苏坤实业有限公司;J2-21高速冷冻离心机:美国Beckman公司;5424R台式冷冻离心机:德国Eppendorf公司;T1 Thermocycler PCR仪:德国Biometra公司;M ini-sub水平电泳系统:美国Bio-Rad公司。
1.3验方法
1.3.1体培养
取1环斜面菌种接于种子培养基中,42℃条件下,160 r/min振荡培养16 h后作为种子液。按2%接种量吸取种子液接于发酵培养基中,42℃条件下,160 r/min振荡培养22 h后作为发酵液用于后续实验。
1.3.2体收集及处理
利用磷酸缓冲液稀释发酵液、离心收集菌体、DEPC水清洗菌体以及溶菌酶处理菌体的四步法获得RNA待分离样品。具体操作如下:取发酵液5m L,用0.2mol/L磷酸缓冲液(pH 6.5)按体积比稀释4倍,轻轻振荡混匀,4℃、12 000×g离心5min,弃去上清,得到菌体沉淀。取适量0.1%DEPC水洗涤菌体,用移液枪充分吹散菌体后,4℃、8 000×g离心1m in,收集菌体;重复洗涤1次。在提取RNA之前,向上述菌体加入100μL溶菌酶(3mg/m L),用移液枪轻轻吹散菌体后,置于37℃恒温水浴锅中处理15min。
1.3.3RNA提取
(1)RNAiso plus法:在溶菌酶处理后的菌液中加入适量RNAiso plus,混匀,室温静置5m in;4℃、12 000×g离心5min,将上清液转移至新的1.5m L EP管中;加入1/5体积的氯仿剧烈振荡15 s,待液体呈乳浊状时,静置5m in;4℃、12 000×g离心15min,此时样品分成三层,转移水相于新的1.5m L EP管中,加入2倍体积异丙醇,混匀,室温静置10min;4℃、12 000×g离心10min,移去上清保留沉淀物,用适量体积分数75%的乙醇清洗沉淀;4℃、8 000×g离心5m in,弃去上清保留沉淀物,室温条件下干燥5~10min;-80 ℃保存。
(2)EZ-10RNAM iniprep kit试剂盒法:参照上海生工EZ-10 RNA M iniprep kit说明书进行操作,在溶菌酶处理后的菌液中加入350μL裂解液,混匀,室温静置5m in;转移至收集柱中,室温静置1min,9 000×g离心1min,将流出液转移至新的1.5m LEP管中,加入250μL无水乙醇,混匀后转移至RZ-10柱子,9 000×g离心1min,弃去流出液,加入500μLGT液,室温静置1min,9 000×g离心1min,弃去流出液,再加入500μL NT液,室温静置1min,9 000×g离心1min弃去流出液后,9 000×g再次离心2min,将RZ-10柱子置于新的1.5m LEP管中,开盖放置3~5m in后加入30μL RNA-free水,室温放置2min,9 000×g离心2min,获得的RNA于-80℃保存。
(3)PureLink RNA M ini kit试剂盒法:参照Thermo Fisher Scientific PureLink RNA M inikit说明书进行操作,在溶菌酶处理后的菌液中加入适量350μL裂解液,混匀后加入250μL无水乙醇,混匀后将液体转移至spin柱子中,12 000×g室温离心2m in,弃去收集管中的液体,重新将spin管置于收集管中,加入700μL洗脱液Ⅰ,12 000×g室温离心30 s,弃去收集管中的液体,并将spin柱子置入新的收集管中,加入500μL洗脱液Ⅱ,12 000×g室温离心30s,弃去收集管中的液体,重新加入500μL洗脱液Ⅱ,再次洗脱,弃去收集管的液体,12 000×g室温离心1m in,弃去收集管,将spin柱子置于新的1.5 m L EP管中,加入30μL RNA-free水,室温静置1min,12 000×g室温离心2min,获得的RNA保存于-80℃。
1.3.4RNA质量检测
取RNA样品5μL,在1.2%琼脂糖凝胶电泳上检测RNA纯度及完整性;取RNA样品2μL,在Nanodrop 2000超微量核酸蛋白测定仪上测定A260nm/A280nm、A260nm/A230nm,检测RNA质量浓度(ng/μL)及纯度。
1.3.5RT-PCR分析
将上述三种方法所提总RNA用DnaseI处理,RevertAid FirstStand cDNA SynthnesisKit反转录成cDNA。反转录反应体系:总RNA 1μg,100μmol/L随机引物1μL,5×反应Buffer 4μL,10mmol/L dNTP混合物2μL,200 U/μL反转录酶1μL,不含核酸酶的水补充至总体积20μL。反转录反应程序:25℃放置5m in;60℃保温60m in;72℃加热5min。cDNA样品置于-20℃保存备用。
以上述所得cDNA为模板进行RT-PCR,扩增目的基因rpoA(RNA聚合酶亚基),上游引物5′-TTCGTAGAGCCACTTGAGCGT-3′,下游引物5′-TGTTGTTACAGCGGCACCAG-3′,引物合成委托上海生工完成。反应体系:cDNA模板1μL,10×PCR Buffer 2.5μL,10mmol/L dNTP 0.5μL,上下游引物各1μL,Taq酶0.4μL,ddH2O 18.6μL。反应程序:94℃预变性2m in,94℃变性30 s,60℃退火30 s,72℃延伸6 s,循环35次;72℃延伸7min。取PCR产物1.2%琼脂糖凝胶电泳分析。
2 结果与分析
2.1体收集
PGA发酵液黏度随着PGA质量浓度和分子质量的增加而增大,当PGA质量浓度>10 g/L、PGA分子质量>1.0×106u时,利用常规高速离心方法很难收集到菌体细胞。在PGA工业生产过程中,常常采用酸化和自来水稀释的方法,将发酵液黏度降低后去除菌体,从而对PGA进行提取纯化。然而,酸化稀释处理后,菌体细胞受损严重,胞内核酸和蛋白质遭到破坏。因此,如何快速大量收集完整的菌体细胞是开展胞内核酸或蛋白质提取实验的前提。
取PGA发酵液(质量浓度18 g/L;PGA分子质量>2.0×106u)50m L分别采用直接离心、蒸馏水稀释4倍体积后离心、0.2mol/L磷酸缓冲液(pH 6.5)稀释4倍体积后离心收集菌体;对照组采用蒸馏水稀释发酵液4倍体积后、再用6mol/LHCl酸化稀释液至pH 3.0,然后离心收集菌体。对离心时间和菌体收集量进行比较,离心均在4℃、12 000×g条件下进行。将对照组收集到的菌体干质量定义为100%。结果(表1)显示,磷酸缓冲液稀释后离心10min可收集到91.2%的菌体细胞,随着离心时间的增加,菌体收集量没有明显增加;而直接离心20 min,收集的菌体细胞只有42.1%;蒸馏水稀释后离心20min,收集的菌体细胞也只有78.2%。因此,无论是从离心时间还是菌体收集量来看,采用0.2mol/L磷酸缓冲液(pH 6.5)稀释4倍体积后离心收集菌体的方法最为合适。
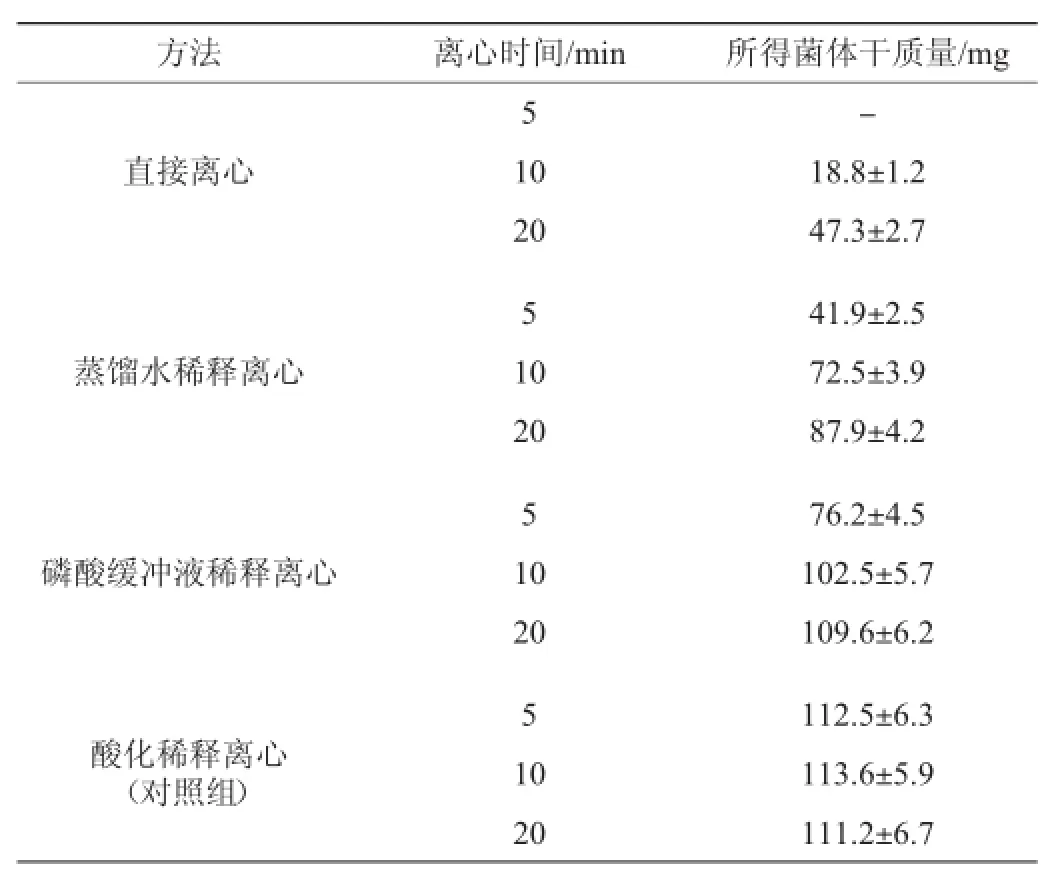
表1 不同菌体收集方法比较Table 1 Comparison of differentbacterial collectionmethod
2.2脂糖凝胶电泳检测总RNA质量
细胞RNA主要包括rRNA、tRNA、mRNA 3种形式,其中rRNA约占80%,tRNA约占10%~15%,mRNA约占1%~5%,而rRNA又分为23S rRNA、16S rRNA和5S rRNA三种类型[15]。获取高质量的总RNA样品是开展RT-PCR、Northern杂交、RNA-seq、cDNA文库构建等分子生物学实验的前提。
利用磷酸缓冲液稀释离心收集到的菌体,经DEPC水清洗菌体以及溶菌酶处理后,采用RNAiso plus提取法、EZ-10 RNA M iniprep kit试剂盒及PureLink RNA M inikit试剂盒提取总RNA。琼脂糖凝胶电泳检测总RNA质量,结果显示,3种方法均能提取出一定量的总RNA,但提取质量和纯度存在差异(图1)。RNAiso plus法提取的总RNA,23S、16S、5S三条带清晰、完整;而EZ-10和PureLink试剂盒提取的总RNA,只有23S和16S两条带;说明RNAiso plus法对小分子量RNA有较好的提取效果。3种方法提取的总RNA均没有向小分子质量区域扩散的现象,说明所提总RNA基本没有降解。但是,PureLink试剂盒提取的总RNA在>2 000 bp处有明显的条带,说明有基因组DNA残留;EZ-10试剂盒提取的总RNA有明显的拖尾现象,点样口也有亮带,说明所提RNA中可能残留蛋白等杂质。此外,用RNAiso plus提取法和EZ-10试剂盒提取的总RNA,在23S上方存在一条<2 000 bp亮带,该现象比较特殊,推测有可能是小分子DNA片段。
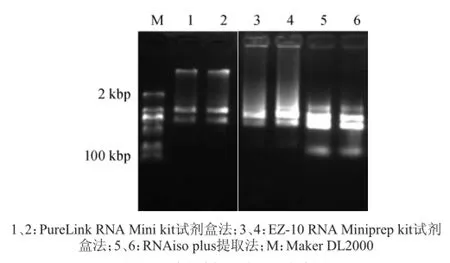
图1 3种方法提取总RNA电泳图Fig.1 Electrophoretog ram of total RNA by three m ethods
2.3RNA浓度和纯度检测
总RNA浓度采用核酸蛋白浓度测定仪测定。通常评价RNA纯度的标准:A260nm/A280nm为1.90~2.10;A260nm/A230nm为2.00~2.40。若A260nm/A280nm<1.90,说明样品中存在蛋白质污染;若260nm/A230nm<2.00,说明样品中存在多聚糖、胍盐和β-巯基乙醇等污染[16]。
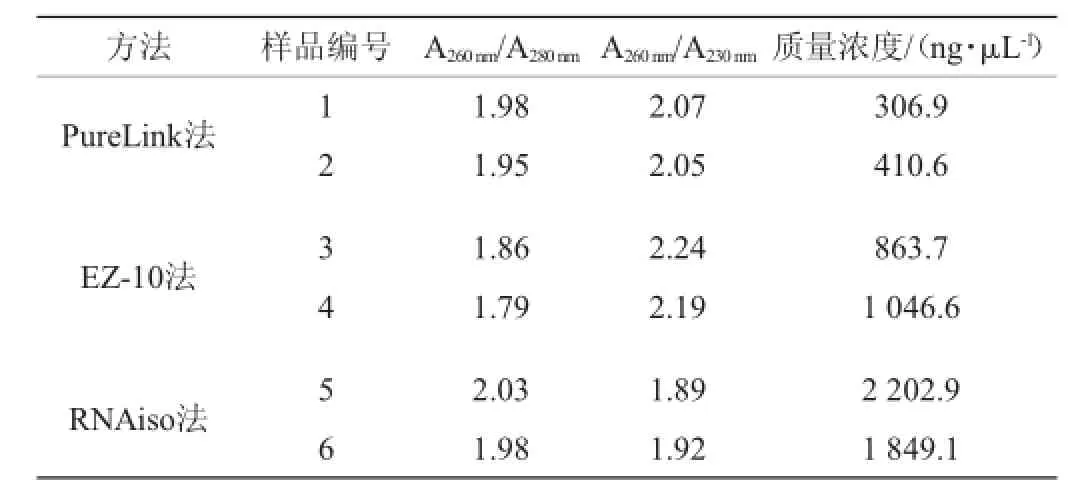
表2 3种方法提取总RNA的浓度及纯度比值Table 2 Concentration and purity of totalRNA by three differentmethods
3种方法所提总RNA经核酸蛋白浓度测定,结果(表2)显示,PureLink试剂盒和RNAiso法所提总RNA,其A260nm/A280nm均在2.0左右,说明蛋白残留较少;而EZ-10试剂盒法所提总RNA样品,其A260nm/A280nm低于1.90,说明有蛋白质残留,此结果与琼脂糖凝胶电泳结果一致。3种方法所提总RNA,A260nm/A230nm也存在一定差异,其中PureLink试剂盒和EZ-10试剂盒法所提总RNA样品,A260nm/A230nm>2.0,说明纯度较好,可能是由于两者在提取过程中均采用过柱提纯,小分子去除比较完全;而RNAiso法所提总RNA样品,A260nm/A230nm<2.0。从总RNA浓度来看,RNAiso法所提总RNA浓度最高,而PureLink试剂盒所提总RNA浓度最低。
2.4RT-PCR检测
3种方法所提总RNA经DNaseI消化后,反转录成cDNA,再以cDNA为模板,扩增看家基因rpoA(RNA聚合酶亚基,96 bp),扩增结果如图2所示,条带清晰、大小正确。说明三种方法提取的RNA均能满足基本的分子生物学实验要求。
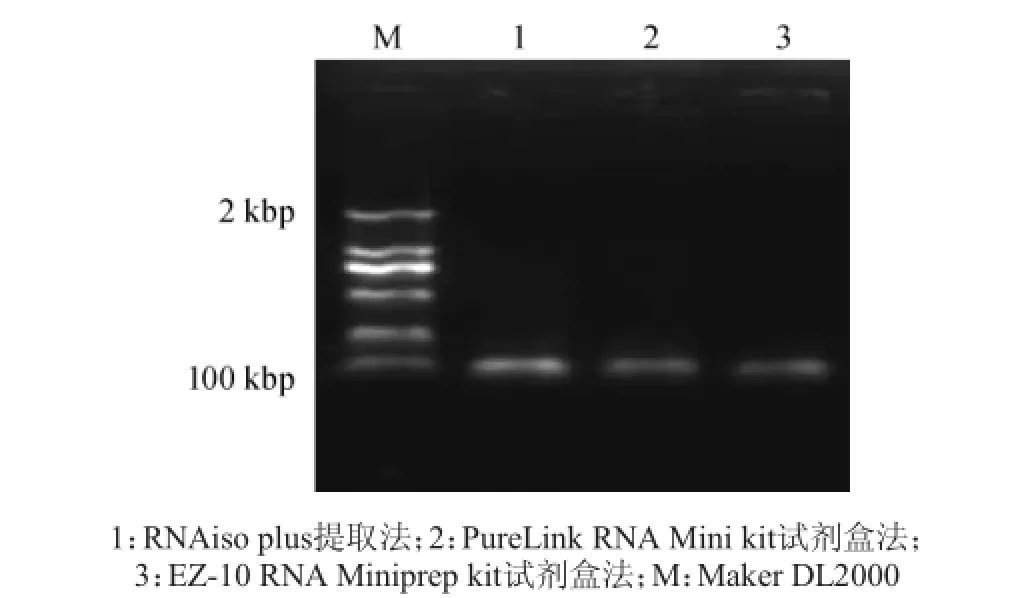
图2 RT-PCR扩增rpoA基因电泳图Fig.2 Electrophoretogram of rpoA gene by RT-PCR am plification
3 结论
枯草芽孢杆菌是典型的原核生物,相比真核生物RNA含量少,半衰期短,同时枯草芽孢杆菌具有旺盛的分泌系统,分泌的蛋白质、核酸酶等对RNA提取造成很大干扰。此外,对于合成高分子量代谢产物的微生物,其发酵液黏度大,常规的稀释离心法很难收集到足够量的菌体细胞。在本实验中,利用DEPC水配制的磷酸缓冲液对发酵液进行稀释,并快速离心收集菌体;同时采用DEPC水对菌体细胞进行洗涤,进一步去除了细胞外杂质;在RNA提取前使用溶菌酶处理菌体,使细胞裂解更完全。通过上述四步操作,有效的提高了RNA提取质量。
RNAiso plus提取法是经典的手提方法,而EZ-10RNA M iniprep kit和PureLink RNAM inikit则是两种商业化试剂盒。PureLink法和RNAiso法提取效果较好,但从A260nm/A230nm来看,RNAiso法存在小分子残留。从浓度来看,RNAiso法提取的总RNA浓度最大。EZ-10则出现了向点样孔方向拖尾的现象,说明存在蛋白质等大分子杂质的污染。总体而言,对于RT-PCR实验,三种方法均能达到要求。如果是对RNA纯度要求高、RNA含量要求多的qRT-PCR实验,则需考虑使用RNAiso法。从提取时间来看,PureLink法用时最短,其次是EZ-10,而RNAiso法提取所用时间最长。如果需进行Northern杂交等实验,则可以选择PureLink法。因此,实验人员可以根据实验材料及后续实验要求选择合适的方法。
[1]SHIH IL,VAN Y T.The production of poly-(γ-glutamic acid)from mi-croorganisms and its variousapplications[J].Bioresour Technol,2001,79(3):207-225.
[2]BAJAJI,SINGHALR.Poly(glutamic acid)-An emerging biopolymerof commercial interest[J].Bioresour Technol,2011,102(10):5551-5561.
[3]KREYENSCHULTED,KRULL R,MARGARITISA.Recentadvances inm icrobialbiopolymer production and purification[J].Crit Rev Biotechnol,2014,34(1):1-15.
[4]HAMANO Y,ARAIT,ASHIUCHIM,et al.NRPSs and am ide ligases producing homopoly(amino acid)sand homooligo(amino acid)s[J].Nat Prod Rep,2013,30(8):1087-1097.
[5]徐速,徐香玲.一种适于枯草芽孢杆菌总RNA提取的改良方法[J].东北农业大学学报,2013,44(5):36-41.
[6]MEW IS JL,SUN X,GUAN MJZLL.Research note:methodology for high-quality RNA extraction from poultry whole blood for further gene expression analysis[J].Brit Poultry Sci,2014,55(2):194-196.
[7]NADIYA F,ANJALIN,GANGAPRASAD A.High quality RNA extraction from smallcardamom tissues rich in polysaccharidesand polyphenols[J].Anal Biochem,2015,485(9):25-27.
[8]刘芳,官春云.富含多酚类植物RNA提取的研究进展[J].作物研究,2015,29(1):91-94.
[9]金敏,赵祖国,邱志刚,等.活性污泥高质量RNA快速提取方法研究[J].环境科学,2010,31(1):260-265.
[10]WANG Y,HAYATSU M,FUJIIT.Extraction of bacterial RNA from soil:challengesand solutions[J].M icrobes Environ,2012,27(2):111-121.
[11]MOELLERR,HORNECK G P,MOLLENKOPFH J,etal.A method for extracting RNA from dormant and germ inating Bacillus subtilis strain 168 endospores[J].Curr M icrobiol,2006,53(3):227-231.
[12]LINDA C,KA-W ING N,ARTHUR B,et al.Use of the M agNA pure LC automated nucleic acid extraction system followed by real-time reverse transcription-PCR for ultrasensitive quantitation of hepatitis C virusRNA[J].JClin M icrobiol,2004,42(9):4130-4136.
[13]ZENGW,LIN Y S,QIZX,etal.An integrated high-throughput strategy for rapid screening of poly(γ-glutamic acid)-producing bacteria[J]. ApplM icrobiol Biot,2013,97(5):2163-2172.
[14]WEIZ,CHENGG,WANGQ L,etal.Metabolic studiesof temperature control strategy on poly(γ-glutamic acid)production in a thermophilic strain Bacillus subtilis GXA-28[J].Bioresour Technol,2014,155(3): 104-110.
[15]王镜岩,朱圣庚,徐长法.生物化学[M].北京:高等教育出版社,2002.
[16]邹晓蕾,刘礼崔,罗立新.细菌总RNA提取方法的比较[J].现代食品科技,2013,29(8):1948-1954.
Comparison of bacterial total RNA extraction methods in the high viscosity fermentation broth of poly-γ-glutamic acid
TANG Zhen1,2,3,WANG Jun1,2,3,CHEN Guiguang3,LIANG Zhiqun1,2,3,WEIYutuo1,2,3,ZENGWei1,2,3*
(1.State Key Laboratory forConservation and Utilization ofSubtropical Agro-bioresources,GuangxiUniversity,Nanning 530004,China;2.Key Laboratory ofM inistry ofEducation forM icrobialand PlantGenetic Engineering,GuangxiUniversity,Nanning 530004,China;3.College ofLife Science and Technology,GuangxiUniversity,Nanning 530004,China)
Thebacteria aredifficult to be separated in the high viscosity fermentation broth.In order to extractbacterial totalRNA from high viscosity fermentation broth of poly-γ-glutam ic acid,fourstepswere taken to obtain the bacteria and prepare sample containing RNA used for separation.The four steps included dilute fermentation broth by phosphate buffer solution,centrifugation,wash cellby DEPC water and lysozyme treatment.Then,total RNA were extracted by RNAiso plusmethod,EZ-10 RNA M iniprep kitmethod and PureLink RNA M inikitmethod.The RNA extraction effectsof agarose gel electrophoresis,nucleic acid concentration detector and reverse transcription PCR were compared.Results showed that the sample obtained by the four-stepmethod met the requirementsof total RNA extraction.Total RNA extracted by the threemethodsallmet the requirementsof the RT-PCR experiments.However,the A260nm/A230nmof RNA that extracted by RNAiso plusmethod and PureLink RNA Minikitmethod were larger than 2.0,and bothmethodsshoned good purity.The PureLink M ini itmethod had the advantagesof rapid extraction and the RNAiso was suitable for theextraction of large quantitiesof samples.
high viscosity fermentation broth;Bacillussubtilis;bacterial isolation;total RNA extraction;reverse transcription PCR
Q93-33
0254-5071(2016)01-0024-05
10.11882/j.issn.0254-5071.2016.01.006
2015-11-13
国家自然科学基金资助项目(31560448);广西自然科学基金资助项目(2015GXNSFBA 139052);广西研究生教育创新计划资助项目(YCSZ2015042)
唐真(1990-),女,硕士研究生,研究方向为工业微生物的代谢调控。
曾伟(1987-),男,助理研究员,博士,研究方向为工业微生物的发酵工艺、代谢调控及生物制品开发应用。
