热应激状态下泌乳奶牛通过激活GHIGF-I轴增强糖异生变化
2016-09-16谢正露张源淑
李 林,艾 阳,谢正露,曹 洋,张源淑
(南京农业大学动物医学院/农业部动物生理生化重点开放实验室,南京 210095)
热应激状态下泌乳奶牛通过激活GHIGF-I轴增强糖异生变化
李 林,艾 阳,谢正露,曹 洋,张源淑
(南京农业大学动物医学院/农业部动物生理生化重点开放实验室,南京 210095)
【目的】选取分娩1周后的泌乳期荷斯坦奶牛6头,提前适应期1周后,正式饲喂从2013年6月29日至8月5日,总共35 d(5周),使泌乳奶牛处于热应激状态。进而检测泌乳奶牛乳产量及乳蛋白含量,血液中生长激素(GH)、胰岛素样生长因子(IGF-I)、葡萄糖以及肝脏中热休克蛋白70(HSP70)和糖异生作用的变化情况,拟从GH-IGF-I轴的角度阐明泌乳奶牛发生热应激时对糖异生作用及乳品质下降的机制。为进一步揭示奶牛热应激的发生机理及控制奶牛热应激的发生提供理论依据。【方法】分别统计第1—5周泌乳奶牛的产奶量及分析乳蛋白含量,并采集泌乳奶牛颈静脉血液和进行活体采取肝脏组织的方法,检测血液中葡萄糖和GH、IGF-I的含量,采用实时荧光定量PCR (qRT-PCR)技术对奶牛肝脏组织中HSP70和糖异生的关键酶丙酮酸羧化酶(PC)、磷酸烯醇式丙酮酸羧激酶(PEPCK)以及生长激素受体(GHR)、胰岛素样生长因子受体(IGFR)进行检测。【结果】在35 d的饲喂过程中,日间平均气温在32℃以上的持续时间达25 d,且最高温度为38℃,高温持续时间大于72 h,即此气候条件下奶牛处于一个热应激状态。随着泌乳奶牛热应激程度的不断加深,从第1周到第5周产奶量和乳蛋白含量都有不同程度的下降。通过比较第5周和第1周泌乳奶牛肝脏中HSP70的表达,发现第5周HSP70的表达量极显著高于第1周。检测血液中GH、IGF-I以及葡萄糖的含量,发现在第5周的时候其含量均高于第1周且差异显著(P<0.05);检测泌乳奶牛肝脏组织中PC和PEPCK的表达水平,发现第5周显著高于第1周(P<0.05);通过检测第5周与第1周肝脏组织中GH和IGF-I受体的表达水平,发现GHR和IGFR同样上调,其中IGFR显著上调(P <0.05)。【结论】随着泌乳奶牛热应激的程度的不断加深,血液中的葡萄糖含量显著升高,其可能是由于垂体分泌的GH刺激肝脏产生更多的IGF-I,即通过GHIGF-I轴上调肝脏糖异生途径关键酶的表达,使糖异生途径处于激活状态。而乳中乳蛋白含量的下降可能是由于其前体物被过多的用来进行糖异生作用,增加血液中葡萄糖含量,维持机体正常供能所致。
泌乳奶牛;热应激;GHIGF-I轴;生长激素(GH);糖异生作用
0 引言
【研究意义】随着全球气候温室效应的不断加剧及高集中化的动物生产方式,热应激对动物生产造成了严重的不利影响,其作为机体处于湿热环境下的一种非特异性反应,当气温高于 32℃或温湿指数(temperature-humidity index, THI)高于72时动物就会发生热应激反应[1-2]。目前,热应激已经成为中国畜禽养殖业中重要的疾病之一。热应激不仅会导致奶牛生产性能和繁殖能力降低,还能引起一些血液激素及热休克蛋白70(HSP70)浓度的变化。【前人研究进展】宋代军等[3]通过对不同泌乳阶段奶牛生产性能、HSP70浓度的研究,发现热应激时各泌乳阶段奶牛的产奶量均显著低于非热应激期,且随着热应激时间的延长,各泌乳阶段奶牛的产奶量有逐渐降低的趋势,并且在泌乳前、中、后期奶牛血清HSP70浓度在热应激期时均明显高于非热应激期。也有研究报道,当动物机体处于热应激状态时,其下丘脑-垂体-肾上腺轴会变得异常活跃,并且使促生长激素释放激素(GHRH)、生长激素(GH)等激素的含量升高,进而促进糖原、脂肪分解和糖异生过程[4]。艾阳等[5]通过研究夏季饲养的泌乳奶牛,发现当奶牛处于南京这种高温梅雨季节状态下时,可引起泌乳奶牛发生热应激反应,表现为乳产量和乳品质下降。GH是参与反刍动物泌乳和合成代谢的重要激素,在动物体内,GH通过与其受体结合发挥作用,具有维持体内环境稳态和免疫等生理功能。研究发现,GH可以通过促进腺泡的发育,维持泌乳量[6],其还可以刺激肝脏合成分泌大量的胰岛素样生长因子(IGF-I)[7-8]。并且有研究发现血液中IGF-I含量与泌乳量呈正相关[9]。糖异生是指由非糖物质转化为葡萄糖或糖原的过程,其过程主要发生在肝细胞中,其中丙酮酸羧化酶(PC)和磷酸烯醇式丙酮酸羧激酶(PEPCK)是调控糖异生的关键酶。有学者提出泌乳奶牛糖异生过程会受到 GH-IGF-I的调节,当发生热应激时血液中 GH、IGF-I水平升高并且会上调肝脏的糖异生途径[10]。【本研究切入点】目前,国内外对奶牛热应激机理的研究已有大量的文献报道,并且对生产性能方面也做了大量的研究,表明其会降低泌乳奶牛的乳产量及乳品质,但在糖异生调控方面的机理报道相对较少。【拟解决的关键问题】本试验以早期泌乳奶牛为研究对象,经过南京夏季6月—8月高温高湿气候条件下饲喂。比较研究不同时期泌乳奶牛乳产量、乳蛋白含量,血液中激素水平以及糖异生关键酶指标的变化,拟从 GH-IGF-I轴的角度阐明泌乳奶牛发生热应激时对糖异生作用及乳品质下降的机制。为进一步揭示奶牛热应激的发生机理及控制奶牛热应激的发生提供理论依据。
1 材料与方法
1.1主要试剂与仪器
SN-695型智能放免γ测量仪(上海原子核研究所日环仪器一厂);RT-6000型酶标分析仪(深圳雷杜生命科学股份有限公司)。MIKRO-22R型高速冷冻离心机(德国Andreas Hettich GmbH8 CO.KG产品);组织匀浆器(瑞士 Kinematica AG);核酸浓度测定仪(德国Eppendorf Biophotometer),MyiQ2 Real-time PCR 仪(Bio Rad,美国)等。
SYBR Green 荧光酶(南京诺唯赞生物科技有限公司);P101型RNA反转录试剂盒(诺唯赞生物科技有限公司,南京)。生长激素放射免疫分析试剂盒(北方生物技术研究所,北京);胰岛素样生长因子-1ELISA试剂盒(中国朗顿生物科技有限公司,上海)。
1.2试验动物与处理
分娩一周后的早期泌乳期荷斯坦奶牛6头(体重(490±7)kg),饲养于南京农业大学江浦畜牧兽医实验站(北纬32°93′,东经119°82′)。适应期1周后,对奶牛进行试验饲料饲喂,饲喂时间从2013年6月 29日至2013年8月5日南京暑热期间,试验周期为35 d(共5周)。采用Cornell-Penn-Miner System(NRC 2001)设计基础日粮,饲料配方及具体营养成分见表1。6头奶牛均饲养于开放式牛舍,期间自由饮水,每日饲喂3次的同时挤奶(时间为早4:00,中午12:00和晚18:00),并记录每日产奶量。
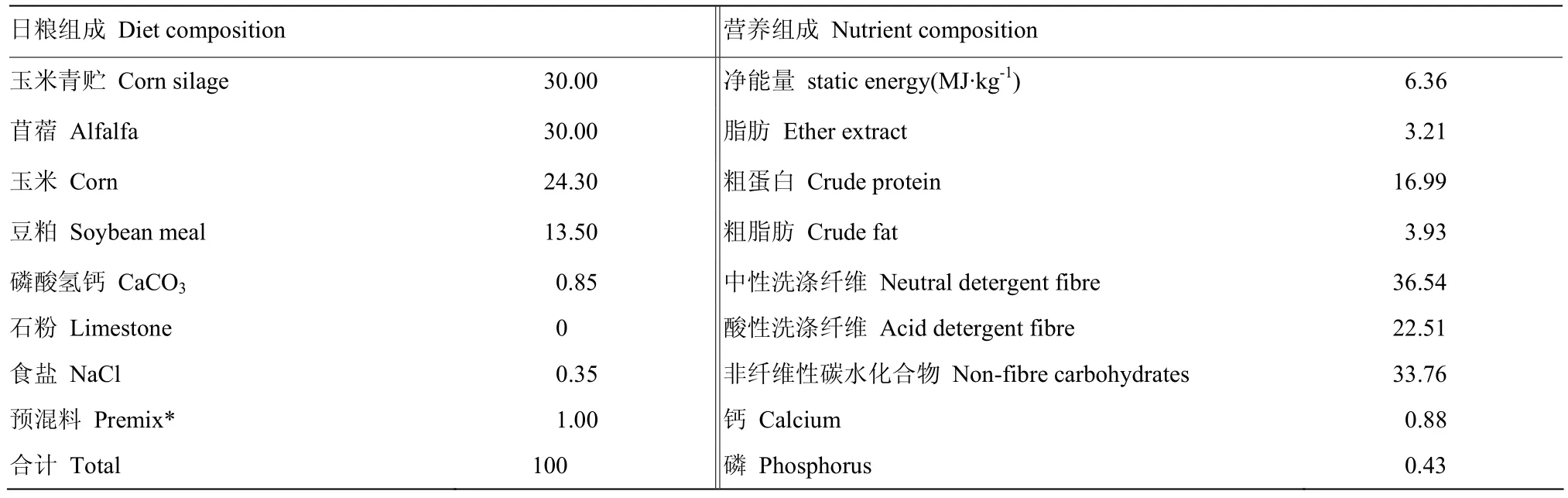
表1 日粮营养成分Table 1 The formulation of dietary (%)
1.3气温测定
试验期间每日气温纪录采用室温检测仪,于上午10:00和下午6:00 进行2次测定,2次气温平均值记为每天日间气温,试验期间日间气温介于26—38℃之间。
1.4产奶量和乳成分测定
试验期间每天在奶牛进食后采用自动挤奶机进行挤奶,早、中、晚共3次并分别称重,总和即为每日产奶量。期间每周五采集全天乳样,按体积4∶3∶3将早、中、晚奶样混合加入200 μL饱和重铬酸钾作为全天乳样,送至南京卫岗乳业检测中心进行乳成分检测。
1.5血液样品的采集及葡萄糖含量检测
分别于第1天和第35天对泌乳奶牛进行颈静脉采血。采用真空抗凝管于奶牛进食2 h后收集其颈静脉血液,以3 000 r/min离心15 min,取上清。并将收集的颈静脉血浆样品送至南京军区总医院血液科检测葡萄糖的含量。
1.6血液中GH、IGF-I含量的测定
1.6.1血液中GH含量测定 通过125I-GH放射免疫分析药盒测定泌乳奶牛血液中GH的含量(测定范围1—50 ng·mL-1;灵敏度≤0.5 ng·mL-1,精密度:批内变异系数<10%,批间变异系数<15%,一抗为兔抗),测定方法严格按照试剂盒说明书进行。SN-695型智能放免γ-测量仪检测计算出血液中GH的含量。
1.6.2血液中IGF-I含量测定 采用ELISA法检测,按试剂盒说明书进行操作(精密度:批内变异系数<9%,批间变异系数<11%)。以空白孔调零,450 nm波长处依次测定各孔的吸光度值(OD值),并计算出血液中IGF-I的含量。
1.7肝脏组织样品的采集
在采集血液样品时对奶牛肝脏进行活体穿刺采样。两次采集的肝脏组织样品均先用预冷的生理盐水清洗 3次,然后迅速置于液氮中冻存,最后转到-80℃保存待测。
1.8肝脏中相关蛋白基因mRNA表达检测
1.8.1总RNA的提取及反转录 取80 mg左右的肝脏组织样本,匀浆机彻底匀浆后采用Trizol抽提法提取总RNA。紫外比色法测定所提取RNA的浓度及纯度。选取A260/A280在1.8—2.0之间的总RNA,两步法进行反转录,得到cDNA。
1.8.2引物设计及合成 根据 GenBank上牛的HSP70、GHR、IGFR、PC、PEPCK及GADPH的基因序列由Primer Premier 5软件自行设计(序列见表2),由北京鼎国昌盛生物技术有限责任公司合成。

表2 Real-time PCR所用引物序列及参数Table 2 The primers sequence and parameters for real-time PCR
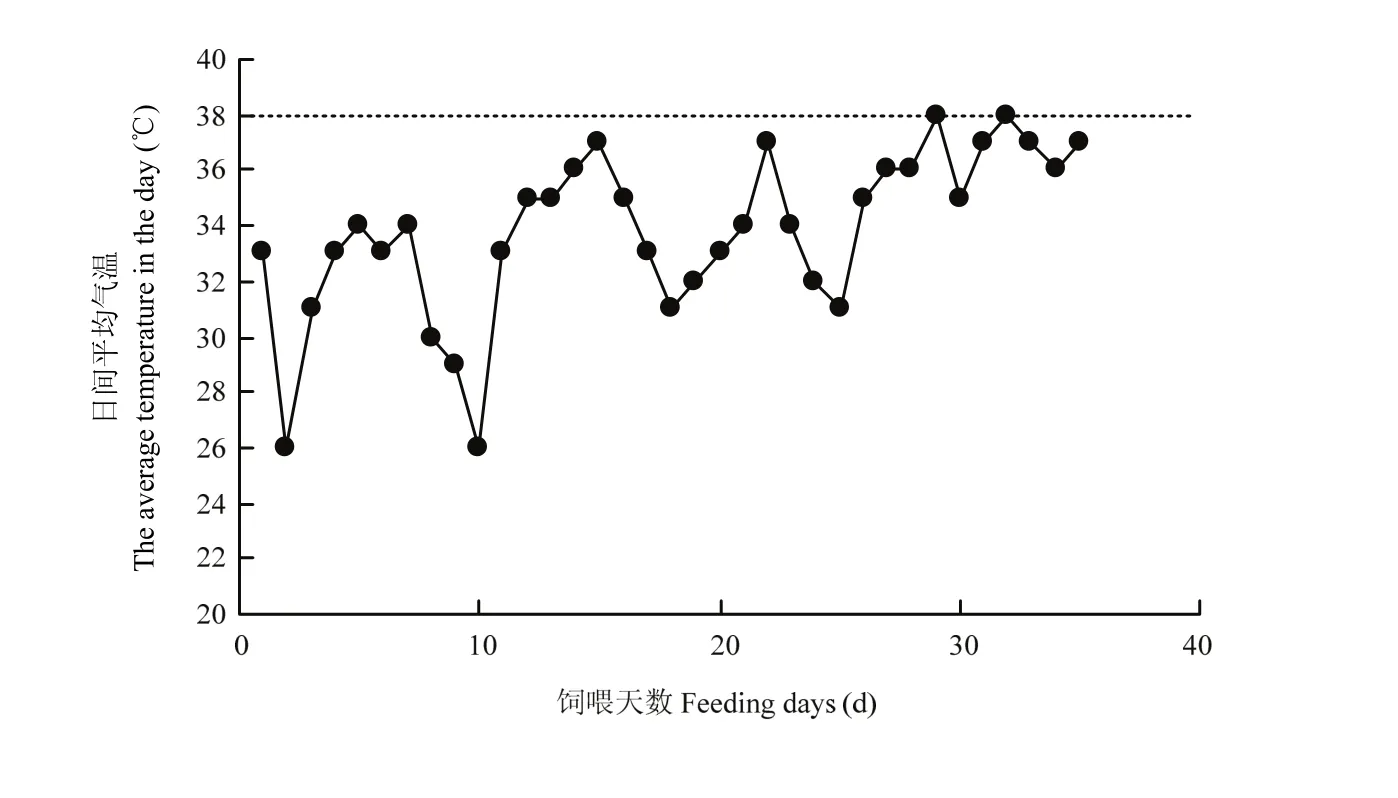
图1 试验期间每日平均气温Fig. 1 Average daily temperature during the experiment
1.8.3肝脏中相关蛋白Real-time PCR检测 对上述cDNA进一步采用Real-time PCR Sybr Green染料法对相关蛋白基因进行相对定量分析。反应在 MyiQ2 Real-time PCR仪上进行,20 μL定量反应体系中包括,荧光酶SYBR-Green 10 μL,10 pmol·μL-1基因引物2 μL,cDNA 模板2 μL,灭菌水6 μL。以最小的Ct值和最高的荧光值及溶解曲线不出现非特异性峰为标准,分别优化退火温度、引物浓度。主反应条件为:95℃变性10 min;95℃变性15 s,60℃退火30 s,72℃延伸30 s,40个循环。每个样品至少做3个重复,GADPH作为内参基因。
1.9数据统计及分析
采用SPSS16.0软件进行独立样本t检验。结果以平均数±标准误表示,组间差异用t检验,判断有无显著性差异。
2 结果
2.1试验期间气温变化
由图1可知,经过前期的适应期后,从第1天开始,日间平均气温剧烈上升,总体保持在32℃以上,在35 d(共5周)的试验期中,日间平均气温32℃以上持续时间达25 d,占试验总天数的68.5%。整个试验期间最高温度为38℃,共计2 d。
2.2热应激对肝脏中HSP70 基因表达的影响
通过检测第 1周和第 5周泌乳奶牛肝脏中HSP70基因的表达,结果如图2。由图2可知在第5周的时候奶牛肝脏内 HSP70 基因表达量显著高于第1周。
2.3热应激对泌乳奶牛乳产量及乳蛋白含量的影响
由图3可知,从第1周开始,日平均产奶量呈现出一个下降趋势,到第4周的时候日平均产奶量达到最低,第5周的时候有所上升,但乳产量随着试验期间温度的升高总体呈下降趋势。日间乳蛋白平均含量在 1—5周内随着温度的升高也呈现出总体的下降趋势。
2.4热应激对血液中葡萄糖及相关激素的影响
通过检测泌乳奶牛血液中葡萄糖、GH、IGF-I激素的含量,结果见表3。由表3可知第5周时奶牛由于发生热应激作用血液中葡萄糖、GH和IGF-I含量均高于第1周,且差异显著。
2.5热应激对糖异生关键酶基因表达的影响
通过检测第1周和第5周泌乳奶牛肝脏糖异生关键酶基因的表达含量(图4)。由图4可知第5周时奶牛肝脏组织中PC和PEPCK 的mRNA表达均高于第1周,且差异显著。
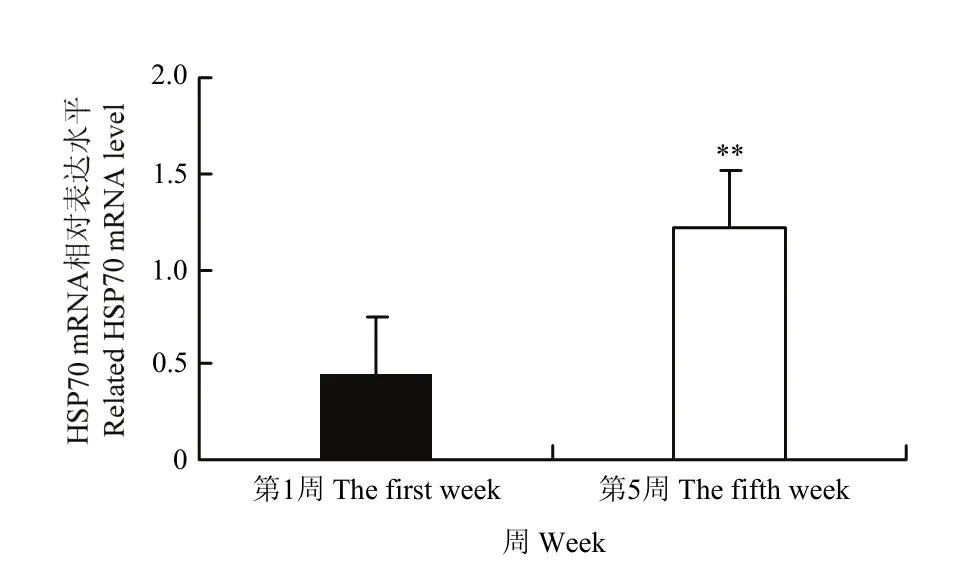
图2 肝脏中HSP70 mRNA的表达变化Fig. 2 Changes of HSP70 mRNA expression in liver (n=6)
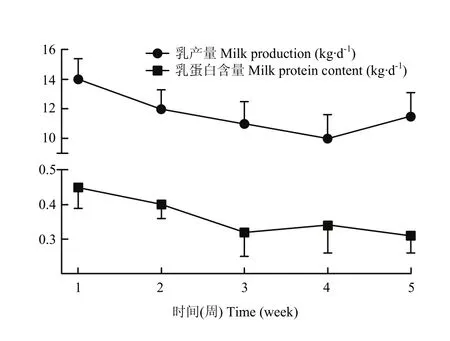
图3 泌乳奶牛乳产量及乳蛋白含量Fig. 3 Lactation cows milk yield and milk protein content (n=6)

图4 肝脏中PC和PEPCK mRNA的表达变化Fig. 4 Changes of PC and PEPCK mRNA expressionin liver (n=6)

图5 肝脏中GHR和IGFR mRNA的表达变化Fig. 5 Change of GHR and IGFR mRNA expression in liver (n=6)
2.6热应激对肝脏中GHR和IGFR 基因表达的影响
通过检测第1周和第5周泌乳奶牛肝脏中GHR、IGFR 基因的表(图5)。图5可知,随着奶牛热应激的发生,在第5周的时候肝脏内GHR 、IGFR表达均高于第1周,且IGFR显著高于第1周。

表3 血液中相关生化指标Table 3 Blood biochemical indices (n=6)
3 讨论
通常当温度超过耐热温度时奶牛就会发生热应激现象,并且随着温度的升高奶牛也越易发生热应激[11]。但也有研究发现,奶牛的热应激一般除了环境因素外,还会受到其他因素的影响,包括其自身的泌乳状态[12]、管理方式[13]、饲养条件[14]等。目前,按照THI的计算公式:THI=0.81Td+(0.99Td-14.3)RH+ 46.3,若以湿度为0作前提,当温度达到32℃时,THI最低值为72;这一数值即为奶牛发生热应激的最低THI。本试验通过对南京地区夏季6月至8月气温条件进行了监测,得出整个试验期间牛舍的温度数据,结果发现,在35 d的试验期中,日间平均气温在32℃以上的持续时间达25 d,且最高温度为38℃。高温持续时间远远超过72 h,即此气候条件下奶牛处于一个热应激状态。在热应激条件下,机体内分泌机能紊乱,直接影响奶牛的泌乳性能导致产奶量下降。李建国[15]研究发现,当发生热应激时,泌乳前、中、后期奶牛的产奶量分别降低了 19.3%、15.88%、13.83%。RAVAGNOLO等[16]报道,当THI>72时,THI每升高 1个单位,奶牛的产奶量降低0.2 kg。本试验中,通过统计5周的产奶量,发现随着热应激时间的延长,其产奶量及乳蛋白含量都有不同程度的下降,与前人的研究一致。
HSP70是一种重要的分子伴侣,ALDERMAN等[17]报道,HSP70与环境温湿变化密切相关,在生物热耐受中起着主要作用。当环境变化产生应激时,产生的 HSP70可以增强细胞对下一次有害损伤的耐受程度,维持细胞的正常生理功能代谢,提高细胞生存率[18-19]。陈强[20]等报道,热应激状态时,奶牛体内HSP70基因的表达量会增加。本试验中,HSP70基因表达量在第5周时极显著高于第1周。结果提示,随着奶牛热应激时间的增长,泌乳奶牛对热应激过程抵抗损失的能力也更强。
有研究认为,血液中的代谢产物对机体生理状况变化十分敏感,可以反映动物机体的代谢变化和组织的生理功能[21]。奶牛作为一种反刍动物,其血液中葡萄糖无法由食物获取,主要来源于肝脏内的糖异生活动。SCHARF[22]等报道急性热应激可以影响奶牛糖代谢并升高血液中葡萄糖含量,弥补热应激时的能量不足。同样也有研究发现当热应激发生时,泌乳奶牛很难从食物中获得足够的能量,必须通过糖异生作用生成葡萄糖,并且这些由多糖直接分解产生的葡萄糖会直接用于泌乳[23-24]。本试验中,随着热应激时间的延长,第5周奶牛血液中葡萄糖浓度显著高于第1周,并且在第5周时奶牛肝脏组织中糖异生关键酶PC和PEPCK与第1周相比表达均显著上调,提示热应激通过上调糖异生作用增加了血液中葡萄糖的含量。
1993年BAUMAN等[25]发现,当给泌乳奶牛注射GH时,肝脏糖异生作用明显增强,并且血液中葡萄糖浓度也相应上升,推测糖异生的关键酶可能会受到GH的影响。吴文旋等[26]研究发现,当动物受到外源GH刺激时,肝细胞IGF-I的合成增加,使外周循环血液中IGF-I的含量也显著增加,提示GH在肝细胞的作用与IGF-I密切相关。RHOADS等[27]提出,热应激发生时GH会作用于肝细胞产生IGF-I,后者能够促进PC和PEPCK的表达,进而激活糖异生途径。本试验发现,第5周与第1周相比奶牛血液中GH、IGF-I以及葡萄糖水平显著升高,并且结合上述研究中肝脏糖异生关键酶表达量的显著上调。说明随着热应激程度的加深,可能是通过GHIGF-I轴,激活了肝脏的糖异生途径,增加了血液中葡萄糖的含量。
4 结论
在给泌乳奶牛制造热应激模型的状态下,会造成乳产量下降,而血液中葡萄糖含量显著上调,激素GH、IGF-I含量也显著上升,肝脏糖异生作用也明显升高,提示血液中葡萄糖含量的升高可能是通过GHIGF-I轴,进而激活肝脏的糖异生作用来发挥效应的。而乳中乳蛋白含量的下降可能是由于其前体物被过多的用来进行糖异生的转化,进而合成的葡萄糖为机体正常供能所致,但其机制有待进一步研究。
References
[1] BOHMANOVA J, MISZTAL I, COLE B. Temperature-humidity indice as indicators of milk production losses due to heat stress. Journal of Dairy Science, 2007, 90(4): 1947-1956.
[2] WEST J W. Interaction of energy and bovine somatotropin with heat stresses. Journal of Dairy Science, 1993, 77(7): 2091-2102.
[3] 宋代军, 何钦, 姚焰础. 热应激对不同泌乳阶段奶牛生产性能和血清激素浓度的影响. 动物营养学报, 2013, 25(10):2294-2302. SONG D J, HE Q, YAO Y C. Effects of heat stress on performance and serum hormone concentrations of dairy cows at different lactation stages. Chinese Journal of Animal Nutrition, 2013, 25(10):2294-2302. (in Chinese)
[4] RONCHI B, LACETERA N, BERNABUCCI U, NARDONE A. Verini supplizi a distinct and common effects of heat stress and restricted feeding on metabolic status of Holstein heifers. Zoot Nutrion Animal, 1999, 25:11-20.
[5] 艾阳, 曹洋, 谢正露, 张源淑, 沈向真. 热应激时血液中游离氨基酸流向与乳蛋白下降的关系研究. 食品科学, 2015, 36(11):10-13. AI Y, CAO Y, XIE Z L, ZHANG Y S, SHEN X Z. Study on the relationship between the free amino acids in biood and decreasing milk protein under heat stress. Food Science, 2015, 36(11):10-13. (in Chinese)
[6] BALDI A, MODINA S, CHELI F, GANDOLFI F, PINOTTI L, SCÈSI L B, FANTUZ F, DELL O V. Bovine somatotropin administration to dairy goats in late lactation: Effects on mammary gland function,composition and morphology. Journal of Dairy Science, 2002, 85(5) :1093-1102.
[7] BAUMAN D E. Bovine somatotropin and lactation:from basic science to commercial application. Domestic Animal Endocrinology, 1999,17(2/3) : 101-102.
[8] VELEZ J C, DONKIN S S. Bovine somatotropin increases hepatic phosphoenolpyruvate carboxykinase mRNA in lactating dairy cows. Journal of Dairy Science, 2004, 87(5): 1325-1335.
[9] ROSE M T, WEEKES T E, ROWLINSON P. Correlation of blood and milk components with the milk yield response to bovine somatotropin in dairy cows. Domestic Animal Endocrinology, 2005, 28(3): 296-307. [10] RHOADS R P, LA NOCE A J, WHEELOCK J B, BAUMGARD L H. Short communication: Alterations in expression of gluconeogenic genes during heat stress and exogenous bovine somatotropin administration. Journal of Dairy Science, 2011, 94(4): 1917-1921.
[11] 高民, 杜瑞平, 温雅俐. 热应激对奶牛生产的影响及应对策略//发展低碳农业应对气候变化-低碳农业研讨会论文集. 2010. GAO M, DU R P, WEN Y L. The effect of heat stress on dairy production and coping strategies//The Development of Lowcarbon Agriculture - Low Carbon Agriculture Symposium on Climate Change. 2010. (in Chinese)
[12] 何钦. 热应激对不同泌乳阶段奶牛生产性能及其营养代谢的影响[D]. 重庆:西南大学, 2012. HE Q. Effects of heat stress on performance and nutrient metabolism of dairy cows in different lactation stages[D]. Chongqing:Southwest University, 2012. (in Chinese)
[13] CARABANO M J, BACHAGHA K, RAMON M, DINZ C. Modeling heat stress effect on Holstein cows under hot and dry conditions:Selection tools. Journal of Dairy Science, 2014, 97(12): 7889-7904.
[14] ORTIZ X A, SMITH J F, ROJANO F, CHOI C Y, BRUER J, STEELE N, SCHURING J, ALLEN J, COLLIER R J. Evaluation of conductive cooling of lactating dairy cows under controlled environmental conditions. Journal of Dairy Science, 2015, 98(3): 1759-1771.
[15] 李建国, 桑润滋, 张正珊, 王铁征, 朱慧中, 安永福, 曹玉凤, 田英才, 许增福. 热应激对奶牛生理常值、血液生化指标、繁殖及泌乳性能的影响. 河北农业大学学报, 1998(4) : 69-70. LI J G, SANG R Z, ZHANG Z S, WANG T Z, ZHU H Z, AN Y F,CAO Y F, TIAN Y C, XU Z F. Influence of heat stress on physciological response, blood biochemical parameters, reproduntion and milk performance of Holstein Cow. Journal of Agricultural University of Hebei, 1998(4):69-70. (in Chinese)
[16] RAVAGNOLO O, MISZTA I, HOOGENBOOM G. Genetic component of heat stress in dairy cattle developmentof heat index function. Journal of Dairy Science, 2000, 83(9): 2120 - 2125.
[17] ALDERMAN B M, COOK G A, FAMILARI M, YEOMANS N D,GIRAUD A S. Resistance to apoptosis is a mechanism of adaptation of rat stomach to aspirin. American Journal of Physiology Gastrointestinal and Liver Physiology, 2000, 278(6): 839-846.
[18] RIABOWOL K T, MIZZEN L A, WELCB W J. Heat shock is lethal to fibroblasts microinjected with antibodies against hsp70. Science, 1988,242: 433-436.
[19] BUKAU B, HORWICH A L. The HSP 70 and Hsp60chaperone machines. Cell, 1998, 92 (3): 351-366.
[20] 陈强, 李忠浩, 王根林. 奶牛 HSP70基因多态性与生产性能的关系. 江西农业学报, 2007, 19(7) :84 - 86. CHEN Q, LI Z H, WANG G L. The cow HSP70 gene polymorphism and the performance of the production relations.Acta Agriculturae Jiangxi, 2007, 19(7): 84-86. (in Chinese)
[21] 吴红岳, 徐庆林, 丁猛. 产犊季节、胎次对荷斯坦牛产奶量的影响.中国奶牛, 2003, 5: 72-73. WU H Y, XU Q L, DING M. The influence of Calving seasontire and time of holstein cows milk production. Chinese Dairy Cows, 2003,5:72-73.(in Chinese)
[22] SCHARF B, CARROLL J A, RILEY D G, CHASE C C, COLEMAN S W, KEISLER D H, WEABER R L, SPIERS D E. Evaluation of physiological and blood serum differences in heat tolerant (Romosinuano) and heat-susceptible (Angus) Bos taurus cattle during controlled heat challenge. Journal of Animal Science, 2010, 88(7):2321-2336.
[23] WELDY J R, MCDOWELL R E, VAN SOEST P J, BOND J. Influence of heat stress on rumen acid levels and some blood constituents in cattle. Journal of Animal Science, 1964, 23(1):147-153.
[24] BEEDE D K, COLLIER R J. Potential nutritional strategies for intensively manage cattle during thermal stress. Journal of Animal Science, 1986, 62:543-554.
[25] BAUMAN D E, VERNON R G. Effects of exogenous bovine somatotropin on lactation. Annual Reviews of Nutrition, 1993, 13:437-461.
[26] 吴文旋, 段永邦. 补饲精料对贵州黑山羊血浆抗氧化应激能力和生化指标的影响. 家畜生态学报, 2013, 34(1):60-65. WU W X, DUAN Y B. Effects of supplemental conentrate on plasma anti-oxidative stress capability and biochemical metabolites for Guizhou Black Goats. Acta Ecologiae Animalis Domastici, 2013,34(1):60-65. (in Chinese)
[27] RHOADS M L, KIM J W, COLLIER R J, CROOKER B A,BOISCLAIR Y R, BAUMGARD L H, RHOADS R P. Effects of heat stress and nutrition on lactating Holstein cows: II. Aspects of hepaticgrowth hormone responsiveness. Journal of Dairy Science,2010, 93:170-179.
(责任编辑 林鉴非)
Lactating Dairy Cows Under Heat Stress Enhanced Gluconeogenesis by Activating the GHIGF-I Axis
LI Lin, AI Yang, XIE Zheng-lu, CAO Yang, ZHANG Yuan-shu
(Key Laboratory of Animal Physiology and Biochemistry of the Ministry of Agriculture/College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095)
【Objective】Six Holstein cows in early lactation after delivery were chosen to be in heat stress,which were fed 35 days from June 29 in 2013 for detecting milk yield and protein content, growth hormone (GH), insulin like growth factor-I(IGF-I),glucose and liver heat shock protein 70 (HSP70) and gluconeogenesis change in blood to illuminate glucose gluconeogenesis and milk quality decline mechanism when lactating dairy in heat stress from the GHIGF-I axis angle and further revealing the cows heat stress mechanism and control of dairy cows heat stress.【Method】Glucose and GH, and IGF-I contents in blood were detected bycollecting jugular venous blood and in vivo taking liver tissue, furthermore milk yield and protein content in lactating cows were counted and analyzed, respectively, before fifth week. In addition, HSP70, PC, PEPCK, GHR, and IGFR were detected by qRT-PCR. 【Result】Dairy cows were in heat stress when the average daytime temperature above 32℃ lasted for 25 days and the highest temperature 38℃ lasted for more than 72 h continuously during 35 days feeding period. The milk yield and protein content generally showed a decline with the degree of heat stress in lactating dairy cows deepening from the first week to the fifth week. The expression of HSP70 in the fifth week was significantly higher than that in the first week, so were the expression of PC and PEPCK and GHR and IGFR in liver tissues (P<0.05) through detecting their contents.【Conclusion】Blood glucose was significantly increased, in the period of study which may be due to the secretion of pituitary GH stimulates the liver to produce more IGF-I,namely through GHIGF-I axis up-regulation of hepatic gluconeogenesis pathway key enzyme expression, gluconeogenesis way was activated with the degree of heat stress in lactating dairy cows deepening. Milk protein content decline may be caused by its precursors was too much for gluconeogenesis to make levels of glucose increase in blood to maintain body’s normal energy supply.
lactaing dairy cows; heat stress; GHIGF-I axis;growth hormones (GH); gluconeogenesis
2015-11-13;接受日期:2016-06-02
国家重点基础研究发展规划项目(“973”计划)(2011CB100802)
联系方式:李林,E-mail:614107822@qq.com。通信作者张源淑,E-mail:zhangyuanshu@njau.edu.cn
