石斛合剂基于PKB/FoxO1通路抑制糖尿病大鼠 肝糖异生的机制研究
2021-09-22林心君胡海霞何昱霖刘佳绣陈勇施红
林心君 胡海霞 何昱霖 刘佳绣 陈勇 施红

〔摘要〕 目的 觀察复方石斛合剂对糖尿病大鼠肝PKB/FoxO1信号通路分子蛋白表达的影响,探讨其抑制肝糖异生的分子机制。方法 随机选取11只雌性Wistar大鼠为正常组,其余36只大鼠高脂高糖饲料喂养,6周后腹腔注射STZ 2次。按糖尿病诊断标准,筛选出糖尿病成模大鼠33只,再随机分为模型组、二甲双胍组、石斛合剂组,每组11只。给药12周后,检测空腹血糖(FBG)、血清空腹胰岛素(FINS)、游离脂肪酸(FFA);免疫组化检测各组的肝脏的胰岛素受体(InsR)、叉头框蛋白O1(FoxO1)、磷酸烯醇式丙酮酸羧激酶(PEPCK)表达情况。Western blot检测各组大鼠肝组织PKB、p-PKB、FoxO1、p-FoxO1的蛋白表达情况。结果 与正常组比较,模型组FBG、FINS、FFA明显升高(P<0.01);与模型组比较,石斛合剂组FBG、INS、FFA显著下降(P<0.05或P<0.01);石斛合剂组与二甲双胍组比较,差异无统计学意义(P>0.05)。免疫组化结果显示石斛合剂能促进InsR表达,抑制PEPCK和FoxO1的表达(P<0.05)。Western blot结果显示石斛合剂组p-PKB/PKB、p-FoxO1蛋白表达增加(P<0.05或P<0.01);FoxO1表达减少(P<0.01)。结论 石斛合剂能抑制肝糖异生,调节糖脂代谢,增强胰岛素敏感性,可能与其调节PKB/FoxO1通路相关蛋白的表达有关。
〔关键词〕 胰岛素抵抗;糖异生;石斛合剂;糖尿病;PKB/FoxO1信号通路
〔中图分类号〕285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.08.006
Study on the Mechanism of Dendrobium Mixture in Inhibiting Hepatic Gluconeogenesis in
Diabetic Rats Based on PKB/FoxO1 Pathway
LIN Xinjun1, HU Haixia2, HE Yulin2, LIU Jiaxiu2, CHEN Yong1, SHI Hong1*
(1. College of Integrated Traditional Chinese and Western Medicine, Fujian University of Traditional Chinese Medicine, Fujian, Fuzhou 350122, China; 2. Institute of Integrated Traditional Chinese and Western Medicine, Fujian University of Traditional Chinese Medicine, Fujian, Fuzhou 350122, China)
〔Abstract〕 Objective To observe the effect of Dendrobium Mixture on the protein expression of liver PKB/FoxO1 signaling pathway in diabetic rats, and to explore its molecular mechanism of inhibiting liver gluconeogenesis. Methods 11 female Wistar rats were randomly selected as normal group, the remaining 36 rats were fed with high-fat and high-sugar, 6 weeks later, STZ was injected intraperitoneally twice. 33 diabetes model rats were screened according to the diagnostic criteria of diabetes, and then randomly divided into model group, metformin group, Dendrobium Mixture group. After 12 weeks of administration, fasting blood glucose (FBG), serum fasting insulin (FINS), and free fatty acid (FFA) were tested; and the liver of each group was tested by immunohistochemistry for insulin receptor (InsR), forkhead box protein O1 (FoxO1), phosphoenolpyruvate carboxykinase (PEPCK) expression. Western blot method was used to detect the expression of PKB, p-PKB, FoxO1, p-FoxO1 in liver tissues of rats in each group. Results Compared with the normal group, FBG, FINS and FFA in the model group increased significantly (P<0.01); compared with the model group, FBG, INS and FFA in the Dendrobium Mixture group decreased significantly (P<0.05 or P<0.01); and there was no significant difference between Dendrobium Mixture group and metformin group (P>0.05). The results of immunohistochemistry showed that Dendrobium Mixture can promote the expression of InsR and inhibit the expression of PEPCK and FoxO1. Western blot results showed that the expression of p-PKB/PKB and p-FoxO1 protein in the Dendrobium Mixture group increased (P<0.05 or P<0.01); the expression of FoxO1 decreased (P<0.01). Conclusion Dendrobium Mixture can inhibit liver gluconeogenesis, regulate glucose and lipid metabolism and enhance insulin sensitivity. It may be related to the protein expression of signal molecules related to the PKB/FoxO1 signaling pathway.
〔Keywords〕 insulin resistance; gluconeogenesis; Dendrobium Mixture; diabetes; PKB/FoxO1 signaling pathway
糖尿病由遗传和环境因素引起持续的高血糖与长期代谢紊乱,是全球广泛关注的公共健康问题;最新调查数据显示,中国18岁及以上成年人中12.8%患有糖尿病,且糖尿病流行率在世界范围内继续上升[1]。因此,如何有效防治糖尿病已成研究热点。
糖异生是将一些非糖前体,如乳酸、甘油、生糖氨基酸等转变为葡萄糖的过程。2型糖尿病多伴随糖异生作用异常活跃[2],这也是导致内源性葡萄糖输出增多的原因,是糖尿病主要的病理生理特点。肝脏在葡萄糖代谢中起着核心的作用[3],其中包括对肝糖异生和肝脏糖原合成的调节。磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase, PEPCK)是催化糖异生第一步的的关键限速酶,在催化草酰乙酸转变成磷酸烯醇式丙酮酸,最后异生为糖的生化过程中起重要作用[4]。PI3K-PKB通路是胰岛素发挥生物学效应的重要传导通路之一。叉头框蛋白O1(forkhead box O1, FoxO1)[5]是受胰岛素信号负性调节的转录因子,在胰岛素对肝脏糖代谢的调节中起重要作用,其通过结合糖异生基因启动子促进糖异生关键酶的基因表达。胰岛素与细胞表面胰岛素受体结合后[6],激活细胞内胰岛素信号传导,发生级联反应,最终作用到效应靶点;研究[7-8]表明,胰岛素受体(insulin receptor, InsR)等参与胰岛素信号转导的分子数量、结构及功能的异常,将导致胰岛素信号转导障碍、生理效应减弱,从而导致胰岛素抵抗和代谢紊乱。
西医治疗糖尿病常用的药物有胰岛素、二甲福明、噻唑烷二酮(TZD)和磺酰脲类处方药,虽有明确疗效,但难以避免因长时间用药引起的药物不良反应、耐药性及继发的肝肾损害。因此,寻找能改善糖尿病症状、稳定血糖的中药,成为亟待解决的问题。富含多种有效活性成分的中药可以多途径、多靶点发挥治疗作用[9-10]。本课题组系列研究[11-12]证明,复方石斛合剂有明显缓解糖尿病患者临床症状、纠正糖耐量异常、改善胰岛素抵抗的作用。肝糖异生不仅决定空腹血糖水平,且对糖稳态维护起关键作用,因此,抑制肝脏糖异生被认为是糖尿病治疗的重要靶点[13]。本部分以高脂高糖喂养加小剂量链脲佐菌素(streptozotocin, STZ)腹腔注射的方法建立2型糖尿病大鼠模型,观察石斛合剂调控胰岛素信号途径抑制糖异生、改善糖稳态的分子机制。
1 材料
1.1 实验动物
健康Wistar大鼠,SPF级,雌性,体质量(200±20) g,购自上海斯莱克实验动物有限责任公司限公司,许可证号:SCXK(沪)2012-0002。饲养于福建中医药大学实验动物中心SPF级实验室中,室温25 ℃、相对湿度60%~70%。单笼5只饲养大鼠,自由取食和饮水,12 h光照/12 h黑暗。基础饲料配方由福建中医药大学动物实验中心提供;高脂饲料购于福建医科大学实验动物中心。配方参照本课题组前期实验经验高脂饲料配方[14]:60.7%基础饲料、10%猪油、15%蔗糖、10%蛋黄粉、4%胆固醇、0.3%胆酸盐。
1.2 实验药物
石斛合剂(石斛15 g,黄芪20 g,五味子8 g,葛根15 g,丹参15 g,生地黄15 g,地龙8 g)购于福建中醫药大学国医堂;二甲双胍(格华止)片剂由中美上海施贵宝制药有限公司生产,规格:0.85 g/片,国药准字:H20023370,批号:1302094。
1.3 主要试剂
血清胰岛素ELISA试剂盒(上海西唐生物科技有限公司,货号F6403);FFA测定试剂盒(北京索莱宝生物科技有限公司,货号BC0590);InsR、PKB和p-PKB抗体购自美国Cell Singaling公司(货号分别为3025、4685、9611);FoxO1和p-FoxO1抗体购自美国ABCAM公司(货号分别为ab179450、ab60945)。
1.4 主要仪器
HM340E型石蜡切片机(德国Microm公司);ELx800型酶标仪(美国BioTek公司);垂直电泳槽、转移槽(北京六一仪器厂);2500型凝胶成像仪(美国Bio-Rad公司);EPS 300型电泳仪(美国Bio-Rad公司)。
2 方法
2.1 动物造模、分组及干预
雌性Wistar大鼠适应性喂养1周后,随机选取11只为正常组(CTR组),其余36只大鼠高脂高糖饲料喂养,6周后2次腹腔注射STZ 25 mg·kg-1m-2,期间间隔4天观察大鼠情况,然后用血糖测定仪测血糖选取连续2 d FBG>11.0 mmol/L或PBG>16.7 mmol/L者为糖尿病模型大鼠。选取符合模型标准的大鼠33只,按体质量、血糖分层后随机分为模型组、石斛合剂组、二甲双胍组,每组11只。分组及干预为正常组:正常鼠+普通饲料+生理盐水灌胃组(10 mL·kg-1·d-1),模型组:模型鼠+普通饲料+生理盐水灌胃(10 mL·kg-1·d-1),石斛合剂组:模型鼠+普通饲料+石斛合剂灌胃(11.3 g·kg-1·d-1),二甲双胍组:模型鼠+普通饲料+二甲双胍灌胃(100 mg·kg-1·d-1)。各组用药剂量按60 kg成人临床等效剂量进行计算,大鼠灌胃体积均为10 mL·kg-1。治疗12周后的大鼠于取材前夜禁食、不禁水第2天上午8点称重后经腹主动脉采血,离心制备血清,-20 ℃保存待测; 同时迅速取出各组大鼠肝脏等组织器官,一部分肝脏按照每100 mg置于一个1.5 mL的EP管中置于液氮中速冻保持,迅速转移至-80 ℃冰箱中保存以待通过Western blot法对PKB、p-PKB等蛋白进行分析。
2.2 指标检测
2.2.1 检测空腹血糖(FBG)、空腹胰岛素(FINS)、游离脂肪酸(FFA) 葡萄糖氧化酶法测定FBG,酶联免疫分析法检测FINS,按照ELISA试剂盒说明进行实验。FFA检测:称取肝组织约0.1 g,加入1.0 mL提取液,匀浆后8 000 r·min-1,4 ℃离心10 min(离心半径为6.5 cm),取上清液,待测;测定步骤:分光光度计预热30 min以上,调节波长到550 nm,无水乙醇调零,试剂二在37 ℃水浴中预热30 min以上;标准品的稀释:将标准品用氯仿稀释成0.8、0.6、0.4、0.2、0.1、0.05、0.025 μmol/mL;按说明书在1.5 mL离心管中加入相应试剂;并计算FFA含量。FFA(μmol/g)=X×V样总÷W;X:吸光值,V样总:上清液总体积,W:样本质量。
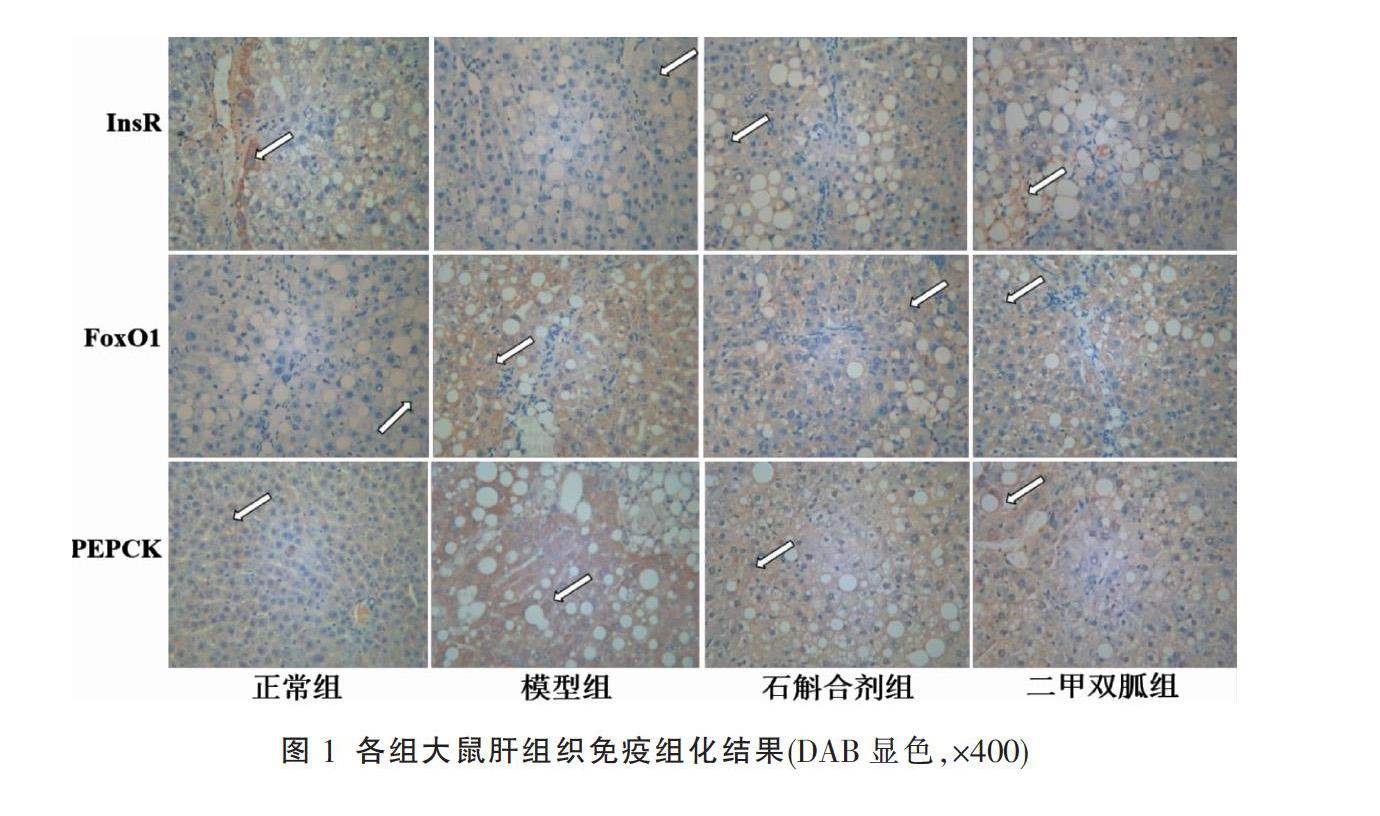
2.2.2 免疫组化检测肝脏InsR、FoxO1和PEPCK蛋白表达 切片、贴片、脱蜡,枸橼酸缓冲液进行修复,PBS清洗3次×5 min,加入阻断性内源性过氧化物酶孵育10 min,PBS清洗;山羊血清室温封闭孵育2 h,除去血清,各组滴加适合浓度的InsR、FoxO1和PEPCK一抗(浓度均1∶500),湿盒中4 ℃孵育过夜;滴加二抗工作液(1∶1 000),于室温在湿盒中孵育10 min, PBS清洗;滴加适量的链霉素抗生物素蛋白-过氧化物酶孵育10 min,PBS清洗;加DAB显色液20 s~2 min,流水冲洗、苏木素复染、流水返蓝、封片,光学显微镜下观察组织并拍照,用Image-Pro Plus 6.0 软件进行分析。
2.2.3 Western blot检测PKB、p-PKB、FoxO1、p-FoxO1蛋白表达 按实验分组准备组织样品,每个样品取50~100 ug大鼠肝脏组织,组织匀浆器研磨匀浆,冰面上用RIPA裂解液裂解组织,冰上裂解30 min后,4 ℃,14 000 r·min-1离心20 min(离心半径为6.5 cm),吸取上清液获取总蛋白;根据BCA蛋白定量结果上样。制胶,95 ℃灭活蛋白5 min,SDS-PAGE凝胶电泳,湿法转膜,5%脱脂奶粉封闭40 min,4 ℃相应的一抗孵育过夜,TBST洗5 min×3次,室温孵育二抗1 h,TBST洗5 min×3次,增强化学发光法(ECL)曝光显影,采用BIO-RAD Image Lab软件进行灰度值分析。
2.3 統计学分析
采用SPSS 20.0统计软件进行统计分析。计量资料用“x±s”表示,若满足正态性及方差齐性则采用单因素方差分析,两两比较采用LSD法,方差不齐时则采用Games-Howell法。P<0.05表示差异有统计学意义。
3 结果
3.1 各组大鼠血清FBG、FINS、FFA的变化
与正常组比较,模型组FBG、FINS、FFA明显升高(P<0.01);与模型组比较,石斛合剂组、二甲双胍组FBG、FINS、FFA明显降低(P<0.05或P<0.01)与;石斛合剂组与二甲双胍组比较,则差异无统计学意义(P>0.05)。见表1。
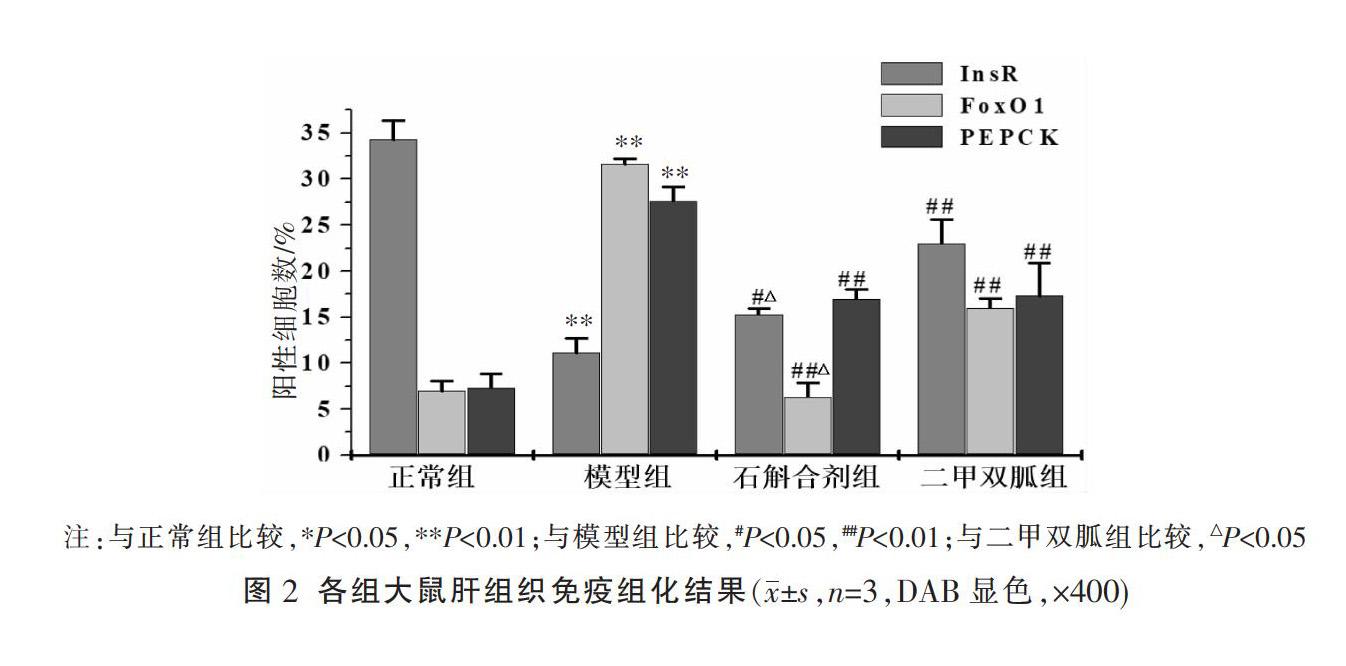
3.2 免疫组化检测各组大鼠肝组织InsR、FoxO1和PEPCK的蛋白表达水平
与正常组比较,模型组FoxO1和PEPCK蛋白阳性染色增多,呈现棕黄色,表达量有显著升高(P<0.05);而InsR蛋白的表达量显著减少(P<0.05);与模型组比较,石斛合剂组和二甲双胍组FoxO1和PEPCK的表达显著减少(P<0.01),InsR显著升高(P<0.05或P<0.01);与二甲双胍组比较,石斛合剂组FoxO1表达明显下调(P<0.05)。见图1-2。3.3 Western blot检测各组大鼠肝组织PKB、p-PKB、FoxO1、p-FoxO1的蛋白表达水平
与正常组比较,模型组p-FoxO1、p-PKB/PKB表达下降,FoxO1表达增加(P<0.05)。与模型组比较,石斛合剂组和二甲双胍组p-FoxO1、p-PKB/PKB表达明显增加(P<0.05或P<0.01),FoxO1表达减少(P<0.01);石斛合剂组与二甲双胍组比较,二甲双胍组p-PKB/ PKB、p-FoxO1 表达增加更为显著(P<0.05)。见图3。
4 讨论
糖尿病根据其临床表现和特征,属中医学“消渴病”范畴。本病的发生与遗传、环境、生活饮食习惯、情志等诸多因素的共同作用有关。历代医家治疗糖尿病多以滋阴法或滋阴益气法论治。我们认为T2DM病机[16]为本虚(气阴)标实(血瘀)、夹杂阶段性瘀、痰、湿及其进一步的病理产物形成“浊毒”,愈加耗气、伤阴、成瘀,形成恶性循环。因此,课题组按滋阴益气活血法则,选定了由石斛、黄芪、丹参、生地、葛根、五味子、地龙组成的石斛合剂,是福建省第二人民医院院内制剂(批号:闽Q/YZ-2012-315,已获国家发明专利,专利号ZL201110408411.0)。方中诸药相须为用,使阴津得补,燥热得消,气血流畅,而有效防治T2DM及其并发症,临床疗效显著[10-11]。本课题组前期肝组基因表达谱芯片研究[17]发现:糖尿病模型大鼠与正常组存在差异的已知功能基因1 339个(P<0.05),石斛合剂治疗后的糖尿病模型大鼠近千个基因表达量恢复正常,聚类分析接近正常组。从基因转录组学角度证实了石斛合剂在动物模型体内产生的分子效应,一定程度印证了上述对T2DM病机规律认识的科学性。二甲双胍作为双胍类口服降糖药的代表[18-19],能促进外周胰岛素敏感组织对葡萄糖的摄取和利用,改善胰岛素抵抗,使肝脏糖异生减少,从而降低血糖,被诸多指南推荐的2型糖尿病首选用药,故本实验选用二甲双胍作为对照药物。
课题组前期动物实验研究[14]发现,高脂高糖饲养大鼠6周后联合2次小剂量STZ腹腔注射制备出的糖尿病大鼠模型成模率高,模型稳定,故本实验采用高脂饮食加小剂量链脲佐菌素腹腔注射的方法成功制备2型糖尿病大鼠模型。与正常组相比,模型组大鼠空腹血糖有显著上升(P<0.01);与模型组相比,治疗12周后,石斛合剂组、二甲双胍组血糖均明显降低(P<0.01);说明石斛合剂有确切的降血糖作用。
研究[20]发现高胰岛素血症是胰岛素抵抗的始动因素之一,持续高胰岛素状态可降低外周组织细胞的胰岛素受体表达,从而减少细胞对葡萄糖的氧化利用,反馈刺激胰岛素分泌进一步增加,造成恶性循环。本实验结果显示:与正常组比,模型组FINS显著上升(P<0.01),说明糖尿病模型大鼠出现高胰岛素血症和胰岛素抵抗;经石斛合剂治疗后,FINS较模型组有明显下降(P<0.01),说明石斛合剂可明显减轻糖尿病大鼠高胰岛素血症,改善其胰岛素抵抗。
胰岛素抵抗与肥胖和FFA水平过高密切相关[21]。FFA是肝脏代谢的主要来源之一[22],血液中FFA过量导致肝脏和骨骼肌中脂质代谢物的累积,进一步加重IR[23-25],是T2DM发展的主要危险因素。本实验结果显示:与正常组相比,模型组的FFA显著上升(P<0.05);经石斛合剂治疗后,FFA较模型组显著下降(P<0.05),说明石斛合剂可通过降低血液FFA水平,减少外周组织脂质代谢物积累,改善胰岛素抵抗和糖尿病。
InsR是细胞胰岛素信号跨膜转导的第一站[26],其表达异常是胰岛素抵抗及糖代谢紊乱的重要原因。FoxO1是受胰岛素信号负性调节的转录因子[27],通过激活胰岛素信号转导途径可引起下游的信号分子FoxO1发生磷酸化降解,从而降低FoxO1的转录活性,减少糖异生酶表达,从而抑制肝脏糖异生。本实验研究中,肝组织免疫组化结果显示:与正常组比较,模型组FoxO1和PEPCK表达显著上调(P<0.01),InsR表达显著降低(P<0.01);而经石斛合剂和二甲双胍治疗后,InsR表达均上调,FoxO1和PEPCK表达均明显下调,与模型组比较差异显著(P<0.05或P<0.01)。与二甲双胍组比较,石斛合剂组下调FoxO1表达更显著。蛋白印迹法检测结果显示:与正常组比较,模型组p-PKB/PKB比值显著降低,p-FoxO1表达明显减少(P<0.05),FoxO1表达明显增多(P<0.05)。經治疗,石斛合剂组和二甲双胍组p-PKB/PKB,p-FoxO1表达均明显增加(P<0.05),FoxO1表达明显下调(P<0.05);两组比较,二甲双胍组p-PKB/PKB,p-FoxO1表达增加更为显著(P<0.05)。上述实验结果说明本研究中糖尿病模型大鼠由于p-PKB/PKB减少,胰岛素通路分子的信号减弱,导致FoxO1磷酸化降解减少,引起糖尿病模型大鼠FoxO1增多,从而促进糖异生关键酶PEPCK表达和肝糖输出。而石斛合剂可通过上调p-FoxO1的蛋白表达,促进FoxO1磷酸化降解,减少糖尿病模型大鼠FoxO1蛋白表达水平,从而抑制肝糖异生,改善糖代谢,其疗效与二甲双胍相类。
总之,石斛合剂能明显降低糖尿病模型大鼠FBG、FINS、FFA水平,可能与促进胰岛素信号通路蛋白InsR、p-PKB,p-FoxO1蛋白表达,减少FoxO1、PEPCK蛋白表达有关,说明石斛合剂能通过调节PKB/FoxO1通路相关蛋白的表达抑制糖异生,调节糖脂代谢,增强胰岛素敏感性,从而有效防治糖尿病。
参考文献
[1] LI Y Z, TENG D, SHI X G, et al. Prevalence of diabetes recorded in mainland China using 2018 diagnostic criteria from the American Diabetes Association: National cross sectional study[J]. BMJ, 2020: m997.
[2] CHUNG S T, HSIA D S, CHACKO S K, et al. Increased glucone?
ogenesis in youth with newly diagnosed type 2 diabetes[J]. Diabetologia, 2015, 58(3): 596-603.
[3] XU T, XU L L, MENG P P, et al. Angptl7 promotes insulin resistance and type 2 diabetes mellitus by multiple mechanisms including SOCS3-mediated IRS1 degradation[J]. The FASEB Journal, 2020, 34(10): 13548-13560.
[4] WANG Z Y, DONG C F. Gluconeogenesis in cancer: Function and regulation of PEPCK, FBPase, and G6Pase[J]. Trends in Cancer, 2019, 5(1): 30-45.
[5] BENCHOULA K, ARYA A, PARHAR I S, et al. FoxO1 signaling as a therapeutic target for type 2 diabetes and obesity[J]. European Journal of Pharmacology, 2021, 891: 173758.
[6] LEE D H, AHN J, JANG Y J, et al. Zingiber mioga reduces weight gain, insulin resistance and hepatic gluconeogenesis in diet-induced obese mice[J]. Experimental and Therapeutic Medicine, 2016, 12(1): 369-376.
[7] H?JLUND K. Metabolism and insulin signaling in common metabo?lic disorders and inherited insulin resistance[J]. Danish Medical Journal, 2014, 61(7): B4890.
[8] TRAN H T, LIONG S, LIM R, et al. Resveratrol ameliorates the chemical and microbial induction of inflammation and insulin resistance in human placenta, adipose tissue and skeletal muscle[J]. PLoS One, 2017, 12(3): e0173373.
[9] XIAO E, LUO L G. Alternative therapies for diabetes: A comparison of western and traditional Chinese medicine (TCM) approaches[J]. Current Diabetes Reviews, 2018, 14(6): 487-496.
[10] 荣晓哲,林帅军,王 瑞.基于PI3K/AKT信号通路探究藤茶总黄酮对2型糖尿病大鼠糖脂代谢、氧化应激损伤的干预作用[J].世界中西医结合杂志,2020,15(11):2041-2048.
[11] 辛金钟,王麒又,陈丽娟,等.石斛合剂改善2型糖尿病胰岛素抵抗的临床研究[J].中国现代医生,2010,48(3):58-59.
[12] 施 红,张学敏,崔 乙,等.糖尿病石斛合剂序贯法的初步临床观察[J].中医临床研究,2013,5(18):1-3.
[13] 谢秀英,沙雯君,雷 涛,等.中医药通过调节肝糖异生从脾论治糖尿病研究进展[J].上海中医药杂志,2021,55(5):94-101.
[14] 林心君,王麒又,辛金钟,等.高成模率和高稳定性的糖尿病大鼠模型制备:高脂高糖膳食+STZ体重联合体表面积法构建糖尿病大鼠模型[J].中国老年学杂志,2013,33(9):2051-2054.
[15] 李敏慧,洪 浩,卢圣锋,等.电针对中枢Stat 5敲除所致胰岛素抵抗小鼠肝脏胰岛素信号通路的影响[J].针刺研究,2018,43(5):314-318.
[16] 林心君,施 红.施红教授石斛合剂序贯疗法治疗糖尿病之思路[J].中医临床研究,2014,6(1):18-19.
[17] XU Q, LIU Y, CONG Y B, et al. Gene expression and microarray investigation of Dendrobium mixture as progressive therapy for the treatment of type 2 diabetes mellitus[J]. Tropical Journal of Pharmaceutical Research, 2013, 12(2): 195-201.
[18] FLORY J, LIPSKA K. Metformin in 2019[J]. JAMA, 2019, 321(19): 1926.
[19] PRATTICHIZZO F, GIULIANI A, MENSà E, et al. Pleiotropic effects of metformin: Shaping the microbiome to manage type 2 diabetes and postpone ageing[J]. Ageing Research Reviews, 2018, 48: 87-98.
[20] NOLAN C J, RUDERMAN N B, KAHN S E, et al. Insulin resistance as a physiological defense against metabolic stress: Implications for the management of subsets of type 2 diabetes[J]. Diabetes, 2015, 64(3): 673-686.
[21] DEN HARTOGH D J, VLAVCHESKI F, GIACCA A, et al. Attenuation of free fatty acid (FFA)-induced skeletal muscle cell insulin resistance by resveratrol is linked to activation of AMPK and inhibition of mTOR and p70 S6K[J]. International Journal of Molecular Sciences, 2020, 21(14): 4900.
[22] ROSSO C, KAZANKOV K, YOUNES R, et al. Crosstalk between adipose tissue insulin resistance and liver macrophages in non-alcoholic fatty liver disease[J]. Journal of Hepatology, 2019, 71(5): 1012-1021.
[23] SU M Q, SUN L, LI W P, et al. Metformin alleviates hyperuricaemia-induced serum FFA elevation and insulin resistance by inhibiting adipocyte hypertrophy and reversing suppressed white adipose tissue beiging[J]. Clinical Science, 2020, 134(12): 1537-1553.
[24] HE Y R, HU W J, YANG G Y, et al. Adipose insulin resistance and circulating betatrophin levels in women with PCOS[J]. BioMed Research International, 2020, 2020: 1253164.
[25] ZHANG Q, KONG X J, YUAN H, et al. Mangiferin improved palmitate-induced-insulin resistance by promoting free fatty acid metabolism in HepG2 and C2C12 cells via PPARα: Mangiferin improved insulin resistance[J]. Journal of Diabetes Research, 2019, 2019: 2052675.
[26] PAYANKAULAM S, RAICU A M, ARNOSTI D N. Transcriptional regulation of INSR, the insulin receptor gene[J]. Genes, 2019, 10(12): 984.
[27] YAN H, YANG W B, ZHOU F H, et al. Estrogen improves insulin sensitivity and suppresses gluconeogenesis via the transcription factor Foxo1[J]. Diabetes, 2019, 68(2): 291-304.
