棉籽蛋白酶解物的制备及其抗菌活性
2016-09-16韩晓燕包郁明辛凤姣孔志强ChristopheBlecker戴小枫
韩晓燕,包郁明,辛凤姣,孔志强,Christophe Blecker,戴小枫
(1中国农业科学院农产品加工研究所/农业部农产品加工重点实验室,中国北京 100193;2烈日大学食品学院,比利时)
棉籽蛋白酶解物的制备及其抗菌活性
韩晓燕1,包郁明1,辛凤姣1,孔志强1,Christophe Blecker2,戴小枫1
(1中国农业科学院农产品加工研究所/农业部农产品加工重点实验室,中国北京 100193;2烈日大学食品学院,比利时)
【目的】通过体外模拟动物胃肠道消化环境,对两种棉籽蛋白的酶解产物抗菌活性进行研究,为棉籽蛋白精深加工、高值化利用提供理论依据。【方法】以棉籽粕为原料,用Osborne法和传统的碱溶酸沉法分别制备棉籽蛋白(清蛋白、球蛋白、醇溶蛋白及谷蛋白)和棉籽分离蛋白(cottonseed protein isolate,CPI),用凯氏定氮法测定所得棉籽蛋白的蛋白含量,Tricine-SDS-PAGE测定蛋白亚基组成,通过扫描电镜观察蛋白的表面微观结构,选取蛋白含量较高的球蛋白(cottonseed globulin,CPG)和CPI进行研究。通过体外模拟动物胃肠道消化环境,用胃蛋白酶和胰蛋白酶依次对CPG和CPI进行酶解;以大肠杆菌和金黄色葡萄球菌为受试菌,分别以抗生素卡那霉素(Kanamycin,Kan)及未经酶解的蛋白溶液为对照,研究棉籽蛋白酶解产物的抗菌活性,同时用高效液相色谱法(high performance liquid chromatography,HPLC)检测酶解产物中小肽的分子量大小及分布。【结果】碱溶酸沉法的提取率为(70.52±2.40)%,所得CPI的蛋白含量为(89.53±0.66)%;用Osborne法分别得到清蛋白、球蛋白、醇溶蛋白和谷蛋白等4种棉籽蛋白,提取率为(67.55±1.16)%,其中CPG的蛋白含量最高为(82.57±1.02)%。Tricine-SDS-PAGE图谱表明CPG的亚基组成与CPI较接近;扫描电镜观察到的蛋白表面微观结构差别较大,CPI为颗粒大小较均匀整齐的蜂窝状结构,CPG由大小不均一的蛋白颗粒构成;相对于CPI,CPG中氨基酸保留较为完全。相同加酶量处理情况下,CPI的水解度高于CPG,且棉籽分离蛋白的小分子肽段(MW ≤0.8 kDa)含量(70%—85%)显著高于棉籽球蛋白(40%—60%)。抗菌活性检测结果表明,当胃蛋白酶-胰蛋白酶加酶量为5 000—5 000 U时,两种蛋白酶解产物的抗菌能力最强,此时CPI和CPG的水解度分别为(24.72±1.07)%和(19.26±0.39)%,二者酶解产物对大肠杆菌的抑制能力均高于对金黄色葡萄球菌的抑制能力;CPI酶解产物的抗菌活性比CPG高,两者未经消化的蛋白溶液均无抗菌能力。通过分子量测定结果分析得到CPI酶解产物的抗菌活性物质的分子量在0.57—0.75 kDa,而CPG分子量分布在0.66—0.78 kDa。【结论】两种方法制备的蛋白在提取率方面没有显著差异(P>0.05),在亚基组成方面,Osborne法分级的蛋白间差异较大,但CPG和CPI组成较为相似;二者经体外模拟消化后的酶解产物均具有一定的抗菌活性,CPI酶解产物的抗菌活性高于CPG。
棉籽分离蛋白;棉籽球蛋白;体外模拟消化;抗菌活性肽;分子量分布
0 引言
【研究意义】中国是产棉大国,近年来产量居世界首位(国家数据)。棉籽(年产量约800万—900万t)是棉花的主要副产物,其基本组成中蛋白含量较高,占棉籽仁的35%—48%[1],且棉籽蛋白的氨基酸(除蛋氨酸稍低外)配比合理,必须氨基酸含量均达到联合国粮农组织和世界卫生组织(FAO/WHO)推荐标准[2],因此,棉籽蛋白是非常重要的植物蛋白资源。在中国,棉籽蛋白多用于肥料或粗饲料,国外棉籽蛋白也多为饲用,少部分作为食品添加剂用于食品行业[3],近年来,植物蛋白短缺严重,因此,棉籽蛋白的高值化利用问题亟待解决。酶解制备生物活性肽是棉籽蛋白精深加工、高值化利用的重要方面。抗菌活性肽具有相对分子质量小、杀菌广谱、抗菌活性高等特点[4],作为抗菌药物,抗菌肽具有无毒副作用、无残留污染等优点,相对于传统抗生素,不易产生抗药性[5-6]。抗菌肽的安全性及广谱性使其有望成为一种新的抗菌剂应用于食品及医药行业,因此,对棉籽蛋白酶解物抗菌活性方面的研究具有重要意义。【前人研究进展】传统的棉籽蛋白提取方法为碱溶酸沉法[7-8],该法因所得蛋白纯度高而用于棉籽分离蛋白(cottonseed protein isolate,CPI)的制备。Osborne法可制备出性质优良的蛋白质,且提取条件温和,剩余残渣可分级利用,已见于谷物[9-10]及其他油料蛋白[11]的提取,但在棉籽蛋白提取过程中未见报道。目前蛋白质高值化利用的研究热点是生物活性肽的制备[12],已有研究表明,棉籽蛋白水解后得到的棉籽肽具有抗氧化活性[13-15]或ACE抑制活性[16],而在抗菌活性方面鲜有涉及。【本研究切入点】目前,棉籽蛋白提取方法多为碱溶酸沉法,Osborne法却未见报道,其提取效果如何仍不清楚;棉籽蛋白酶解物的生物活性研究多集中在抗氧化活性等方面,是否有抗菌活性仍是未知。【拟解决的关键问题】本研究通过传统方法和Osborne法制备棉籽蛋白,进一步对其在体外模拟消化环境下的抑菌活性进行研究,旨在对棉籽蛋白的精深加工与应用提供理论依据,对提高棉籽附加值,开发棉花副产物综合利用提供参考。
1 材料与方法
试验于2014年11月至2015年10月在中国农业科学院农产品加工研究所(农业部农产品加工重点实验室)进行。
1.1试验材料
棉籽粕,北京银天使国际贸易有限公司;本研究所用棉籽粕中蛋白质含量为(45.85±0.26)%,棉酚含量为(190.37±0.14)mg·kg-1,水分含量为(7.03±0.02)%,灰分含量为(5.09±0.02)%,脂肪含量为(0.87±0.53)%;金黄色葡萄球菌,中国农业微生物菌种保藏管理中心;大肠杆菌,中国农业科学院农产品加工研究所棉花病害防治实验室;二硫苏糖醇(DTT)、十二烷基磺酸钠(SDS)、丝氨酸、邻苯二甲醛(OPA)、抑肽酶、Gly-Gly-Gly、Gly-Gly-Arg-Gly、细胞色素C、维生素B12、三氟乙酸(TFA,色谱纯)、胃蛋白酶、胰蛋白酶,Sigma公司;氯化钠(NaCl)、无水乙醇、氢氧化钠(NaOH)、盐酸(HCl)等试剂均为分析纯,国药集团化学试剂有限公司;琼脂糖,瑞尔新德生物有限公司;蛋白胨、牛肉提取物、胰蛋白胨、酵母浸粉,Oxoid公司。
LB培养基:酵母浸粉1.0%,胰蛋白胨0.5%,NaCl 1.0%,琼脂糖1.5%(液体培养基中不添加),121℃高压蒸汽灭菌20 min;营养肉汁培养基:蛋白胨1.0%,牛肉提取物0.3%,NaCl 1.0%,琼脂糖1.5%(液体培养基中不添加),121℃高压蒸汽灭菌20 min。
1.2仪器设备
AUW220电子天平:日本岛津公司,ZHWY-200B型恒温培养振荡器:上海智城分析仪器制造有限公司,SPX-100B-Z型生化培养箱:上海博迅实业有限公司医疗设备厂,ChameleonV型酶标仪:芬兰Hidex公司,Evolution 260型紫外分光光度计:美国Thermo Fisher公司,Alpha 1-4 LDplus型冷冻干燥机:德国CHRIST公司,IB-5型离子溅射镀膜仪:日本Eiko公司,S-3400N型电子扫描电镜、CR22GⅡ型高速冷冻离心机、L-8900型全自动氨基酸分析仪:日本日立公司,ZHGHC1112B型超净工作台:上海智城分析仪器制造有限公司,GI80TW型灭菌锅:美国ZEALWAY公司,DK-8D型电热恒温水浴槽:上海一恒科技有限公司,Agilent 1200型高效液相色谱仪:美国Agilent公司。
1.3试验方法
1.3.1棉籽蛋白的制备
1.3.1.1棉籽分离蛋白制备 参考碱溶酸沉法[17]制备棉籽分离蛋白(CPI),试验流程如下:
棉粕粉碎过80目筛→碱溶(pH 10.0,40℃,振荡2.5 h)→离心(4 000 r/min,20 min)取上清→等电点(pI 4.8)酸沉(4℃静置2 h使蛋白充分沉淀)→离心(4 000 r/min,20 min)得沉淀→水洗沉淀两次→冷冻干燥→CPI。
1.3.1.2Osborne法分级制备棉籽蛋白 采用Osborne法[18]分级制备棉籽清蛋白、球蛋白(cottonseed globulin,CPG)、醇溶蛋白及谷蛋白。具体提取流程如图1。
1.3.2蛋白含量、表面微观结构及亚基组成
1.3.2.1蛋白含量测定 根据GB5009.5—2010凯氏定氮法测定原料及所得蛋白质的蛋白含量,其中蛋白质换算系数取5.43,并按如下公式计算蛋白提取率:

1.3.2.2棉籽蛋白表面微观结构 取少量蛋白样品,均匀铺开,用双面胶粘在电镜进样台上,真空条件下,对样品进行喷金处理,并保持样品干燥,以便观察。调节扫描电镜至3 000及8 000倍数下,观察同一视野内蛋白的表面微观结构[19]。
1.3.2.3Tricine-SDS-PAGE凝胶电泳 参考周乃继[20]的方法并作相应修改,采用 4%的浓缩胶和 12%的分离胶对制备的棉籽分离蛋白、清蛋白、球蛋白、醇溶蛋白及谷蛋白质进行Tricine-SDS-PAGE电泳分析,浓缩胶电压为60 V,分离胶电压为100 V;分离完成后用蛋白凝胶染色液InstantBlue染色30 min,用蒸馏水漂洗干净即可采集蛋白凝胶图像。
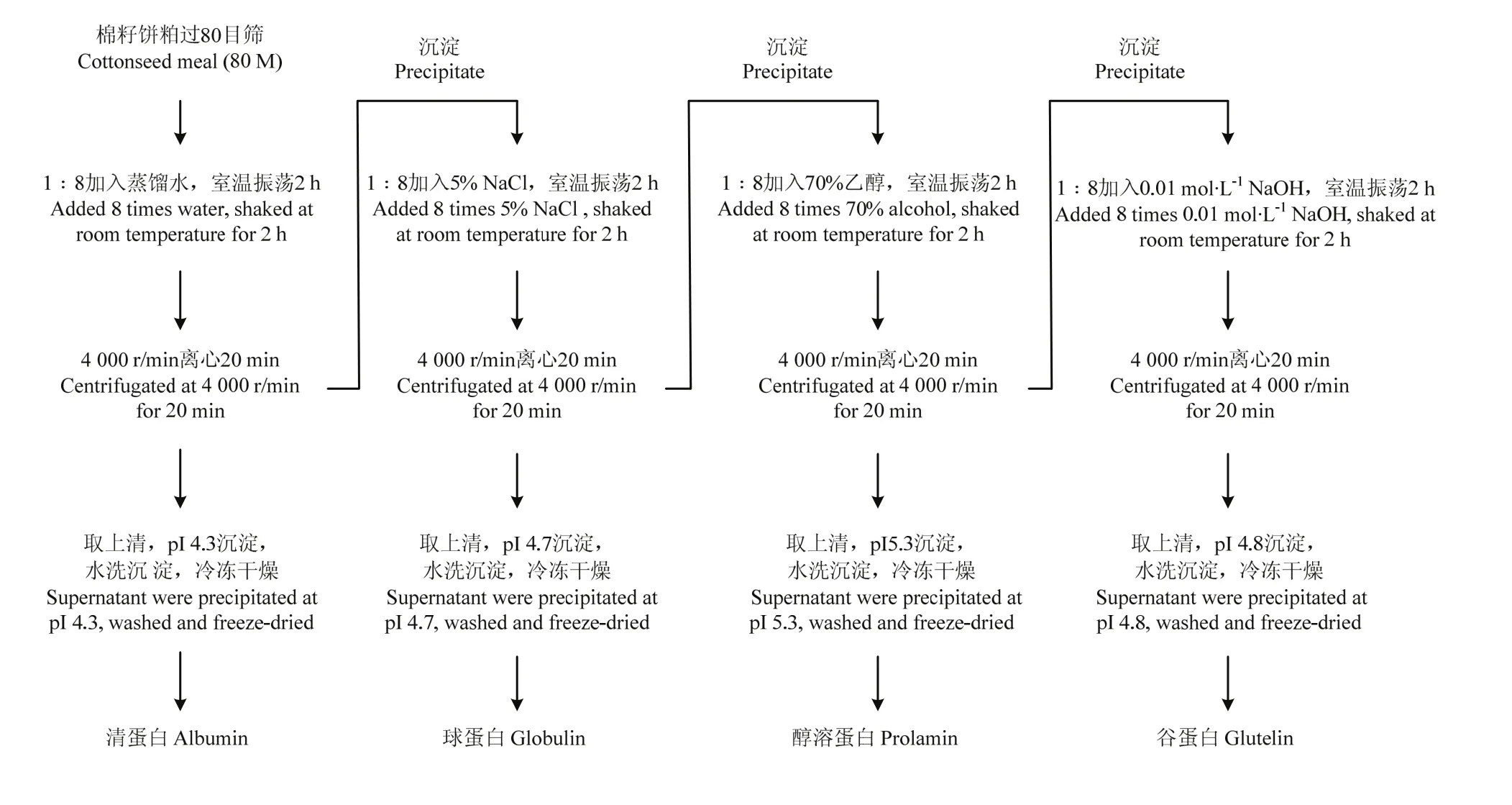
图1 Osborne法分级提取棉籽清蛋白、球蛋白、醇溶蛋白及谷蛋白工艺流程Fig. 1 The flow diagram of Osborne extraction of protein fractions from cottonseed meal
1.3.3氨基酸含量测定 参考颜静等[21]的方法,准确称取蛋白质量为60—80 mg的样品于水解管中,加入10 mL 6 mol·L-1HCl,氮吹1 min使管内充满氮气,密封,将其放入110℃烘箱内水解24 h;冷却至室温,过滤到50 mL容量瓶中,用纯净水冲洗水解管2—3次,将冲洗液也一并过滤到容量瓶中,定容至50 mL,混匀;移取1 mL水解液至5 mL氮吹小瓶中,氮吹40 —60 min至干;加入1 mL 0.02 mol·L-1HCl复溶,混匀,0.45 μm滤膜过滤,用氨基酸自动分析仪进行测定。
htot是分析蛋白质水解度必不可少的常数,根据氨基酸测定结果可得出棉籽蛋白的总肽键数(htot)值,其计算公式如下:

1.3.4棉籽蛋白模拟体外消化[22]称取一定量的棉籽蛋白粉,加入蒸馏水配制成 2%的蛋白溶液,37℃恒温水浴预热。用1 mol·L-1HCl调节pH至2.0,加入一定量的胃蛋白酶,37℃恒温振荡酶解 2 h。用 0.9 mol·L-1NaHCO3溶液调节pH至5.3,加入一定量的胰蛋白酶后,用1 mol·L-1NaOH溶液调节pH至7.6,37℃恒温振荡酶解2 h,100℃灭酶10 min。并在酶解过程中每隔30 min取出100 μL消化液,100℃灭酶10 min以终止消化反应,测定其水解度。将所得消化液冷冻干燥得到肽粉,作为进一步试验的样品保存备用。
1.3.5水解度测定 参考邻苯二甲醛(orthophthalaldehyde,OPA)法[23]并稍作修改,用酶标仪测定消化液的水解度(degree of hydrolysis,DH)。在 96孔透明酶标板的不同微孔中分别加入等浓度梯度的丝氨酸标准液及稀释 10倍的消化液样品 30 μL,再向各微孔中添加200 μL OPA试剂(现配现用),混匀,精确反应2 min,用酶标仪测定340 nm处的吸光值,重复测定3次。根据标准曲线及吸光度计算样品的 CSerine-NH2(mmol·L-1),并按下式计算出DH。

式中,Serine NH2:每克蛋白质中 Serine NH2含量(mmol·g-1);N:稀释倍数;V:上清液体积(L);X:样品质量(g);P:样品中蛋白含量(%);常数α、β分别取1和0.4。
1.3.6抗菌活性测定 滤纸片-琼脂扩散[24]:酶解产物冻干后的肽粉用灭菌水(蒸馏水,121℃高压灭菌20 min)配成100 mg·mL-1溶液,用0.22 μm微孔滤膜过滤除菌,将灭菌的滤纸片浸于其中,备用。
将大肠杆菌接种于LB液体培养基、将金黄色葡萄球菌接种于营养肉汁培养基中,37℃恒温摇床过夜培养,用紫外分光光度计在600 nm波长下调节菌悬液吸光度值(optical density,OD)至1,即菌落形成单位(colony forming unit,CFU)约为1×108,再稀释1 000倍,取100 μL菌液均匀涂布于相应固体培养基上,待菌液完全渗入培养基后放上不同药液浸泡后的滤纸片,37℃恒温培养箱中培养18—24 h,观察是否有抑菌圈形成。
1.3.7蛋白酶解物分子量分布测定 用高效液相色谱法[25]测定抗菌肽的分子量大小,取一定浓度的酶解液及标准品溶液,0.22 μm微孔滤膜过滤后进样,色谱条件如下。
色谱柱:TSK gel G2 000SWXL(7.8 mm×300 mm);流动相:A(乙腈)∶B(含 0.1% TFA超纯水)= 45∶55;检测波长:220 nm;流速:0.5 mL·min-1;柱温:30℃;进样量:10 μL。
相对分子质量标准曲线所用标准品:细胞色素C (MW12 384 Da),抑肽酶(MW6 511 Da),维生素B12(MW1 355 Da),甘氨酰-甘氨酰-酪氨酰-精氨酸(MW451 Da),甘氨酰-甘氨酰-甘氨酸(MW189 Da)。配成1 mg·mL-1混合标样,备用。
1.4数据处理
采用Excel软件对试验结果进行分析,不同处理组间显著性分析采用t-双尾检验(平均值的成对二样本分析),结果以平均值±标准差表示。
2 结果
2.1两种方法提取的蛋白含量和提取率
过筛(80目)棉籽粕含有 45.85%的棉籽蛋白,碱溶酸沉法制备的CPI含量为(89.53±0.66)%,提取率为70.52%;Osborne法分级提取4种蛋白蛋白中,醇溶蛋白含量最低,CPG含量最高,而清蛋白和谷蛋白含量稍低,该方法提取率为67.55%,两种方法的提取率没有显著性差异(P>0.05)。
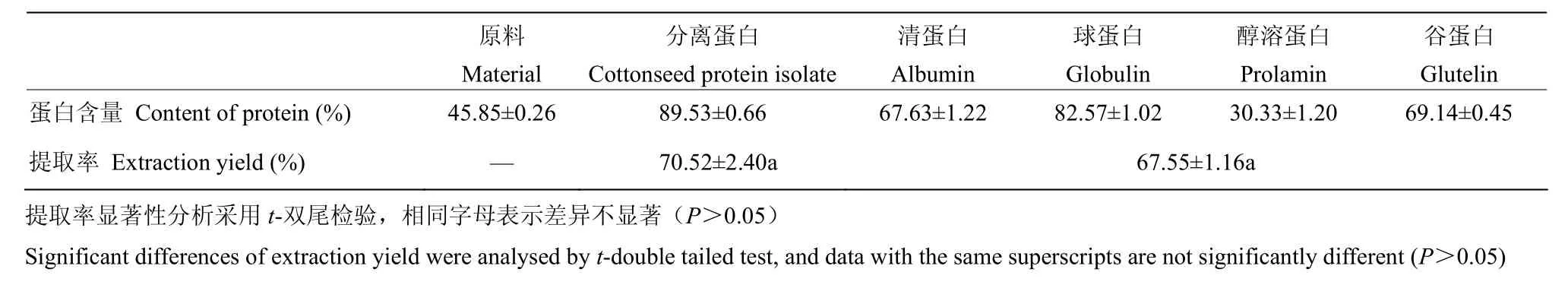
表1 两种方法提取的蛋白含量和提取率Table 1 The protein content and extraction efficiency by these two extraction methods
2.2蛋白的表面微观结构观察
扫描电镜在3 000及8 000倍视野下观察到5种棉籽蛋白的表面微观结构如图2所示,CPI的表面微观结构为蜂窝状(图 2-A);棉籽清蛋白的表面微观结构为鳞片状(图2-B);CPG的表面微观结构为大小不均一的小颗粒组成(图 2-C);棉籽醇溶蛋白的微观结构显示为颗粒物质的组合,结构较松散(图2-D);棉籽谷蛋白的表面微观结构与CPI较接近,均为蜂窝状结构,但棉籽分离蛋白结构相对松散,且颗粒大小较均匀整齐(图2-A、E)。
2.3棉籽蛋白的Tricine-SDS-PAGE电泳分析
Tricine-SDS-PAGE电泳图谱如图3所示,其中清蛋白分子量在20 kDa左右;谷蛋白分子量多在17 kDa左右;CPG主要由4个亚基组成,其分子量分别为56、 48、20及18 kDa;CPI主要由5个亚基组成,分子量分别为56、48、40、20及18 kDa;醇溶蛋白几乎没有电泳条带。综上表明,不同的提取方法所得的蛋白质含量及亚基组成不同,Osborne法所得的4种蛋白中CPG的蛋白含量最高,且亚基组成与CPI接近,因此,选用CPG和CPI作为蛋白样品进行进一步试验。
2.4氨基酸组成及含量
由表2可知,相对于原料,CPI中异亮氨酸、亮氨酸及赖氨酸含量稍低,而CPG中氨基酸保留较好。DH是检测蛋白水解程度的重要指标,而水解度常数总肽键数(htot)是计算蛋白水解度必需的常数。通过测定蛋白质的氨基酸组成及含量,可以计算蛋白质htot。根据表2测定结果计算,CPI水解度常数htot=7.48,而棉籽粕及CPG的htot=7.55。

图2 蛋白扫描电镜图Fig. 2 SEM micrograph of cottonseed protein
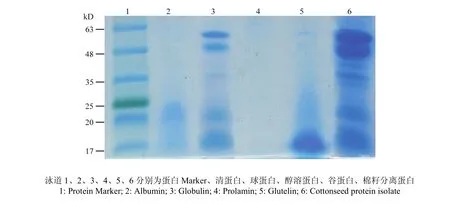
图3 蛋白电泳图谱Fig. 3 Protein profiles by Tricine-SDS-PAGE
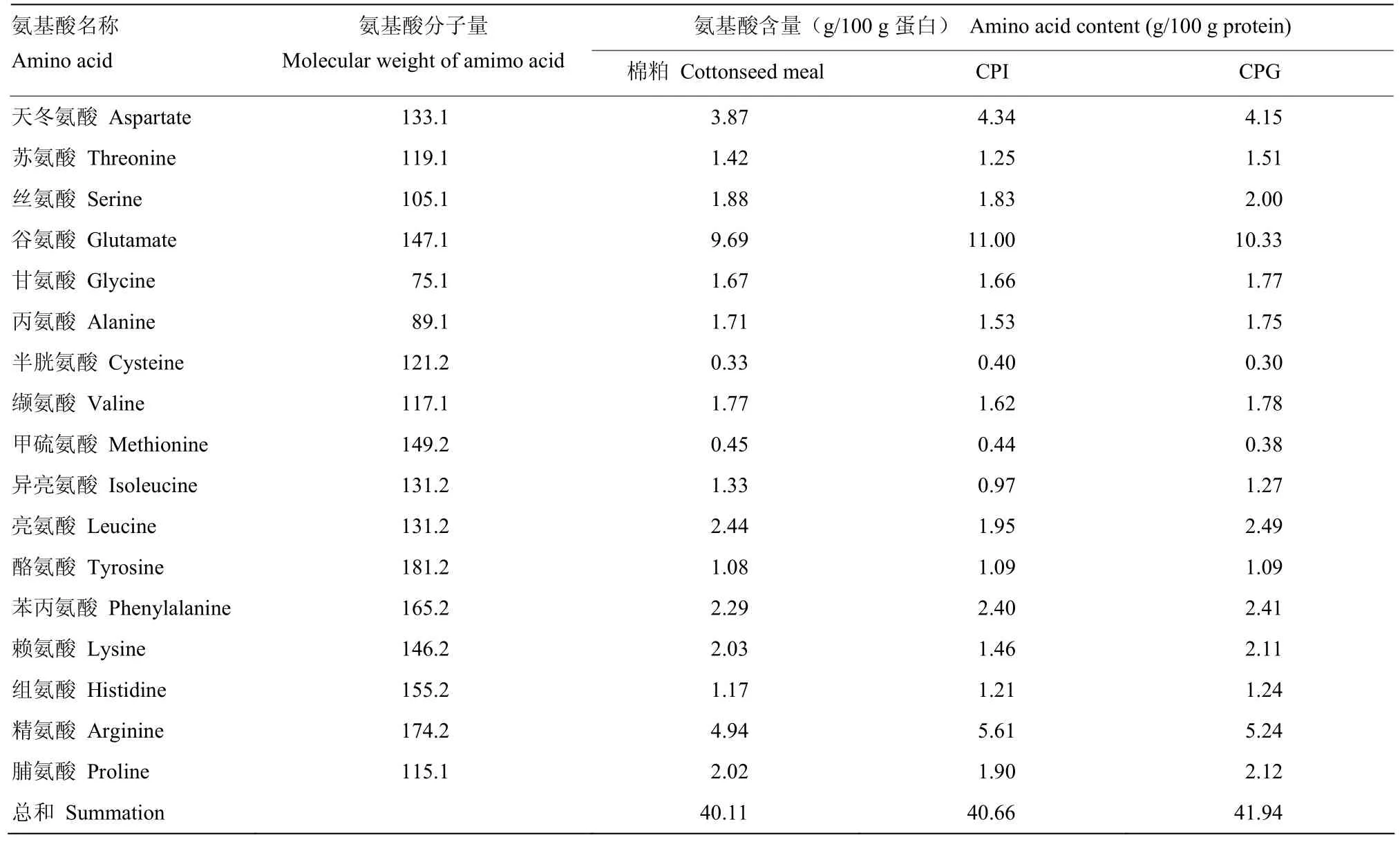
表2 原料及蛋白中氨基酸测定结果Table 2 The results of determination of amino acid in cottonseed meal and protein
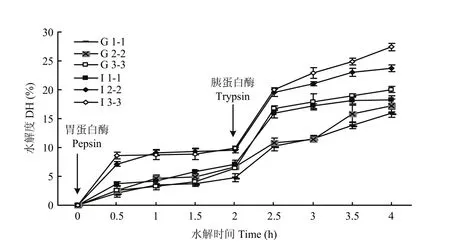
图4 棉籽蛋白水解度随时间变化曲线Fig. 4 The trend of hydrolysis degree of cottonseed protein
2.5蛋白酶解物水解度动态分析
根据丝氨酸浓度及相应吸光度绘制标准曲线,回归方程为y=0.556x+0.275(R2= 0.9949)。根据丝氨酸标准曲线及各时间段酶解物的吸光值计算出酶解物的相对丝氨酸浓度,从而计算出酶解物的水解度(DH),DH随时间变化曲线如图 4所示,胃蛋白酶处理 2 h后,加入胰蛋白酶,DH上升趋势变大,由此可看出蛋白经胃蛋白酶消化,加入胰蛋白酶后,消化率显著升高。根据3 000 U、5 000 U及10 000 U处理的CPI 及CPG酶解物的水解度可看出,加酶量增加,水解度增大,且CPI水解度高于相同处理的CPG,说明CPI 较CPG易水解。
2.6蛋白酶解物抗菌活性分析
用滤纸片-琼脂扩散法,分别以Kan和未经酶解的蛋白溶液为正负对照,以抑菌圈大小为指标,测定每个处理液的抗菌活性,测定结果如图5,与CPI和CPG的蛋白溶液相比,其消化液(I2-2、G2-2)对大肠杆菌都有相对明显的抑制作用,而对金黄色葡萄球菌抗性相对较差(图5-C、5-D);Kan是一种广谱性的抗生素,对大肠杆菌及金黄色葡萄球菌都有一定的抗性,通过正对照Kan即可说明该方法的可行性,也能反映酶解产物的抗菌能力。由上述结果可知,I2-2、G2-2对革兰氏阴性菌(G-)大肠杆菌的抗性要强于对革兰氏阳性菌(G+)金黄色葡萄球菌的抗性。
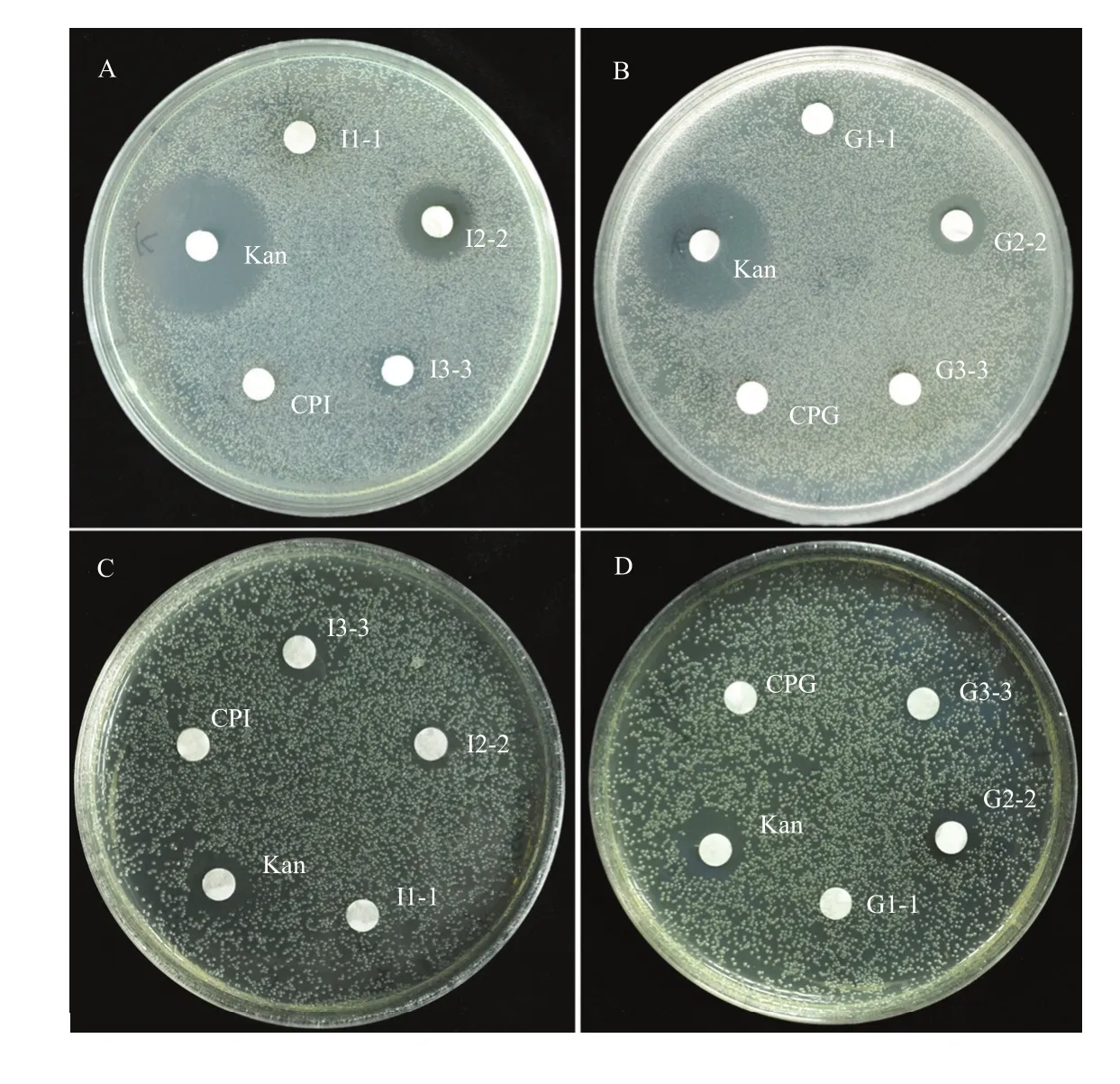
图5 CPI、CPG酶解产物对大肠杆菌(A、B)和金黄色葡萄球菌(C、D)抑制效果Fig. 5 The inhibition effect of hydrolysates of CPI and CPG respectively on the Escherichia coli (A, B) and Staphylococcus aureus (C, D)
2.7蛋白酶解物分子量测定结果
标准曲线测定结果如图 6,保留时间与标准品相对分子质量的对数呈很好的相关性,其回归方程为:y=-0.3917x+14.082(R2=0.9933),其中,y为分子量(MW)以10为底的对数(lg MW)。进而得出酶解液中肽分子量大小及分布结果(图7)。图7-B所示棉籽球蛋白在加酶量为3 000 U时的酶解物分子量在1.65 kDa以上的肽段约为40%,明显高于加酶量为5 000 U和10 000 U的酶解物,而10 000 U处理的酶解物中小分子量肽段较多,随着加酶量的增加,酶解物分子量呈现1.34 kDa以上的肽段含量越来越低,而分子量小于0.78 kDa的肽段含量越来越高。而CPI也有这种趋势,但没有球蛋白明显(图7-A)。
3 讨论
CPI蛋白含量高且Tricine-SDS-PAGE电泳图谱显示其亚基组成较为丰富,表明碱溶酸沉法提取总蛋白的效果更好;Osborne法提取条件相对温和,更有利于维持蛋白的构象[10],且能够较大程度避免蛋白的氨基酸损失,此方法所得蛋白中,醇溶蛋白含量最低,在Tricine-SDS-PAGE电泳图谱上没有显示,可能是棉籽榨油过程中醇溶蛋白被萃出,醇提时醇溶性物质如色素等被提取从而降低了醇溶蛋白的纯度。扫描电镜观察到5种棉籽蛋白的表面微观结构特征具有较大差异,棉籽谷蛋白的结构特征与CPI较接近,可能由于两种蛋白均在碱性条件下提取得到。根据氨基酸测定结果计算得到,CPI水解度常数 htot=7.48与林虬等[2]的结果(htot=7.48)相似,而棉籽粕及CPG的htot=7.55与谢丽蒙等[26]的结果(htot=7.54)相似,且两种蛋白质CPI和CPG的htot没有明显差异。
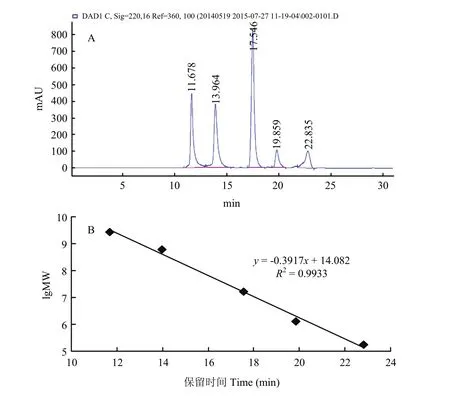
图6 分子量校正标准品的HPLC图谱(A)及分子量测定标准曲线(B)Fig. 6 HPLC chromatogram of mixed standard (A) and calibration curve of molecular weight measurement (B)
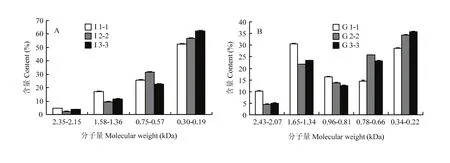
图7 棉籽分离蛋白(A)和棉籽球蛋白(B)酶解物分子量分布Fig. 7 Molecular weight and content of hydrolysates of cottonseed protein isolate (A) and cottonseed globulin (B)
在体外模拟动物消化的酶解过程中,不同加酶量处理组间,CPI水解度及肽分子量分布的差别没有CPG明显,可能是不同制备过程的蛋白结构不同,CPI在制备过程中的碱性环境导致其变性,易被酶水解,而球蛋白具有一定的蛋白结构,蛋白酶(尤其是胃蛋白酶)不易与其作用位点接触。蛋白酶的浓度对其水解度及肽分子量分布的影响没有对CPG的影响大。体外模拟消化所得的酶解物中2-2的抗菌活性较好,但对不同的菌抗菌效果不同,除了菌活力的影响,还可能与革兰氏阳性菌及革兰氏阴性菌的细胞膜结构不同有关[27]。
从酶解物的分子量分布可看出,CPI酶解物 2-2 中 0.57—0.75 kDa这一区间的小肽含量高于 1-1及3-3,而CPG酶解物2-2中则是在0.66—0.78 kDa的小肽含量高于1-1及3-3。由此可推测CPI消化液抗菌活性物质分子量应在0.57—0.75 kDa,而CPG中抗菌活性物质分子量则在0.66—0.78 kDa。至于具体是何种肽具有抗菌活性,其抗菌活性如何作用,还有待于深入研究。
4 结论
Osborne法制备的4种棉籽蛋白中球蛋白含量最高,其蛋白含量为(82.57±1.02)%,碱溶酸沉法提取得到的棉籽分离蛋白含量为(89.53±0.66)%,Tricine-SDS-PAGE电泳分析,球蛋白亚基组成较接近于棉籽分离蛋白。球蛋白和棉籽分离蛋白经体外模拟消化后的产物均能抑制金黄色葡萄球菌和大肠杆菌的生长,因此,棉籽蛋白酶解产物具有抗菌活性,通过一定的分离纯化方法可从中制备出棉籽抗菌肽。
References
[1] 周建中, 张晖. 棉籽蛋白的研究进展及其在食品中的应用. 农产品加工(学刊), 2014(6): 53-57. ZHOU J Z, ZHANG H. Research and application of cottonseed protein in food. Academic Periodical of Farm Products Processing,2014(6): 53-57. (in Chinese)
[2] 林虬, 黄薇, 宋永康, 姚清华, 苏德森. 双酶分步水解法制备棉籽多肽的蛋白酶筛选. 中国粮油学报, 2012, 27(2): 76-80. LIU Q, HUANG W, SONG Y K, YAO Q H, SU D S. Selection of proteolytic enzymes to prepare cottonseed peptide by two-stephydrolysis. Journal of the Chinese Cereals and Oils Association, 2012,27(2): 76-80. (in Chinese)
[3] ARTHU J C, MELVIN K K. Preparation and properties of cottonseed protein dispersions. Journal of the American Oil Chemists’ Society,1948, 25(3): 99-102.
[4] YUAN W, JIN H T, REN Z H, DENG J L, ZUO Z C, WANG Y,DENG H D, DENG Y T. Effects of antibacterial peptide on humoral immunity in weaned piglets. Food and Agricultural Immunology,2015, 26(5): 682-689.
[5] SILA A, NEDJAR-ARROUME N, HEDHILI K, CHATAIGNÉ G,BALTI R, NASRI M, DHULSTER P, BOUGATEF A. Antibacterial peptides from barbel muscle protein hydrolysates: activity against some pathogenic bacteria. LWT-Food Science and Technology, 2014,55(1): 183-188.
[6] 李燕, 王嘉榕, 孙红宾. 抗菌肽的制备和抗菌机制研究进展. 生物医学工程学杂志, 2015, 32(2): 465-469. LI Y, WANG J R, SUN H B. Research progress in preparation of antimicrobial peptides and their mechanisms of action. Journal of Biomedical Engineering, 2015, 32(2): 465-469. (in Chinese)
[7] ZHANG B N, CUI Y D, YIN G Q, LI X M, ZHOU X X. Alkaline extraction method of cottonseed protein isolate. Modern Applied Science, 2009, 3(3): 77-82.
[8] 何旭. 棉籽分离蛋白提取工艺的研究[D]. 郑州: 河南工业大学,2010. HE X. Cottonseed protein isolated extraction technology [D]. Zhengzhou: Henan University of Technology, 2010. (in Chinese)
[9] CHATAIFRAGKOU A, PRABHAKUMARI P C, KOSIK O,LOVEQROVE A, SHEWRY P R, Charelampopoulos D. Extractability and characteristics of proteins deriving from wheat DDGS. Food Chemistry, 2016, 198: 12-19.
[10] WANG C, LI D, XU F, HAO T S, ZHANG M. Comparison of two methods for the extraction of fractionated rice bran protein. Journal of Chemistry, 2014, 2014: 1-10.
[11] USMAN L A, AMEEN O M, LAWAL A, AWOLOLA G V. Effect of alkaline hydrolysis on the quantity of extractable protein fractions (prolamin, albumin, globulin and glutelin) in Jatropha curcas seed cake. African Journal of Biotechnology, 2009, 8(6): 6374-6378.
[12] AGYEI D, DANQUAH M K. Rethinking food-derived bioactive peptides for antimicrobial and immunomodulatory activities. Trends in Food Science and Technology, 2012, 23(2): 62-69.
[13] GAO D, CAO Y, LI H. Antioxidant activity of peptide fractions derived from cottonseed protein hydrolysate. Journal of the Science of Food and Agriculture, 2010, 90(11): 1855-1860.
[14] SUN H, YAO X, WANG X, WU Y F, LIU Y, TANG J W, FENG J. Chemical composition and in vitro antioxidant property of peptides produced from cottonseed meal by solid-state fermentation. CyTA-Journal of Food, 2015, 13(2): 264-272.
[15] BOBOEV A, HASANOV A, YOTOVA L, HASANOV H. Antioxidant activity of peptides obtained from wheat and cottonseed proteins. Bulgarian Journal of Agricultural Science, 2012, 18(1): 103-111.
[16] GAO D D, CHANG T, LI H X, CAO Y S. Angiotensin I-converting enzyme inhibitor derived from cottonseed protein hydrolysate. African Journal of Biotechnology, 2010, 9(53): 8977-8983.
[17] 赵小龙, 刘大川, 刘晔, 黄鑫, 黄良哲. 棉籽分离蛋白制备工艺研究. 中国油脂, 2014, 39(12): 31-34. ZHAO X L, LIU D C, LIU Y, HUANG X, HUANG L Z. Preparation of cottonseed protein isolate. China Oils and Fats, 2014, 39(12):31-34. (in Chinese)
[18] SUGIMOTO T, TANAKA K, KASAI Z. Improved extraction of rice prolamin. Agricultural and Biological Chemistry, 1986, 50(9):2409-2411.
[19] TORO-SIERRA J, SCHUMANN J, KULOZIK U, Impact of spraydrying conditions on the particle size of microparticulated whey protein fractions. Dairy Science and Technology, 2013, 93(4): 487-503.
[20] 周乃继. 棉籽肽饲料开发与小肽的检测[D]. 合肥: 安徽农业大学,2009. ZHOU N J. Exploitation and identification of small peptide from cotton seed meal[D]. Hefei: Anhui Agricultural University, 2009. (in Chinese)
[21] 颜静, 刘继, 熊亚波, 李玉, 秦文. 川明参不同部位主要营养成分及氨基酸组成分析. 食品科学, 2015, 36(1): 240-244. YAN J, LIU J, XIONG Y B, LI Y, QIN W. Analysis of nutritional components and amino acid composition of different parts of Chuanmingshen violaceum Sheh et Shan. Food Science, 2015, 36(1):240-244. (in Chinese)
[22] 陈倩倩, 佟立涛, 钟葵, 刘丽娅, 周素梅, 钱海峰. 大米蛋白酶解物的ACE抑制活性研究. 现代食品科技, 2015, 31(3): 91-96. CHEN Q Q, TONG L T, ZHONG K, LIU L Y, ZHOU S M, QIAN H F. Andiotensin-converting enzyme inhibition by rice protein hydrolysate. Modern Food Science and Technology, 2015, 31(3): 91-96. (in Chinese)[23] NIELSEN P M, PETERSEN D, DAMBMANN C. Improved method for determining food protein degree of hydrolysis. Journal of Food Science, 2001, 66(5): 642-646.
[24] 王娣, 许晖, 钱时权, 曹珂珂, 任茂生, 田长城. 麝香草酚对食品常见污染菌的抑菌作用. 食品科学, 2013, 34(3): 119-122. WANG D, XU H, QIAN S Q, CAO K K, REN M S, TIAN C C. Antimicrobial activity of thymol against foodborne pathogenic bacteria. Food Science, 2013, 34(3): 119-122. (in Chinese)
[25] SU G W, REN J Y, ZHAO M M, SUN D W. Comparison of superdex peptide HR 10/30 column and TSK gel G2000 SWXL column for molecular weight distribution analysis of protein hydrolysates. Food and Bioprocess Technology, 2013, 6(12): 3620-3626.
[26] 谢丽蒙, 程凡升, 袁瑾, 朴美子. 食源性蛋白质水解度常数 h_(tot)值的测定. 氨基酸和生物资源, 2013, 35(1): 15-18. XIE L M, CHENG F S, YUAN J, PIAO M Z. Study on the htot value of foodborne protein. Amino Acids and Biotic Resources, 2013, 35(1):15-18. (in Chinese)
[27] 王娟娟, 包永波, 王素芳, 林志华. 泥蚶血红蛋白异源四聚体酶解多肽抗菌活性及其机理研究. 海洋学报, 2015, 37(12): 106-115. WANG J J, BAO Y B, WANG S F, LIN Z H. Antibacterial activity and mechanisms of heterotetramer hemoglobin drrived polypeptide from Tegillarca granosa. Haiyang Xuebao, 2015, 37(12):106-115. (in Chinese)
(责任编辑 赵伶俐)
Preparation and Antimicrobial Activity of Cottonseed Protein Hydrolysate
HAN Xiao-yan1, BAO Yu-ming1, XIN Feng-jiao1, KONG Zhi-qiang1, Christophe Blecker2, DAI Xiao-feng1
(1Institute of Agro-Products Processing Science and Technology, Chinese Academy of Agricultural Sciences/Key Laboratory of
Agro-Products Processing, Ministry of Agriculture, Beijing 100193, China;2Department of Food Science,University of Liège, Belgium)
【Objective】 In order to provide a theoretical basis and technical support for efficient utilization of cottonseed protein, two methods were used to prepare cottonseed protein, then the isolated proteins were compared and digested in vitro bypepsin and trypsin, lastly the hydrolysates were detected and selected in antibacterial activity. 【Method】 In this paper, cottonseed protein isolate was prepared by the traditional method which is alkali extraction and acid precipitation and Osborne fractionation method. The protein content and molecular weight of the obtained proteins were determined by the Kjeldahl method and Tricine-SDS-PAGE respectively, microstructure of the proteins were examined by scanning electron microscopy. Amino acid composition of cottonseed proteins were analyzed by automatic amino acid analyzer (L-8900). And then proteins were digested by pepsin and trypsin in vitro in the process of digestination, the degree of hydrolysis (DH) of cottonseed protein isolate (CPI) and cottonseed globulin (CPG) hydrolysates were determined by ortho-phthalaldehyde (OPA), and then kanamycin (Kan) and protein solution without hydrolysis were used as control to determine the antibacterial activity of protein hydrolysates with Staphylococcus aureus and Escherichia coli bacteria. Meanwhile, the molecular weight distribution of the hydrolysis products were detected by high performance liquid chromatography (HPLC). 【Result】The extraction rate of CPI by the method of alkali extraction and acid precipitation was (70.52±2.40)% and its protein content reached (89.53±0.66)%. While the albumin, globulin, prolamin and glutelin were classified by Osborne fractionation method, and compared with the other three proteins, cottonseed globulin got the highest protein content that was (82.57±1.02)%. And there was no significant difference (P>0.05) in protein extraction rate between the two preparation methods for the proteins extraction rate of Osborne fractionation method was (67.55±1.16)%. The Tricine-SDS-PAGE pattern showed that the subunits composition of CPG was more closely to CPI, compared to the other obtained proteins by Osborne fractionation method. The microstructures of the obtained proteins were different from each other. The structure of CPI showed a neat honeycomb structure, which was similar to glutenins’ microstructure, while the CPG showed a uneven granulated one. Amino acid composition analysis indicated that the amino acids of CPG were well maintained by Osborne method, compared to CPI. Cottonseed proteins were hydrolyzed by pepsin and trypsin simulated the digestive system in vitro. The hydrolysis degree of cottonseed protein hydrolysates was determined by microplate reader, and the result showed that the degree of hydrolysis of CPI hydrolysates was higher than CPG at the same amount of added enzyme, which indicated that CPI was easier to be hydrolysed than CPG. The molecular weight of cottonseed protein hydrolysates was measured by HPLC, and the result showed that the content of peptides (MW≤0.8 kDa) of CPI hydrolysates was significantly higher than CPG with the content of 70%-85% and 40%-60%,respectively. Results of antibacterial activity analysis showed that the antibacterial ability of these protein hydrolysates were strongest when the amount of pepsin-trypsin in digestion simulation system was 5 000-5 000 U (2-2), and the degree of hydrolysis of these protein hydrolysates were (24.72±1.07)% and (19.26±0.39)%, respectively, under such digested conditions, and the ability of both digestions to against E. coli were higher than S. aureus. CPI was higher than CPG in antibacterial activity, while both of the original protein without digestion treatment showed no antibacterial ability. The molecular weight determination results showed that the molecular weight of antibacterial activity peptides of cottonseed protein isolate should be in 0.57-0.75 kDa while cottonseed globulins’ were in 0.66-0.78 kDa.【Conclusion】 There was no significant difference between the two methods in the extracted yield of protein (P>0.05), proteins classified by Osborne fractionation method showed an obvious difference in subunit composition, but the CPG and CPI showed a similarity. CPI is easier to be digested compared to the CPG and both of these two proteins’ hydrolysates showed an antibacterial activity, the hydrolysates of CPI is higher than CPGs’ in antibacterial activity.
cottonseed protein isolate; cottonseed globulin; in vitro digestion; antibacterial peptide; molecular weight distribution
2016-02-29;接受日期:2016-05-12
中国-阿根廷食品科学技术研究中心(阿根廷)项目
联系方式:韩晓燕,E-mail:hanxiaoyan131@126.com。包郁明,E-mail:baoyuming@caas.cn。韩晓燕与包郁明为同等贡献作者。通信作者戴小枫,E-mail:daixiaofeng@caas.cn
