不同培养基继代培养球孢白僵菌对西花蓟马毒力和产孢量的影响
2016-09-16吴圣勇张璐璐张林雅雷仲仁
张 慧,吴圣勇,李 娟,张璐璐,张林雅,雷仲仁
(中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193)
不同培养基继代培养球孢白僵菌对西花蓟马毒力和产孢量的影响
张 慧,吴圣勇,李 娟,张璐璐,张林雅,雷仲仁
(中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193)
【目的】通过开展连续继代培养对高毒菌株产孢和毒力的影响研究,获得对西花蓟马(Frankliniella occidentalis)毒力和产孢量均高且稳定的球孢白僵菌(Beauveria bassiana)菌株,进一步提出有效防止菌株退化、优良菌株保存和改良的方法与措施,为高效菌株的规模化生产提供参考。【方法】室内条件下,采用浸虫法,用浓度为1×107个孢子/mL球孢白僵菌悬浮液处理西花蓟马初羽化成虫,分别测定28株不同来源的菌株对西花蓟马的毒力;并将筛选出的4株高毒力菌株的分生孢子分别涂布于玉米琼脂(CMA)培养基与SDAY培养基上,比较不同菌株以及不同培养基之间产孢量的差异,筛选出高产孢菌株与产孢培养基,以筛选得到的白僵菌菌株为初始菌株F0,把F0代球孢白僵菌分别接种于CMA培养基、添加蝉蜕的CMA培养基和添加西花蓟马虫尸粉的CMA培养基,分别测定经过不同培养基连续5代继代培养得到的球孢白僵菌对西花蓟马成虫的毒力,并测定产孢量。使用模型模拟分析球孢白僵菌菌株经过不同培养基继代培养后培养代数与产孢量的关系,并对不同培养基培养得到的不同培养代数的白僵菌菌株的产孢量与其对西花蓟马的致死中时(LT50)进行回归分析,研究毒力与产孢量的相关关系。【结果】经过室内毒力测定,处理5 d后,菌株DZDC-9、GZGY-5、WLMQ1-8、SZ-26对西花蓟马成虫的校正累积死亡率均高于90%,LT50均在3 d内,毒力显著高于其他菌株;比较高毒力菌株在两种产孢培养基上的产孢量,发现4株球孢白僵菌的产孢量存在显著差异,菌株DZDC-9的产孢量显著高于其他3株,4株菌株在CMA培养基中的产孢量均明显高于SDAY培养基。随着白僵菌菌株在CMA培养基上连续5代的继代培养,菌株对西花蓟马成虫的致病力呈现下降趋势,从第3代开始致病力显著降低,而添加蝉蜕的CMA培养基培养得到的不同培养代数的分生孢子对西花蓟马致病力则没有显著差异,添加西花蓟马虫尸粉的CMA 培养基培养得到的不同代数的分生孢子对西花蓟马致病力有一定的增强趋势;通过模型可以发现单纯以CMA培养基继代培养白僵菌的产孢量随培养代数呈现指数下降,而在培养基中添加蝉蜕或西花蓟马虫尸粉白僵菌产孢量则随培养代数呈现指数上升,蝉蜕或西花蓟马虫尸粉的添加对产孢量有一定的增强作用。白僵菌菌株产孢量与毒力存在一定正相关关系,产孢量相对较高的菌株对西花蓟马成虫的致病力相对较高,致死中时短。【结论】筛选得到一株对西花蓟马高效的白僵菌菌株 DZDC-9,产孢培养基中加入蝉蜕和西花蓟马虫尸可以维持菌株生长特性,延缓毒力退化趋势;同一菌株的产孢量可以作为菌株毒力评价的一个指标。
西花蓟马;球孢白僵菌;继代培养;毒力;产孢量
0 引言
【研究意义】西花蓟马(Frankliniella occidentalis)属缨翅目(Thysanoptera)蓟马科(Thripidae)花蓟马属(Frankliniella),是蔬菜、花卉和棉花上的重要害虫[1-2],其在中国的潜在适生区多达28个省[3-4]。西花蓟马除了直接取食危害寄主植物外,还可以传播番茄斑萎病毒(Tomato spotted wilt virus,TSWV)、凤仙花坏死病毒(Impatiens necrotic spot virus,INSV)和番茄褪绿病毒(Tomato chlorotic spot virus,TCSV)等多种植物病毒[5],严重时导致作物绝产。由于西花蓟马虫体小,善于隐蔽,对多种杀虫剂易产生抗性[6-7],难以防治[8],有必要开发对西花蓟马高效安全的可持续防治方式。球孢白僵菌(Beauveria bassiana,简称白僵菌),是目前应用最广泛的虫生真菌,寄主范围广,对环境安全,对人畜无害且不杀伤天敌,在田间使用可以循环扩散发挥侵染作用。在防治中应用的白僵菌菌种主要来源于野外采集自然直接分离筛选的特定菌株,在人工培养基上,球孢白僵菌在继代培养过程中,菌株易发生变异,导致产孢量和对害虫的致病性等性状发生改变[9-11]。因此,筛选对西花蓟马高效的球孢白僵菌菌株,并提出一个有效的稳定菌株毒力和产孢能力的方法,对菌株保存、改良和规模化生产具有重要意义。【前人研究进展】JACOBSON等研究发现,球孢白僵菌等昆虫病原真菌对西花蓟马有较好的防治效果[12-13];SAFAVI等[14]研究认为人工培养的白僵菌菌株的毒力稳定性是白僵菌大规模生产及保证市售商品和田间使用的白僵菌产品质量一致性的重要指标。而异核现象造成的变异和线粒体基因组的异质性或突变会造成白僵菌生产菌株在继代培养中的退化,温度、光照及培养基含水量等因素都能诱发或加剧变异的发生[15-17];唐晓庆等研究认为碳源、氮源及少量微量元素是白僵菌正常生长所必需的营养物质。白僵菌在培养过程中,如果营养物质供给不足,容易衰老退化,出现菌落局变、菌苔生长瘠薄或是菌丝徒长的现象,导致分生孢子产率下降,从而影响球孢白僵菌对害虫的致病力[15,18];樊美珍等[19]研究认为不同营养条件下生长的球孢白僵菌其产孢水平有所不同,适宜的营养条件会促进菌株生长,提高其杀虫活性;JAMES[20]研究认为氮源是组成细胞蛋白质、氨基酸及核酸的重要成分,丰富的氮源不仅有利于白僵菌孢子的萌发,而且可以促进菌丝的生长并能增加菌苔厚度;SHAH等[21]研究发现不同白僵菌菌株有一定的寄主专化性,毒力也有一定差异,白僵菌菌株如果长期侵染一种昆虫,便能提高对该昆虫的毒力,且从人工培养基上获取的绿僵菌分生孢子的侵染相关基因的表达量显著低于从虫尸上获取的分生孢子的相关基因的表达量;FURLANETO等[22]也认为可以通过定期人工定向分离培养稳定甚至提高绿僵菌菌株的毒力特性;ANSARI等[23]报道培养基会影响昆虫病原真菌的特性,不同产孢培养基上绿僵菌在分生孢子毒性和产孢量方面有显著差异;李会平等[24]把白僵菌菌株反复接种于桑天牛(Apriona germari)幼虫虫体,提高了白僵菌对桑天牛幼虫的侵染力,而通过普通沙式培养基培养得到的白僵菌对桑天牛幼虫的侵染力下降;关兵兵等[25]研究证明白僵菌在蝉蜕诱导培养基上的产孢量显著高于PDA培养基,且产孢相关蛋白和其他蛋白质的表达上调。【本研究切入点】目前对白僵菌继代培养影响的研究主要是对产孢量的数据统计,没有对两者的相关性进行有效拟合和分析。虽然利用白僵菌防治西花蓟马的研究报道较多,但已报道的对西花蓟马高效菌株的筛选仅局限于对原始菌株分生孢子的室内毒力测定,关于继代培养过程中菌株产孢量和毒力的变化及对西花蓟马具有高致病力的球孢白僵菌的复壮研究鲜有报道。目前对菌株复壮主要是人工定向培养,但人工定向分离培养耗时较长,且西花蓟马虫体较小,难以分离,极易污染,难以稳定菌株毒性,影响了菌株的大规模生产和在西花蓟马田间防治中的应用。【拟解决的关键问题】通过测定野外采集分离得到的28株球孢白僵菌对西花蓟马的毒力,筛选出高毒力菌株,进一步对高毒力菌株进行产孢培养基的筛选和产孢量的比较,筛选出接种产孢培养基和继代培养菌株;对该菌株在添加西花蓟马虫尸粉与蝉蜕的培养基上连续5代继代培养,测定不同培养基培养得到的白僵菌菌株产孢量与毒力变化,并进行曲线拟合和相关性分析。以期明确连续继代培养与菌株毒力和产孢的关系,并评估蝉蜕和西花蓟马虫尸的诱导是否可以稳定高毒菌株的毒力和产孢量。
1 材料与方法
试验于 2015年在中国农业科学院植物保护研究所完成。
1.1供试菌株
从被感染白僵菌的温室白粉虱(Trialeurodes vaporariorum)和亚洲玉米螟(Ostrinia furnacalis)上分离得到的 28株球孢白僵菌菌株,斜面保存于4℃,由中国农业科学院植物保护研究所蔬菜害虫组提供。试验时,取斜面上保存的菌株,用接种环蘸取适量孢子粉,接种于CMA产孢培养基,于26℃恒温培养箱(GXZ-9240A)光周期L∶D=12 h∶12 h培养7 d,活化备用。各菌株分离虫体和地理来源见表1。
1.2供试虫源
西花蓟马于 2014 年采自北京市门头沟碧琨蔬菜种植中心,已在实验室内用蛇豆(Trichosanthes anguina)饲养多代。饲养温度为(26±1)℃,相对湿度为60%,光周期L∶D=14 h∶10 h。选用生长一致的初羽化成虫供试验所用。
1.3供试培养基和试剂
CMA培养基:玉米粉20 g·L-1、麦麸10 g·L-1、蛋白胨 5 g·L-1、KH2PO43 g·L-1、NH4NO31 g·L-1、MgSO4·7H2O 1 g·L-1、琼脂15 g·L-1;SDAY培养基:葡萄糖40 g·L-1、蛋白胨10 g·L-1、琼脂15 g·L-1;添加蝉蜕的CMA培养基:在CMA产孢培养基中添加5 g·L-1的蝉蜕粉,配制带有蝉蜕成分的产孢培养基;添加西花蓟马虫尸粉的CMA培养基:在CMA产孢培养基中分别添加5 g·L-1的西花蓟马虫尸粉,配制带有西花蓟马虫尸成分的产孢培养基。
试验所用蛋白胨购自北京奥博星生物技术有限责任公司(净含量250 g,国产),葡萄糖购自国药集团化学试剂有限公司(500 g分析纯,国产),KH2PO4、NH4NO3和 MgSO4·7H2O购自北京化工厂(净含量500 g分析纯,国产),吐温-80购自国药集团化学试剂有限公司(500 g化学纯,国产),琼脂粉为北京中保绿农科技集团有限公司产品,麦麸和玉米粉为市售,蝉蜕粉购自北京同仁堂药店,西花蓟马虫尸粉为实验室饲养的健康西花蓟马成虫磨碎得到。
1.4高毒力球孢白僵菌的筛选
测定已活化白僵菌菌株的孢子萌发率,萌发率在90%以上的菌株可用于菌株筛选试验。将各菌株分生孢子分别加入 0.05%的吐温-80溶液中配制成1×107个孢子/mL的孢子悬浮液,对生长一致的西花蓟马初羽化成虫采用浸虫法进行毒力测定。
1.5高产孢菌株和产孢培养基的筛选
把筛选得到的高毒力球孢白僵菌分生孢子分别涂布于SDAY和CMA培养基,比较不同白僵菌以及不同培养基之间产孢量的差异,筛选高产孢菌株与产孢培养基。
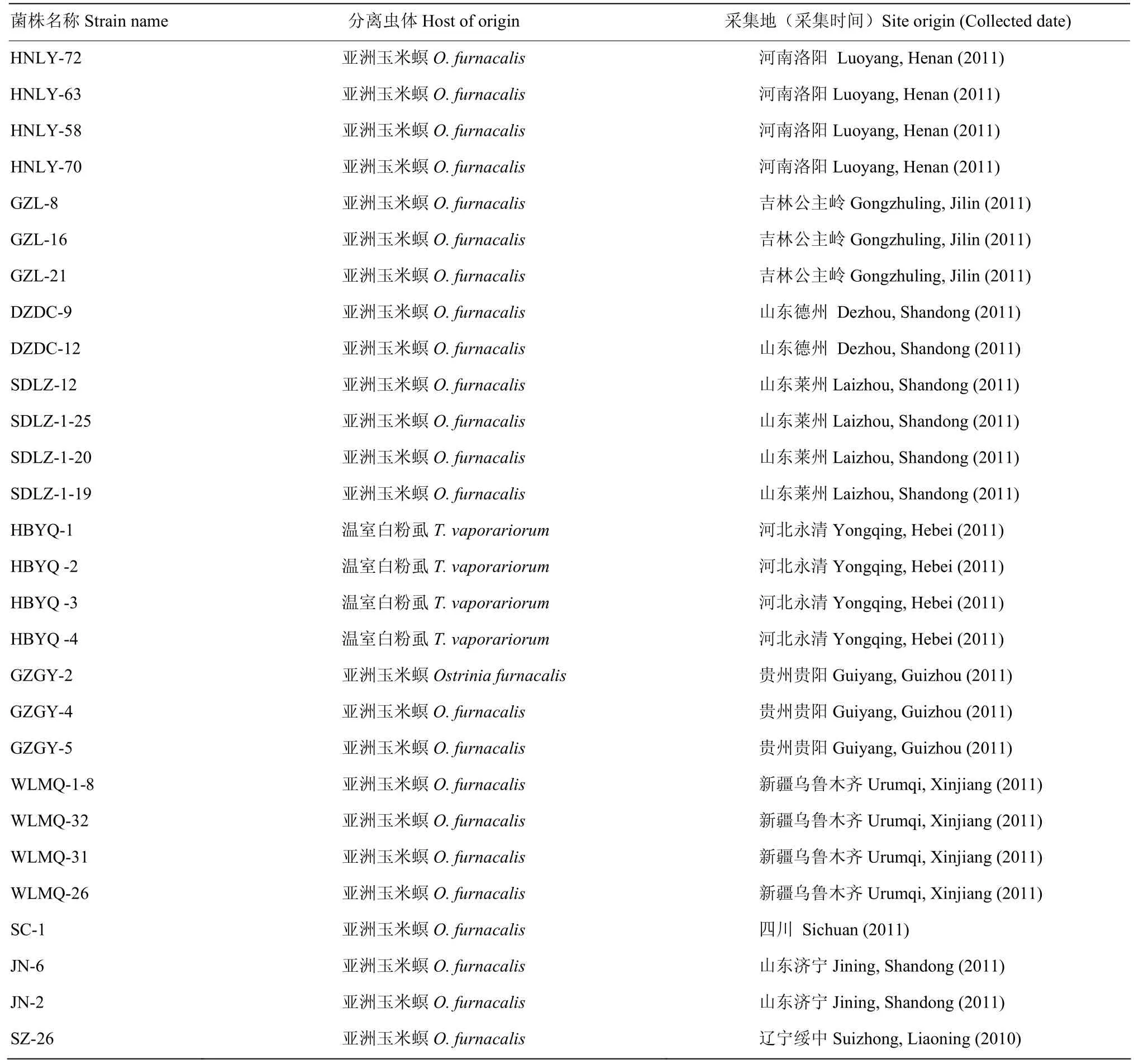
表1 不同菌株分离虫体及地理来源Table 1 The geographical origin and host of different strains
1.6不同培养基的继代培养
把筛选出的对西花蓟马成虫有高致病力且产孢量高的白僵菌菌株(DZDC-9)定义为原始菌株F0代,F0代分别接种于CMA培养基获得F1代,F1代再接种于CMA培养基获得F2代,以此类推共得到5代(F1—F5)。同样的方法,把F0代球孢白僵菌分别接种于添加蝉蜕的 CMA培养基和添加西花蓟马虫尸粉的CMA培养基,获得C1—C5代和X1—X5代球孢白僵菌,分别对经过继代培养得到的 F1—F5、C1—C5和 X1—X5代球孢白僵菌对西花蓟马成虫进行毒力测定,并测定产孢量。
1.7球孢白僵菌对西花蓟马的室内毒力测定
用恒定CO2气流将西花蓟马麻醉,随后将其倒入配制好的孢子悬浮液中,浸泡5 s,倒于滤纸上,并吸去多余孢子悬浮液,然后用软毛刷将试虫挑入已放入一根蛇豆的养虫管(高20 cm,直径3 cm)中,每个养虫管接虫20头,用纱布封口。试验设置3次重复,以0.05%吐温-80溶液作为对照。放入温度为(26±1)℃,相对湿度为60%,光周期L∶D=14 h∶10 h的光照培养箱中培养,每日观察西花蓟马的死亡情况,记录死亡数,并将死亡的成虫挑出,置于底部铺有保湿滤纸的培养皿中保湿培养,若长出白色菌丝或孢子则为有效侵染致死,连续观察5 d[26]。
为了确定沉降到西花蓟马体表的分生孢子数,将西花蓟马浸于浓度为1×107个孢子/mL的孢子悬浮液中,5 s后挑取10只西花蓟马放在滤纸上,并吸干多余液体,然后放入含有20 mL灭菌0.05%吐温-80的50 mL锥形瓶中,并放入摇床中,125 r/min振荡,使孢子从西花蓟马体表洗脱,2 h后吸取100 μL液体并均匀涂抹于CMA培养基上,于(26±1)℃培养箱中培养,4 d后计数平板上成菌落数(CFU),粗略作为西花蓟马体表的孢子数[27]。
1.8球孢白僵菌产孢量测定
将球孢白僵菌的分生孢子配制成 1×107个孢子/mL的孢子悬浮液,取1 mL涂布于培养基,置于温度为(26±1)℃,相对湿度为60%,光周期L∶D= 14 h∶10 h的恒温培养箱培养14 d,待培养基中长出淡黄色孢子粉时,用直径3.5 mm的打孔器在平板中央到边缘1/2处打下孢子,将打下的孢子放入内含10 mL 0.05%吐温-80溶液的15 mL离心管中,涡旋振荡均匀,吸取适量溶液置于血球计数板上,静置1 min后计数,换算成每cm2所含分生孢子数量。每板分别取3处打下菌落块,每个菌株设3个平板作为重复。
1.9数据统计与分析
采用POLO软件计算白僵菌对西花蓟马的致死中时(LT50),用Abbott公式计算校正累积死亡率,用SPSS 19.0软件进行Tukey’s(HSD)显著性差异分析。
2 结果
2.1对西花蓟马高毒力白僵菌菌株的筛选
通过计数平板上成菌落数可知,试验用的西花蓟马在浓度为1×107个孢子/mL的孢子悬浮液中浸泡5 s后其体表的孢子数约为(3.76±0.08)×103个孢子/头,由于分生孢子无法全部洗脱,该测定结果会略小于实际孢子数。经过室内毒力测定,在1×107个孢子/mL的接种浓度下,各白僵菌菌株对西花蓟马成虫均表现出一定的致病力,以第5天的校正累积死亡率作为菌株毒力比较的指标,可以看出不同菌株校正累积死亡率差异显著(F=11.290,df=27,83;P<0.01),其中菌株DZDC-9、GZGY-5、WLMQ1-8、SZ-26对西花蓟马第5天的校正累积死亡率均在90%以上。不同菌株对西花蓟马成虫的致病力差异显著(F=85.509,df=27,83;P<0.01),LT50在2—6 d(图1),均明显低于对照(10.25±1.16)d,其中菌株 DZDC-9、GZGY-5、WLMQ1-8和SZ-26对西花蓟马的LT50在3 d以内。综合考虑 LT50和校正累积死亡率,菌株DZDC-9、GZGY-5、WLMQ1-8、SZ-26对西花蓟马致病较快、致病力较强,显著优于其他菌株。
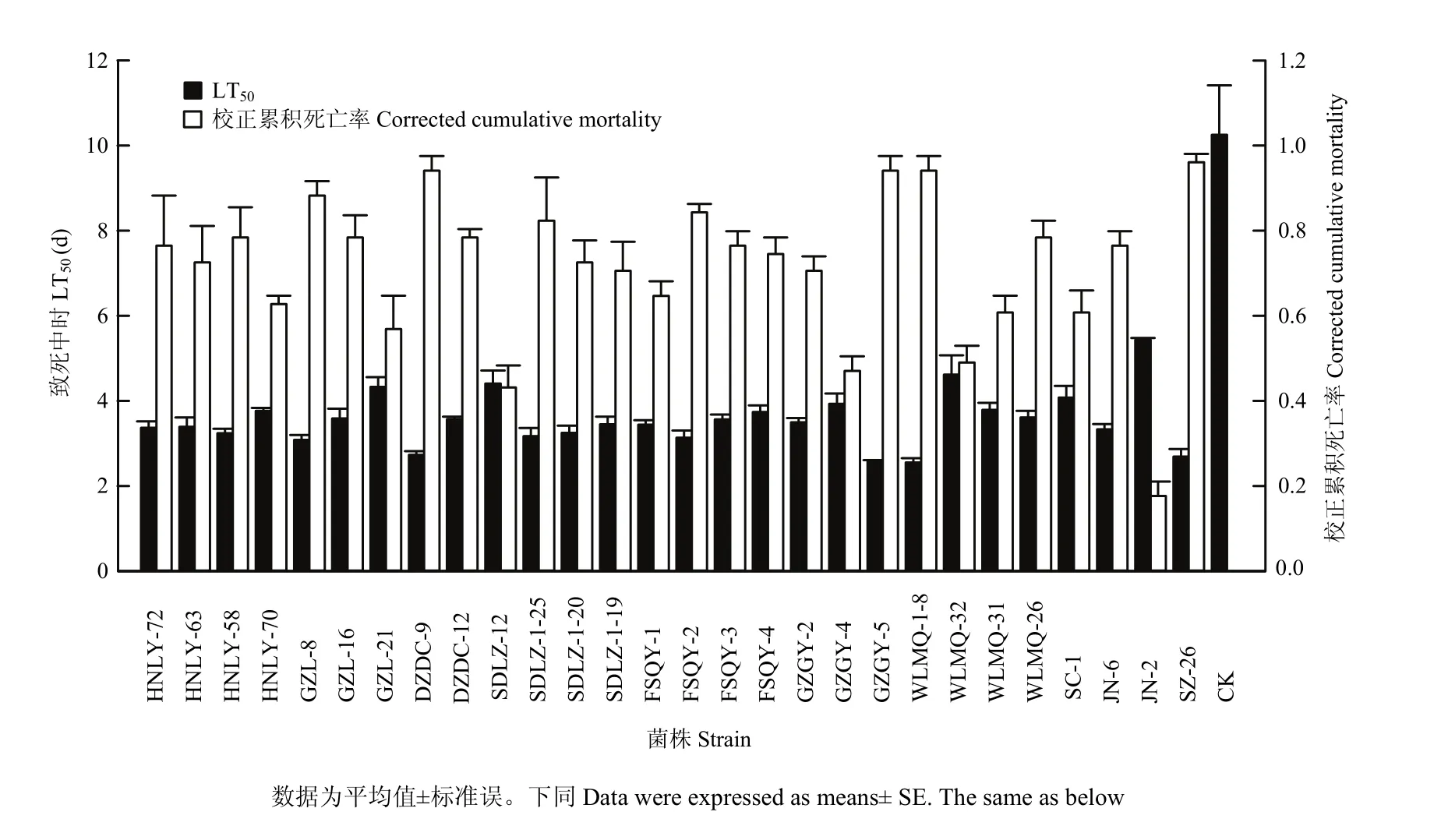
图1 28株球孢白僵菌对西花蓟马成虫致死中时和第5天校正累积死亡率Fig. 1 LT50and corrected cumulative mortality of 5 days post treatment of 28 strains against adult F. occidentalis in the laboratory
2.2高毒力球孢白僵菌在不同培养基上的产孢量
在两种产孢培养基上,4株球孢白僵菌的产孢量均存在显著差异(CMA培养基:F=334.457,df=2,8;P<0.01;SDAY培养基:F=212.586,df=2,8;P<0.01),但无论采用哪种产孢培养基,菌株 DZDC-9的产孢量均显著高于其他3株。对于同一菌株,采用不同产孢培养基在相同培养条件下进行产孢量测定,结果显示4株菌株在CMA培养基中的产孢量均明显高于SDAY培养基,所以选择CMA培养基为接种产孢培养基,菌株DZDC-9为继代培养菌株(图2)。

表2 不同培养基继代培养白僵菌菌株对西花蓟马成虫LT50的影响Table 2 LT50of different generations of continuous subculture of B. bassiana growing on different culture media against adult F. occidentalis
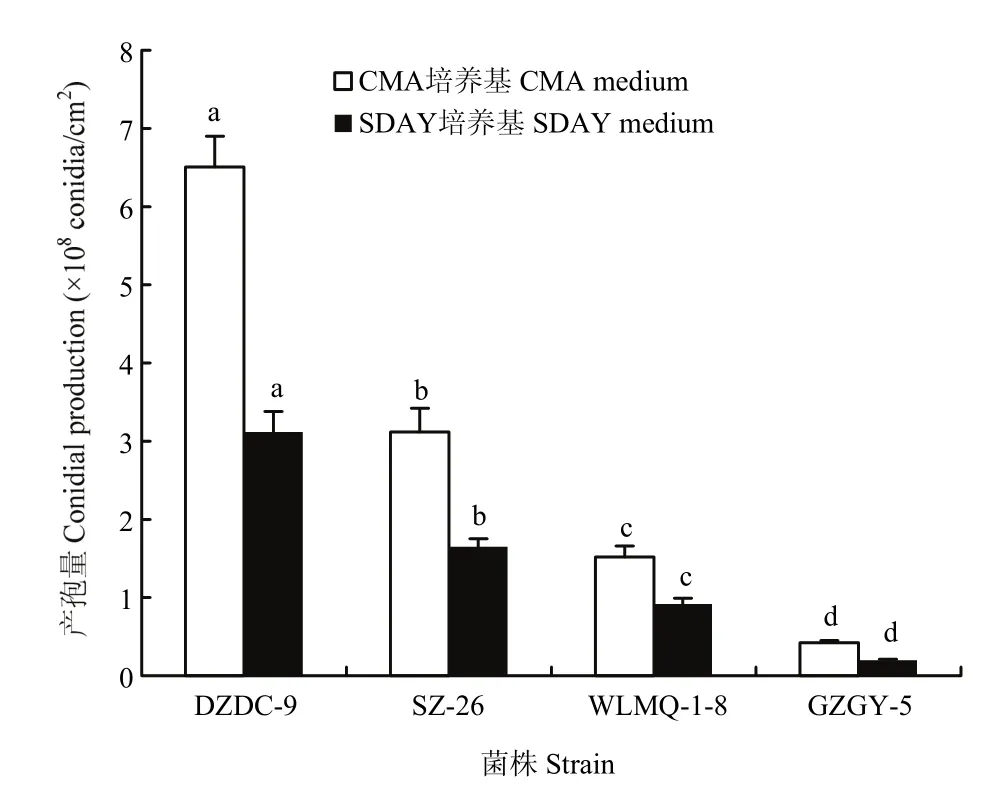
图 2 4株对西花蓟马高毒力的球孢白僵菌在 CMA和 SDAY产孢培养基上的产孢量Fig. 2 Conidial production of 4 highly virulent strains against adult F. occidentalis growing on SDAY and CMA media
2.3不同培养基继代培养的白僵菌菌株对西花蓟马的毒力
各不同培养代数白僵菌菌株对西花蓟马均表现出较好的致病效果。经过CMA培养基培养得到的各菌株不同培养代数对西花蓟马的致病力呈现下降趋势,从第 3代开始致病力显著降低, LT50由第1代的2.55 d上升至第5代的 3.40 d,延长33.33%;西花蓟马的校正累积死亡率也由第1代的93.62%降至第5代的65.96%;添加蝉蜕的CMA培养基培养得到的各菌株不同培养代数对西花蓟马的致病力则没有显著差异;而添加西花蓟马虫尸粉的 CMA 培养基培养得到的各菌株不同培养代数对西花蓟马的致病力有一定的增强趋势,LT50由第1代的2.80 d降至第5代的2.36 d,降低15.7%,对西花蓟马的校正累积死亡率没有变化(表2、表3)。
2.4不同继代培养的白僵菌菌株产孢量变化
将菌株DZDC-9在3种培养基中连续培养5代,对于每种培养基,产孢量和培养代数拟合曲线 y= a ln(x)+b,y代表产孢量(108个孢子/cm2),x代表培养代数;a与b为建模参数。菌株在不同培养基中产孢量随培养代数呈现指数增长或下降趋势(图 3),在CMA培养基中菌株产孢量与继代培养代数符合模型y = -1.657ln(x)+8.0222(R2=0.9456)。随着培养代数的增加呈现一定下降趋势,而当在CMA培养基中添加0.5%蝉蜕或0.5%西花蓟马虫尸粉时,菌株产孢量与继代培养代数符合模型y=1.1574ln(x)+10.58(R2= 0.9972)与y=1.1364ln(x) +10.232(R2=0.9846)。产孢量则随着培养代数的增加呈现缓慢的上升趋势,最后趋于稳定。菌株DZDC-9继代培养之后,产孢量能很好地拟合方程 y=aln(x)+b,其 R2均>0.94。对相同培养代数不同培养基培养的菌株产孢量进行方差分析(表4),可见在CMA培养基中添加0.5%蝉蜕或者 0.5%西花蓟马虫尸粉对白僵菌产孢量没有显著性差异,但明显高于菌株在 CMA培养基中的产孢量。
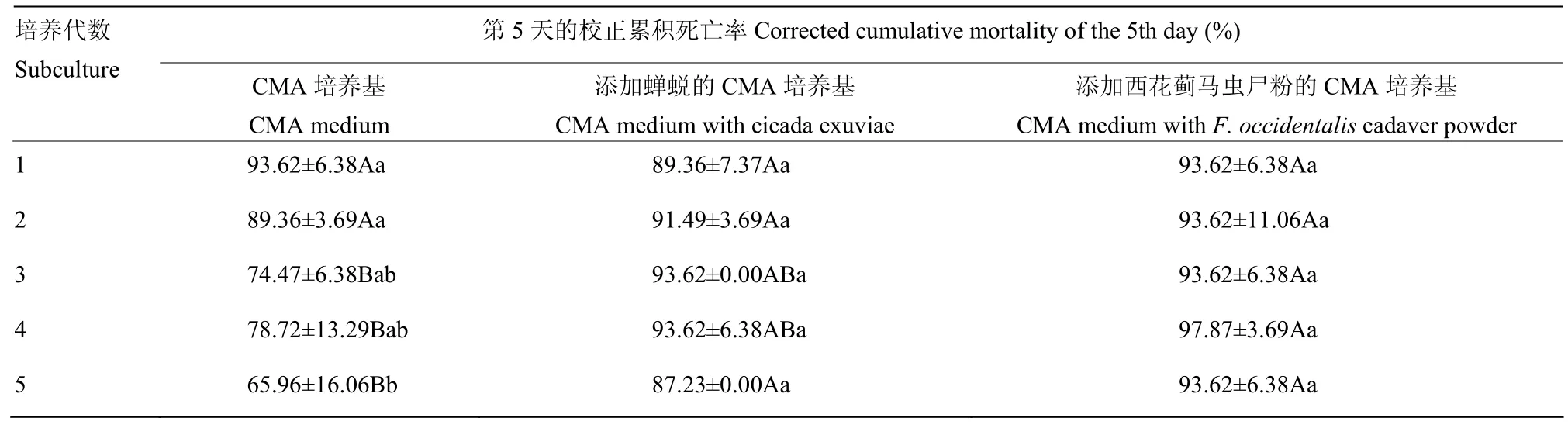
表3 不同培养基继代培养白僵菌对西花蓟马成虫死亡率的影响Table 3 Corrected cumulative mortality of different generations of continuous subculture of B. bassiana growing on different culture media against adult F. occidentalis

表4 球孢白僵菌菌株在不同培养基上连续继代培养5代产孢量的变化Table 4 Conidial production of the 1st to 5th generations of continuous subculture of strain DZDC-9 on different media
2.5产孢量与毒力相关性分析
将不同培养基培养得到的不同培养代数白僵菌菌株产孢量与其对西花蓟马的LT50进行回归分析,拟合曲线如图4所示,y=-0.831ln(x)+4.6694,y代表LT50,x代表产孢量(1×108个孢子/cm2),相关系数为0.7206;产孢量与毒力存在一定的相关性,产孢量相对较高的菌株对西花蓟马成虫的致病力相对较高,LT50值相对较小,因此,对于同一菌株可以根据其产孢量的变化判断其在不同培养条件下相对毒力的变化。
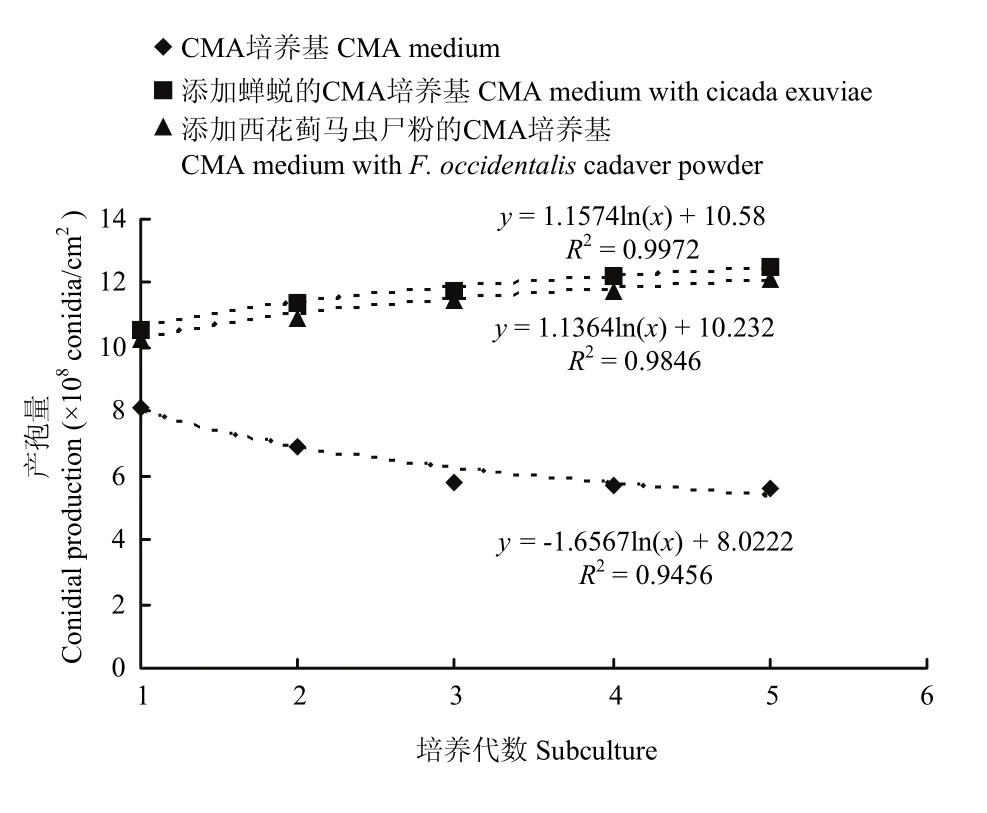
图3 球孢白僵菌DZDC-9在不同培养基上连续继代培养与产孢量的关系Fig. 3 Relationship between subcultures and conidial production of B. bassiana strain DZDC-9 obtained from different media
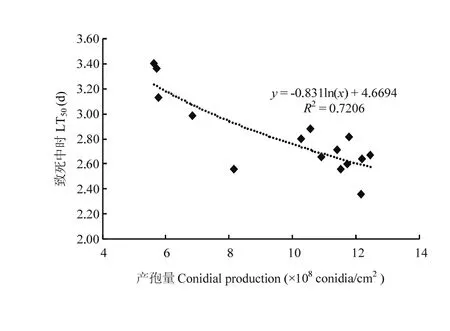
图4 球孢白僵菌DZDC-9产孢量与致病性的相关性Fig. 4 Relationship between virulence against adult F. occidentalis and conidial production of B. bassiana strain DZDC-9
3 讨论
白僵菌作为一种生防真菌,在农业害虫防治中具有重要的地位,白僵菌菌株在继代培养中会出现菌株变异和退化现象,高毒力菌种选育和毒力稳定性保持是白僵菌生物防治应用的前提,但如何能够长久地维持其毒力和产孢能力则是白僵菌在应用中的关键技术。经过筛选得到4株对西花蓟马有高毒力的菌株,通过对这 4株高毒力菌株产孢量比较发现,菌株DZDC-9的产孢量显著高于其他3株,各不同高毒力菌株在CMA培养基上的产孢量显著高于SDAY培养基,这与张璐璐等[28]在白僵菌大规模生产中的结果类似。通过对白僵菌菌株的继代培养发现,连续使用CMA培养基培养得到的白僵菌分生孢子对西花蓟马的毒力和产孢量均呈下降趋势,且从第3代开始呈现明显的下降趋势,而当在CMA培养基中添加适量的蝉蜕或者西花蓟马虫尸粉时则能增加产孢量,稳定白僵菌菌株毒力。菌株发生变异的主要原因是菌株本身遗传物质改变。菌株不同基因型核比例受环境条件尤其是培养条件的影响,张志光等[29]研究发现自然界中的白僵菌是以异核形式存在的,但是异核体不稳定,可以通过人工培养基培养的方法改变异核体内核的比例;蔡国贵等[18]研究发现白僵菌菌株在营养丰富的培养基中生长相对稳定,在营养贫瘠的培养基中生长则容易变异,当在培养基中添加松毛虫和木毒蛾虫尸粉时则可以有效控制白僵菌对松毛虫和木毒蛾的毒力退化。不同培养基通过影响白僵菌菌株酶的表达水平引起菌株毒力的变化,李会平等[30]研究发现白僵菌菌株产酶能力与其对桑天牛幼虫的毒力呈正相关关系,而培养基成分和培养条件会影响白僵菌菌株的产酶能力。经过添加蝉蜕和西花蓟马虫尸粉继代培养得到的孢子粉的毒力能够稳定遗传并略有增强,这可能是由于昆虫表皮成分中含有能够诱导水解酶产生的特殊基质,经过诱导培养提高了白僵菌菌株的产酶能力,进而增强了菌株毒力。
本研究通过模型直观模拟了CMA培养基与添加蝉蜕、西花蓟马虫尸的CMA培养基上,球孢白僵菌菌株DZDC-9经过连续5代继代培养产孢量和培养代数的相关关系,并对相同代数的不同培养基的产孢量进行显著性检验。通过模型可以发现添加蝉蜕或西花蓟马虫尸粉的培养基继代培养得到的白僵菌对西花蓟马的产孢量和毒力有一定的增强作用。单纯以 CMA培养基继代培养白僵菌产孢量随培养代数呈现指数下降,而在培养基中添加蝉蜕或西花蓟马虫尸粉白僵菌产孢量则随培养代数呈现指数上升,已有报道表明蝉蜕等可以诱导白僵菌产孢相关蛋白的表达[31],从而提高白僵菌菌株的产孢量。蝉蜕和西花蓟马的虫尸粉中含有大量的几丁质,可以促进分生孢子的产生,而其中蕴含的磷脂与蛋黄素可以促进分生孢子的萌发,有利于球孢白僵菌的有效侵染,稳定甚至增强菌株毒性[32]。经过西花蓟马虫尸粉培养得到的白僵菌孢子粉对西花蓟马的毒力略高于经过蝉蜕培养得到的孢子粉对西花蓟马的毒力。胡景江等[33]通过研究白僵菌胞外蛋白酶与其毒力的关系,发现培养基中添加虫尸粉后白僵菌产酶水平提高。这可能是白僵菌经过西花蓟马虫尸粉培养后对西花蓟马的专化性更强,同时西花蓟马虫尸内含有更多的蛋白质和某些特殊营养成分更适合白僵菌的生长(或刺激蛋白酶合成所需),有利于菌株的复壮。因此,可在培养基中添加适量的虫尸粉和蝉蜕粉,以提高菌株的活力,但培养基中虫尸粉和蝉蜕粉的含量还有待于进一步研究。本研究在室内条件下对其他 3株高效球孢白僵菌菌株 SZ-26、WLMQ-1-8、GZGY-5进行连续5代继代培养,采用相同方法对菌株进行复壮,结果也显示连续复壮5代后,虫尸粉和蝉蜕粉复壮法菌株产孢和毒力恢复效果最好。综合考虑,在产孢培养基中添加适量的虫尸粉和蝉蜕粉对退化菌株的产孢和毒力恢复效果较好且有很好的稳定性。
李农昌等[34]对不同培养基和培养条件下得到的白僵菌孢子粉进行产孢量和毒力的比较,发现产孢量与毒力之间存在相关性。本研究对白僵菌菌株产孢量与毒力进行相关性分析发现,产孢量与毒力之间存在一定的正相关关系。同一菌株产孢量可以作为菌株毒力筛选评价的一个重要指标。
4 结论
通过对西花蓟马有高毒力的白僵菌菌株的筛选和连续继代培养,筛选出一株对西花蓟马高毒力的菌株DZDC-9,通过曲线模拟对球孢白僵菌继代培养与菌株产孢量和毒力进行了相关分析,产孢培养基中加入蝉蜕和西花蓟马虫尸粉能够维持菌株产孢特性,延缓毒力退化趋势。
References
[1] Kirk W D, Terry L I. The spread of the western flower thrips Frankliniella occidentalis (Pergande). Agricultural and Forest Entomology, 2003, 5(4): 301-310.
[2] REITZ S R, Gao Y L, LEI Z R. Thrips: pests of concern to China and the United States. Agricultural Sciences in China, 2011, 10(6):867-892.
[3] 郑长英, 刘云虹, 张乃芹, 赵希丽. 山东省发现外来入侵有害生物——西花蓟马. 青岛农业大学学报(自然科学版), 2007, 24(3):172-174. ZHENG C Y, LIU Y H, ZHANG N Q, ZHAO X L. Invaded insect pest-Frankliniella occidentalis first reported in Shandong Province. Journal of Qingdao Agricultural University (Natural Science), 2007,24(3): 172-174. (in Chinese)
[4] 吕要斌, 张治军, 吴青君, 杜予洲, 张宏瑞, 于毅, 王恩东, 王铭华,王满囷, 童晓立, 吕立华, 谭新球, 付卫东. 外来入侵害虫西花蓟马防控技术研究与示范. 应用昆虫学报, 2011, 48(3): 488-496. LÜ Y B, ZHANG Z J, WU Q J, DU Y Z, ZHANG H R, YU Y, WANG E D, WANG M H, WANG M Q, TONG X L, LÜ L H, TAN X Q, FU W D. Research progress of the monitoring, forecast and sustainable management of invasive alien pest Frankliniella occidentalis in China. Chinese Journal of Applied Entomology, 2011, 48(3): 488-496. (in Chinese)
[5] REITZ S R, YEARBY E L, FUNDERBURK J E, STAVISKY J,MOMOL M T, OLSON S M. Integrated management tactics for Frankliniella thrips (Thysanoptera: Thripidae) in field-grown pepper. Journal of Economic Entomology, 2003, 96(4): 1201-1214.
[6] 雷仲仁, 问锦曾, 王音. 危险性外来入侵害虫——西花蓟马的鉴别、危害及防治. 植物保护, 2004, 30(3): 63-66. LEI Z R, WEN J Z, WANG Y. The identification, damage and control of an invasive western flower thrips (Frankliniella occidentalis). Plant Protection, 2004, 30(3): 63-66. (in Chinese)
[7] HELYER N L, BROBYN P J. Chemical control of western flower thrips (Frankliniella occidentalis Pergande). Annals of Applied Biology, 1992, 121(2): 219-231.
[8] NIASSY S, MANIANIA N K, SUBRAMANIAN S, GITONGA L M,MBURU D M, MASIGA D, EKESI S. Selection of promising fungal biological control agent of the western flower thrips Frankliniella occidentalis (Pergande). Letters in Applied Microbiology, 2012, 54(6):487-493.
[9] SHAH F A, ALLEN N, WRIGHT C J, BUTT T M. Repeated in vitro subculturing alters spore surface properties and virulence of Metarhizium anisopliae. FEMS Microbiology Letters, 2007, 276(1):60-66.
[10] WANG C S, BUTT T M, ST LEGER R J. Colony sectorization of Metarhizium anisopliae is a sign of ageing. Microbiology, 2005,151(10): 3223-3236.
[11] 徐金柱, 黄勃, 李增智. 球孢白僵菌单孢子分离株在继代培养过程中菌落局变的遗传分析. 菌物学报, 2010, 29(2): 279-284. XU J Z, HUANG B, LI Z Z. Genetic analysis of colony sectorization of Beauveria bassiana single-spore isolates during subculturing. Mycosystema, 2010, 29(2): 279-284. (in Chinese)
[12] JACOBSON R J, CHANDLER D, FENLON J, RUSSELL K M. Compatibility of Beauveria bassiana (Balsamo) Vuillemin withAmblyseius cucumeris Oudemans (Acarina: Phytoseiidae) to control Frankliniella occidentalis Pergande (Thysanoptera: Thripidae) on cucumber plants. Biocontrol Science and Technology, 2001, 11(3):391-400.
[13] UGINE T A, WRAIGHT S P, BROWNBRIDGE M, SANDERSON J P. Development of a novel bioassay for estimation of median lethal concentrations (LC50) and doses (LD50) of the entomopathogenic fungus Beauveria bassiana, against western flower thrips,Frankliniella occidentalis. Journal of Invertebrate Pathology, 2005,89(3): 210-218.
[14] SAFAVI S A, SHAH F A, PAKDEL A K, RASOULIAN G R,BANDANI A R, BUTT T M. Effect of nutrition on growth and virulence of the entomopathogenic fungus Beauveria bassiana. FEMS Microbiology Letters, 2007, 270(1): 116-123.
[15] 唐晓庆, 樊美珍, 李增智. 球孢白僵菌继代培养中菌落局变现象及环境影响因素的研究. 真菌学报, 1996, 15(3): 188-196. TANG X Q, FAN M Z, LI Z Z. Study on saltation of Beauveria bassiana, an important entomogenous fungus subcultured in different conditions. Acta Mycologica Sinica, 1996, 15(3): 188-196. (in Chinese)
[16] XU J Z, HUANG B, QIN C S, LI Z Z. Sequence and phylogenetic analysis of Beauveria bassiana with mitochondrial genome. Mycosystema, 2009, 28(5): 718-723.
[17] 汪黎明, 陈雪, 徐延平, 胡晓磊, 何灵敏, 黄勃, 李增智. 一株球孢白僵菌转基因工程菌在继代培养中的变异. 菌物学报, 2011, 30(5):738-743. WANG L M, CHEN X, XU Y P, HU X L, HE L M, HUANG B, LI Z Z. Variation of a transgenic strain of Beauveria bassiana during subculturing. Mycosystema, 2011, 30(5): 738-743. (in Chinese)
[18] 蔡国贵, 林庆源, 徐耀昌, 黄芙蓉, 陈金标. 白僵菌菌株退化与培养条件关系及其控制技术. 福建林学院学报, 2001, 21(1): 76-79. CAI G G, LIN Q Y, XU Y C, HUANG F R, CHEN J B. The relationship between culture condition and strain degeneration of Beauveria bassiana and its control technique. Journal of Fujian College of Forestry, 2001, 21(1): 76-79. (in Chinese)
[19] 樊美珍, 李增智, 唐晓庆. 白僵菌菌种退化及其控制. 安徽农业大学学报, 1996, 23(3): 239-245. FAN M Z, LI Z Z, TANG X Q. Strain degeneration and its control of Beauveria bassiana. Journal of Anhui Agricultural University, 1996,23(3): 239-245. (in Chinese)
[20] JAMES R R. Effects of exogenous nutrients on conidial germination and virulence against the silverleaf whitefly for two Hyphomycetes. Journal of Invertebrate Pathology, 2001, 77(2): 99-107.
[21] SHAH F A, BUTT T M. Influence of nutrition on the production and physiology of sectors produced by the insect pathogenic fungus Metarhizium anisopliae. FEMS Microbiology Letters, 2005, 250(2):201-207.
[22] FURLANETO M C, PAIÃO F G, PINTO F G, FUNGARO M H. Transformation of the entomopathogenic fungus Metarhizium flavoviride to high resistance to benomyl. Canadian Journal of Microbiology, 1999, 45(10): 875-878.
[23] ANSARI M A, BUTT T M. Effects of successive subculturing on stability, virulence, conidial yield, germination and shelf-life of entomopathogenic fungi. Journal of Applied Microbiology, 2011,110(6): 1460-1469.
[24] 李会平, 黄大庄, 杜邵华, 高洁. 白僵菌经不同基质传代后对桑天牛幼虫的侵染力比较. 蚕业科学, 2008, 34(2): 339-341. LI H P, HUANG D Z, DU S H, GAO J. Comparative infectivity of different passage reisolates of Beauveria bassiana to Apriona germari larvae. Science of Sericulture, 2008, 34(2): 339-341. (in Chinese)
[25] 关兵兵, 王冰, 刘艳微, 孟鑫睿, 李晓慧, 张佳诗, 徐文静, 李启云,冯树丹, 张正坤. 蝉蜕诱导对球孢白僵菌生物学特性及其毒力影响的研究. 中国农学通报, 2014, 30(34): 51-55. GUAN B B, WANG B, LIU Y W, MENG X R, LI X H, ZHANG J S,XU W J, LI Q Y, FENG S D, ZHANG Z K. Research on effect on biological characteristics and virulence of Beauveria bassiana induced by Periostracum Cicadae. Chinese Agricultural Science Bulletin, 2014,30(34): 51-55. (in Chinese)
[26] 李娟, 吴圣勇, 王晓青, 王帅宇, 雷仲仁. 防治西花蓟马的球孢白僵菌菌株筛选及耐热性测定. 中国生物防治学报, 2015, 31(6):845-852. LI J, WU S Y, WANG X Q, WANG S Y, LEI Z R. Screening of Beauveria bassiana strains against Frankliniella occidentalis and their conidial thermotolerance. Chinese Journal of Biological Control, 2015,31(6): 845-852. (in Chinese)
[27] WU S Y, GAO Y L, XU X N, GOETTEL M S, LEI Z R. Compatibility of Beauveria bassiana with Neoseiulus barkeri for control of Frankliniella occidentalis. Journal of Integrative Agriculture, 2015, 14(1): 98-105.
[28] 张璐璐, 吴圣勇, 王帅宇, 李娟, 雷仲仁. 防治蓟马的球孢白僵菌SDDZ-9菌株液体发酵工艺优化. 中国农业科学, 2015, 48(15):2985-2994. ZHANG L L, WU S Y, WANG S Y, LI J, LEI Z R. Optimization of fermentation process of Beauveria bassiana of SDDZ-9 against Frankliniella occidentalis. Scientia Agricultura Sinica, 2015, 48(15):2985-2994. (in Chinese)
[29] 张志光, 李建宗, 欧笑兰, 徐正平, 刘敏颂. 白僵菌生活史的研究——()Ⅱ异核体的形成和准性生殖的显微摄影观察. 湖南师范大学自然科学学报, 1981(2): 38-44. ZHANG Z G, LI J Z, OU X L, XU Z P, LIU M S. Life history research of Beauveria bassiana-() Photomicrography observation of forming Ⅱthe nucleus and associate different sexual reproduction. Journal of Natural Science of Hunan Normal University, 1981(2): 38-44. (in Chinese)
[30] 李会平, 黄大庄, 王志刚, 郑建伟, 黄秋娴. 不同基质传代白僵菌菌株胞外蛋白酶和几丁质酶产生水平与菌株对桑天牛幼虫毒力的关系. 蚕业科学, 2008, 34(3): 521-524. LI H P, HUANG D Z, WANG Z G, ZHENG J W, HUANG Q X. Relationships between extracellular protease and chitinase activity level of different successive reisolates of Beauveria bassiana and virulence against the Apriona germari larvae. Science of Sericulture,2008, 34(3): 521-524. (in Chinese)
[31] FANG W, LENG B, XIAO Y, JIN K, MA J, FAN Y, FENG J, YANG X, ZHANG Y, PEI Y. Cloning of Beauveria bassiana chitinase gene Bbchit1 and its application to improve fungal strain virulence. Applied & Environmental Microbiology, 2005, 71(1): 363-370.
[32] LOHMANN U, SIKORA R A, HÖFER M. Influence of phospholipids on growth, sporulation and virulence of the endoparasitic fungi Drechmeria coniospora, Verticillium balanoides, and Harposporium anguillulae, in liquid culture. Journal of Phytopathology, 1989,125(2): 139-147.
[33] 胡景江, 樊美珍. 球孢白僵菌胞外蛋白酶与其毒力的关系. 安徽农业大学学报, 1996, 23(3): 273-278. HU J J, FAN M Z. Relation between extracellaluar protease of Beauveria bassiana and its virulence to Dendrolimus punctatus. Journal of Anhui Agricultural University, 1996, 23(3): 273-278. (in Chinese)
[34] 李农昌, 樊美珍, 李春如, 李华, 高智辉, 朱润德. 白僵菌有关培养条件及其与毒力关系的研究. 安徽农业大学学报, 1996, 23(3):254-259. LI N C, FAN M Z, LI C R, LI H, GAO Z H, ZHU R D. Relationship between culture condition and virulence of Beauveria bassiana. Journal of Anhui Agricultural University, 1996, 23(3): 254-259. (in Chinese)
(责任编辑 岳梅)
Influence of Subculture on Virulence to Frankliniella occidentalis and Conidial Production of the Entomopathogenic Fungus Beauveria bassiana
ZHANG Hui, WU Sheng-yong, LI Juan, ZHANG Lu-lu, ZHANG Lin-ya, LEI Zhong-ren
(State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193)
【Objective】The objective of this study is to assess the capability of the Beauveria bassiana against Frankliniella occidentalis in the field, and explore the influence of subculture on virulence and conidial production of the B. bassiana, propose an effective method for preventing the retrogression during successive subculture, and provide a basis for the large-scale production technology of B. bassiana. 【Method】 The virulence of 28 fungal strains to adult F. occidentalis was evaluated by soaking method with B. bassiana concentration of 1×107conidia/mL in the laboratory. The adults were dipped for 5 s in the conidial suspension. Conidial production of the 4 high virulent strains was measured on corn meal agar (CMA) medium and sabouraud dextrose agar yeast (SDAY) medium, screening high conidial production strain and spore production medium by comparing conidial production of different strains on different media. Subsequently, strain DZDC-9 was subcultured on three media (CMA medium, CMA medium with cicada exuviae, and CMA medium with F. occidentalis cadaver powder) to compare its virulence and conidial production over five subcultures. The relationship between conidial production and virulence was analyzed. 【Result】Among 28 strains of entomopathogenic fungi B. bassiana tested for virulence against F. occidentalis in laboratory bioassays, strains DZDC-9, GZGY-5,WLMQ1-8 and SZ-26 were found as the most potent. The corrected cumulative mortalities were over 90% after 5 days, and LT50<3 d. Conidial production obtained from the CMA medium of each strain was higher than from SDAY medium, and strain DZDC-9 had the higher conidial production among the four strains. The results demonstrated that the virulence of strain DZDC-9 declined with successive subculture. However, when the strain was subcultured on the CMA medium with 0.5% cicada exuviae or 0.5% F. occidentalis cadaver powder as an additive, the virulence increased with successive subculture. Conidial production was not significantly different between the same generation subculture on CMA medium with cicada exuviae and CMA medium with F. occidentalis cadaver powder, but they were significantly greater than conidial production obtained from CMA medium. A positive correlation was found between sporulation and virulence of B. bassiana conidia under different media and culture conditions. 【Conclusion】The potential of B. bassiana strain DZDC-9 for the control of F. occidentalis was studied, and proposed an effective method for stabilizing the virulence and sporulation of B. bassiana. Conidial production could be used as an indicator for virulence evaluation.
Frankliniella occidentalis; Beauveria bassiana; subculture; virulence; conidial production
2016-03-28;接受日期:2016-05-20
国家大宗蔬菜产业技术体系(CARS-25-B-07)、韭菜安全生产关键技术研究及科技示范基地建设(Z151100001215009)联系方式:张慧,E-mail:huizhang0926@sina.com。通信作者雷仲仁,Tel:010-62815930;E-mail:leizhr@sina.com
