关于心室复极顺序的错误表述
——浅谈心室除复极过程与QRS-T同向机制
2016-09-15袁杰
袁杰
关于心室复极顺序的错误表述
——浅谈心室除复极过程与QRS-T同向机制
袁杰
传统观点认为QRS-T同向是由于“先除极的地方后复极”,这是除、复极概念上的混淆,是把3相当成了复极的全部,把2相当成了除极的延续,把复极进程的差异归于外因,而忽略了心室肌本身在细胞电生理特点上的巨大差异。实际上,先除极的地方必然先复极,但后除极的地方复极更快、结束更早,使整个心室的膜电位梯度指向外膜,故QRS向量与T向量大致同向。
心室复极;QRS-T同向;电生理异质性
R540.41
A
2095-9354(2016)04-0291-03
1 传统教科书对心室复极顺序的不严谨表述
由人民卫生出版社出版的“十二五”普通高等教育本科国家级规划教材《诊断学》(第八版)在“心电图产生原理”章节中指出:在正常的体表心电图上记录到的复极波方向与除极波主波方向一致,与单个心肌细胞不同,这是因为正常人心室的除极是从心内膜下心肌开始然后向心外膜推进,而复极则是从较晚除极的心外膜下心肌开始并向心内膜方向进行[1]。
这即是传统教科书中概括性表述“先除极的地方后复极”的含义,即整个心室的除极复极顺序相反,而除极复极的电偶极性相反,故复极向量与除极向量同向。同时,传统观点认为是压力、温度和心肌供血等影响心室肌代谢的因素造成了这种改变:心内膜下心肌由于受到心室射血时的反作用力,压力较高;而心外膜下心肌由于周围受脂肪包绕,温度较高;且由于冠状动脉在心室肌内的走行是由外至内,外膜下心室肌供血较好。综上几点,心外膜下心肌的代谢状况较好,所以心内膜下心肌先除极但后复极,心外膜下心肌后除极却先复极。
笔者认为这种表述方式是不严谨的,因为它直接混淆了细胞电生理中整个除复极程序的基本概念,且忽视了各部位心室肌细胞本身的电生理异质性的影响。
2 QRS-T同向机制的细胞电生理基础
2.1心室肌细胞动作电位曲线的组成与特点
所有的心室肌细胞均为快反应非自律细胞,其动作电位曲线为连续的五个部分:0相、1相、2相、3相、4相,其特征是除极迅速(0相,1~2 ms),复极缓慢而复杂(1、2、3相,总计200~300 ms),复极完成后进入静息期(4相)[2]。
心室肌细胞兴奋时,由于快钠通道的快速大量激活并迅速失活,造成瞬间的细胞外钠离子循电化学梯度快速内流,形成动作电位曲线的0相,膜电位由静息时的-90 mV骤升至约+30 mV,历时仅1~2 ms。1相为快速复极初期,由瞬时性外向离子流(Ito,主要为钾离子)引起,膜电位由+30 mV复极化至约0 mV,历时约10 ms。随后复极过程突然变得非常缓慢,形成平台期,即2相,膜电位稳定于约0 mV,持续约100~150 ms,是心室肌细胞动作电位时程(APD)较长的主要原因。2相由钠钙离子缓慢内流(L型钙流及晚钠电流)和少量钾离子缓慢外流(延迟整流钾流)形成,两者处于相对平衡状态。2相晚期钙通道逐渐失活,钾离子外流增加并呈再生性循环,形成净外向电流,进入3相即快速复极末期,膜电位由约0 mV逐步复极至约-90 mV,历时100~150 ms。在4相,膜电位稳定于约-90 mV,但细胞膜的离子转运机制加强,使细胞内外各离子浓度梯度得以恢复,保障细胞的正常兴奋性。
2.2心室肌细胞的分类与电生理异质性
心室肌细胞可分为心内膜下心肌细胞、心外膜下心肌细胞和中层M细胞,其0相均为1~2 ms,但1、2、3相的时程、形态和电位高低变化均有显著的不均一性(图1)[2]。如心外膜下心肌Ito幅度大,1相复极化明显,与2相初期形成“锋和圆顶”,并影响了2相平台期的长短;心内膜下心肌细胞1相不显著,而两种钙流ICa-L和ICa-T都大于心外膜下心肌细胞,因此APD较长;M细胞的ICa-L和晚钠电流INa-L更强而Iks较弱,故APD时程最长,并有更明显的APD慢频率依赖性延长;室壁中层与心内膜下心肌的电耦联较好,通过电紧张的影响,使心内膜下心肌细胞APD比心外膜下心肌细胞长(图2)。除了跨室壁离散,在心室同一层次不同区域的心肌细胞APD也有很大差异,如左室长于右室,心尖部远长于心底部(后者的IK离子流幅值远大于前者),形成跨部位离散。

各层心肌的动作电位形态有差异,复极时间有明显差异,且动作电位时程随刺激频率(Hz)的加快而缩短
2.3ST-T形成与心室肌细胞动作电位曲线的关系
在单个的心室肌细胞上,其细胞膜各部位之间并无明显的电生理异质性,且先除极的地方必然先复极,因除复极电偶极性相反,故复极波与除极波反向。对整个心室而言,仍然只能是先除极的部位先复极,这是由动作电位曲线的连续性所决定的,因为每个心肌细胞的0相除极仅仅1~2 ms,一旦发生,瞬间就会结束而进入漫长的1~3相复极过程。除极顺序就是0相在各心室肌细胞之间传导的先后顺序,可以说0相在整个心室的传导顺序一经形成,复极的发生顺序也随之确立,但这并不是在体心肌各部位复极进入3相及复极结束的顺序。假如所有心肌细胞不存在电生理异质性,那么心室各处进入1~4相的顺序仍会与除极相同,相当于一个功能上的合胞体,将产生与除极向量方向相反的复极向量,最终投影在心电图上呈现T波倒置。但是,心室复极化差异的存在使得实际情况与单细胞时有所不同,这也是心电图上ST-T形成的细胞电生理学基础。
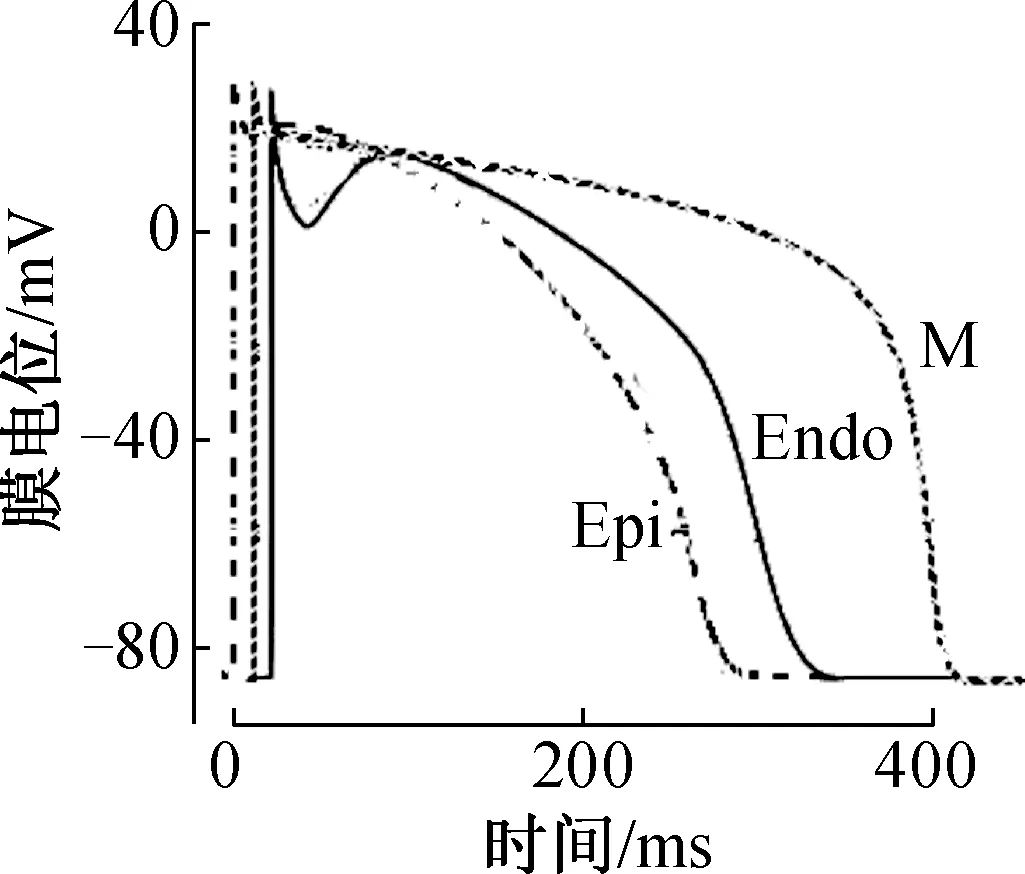
图2 心室肌各层细胞动作电位示意图
心电图是心肌细胞电活动的总和,即综合心电向量在体表的反映。心室复极在时间上具有连续性,在空间上呈三维扩布,其形成的综合心电向量受以下因素影响:各处心肌细胞固有的APD跨室壁离散和跨部位离散、进入复极的先后顺序、处于同一膜电位值的心肌细胞数。复极进程依赖于心室肌细胞膜的自身离子流变化,它决定了各心室肌细胞1~3相的时程和坡度(尤其是2相和3相的跨室壁离散和跨部位离散);而后者与各部位心室肌0相结束的先后顺序及时差,共同决定了每一时刻心室复极各部位的膜电位值及彼此间电位差梯度的大小和方向,即产生了随时间呈特定变化趋势的无数的瞬时综合复极向量。可以说,有什么样的膜电位差演进趋势,就会形成什么样的综合心电向量,最终投影在各导联轴上形成什么样的ST-T形态。
J波:在全部心肌除极结束之前,已处于复极1相和2相的部位也会因膜电位的轻微不同而产生很小的心电向量,但被强大的除极向量抵消和掩盖,只有在QRS终末部分与ST段交界处可能会因心外膜下心肌Ito的增强而产生J波。
ST段:复极初期心室肌各部位均处于2相时,膜电位稳定在约0 mV,没有明显的膜电位梯度,故不产生ST向量,ST段在基线水平。如果有心肌疾病或缺血损伤等各种因素,使各部位心室肌2相的膜电位在空间上水平各异,或在时间连续性上各处不能同时处于2相,出现了明显的膜电位差,就会形成ST向量,ST段偏离基线。
T波:随着复极由2相末期进展到3相结束,因心室各部位及室壁各层之间膜电位演进趋势的不同而产生不断变化的膜电位差,从而形成T向量。T向量起始缓慢,与ST向量存在明显的延续性,终末部分相比于前期递减速度要快得多,在心电图上形成升支降支不对称的T波。
2.4离体及在体动物实验研究中T波与心室复极离散的关系
在离体心肌块的跨壁心电图研究中[3],心外膜下心肌细胞除极最晚,但其APD最短,于是最早进入3相,复极最快;心内膜下心肌细胞次之,中层M细胞复极最慢、结束最晚。因此,在2相后期及3相,中层M细胞的膜电位水平最高,与心内膜下和心外膜下心肌细胞之间均存在着不同的电位差,M细胞和心内膜下心肌的膜电位差在心外膜面记录是一个向下的波,而M细胞和心内膜下心肌的膜电位差在心外膜面记录是一个向上的波,两者的代数和是一个向上的波,与跨壁心电图的T波吻合。T波开始于心外膜下心肌与M细胞2相后期出现膜电位差时,随着3相两者电位差逐渐增大而反映为T波升支,在心外膜下心肌复极结束、两者电位差最大时T波达峰;心内膜下心肌和M细胞之间的膜电位差方向与心外膜下心肌和M细胞之间的膜电位差方向相反,故其限制了T波的振幅大小,并参与T波降支初期的形成;M细胞复极完毕时T波结束。在体动物实验的研究则显示:心室不同部位间最早的复极结束与T波达峰一致,而最晚的复极结束与T波结束一致;心室跨壁离散远小于心室的整体离散,而心室整体离散与Tp-Te相近[4];说明T波的形成机制可能与心室整体的复极离散关系更密切。
3 小结
传统观点所谓的“先除极的地方后复极”,显然是除复极概念上的混淆和错误,把3相复极当成了复极的全部,把2相平台期的复极当成了除极的延续,并忽略了1相的复极离散对2相平台期膜电位及时程的影响;把复极进程的差异归于外因(温度和压力),而忽略了内因(各部位心室肌本身在细胞电生理特点上的巨大差异,尤其是心室整体复极离散可能比跨壁离散更重要)。
因此,笔者认为对T波与QRS主波同向的机制应表述为: 先除极的地方先复极, 由于各处心室肌
细胞的电生理异质性,先除极部位的动作电位时程更长,进入3相及复极结束晚于后除极部位,使整个心室的膜电位梯度与除极时同向,故T向量与QRS向量方向一致。或者概括为“后除极的地方复极快、结束早”。
[1] 陈文彬,潘祥林.诊断学[M].8版.北京:人民卫生出版社,2013:483.
[2] 姚泰.生理学[M].6版.北京:人民卫生出版社,2005:132.
[3] Yan GX,Antzelevitch C.Cellular basis for the normal T wave and the electrocardiographic manifestations of the long-QT syndrome[J]. Circulation,1998,98(18):1928-1936.
[4] Opthof T,Coronel R,Wilms-Schopman FJ,et al. Dispersion of repolarization in canine ventricle and the electrocardiographic T wave:Tp-e interval does not reflect transmural dispersion[J]. Heart Rhythm,2007,4(3):341-348.
About the incorrect description of ventricular repolarization order: discussion on ventricular depolarization and repolarization process, and direction consistency mechanism of QRS-T
Yuan Jie
(Department of Cardiology, Union Hospital Affiliated to Tongji Medical College of Huazhong University of Science and Technology, Wuhan Hubei 430015, China)
In traditional opinion, the direction consistency of QRS-T is resulted from the fact that the location depolarized first is repolarized after. It confuses the concepts of depolarization and repolarization, in which 3 phases are mistakenly regarded as the whole of repolarization, 2 phases are taken as the continuation of depolarization, and the variation of repolarization process is attributed to external causes without noticing the huge difference of electrophysiologic features in ventricular myocytes. Actually, where is depolarized first is necessarily repolarized first, but where is depolarized after is repolarized faster and finishes earlier, which makes membrane potential gradient of the whole ventricle points to outer membrane. Therefore, the vectors of QRS and T orient to almost the same direction.
ventricular repolarization; direction consistency of QRS-T; electrophysiological heterogeneity
430015 湖北 武汉,华中科技大学同济医学院附属协和医院心内科
袁杰,主治医师,主要从事心脏电生理检查及心血管内科介入心脏病学方向的研究,E-mail:yuanjie1116@msn.com
探讨与争鸣
10.13308/j.issn.2095-9354.2016.04.017
2016-07-16)(本文编辑:李政萍)
