猪肉超氧化物歧化酶超高压失活动力学研究
2016-09-12黄业传李婷婷
孙 娟,黄业传,李婷婷
(西南科技大学 生命科学与工程学院,四川绵阳 621010)
猪肉超氧化物歧化酶超高压失活动力学研究
孙娟,黄业传*,李婷婷
(西南科技大学 生命科学与工程学院,四川绵阳 621010)
以猪背最长肌为材料,用不同压力(400~750 MPa)结合热(20~60 ℃)处理,以研究猪肉中超氧化物歧化酶(SOD)的超高压失活动力学情况。结果表明:在某一恒定的温度下(20 ℃≤T≤60 ℃),猪肉中SOD的失活速率常数k随着处理压力的增加而增大。各温度条件下的反应活化体积Va都是负值,表明随着压力的增加SOD失活速率常数在增大。SOD反应活化体积Va的绝对数值在40 ℃及60 ℃时达到最小,表明此温度下SOD超高压失活速率常数受压力影响最小,具有较高的压力稳定性。在实验压力范围之内(400 Mpa≤P≤750 Mpa),反应活化能Ea值总体呈减小趋势,说明随着压力的增加,温度对SOD失活速率常数的影响在减弱。
超高压,超氧化物歧化酶,猪肉,失活,动力学
高压处理是一种食品冷杀菌技术,与传统的热处理相比,它对食品的营养和感官品质破坏更小[1-3],能改变肉的营养、风味、凝胶性、嫩度[4-5]、色泽[6-10]等。高压处理也会产生对食品不利因素,如一定压力处理肉制品能加快脂肪氧化,从而导致肉制品品质败坏[11],而脂肪氧化产生游离自由基[12-15],影响肉质品的安全性,对人体健康造成威胁。目前高压处理对肌肉中脂肪氧化影响的研究比较多[16-18],但有关高压处理对肌肉中各种酶活性影响的研究却很少。动物肌肉中很多酶可能与高压处理下的脂肪氧化有关,如脂肪氧化酶、脂肪酶等能加速脂肪氧化或降解[19-20],但动物肌肉中的抗氧化酶,如过氧化氢酶、超氧化物歧化酶[21]、谷胱甘肽过氧化物酶等可以清除自由基、起到抑制或者减缓脂肪氧化的作用。
超氧化物歧化酶(SOD)是广泛存在于动植物、微生物中的一种酸性蛋白质,在抵御氧自由基导致的细胞损伤及修复受损细胞中起着重要作用。动物肌肉中的超氧化物歧化酶能清除自由基减缓脂肪氧化,酶活性越高,清除自由基的能力越强,肌肉保水能力就越高、颜色越鲜艳,肉的品质就越好。由此可见,超氧化物歧化酶对肉的品质具有很大的影响,而高压结合热处理对肌肉中的超氧化物歧化酶[22]是否有显著影响,有必要进行研究。因此本课题以猪背最长肌为材料,探究不同压力(400~750 MPa)结合热(20~60 ℃)处理后猪肉中超氧化物歧化酶(SOD)活性变化情况和动力学特征,为猪肉品质的研究、改善及加工贮藏过程中酶活性的控制奠定一定的理论基础。
1 材料与方法
1.1材料与仪器
四川绵阳市青义镇青义市场土猪,6~8个月月龄,体重80~110 kg,早上宰杀,取新鲜背最长肌约4 kg,快速运回实验室,去掉表面可见脂肪、筋膜及结缔组织,切成长宽高约1 cm左右的小块,迅速混合均匀后按每份10 g左右分装于透明聚乙烯包装袋中,并真空包装,在-20条件下冷冻备用。氯化钠四川成都市科龙化工试剂厂,分析纯;SOD试剂盒江苏南京建成生物工程研究所,分析纯。
HPP.L2-800/1型食品高压设备天津华泰森淼生物工程技术股份有限公司;DZ400-DZ(2L)型真空封装机四川成都瑞昌仪器制造有限公司;TDL-60B型低速台式离心机上海安亭科学仪器厂;FSH-2A型可调高速匀浆器金坛市金玻实验仪器厂;HH4型数显恒温水浴锅江苏常州澳华仪器有限公司;UV1000型单光束紫外可见分光光度计上海天美科学仪器有限公司。
1.2实验方法
1.2.1猪肉的超高压处理样品解冻24 h后按设定的压力(400~750 MPa),温度(20~60 ℃)和时间(5~20 min)进行处理,经处理的样品立即置于4 ℃冷藏待测,每组处理设置3个平行实验。超高压设备的工作参数为:压力范围0~800 MPa,升压速度约为50 MPa/s,卸压速度约为100 MPa/s。葵二酸二辛酯作为高压处理的传压介质。
1.2.2SOD活性测定取一定量高压处理后的猪肉组织,根据预实验所确定的最佳取样浓度制备上清液,在紫外可见分光光度计550 nm处测定吸光值,再通过吸光值及蛋白质含量计算出SOD的活力。根据试剂盒说明,每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活力单位(U)。
1.3数据分析方法
根据预实验,温度一定的情况下,酶失活速率常数k与高压处理时间t满足一阶反应动力学方程(1),本实验用一阶反应动力学来描述超氧化物歧化酶的超高压失活情况[23],对方程(1)进行积分得到方程(2),方程(1)、(2)如下所示:
dA/dt=-kA
式(1)
ln(A/A0)=-kt
式(2)
式中:A为高压处理时间为t时的样品酶活,U/mgprot;t为超高压处理时间,min;k为酶的失活速率常数,min-1;A0为高压处理时间为0时的样品酶活,U/mgprot。
由此,利用SPSS的线性回归程序,绘制出酶活力的自然对数ln(A/A0)与时间t的线性图,而相应温度或压力下猪肉中超氧化物歧化酶的失活速率常数k可以从线性图的斜率中求得。
在本实验中,用Eyring方程(3)和Arrhenius方程(4)来评价处理温度和压力对超氧化物歧化酶反应速率常数k的影响[24],具体表现为反应活化体积Va(cm3/mol)和反应活化能Ea(kJ/mol)。
式(3)
式(4)
式中:krefT,krefP为参考温度或压力下的失活速率常数,min-1;R为通用气体常数,8.314J/(mol·K);T为温度,K;Tref为参考温度,K;P为压力,MPa;Pref为参考压力,MPa。

2 结果与分析
2.1超氧化物歧化酶超高压失活速率常数的确定


图1 ln(A/A0)与高压结合热处理时间t的关系图Fig.1 Relationship between ln(A/A0)and processing time
从图1可以看出,不同压力及温度处理猪肉后超氧化物歧化酶失活速率常数k值不同,根据公式(2)可得,k值越小表明酶的活性越高,k值越大酶活性越小。根据图中5种不同处理条件下k的大小可以判断出四种样品中SOD活性是:675 MPa-30 ℃>550 MPa-50 ℃>650 MPa-40 ℃>750 MPa-20 ℃>400 MPa-60 ℃。不同压力、温度处理下的超氧化物歧化酶失活速率常数及其标准偏差如表1所示。
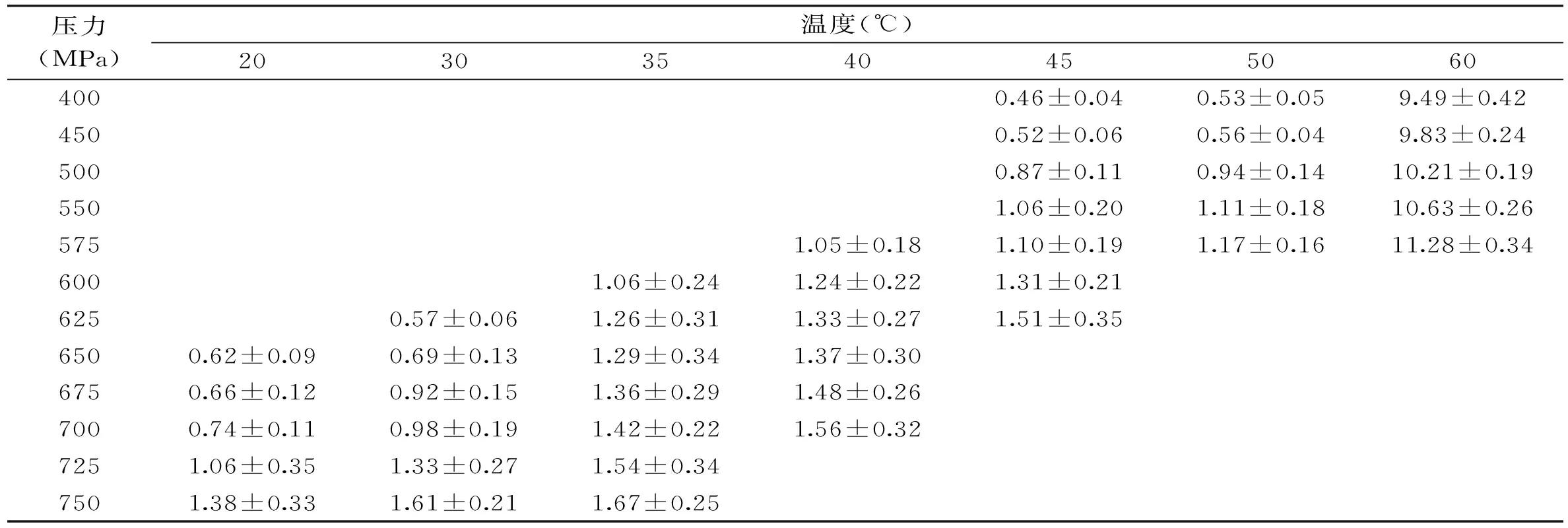
表1 猪肉中超氧化物歧化酶的超高压失活速率常数(×10-2 min-1)
注:表中SOD失活速率常数表示为平均值±标准偏差,是3次重复测定的结果。
由表1可知在一定的处理温度下(20 ℃≤T≤60 ℃),猪肉中超氧化物歧化酶的失活速率常数随着处理压力的增加而增大,表明在一定温度下增加压力可以加快超氧化物歧化酶失活。当处理温度为60 ℃时,SOD失活速率常数均大于2×10-2min-1,明显高于20~50 ℃时的失活速率常数。在一定的处理压力下(400~750 Mpa),猪肉中超氧化物歧化酶失活速率常数随着温度的增加而增大,说明升高温度可以加速超氧化物歧化酶失活。在王韧[25]等人研究的大豆脂肪氧合酶超高压失活情况中,发现10~20 ℃时脂肪氧合酶具有较高的压力稳定性,在此温度之外增加或减小温度都会降低酶的稳定性,但本研究的温度范围是20 ℃以上,因此未发现温度有临界点。苗文娟[26]进行了小麦胚芽脂肪酶和脂肪氧化酶的微波钝化动力学研究,研究表明在45~60 ℃区间内,微波、水浴处理脂肪酶和脂肪氧化酶,随着温度的增大,两种酶的失活速率常数均在升高。本研究的结论与他们的研究基本一致。
2.2压力对超氧化物歧化酶失活速率常数的影响
实验得出在某一特定的温度下,猪肉中超氧化物歧化酶失活速率常数随着处理压力的增加而增大,压力对超氧化物歧化酶反应速率常数k的影响规律可以用热力学方程Eyring方程(式3)来评价。利用SPSS,对SOD失活速率常数的自然对数ln(k)差与压力P线性回归后得到的斜率即为反应活化体积Va值,从而可以从数量上客观衡量处理压力对SOD失活速率常数k的影响情况。不同温度条件下的Va值如表2所示。
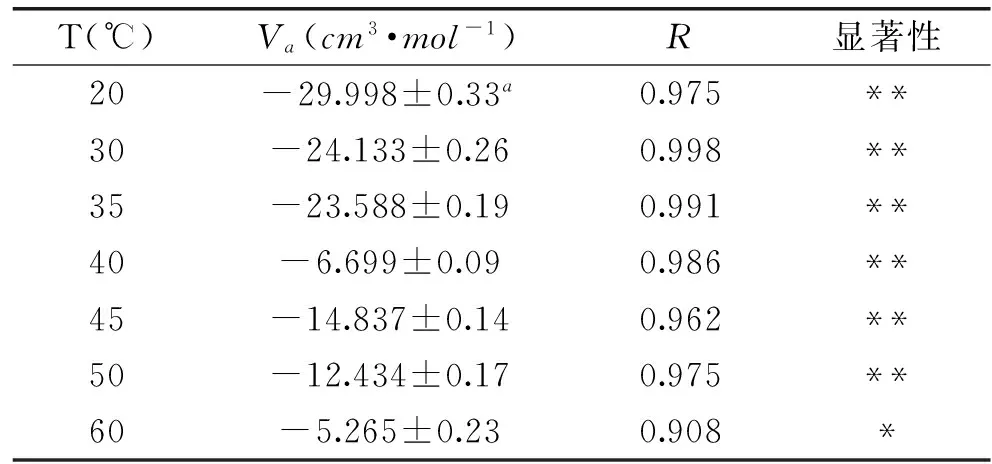
表2 不同温度条件下超氧化物歧化酶
注:a为标准偏差,**为极显著,*为显著,表3同。
从表2可知,在实验温度20~60 ℃之间,各温度条件下的反应活化体积Va都是负值,这说明随着压力的增加SOD失活速率常数k在增大。表中反应活化体积Va的绝对数值随着温度的增加呈先减小后增大再减小的趋势,Va绝对数值在40 ℃时相对较小,在60 ℃时最小,说明40 ℃和60 ℃相比其他温度条件下的压力对SOD超高压失活速率常数影响较弱。压力对食物中SOD影响情况的研究还未有报道,但一些学者研究了其它酶,如王韧等人研究了大豆脂肪氧合酶的超高压失活情况,Ludikhuzye等人研究了超高压下纯酶缓冲液失活情况,Indrawati[27]等对绿豆脂肪氧合酶超高压失活进行了研究,他们的研究中Va绝对值比本实验中的要高,说明在他们的实验中压力对酶失活速率常数的影响比较明显;而Katsaros[28]等人对猕猴桃汁中蛋白水解酶高压结合热处理进行研究中的Va绝对值比本实验的小,表明压力对蛋白水解酶失活速率常数的影响不明显。本研究中Va的变化趋势与他们的研究结论不完全一致。
2.3温度对超氧化物歧化酶失活速率常数的影响
根据实验得出在压力400~750 Mpa之间,超氧化物歧化酶的失活速率常数k随着温度的升高而增大,因此Arrhenius(动力学)式(4)在整个温度20~60 ℃之间都适用,通过动力学方程计算SOD的反应活化能Ea进而了解SOD失活速率常数的变化情况。不同压力条件下的Ea值见表3。
由表3知,在整个实验压力范围之内(400~750 Mpa),反应活化能Ea全部是正值,说明在特定压力下SOD失活速率常数随着温度的升高而增大,Ea值呈先减小后增大再减小的趋势,说明随着压力的增大,温度对SOD失活速率常数的影响先减小后增大再降低。SOD反应活化能Ea总体呈现减小的趋势,说明随着压力的增大,温度对SOD失活速率常数的总体影响在减弱,但结合表2可知随着压力的增大,其对SOD失活速率常数的影响增加。高压结合热处理对食物中SOD影响情况的研究几乎没有报道,学者对其他酶的研究如王韧等人关于大豆脂肪氧合酶超高压失活及Katsaros等人对猕猴桃汁中蛋白水解酶高压结合热处理进行研究中的Ea值要比本实验的大,而Ludikhuyze等关于高压结合热处理I型大豆脂肪氧合酶的部分Ea比本实验的低,说明不同的酶,不同的体系对酶的超高压失活动力学影响不同,本研究中Ea值的变化趋势与他们的研究基本一致。
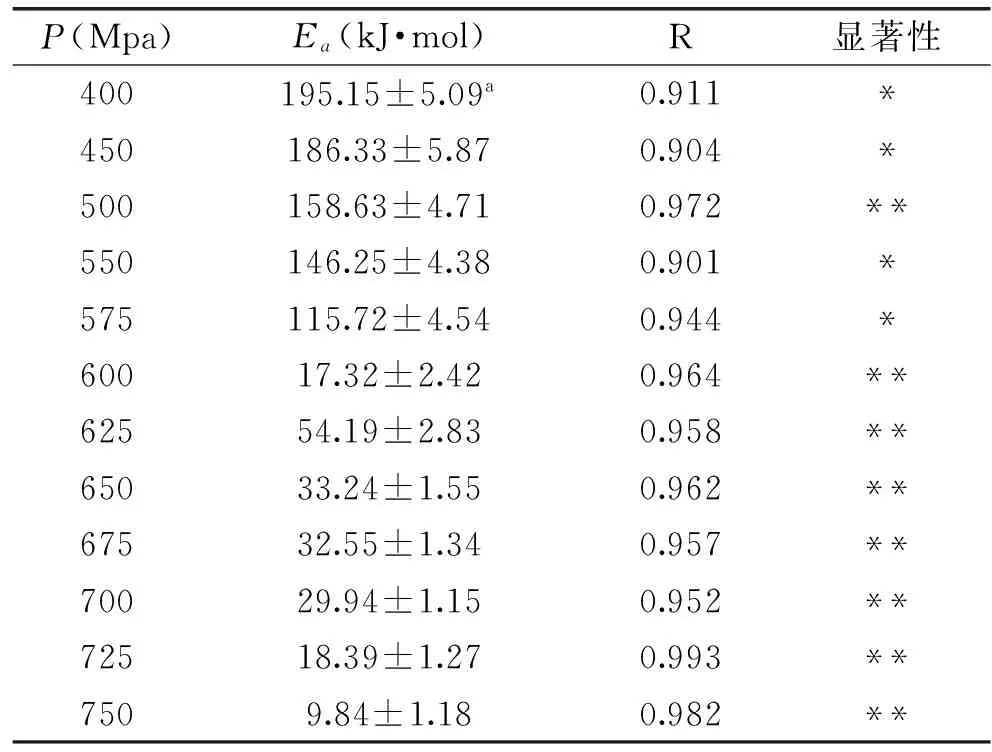
表3 不同压力条件下超氧化物
3 结论
在一定的处理温度下(20 ℃≤T≤60 ℃),SOD的失活速率常数随处理压力增加而增加。各实验温度条件下的反应活化体积Va都是负值,说明随压力的增加SOD失活速率常数在增大;40 ℃及60 ℃时SOD超高压失活速率常数受压力的影响最弱。在整个实验压力范围内(400~750 Mpa),反应活化能Ea值总体呈减小趋势,说明温度对SOD失活速率常数的影响随着压力的增加而减弱。
[1]靳烨,南庆贤. 高压技术在食品加工中应用的发展[J]. 肉类研究,1997,(4):15-16.
[2]Cheftel J C,Culioli J. Effects of high pressure on meat[J]. Meat Science,1997,46(3):211-230.
[3]熊建文. 超高压技术在食品保鲜上的研究进展[J]. 食品工业,2012,33(9).140-142.
[4]MacFarlane J J,Morton D J. Effects of pressure treatment on the ultrastructure of striated muscle[J]. Meat Science,1978,2:281-286.
[5]MacFarlane J J. Pre-rigor pressurization of muscle:Effects on pH,shear value and taste panel assessment[J]. Journal of Food Science,1973,38:294-295.
[6]Dileep A,Omana,Graham Plastow,Mirko Betti. Effect of different ingredients on color and oxidative characteristics of high pressure processed chicken breast meat with special emphasis on use ofβ-glucan as a partial salt replacer[J]. Innovative Food Science and Emerging Technologies,2011,12:244-249.
[7]孙新生,韩衍青,徐幸莲,等. 超高压处理对烟熏火腿色泽、游离脂肪酸及脂肪氧化指标的影响[J]. 食品工业科技,2011,32(7):123-125.
[8]Cruz-Romeroa M C,Kerrya J P,Kelly A L. Fatty acids,volatile compounds and colour changes in high-pressure-treated oysters(Crassostrea gigas)[J]. Innovative Food Science & Emerging Technologies,2008,9(1):55-59.
[9]Goutefongea R,Rampon V,Nicolas N,et al.Meat color changes under high pressure treatment.[J]In:American Meat Science Association,1995,41(2):384-385.
[10]Junga,M Ghoula,M de Lamballerie-Antonb. Influence of high pressure on the color and microbial quality of beef meat[J]. Lebensm.-Wiss. u.-Technol,2003,36:625-629.
[11]Orlien V,Hansen E,Skibsted L H. Lipid oxidation in high pressure processed chicken breast muscle during chill storage:critical working pressure in relation to oxidation mechanism[J]. European Food Research and Technology,2000,211:100-101.
[12]Ma H J,Ledward D A,Zamri A I,et al. Effects of high pressure/thermal treatment on lipid oxidation in beef and chicken muscle[J]. Food Chemistry,2007,104(4):1577-1579.
[13]Yechuan Huang,Zhifei He,Hongjun Li,et al. Effect of antioxidant on the fatty acid composition and lipid oxidation of intramuscular lipid in pressurized pork[J]. Meat Science,2012,91:137-139.
[14]Angsupanich K,Ledward D A.High pressure treatment effects on cod muscle[J]. Food Chemistry,1998,63(1):39-46.
[15]Yagiz Y,Kristinsson H G. Effect of high pressure processing and cooking treatment on the quality of Atlantic salmon[J].Food Chemistry,2009,116:828-833.
[16]马汉军,王霞,周光友,等. 高压和热结合处理对牛肉蛋白质变性和脂肪氧化的影响[J]. 食品工业科技,2004,25(10):64-66.
[17]李斌,高海燕,刘勤华,等. 高压处理对牛肉理化特性的影响[J]. 农产品加工,2009(9):74-77.
[18]Mussa D M. High pressure processing of milk and muscle foods:evaluation of process kinetics,safety and quality changes[D]. Canada:McGill University,1999.
[19]林庆斌,廖升荣. 超氧化物歧化酶(SOD)的研究和应用进展[J]. 化学世界,2006(6):378-381.
[20]汤章城. 植物生理与分子生物学第二版[M].北京:科学出版社,1998.366-380.
[21]Mccord J M,et al. Superoxide and Superoxide Dismutase[M].N.Y,Academic Press,1977,129-134.
[22]李豪,车振明. 猪血超氧化物歧化酶的纯化研究[J]. 食品工业科技,2006(3):156-158.
[23]Ludikhuzye L,Indrawati I,van den Broeck I,et al. Effect of combined pressure and temperature on soybean lipoxygenase I. Influence of extrinsic and intrinsic factors on isobaric-isothermal inactivation kinetics[J]. Journal of Agricultural & Food Chemistry,1998,46:4075-4077.
[24]Indrawati I,van Loey A M,Ludikhuyze L R,et al. Soybean lipoxygenase inactivation by pressure at subzero and elevated temperatures[J]. Journal of Agricultural & Food Chemistry,1999,47:2469-2472.
[25]王韧,周星,徐广超,等. 大豆脂肪氧合酶超高压失活动力学研究[J].农业工程学报,2007,23(11):31-34.
[26]苗文娟.小麦胚芽脂肪酶和脂肪氧化酶的微波钝化动力学研究[D].江苏大学硕士学位论文,2013(6):32-34.
[27]Indrawati I,van Loey A M,Ludikhuyze L R,et al. Kinetics of pressure in activation at subzero and elevated temperature of lipoxygenase in crude green bean(Phaseolus vulgar is L.)extract[J]. Biotechnology Progress,2000,16:110-113.
[28]Katsaros G I,Katapodis P S,Taoukis. Modeling the effect of temperature and high hydrostatic pressure on the proteolytic activity of kiwi fruit juce[J]. Journal of Food Engineering,2009,94:40-45.
Study on the ultrahigh pressure inactivation kinetics of pork superoxide dismutase
SUN Juan,HUANG Ye-chuan*,LI Ting-ting
(College of Life Science and Engineering,Southwest University of Science and Technology,Mianyang 621010,China)
The superoxide dismutase(SOD)activity of pork under different pressure(400~750 MPa)combined with different tempreture(20~60 ℃)were determined. and the ultrahigh-pressure inactivation kinetics of SOD was researched in the further study. The results showed that at a constant temperature(20 ℃≤T≤60 ℃),the deactivation constants of SOD in the pork was increased with the increasing of pressure. The reaction activation volumeVawas negative in the various temperature conditions,which showed that the inactivation constants of SOD increased with the increasing of pressure. The absolute value of SOD reaction activation volume was minimum at 40 ℃ and 60 ℃,which showed that the pressure had the minimal effect on ultrahigh-pressure inactivation of SOD,and SOD had a high pressure stability in these temperature conditions. Throughout the test pressure range(400 Mpa≤P≤750 Mpa),the activation energyEavalues were decreased generally,which indicated that the influence of temperature on SOD inactivation constants were weakening with the increasing of pressure.
ultrahigh pressure;superoxide dismutase;pork;inactivation;kinetics
2015-05-15
孙娟(1988-),女,在读硕士,研究方向为化学工程,E-mail:631160547@qq.com。
黄业传(1975-),男,副教授,研究方向:肉制品加工与酶工程,E-mail:hyc2005@sina.com。
国家自然科学基金资助项目(31271892);西南科技大学博士基金(12zx7110)。
TS
A
1002-0306(2016)01-0000-00
10.13386/j.issn1002-0306.2016.01.000
