年龄和组织类型对X连锁Alport综合征女性患者X染色体失活方式的影响
2011-01-19张宏文
张宏文 王 芳 丁 洁
Alport综合征(AS)是最常见的遗传性肾脏疾病,临床主要表现为血尿和进行性肾功能减退,常伴感音神经性耳聋和眼部病变等。AS具遗传异质性,X连锁显性遗传是其主要遗传方式,由COL4A5和(或)COL4A6基因突变所致[1,2]。X连锁AS(XLAS)男性患者临床症状较重,常进展至终末期肾病(ESRD),而XLAS女性患者临床表现差异较大,从无症状血尿到慢性肾功能衰竭均可发生。已知XLAS女性患者临床表型的较大差异不能单纯用COL4A5基因突变来解释,特别是来自同一家系基因型完全相同的姐妹,临床表型可以截然不同,提示除了COL4A5基因突变外可能还有其他因素影响临床表型[3,4]。
研究表明其他X连锁遗传性疾病临床表型的差异和X染色体失活有关[5,6],因此推测XLAS女性患者的临床表型差异可能也与X染色体失活相关[3,7,8],但与其他X连锁遗传性疾病相似,目前有关X染色体失活与XLAS女性患者临床表型关系的研究结果相互矛盾或不一致,尚无定论[9~14]。进一步研究发现,X染色体失活存在年龄和组织特异性[15~17],这也许能解释为什么有关X连锁遗传性疾病和X染色体失活研究的结果互相矛盾。为此,本研究观察了不同年龄和组织类型对XLAS女性患者X染色体失活方式的可能影响,以期解释临床上有关XLAS女性患者与X染色体失活相互关系研究结果不一致的主要原因。
1 方法
1.1 XLAS的诊断标准 XLAS的诊断标准参照Flinter等[18,19]的4项标准:①血尿或慢性肾功能衰竭家族史;②肾活检电镜检查有典型病变;③进行性感音神经性耳聋;④眼部病变。符合以上3/4项即诊断为XLAS。并结合肾小球基底膜(GBM)Ⅳ胶原α3、α4 和α5链的染色和皮肤基底膜(EBM)Ⅳ胶原α5链的染色及COL4A5基因突变分析结果[18,19]。
1.2 研究家系的纳入标准 1997年1月至2006年12月北京大学第一医院(我院)儿科肾脏病遗传门诊就诊、符合XLAS诊断标准的家系。
1.3 研究家系的排除标准 ①家系病例资料不完整;②就诊时家系中没有男性患者或已死亡,就诊时家系中没有女性患者或已死亡;③不能获得外周血或皮肤成纤维标本。
1.4 分组 已知根据家系中男性发生ESRD的年龄将AS家系分为青少年型(31岁前发生)和成年型(31岁以后发生)[20]。本研究中多数家系不能确定其为青少年型或成人型,为方便分析以30岁为年龄界点,将XLAS家系中女性患者分为两组,年龄≤30岁为A组,年龄>30岁为B组。
1.5 伦理和知情同意 本研究通过我院伦理委员会审批,家系中的每例患者均签署知情同意书,包括同意采集外周静脉血、皮肤活检、COL4A5基因突变分析和X染色体失活分析。未成年患儿由家长代为签署。
1.6 DNA提取 签署知情同意书后的任意时间点采集患者及其家属静脉血3 mL,盐析法提取淋巴细胞基因组DNA。对家系中的女性患者在前臂下1/3处进行皮肤活检,皮肤活检和皮肤成纤维细胞培养方法参见文献[18],同时采用试剂盒(Promega,Madison,WI,USA)提取皮肤成纤维细胞DNA,按说明书操作。
1.7 X染色体失活分析 通过PCR扩增雄性激素受体(AR)基因第一外显子CAG重复序列的多肽性分析X染色体失活,方法参见 Allen等[21]的报道,根据文献[14]进行稍加调整。X染色体失活比例计算公式[17]:
失活率=(d1/u1)/(d1/u1+d2/u2)×100%
其中 d1和d2分别代表消化样本PCR产物2条带峰值大小,u1和u2则分别代表未消化样本PCR产物2条带峰值大小。以X染色体失活率≥80%作为X染色体失活倾斜的标准[22,23]。每个家系同时分析1例男性患者,以区分突变COL4A5等位基因所在X染色体[14]。每一标本X染色体失活分析均检测2次,取其平均值用于统计分析。
本课题组以X染色体失活率50%为临界点,以两种组织中同一条X染色体失活比例同时>或<50%,认为两种组织中以同一条X染色体失活为主;以两种组织中同一条X染色体失活比例一种>50%和一种<50%,认为两种组织分别以两条X染色体中的一条失活为主。
1.8 统计学方法 采用SPSS 11.5软件进行统计分析,不同组间X染色体失活率比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 研究期间我院儿科肾脏病遗传门诊共诊断XLAS家系186个,符合纳入和排除标准的XLAS家系共32个,包括36例女性患者和32例男性患者。A组13例,B组23例,平均年龄分别为(17.9±11.7)和(38.6±6.2)岁。XLAS家系的纳入和排除流程见图1。

图1 研究对象的纳入和排除流程
Fig 1 Flow chart of patients selection process
2.2 年龄对X染色体失活的影响 36例女性患者中,外周血中AR基因位点杂合者32例,异质性为88.9%(32/36例);AR基因位点纯合者4例,其中A组1例,B组3例。以80%作为X染色体失活倾斜的标准[22,23],外周血中X染色体失活倾斜率为12.5%(4/32例),其中A组0例,B组4/20例(20.0%),两组差异无统计学意义(χ2=2.743,P=0.098);以70%作为X染色体失活倾斜的标准,外周血中X染色体失活倾斜率为28.1%,其中A组4/12例(33.3%),B组5/20例(25.0%),两组差异无统计学意义(χ2=0.258,P=0.612)。
2.3 组织类型对X染色体失活的影响 12例女性患者同时分析外周血和皮肤成纤维细胞X染色体失活。如表1所示,两种组织中X染色体失活方式明显不同,3例(例1,6,10)患者仅皮肤成纤维细胞显示为X染色体失活倾斜而外周血无失活倾斜;1例(例3)外周血中显示X染色体失活倾斜而皮肤成纤维细胞无失活倾斜。7/12例(58.3%)患者两种组织中以同一条X染色体失活为主;5/12例(41.7%)患者则相反,即外周血中以两条X染色体中的一条失活为主,皮肤成纤维细胞中则以另一条失活为主,差别最高达43.5%。
表1 12例XLAS女性患者外周血和皮肤成纤维细胞X染色体失活情况
Tab 1 X-inactivation patterns of 12 XLAS females in peripheral blood cells and skin fibroblasts
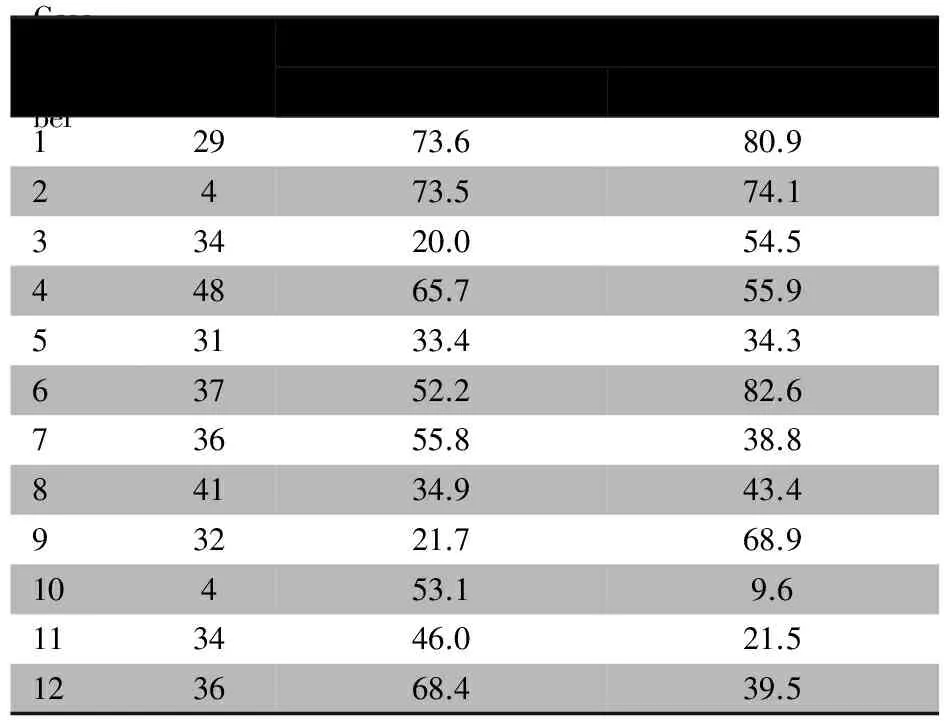
Casenum⁃berAge/yearsX⁃inactivationrateofthemutantallele/%PeripheralbloodcellsSkinfibroblasts12973.680.92473.574.133420.054.544865.755.953133.434.363752.282.673655.838.884134.943.493221.768.910453.19.6113446.021.5123668.439.5
3 讨论
本研究结果发现,36例XLAS女性患者中,4例AR基因位点为纯合,即两条X染色体上AR基因的CAG 重复数目相等,因此不能用PCR扩增AR基因第一外显子CAG重复序列多肽性的方法分析其X染色体失活情况。因此,本研究AR基因的杂合度为88.9%(32/36例),与其他研究者的报道相似(86.5%~90.0%)[17,24]。以80%作为X染色体失活倾斜的标准,外周血中X染色体失活倾斜率为12.5%(4/32例),与其他研究者结果一致[17]。
虽然部分研究显示大年龄组外周血或口腔黏膜细胞中的X染色体失活倾斜率高于小年龄组[25~27],但更多研究显示年龄与X染色体失活倾斜率两者间无相关性,而与遗传因素有关[28,29]。Sandovici等[30]对178名正常女性两份不同时间(相隔20年以上)的外周血标本进行了X染色体失活分析,未发现随年龄增长X染色体失活倾斜率增加。由于是同一个体不同时间的X染色体失活情况的自身对比,所以该研究的结果相对较为准确可靠。Amos-Landgraf等[31]检测了1 005名正常女性外周血中X染色体失活情况,结果显示成年女性X染色体失活倾斜率高于新生儿,但在成年女性之间并无差异,即随年龄增长X染色体失活倾斜比例增加并不明显。本研究结果显示,无论是以80%或70%作为X染色体失活倾斜的标准,A组和B组外周血X染色体失活倾斜率差异均无统计学意义,这与上述多数研究者的结果相似,即年龄对X染色体失活无明显影响。
同时有研究表明同一个体X染色体失活存在组织差异性[16,17],即同一个体外周血、皮肤、口腔黏膜和尿道上皮细胞等组织中X染色体失活比例明显不同。Gale等[32]分析了20例不同胃肠道疾病女性患者外周血、皮肤和肌肉组织的X染色体失活情况,结果显示11/20例(55.0%)患者3种组织中X染色体失活比例相似,9/20例(45.0%)患者两种或3种组织间X染色体失活比例明显不同,差别最高达50%以上。本研究中12例女性患者同时分析了外周血和皮肤成纤维细胞中X染色体失活情况,两种组织中X染色体失活方式明显不同,3例患者仅皮肤成纤维细胞显示为X染色体失活倾斜而外周血无失活倾斜;1例患者外周血中显示X染色体失活倾斜而皮肤成纤维细胞无失活倾斜。7/12例(58.3%)患者两种组织中以同一条X染色体失活为主;5/12例(41.7%)患者则相反,差别最高达43.5%,与Gale等[32]的结果相似。此外,Azofeifa等[16]研究外周血、肌肉和甲状腺组织间X染色体失活情况,Sharp等[17]对外周血、口腔黏膜细胞和尿道上皮细胞组织间X染色体失活情况进行了研究,结果均证实X染色体失活存在组织特异性。
根据目前有关X染色体失活与XLAS女性患者临床表型的研究结果,似乎尚不能完全以X染色体失活来解释XLAS女性患者临床表型的差异性。首先,因同一个体的X染色体失活方式相对衡定,不随年龄增长而明显变化,而已知XLAS女性患者的临床表现,如蛋白尿或肾功能不全呈动态变化,即随年龄增长而加重,两者不平行。其次,假设X染色体失活确实与XLAS女性患者的临床表型相关,那么该采用何种临床指标和哪部分组织进行分析?目前尚无定论,仍需更多的研究进一步分析。另外,除了年龄和组织类型对X染色体失活方式的影响,不同研究者采用的不同研究方法以及样本量太小等也可能影响结果的一致性[14,33],因此需要增加样本量并采用相同检测方法来进一步评价或证实两者间的真实关系。另外,其他的表观遗传学因素如DNA甲基化、组蛋白乙酰化和非编码RNAs修饰等均可能对X染色体失活方式产生影响[34,35]。
本研究结果证实,不同组织类型而非年龄可能影响XLAS女性患者的X染色体失活方式,这也许是临床上有关XLAS女性患者和X染色体失活相互关系研究结果不一致的一个主要原因,因此有关X染色体失活对XLAS女性患者临床表型差异的影响尚需进一步研究。
本研究的不足之处和局限性:①本研究仅比较了外周血和皮肤组织的X染色体失活方式,在后续的研究中需要增加组织样本种类,特别是肾脏组织,以评价不同组织类型对XLAS女性患者X染色体失活方式的影响;②本研究中大多数患者年龄在40岁以下,因此需要进一步长期随访以判定年龄对XLAS女性患者X染色体失活的影响;③本研究样本量较小,且未考虑其他表观遗传学因素,后续研究需要增加样本量进一步研究。
[1]Thorner PS. Alport syndrome and thin basement membrane nephropathy. Nephron Clin Pract, 2007, 106(2):82-88
[2]Hertz JM. Alport syndrome. Molecular genetic aspects. Dan Med Bull, 2009, 56(3):105-152
[3]Jais JP, Knebelmann B, Giatras I, et al. X-linked Alport syndrome: natural history and genotype-phenotype correlations in girls and women belonging to 195 families: a "European Community Alport Syndrome Concerted Action" study. J Am Soc Nephrol, 2003, 14(10):2603-2610
[4]Wang F, Ding J, Guo S, et al. Phenotypic and genotypic features of Alport syndrome in Chinese children. Pediatr Nephrol, 2002, 17(12):1013-1020
[5]Jungbluth H, Sewry CA, Buj-Bello A, et al. Early and severe presentation of X-linked myotubular myopathy in a girl with skewed X-inactivation. Neuromuscul Disord, 2003, 13(1):55-59
[6]Andreu N, Pujol-Moix N, Martinez-Lostao L, et al. Wiskott-Aldrich syndrome in a female with skewed X-chromosome inactivation. Blood Cells Mol Dis, 2003, 31(3):332-337
[7]Nakanishi K, Iijima K, Kuroda N, et al. Comparison of alpha5(IV) collagen chain expression in skin with disease severity in women with X-linked Alport syndrome. J Am Soc Nephrol, 1998, 9(8):1433-1440
[8]Kashtan CE. Alport syndromes: phenotypic heterogeneity of progressive hereditary nephritis. Pediatr Nephrol, 2000, 14(6):502-512
[9]Shimizu Y, Nagata M, Usui J, et al. Tissue-specific distribu-tion of an alternatively spliced COL4A5 isoform and non-random X chromosome inactivation reflect phenotypic variation in heterozygous X-linked Alport syndrome. Nephrol Dial Transplant, 2006, 21(6):1582-1587
[10]Vetrie D, Flinter F, Bobrow M, et al. X inactivation patterns in females with Alport′s syndrome: a means of selecting against a deleterious gene? J Med Genet, 1992, 29(9):663-666
[11]Wang Y, Zhang H, Ding J, et al. Correlation between mRNA expression level of the mutant COL4A5 gene and phenotypes of XLAS females. Exp Biol Med (Maywood), 2007, 232(5):638-642
[12]Guo C, Van Damme B, Vanrenterghem Y, et al. Severe alport phenotype in a woman with two missense mutations in the same COL4A5 gene and preponderant inactivation of the X chromosome carrying the normal allele. J Clin Invest, 1995, 95(4):1832-1837
[13]Bell RJ, Lees GE, Murphy KE. X chromosome inactivation patterns in normal and X-linked hereditary nephropathy carrier dogs. Cytogenet Genome Res, 2008, 122(1):37-40
[14]Zhang HW(张宏文), Ding J, Wang F. Correlation between X-inactivation of different tissues and phenotypes in female with X-linked Alport syndrome. J Appl Clin Pediatr(实用儿科临床杂志), 2010, 25(5):320-323
[15]Busque L, Mio R, Mattioli J, et al. Nonrandom X-inactivation patterns in normal females: lyonization ratios vary with age. Blood, 1996, 88(1):59-65
[16]Azofeifa J, Waldherr R, Cremer M. X-chromosome methylation ratios as indicators of chromosomal activity: evidence of intraindividual divergencies among tissues of different embryonal origin. Hum Genet, 1996, 97(3):330-333
[17]Sharp A, Robinson D, Jacobs P. Age- and tissue-specific variation of X chromosome inactivation ratios in normal women. Hum Genet, 2000, 107(4):343-349
[18]Wang F, Wang Y, Ding J, et al. Detection of mutations in the COL4A5 gene by analyzing cDNA of skin fibroblasts. Kidney Int, 2005, 67(4):1268-1274
[19]Flinter FA, Cameron JS, Chantler C, et al. Genetics of classic Alport′s syndrome. Lancet, 1988, 2(8618):1005-1007
[20]Flinter F. Alport′s syndrome. J Med Genet, 1997, 34(4):326-330
[21]Allen RC, Zoghbi HY, Moseley AB, et al. Methylation of HpaII and HhaI sites near the polymorphic CAG repeat in the human androgen-receptor gene correlates with X chromosome inactivation. Am J Hum Genet, 1992, 51(6):1229-1239
[22]Plenge RM, Stevenson RA, Lubs HA, et al. Skewed X-chromosome inactivation is a common feature of X-linked mental retardation disorders. Am J Hum Genet, 2002, 71(1):168-173
[23]Calvo RM, Asuncion M, Sancho J, et al. The role of the CAG repeat polymorphism in the androgen receptor gene and of skewed X-chromosome inactivation, in the pathogenesis of hirsutism. J Clin Endocrinol Metab, 2000, 85(4):1735-1740
[24]Kubota T, Nonoyama S, Tonoki H, et al. A new assay for the analysis of X-chromosome inactivation based on methylation-specific PCR. Hum Genet, 1999, 104(1):49-55
[25]Knudsen GP, Pedersen J, Klingenberg O, et al. Increased skewing of X chromosome inactivation with age in both blood and buccal cells. Cytogenet Genome Res, 2007, 116(1-2):24-28
[26]Hatakeyama C, Anderson CL, Beever CL, et al. The dynamics of X-inactivation skewing as women age. Clin Genet, 2004, 66(4):327-332
[27]Orstavik KH. Skewed X inactivation in healthy individuals and in different diseases. Acta Paediatr Suppl, 2006, 95(451):24-29
[28]Racchi O, Mangerini R, Rapezzi D, et al. X chromosome inac-tivation patterns in normal females. Blood Cells Mol Dis, 1998, 24(4):439-447
[29]Kristiansen M, Knudsen GP, Bathum L, et al. Twin study of genetic and aging effects on X chromosome inactivation. Eur J Hum Genet, 2005, 13(5):599-606
[30]Sandovici I, Naumova AK, Leppert M, et al. A longitudinal study of X-inactivation ratio in human females. Hum Genet, 2004, 115(5):387-392
[31]Amos-Landgraf JM, Cottle A, Plenge RM, et al. X chromo-some-inactivation patterns of 1,005 phenotypically unaffected females. Am J Hum Genet, 2006, 79(3):493-499
[32]Gale RE, Wheadon H, Boulos P, et al. Tissue specificity of X-chromosome inactivation patterns. Blood, 1994, 83(10):2899-2905
[33]Zhang HW(张宏文), Ding J. The possible mechanisms of variated phenotypes in females of X-linked Alport syndrome. Chin J Pediatr(临床儿科杂志), 2011, 29(2):189-191
[34]Holliday R. DNA methylation and epigenotypes. Biochemistry (Mosc), 2005, 70(5):500-504
[35]Lund AH, van Lohuizen M. Epigenetics and cancer. Genes Dev, 2004, 18(19):2315-2335
