沙门菌定性检验方法的关键环节分析
2016-09-10郭晓焕驻马店市食品药品检验所河南驻马店463000
郭晓焕驻马店市食品药品检验所,河南驻马店 463000
沙门菌定性检验方法的关键环节分析
郭晓焕
驻马店市食品药品检验所,河南驻马店463000
目的探究沙门菌定性检验方法的关键环节。方法选取驻马店市食品药品检验所2015年1月—2016年2月间以“食品药品鉴定系统能力验证计划”所提供的15件考核样品为对象,针对原始标本,利用BPW进行前增菌,采用TTB和SC实施二次增菌。基于此,通过3种分离培养基,鉴定分离培养。同时,通过实时荧光PCR方法,对比分析前增菌和二次增菌后的增菌效果。结果基于分离培养方法作用下,15件考核样品中有12件样品可检测到沙门菌。基于实时荧光PCR检测方法作用下,15件考核样品中有14件样品可检测到沙门菌。结论在优化沙门菌检测方案的基础上,特别是筛查大规模样本或监测时,前增菌后直接进行检测,或者利用SC二次增菌后鉴定分离培养,有助于减少工作量,减低资源浪费。
沙门菌;检验方法;关键环节
[Abstract]Objective To explore the key qualitative test method of salmonella.Methods Zhumadian City Food and drug inspection and the January 2015— Fcbrnany 2016 are provided by the food and drug identification system capacity verification plan 15 examination sample selection as the object,the original specimens,use BPW of pre enrichment and using TTB and SC implementation secondary enrichment.Based on this,through three kinds of separation medium,were isolated and identified.At the same time,by real-time fluorescent quantitative PCR,analysis and comparison to increase bacteria and secondary enrichment increased bacterial.Results Based on the methods of isolation and culture under the action of 15 assessment samples of 12 samples were detected salmonella.Based on the method of real-time fluorescence PCR detection under the 15 assessment samples of 14 samples were detected salmonella.Conclusion In Salmonella detection scheme based optimization,especially large-scale screening of samples or monitoring,pre enrichment direct detection,or using SC second increase bacteria isolation and identification of culture,it can help to reduce the workload and reduce the waste of resources.
[Key words]Salmonella;Test method;Key link
目前,全球食源性疾病呈现出日渐流行趋势,致使食品完全问题逐渐得到社会各界的关注与重视,然而,沙门菌是导致食源性疾病的关键致病菌,且检测方案的可行性与监测敏感性存在密切联系。针对我国,卫生部行业标准(即行标)和国家标准方法GB/ T4789.4-2010(即国标)是沙门菌分离鉴定的两大方法[1]。其中,行标主要用于检测临床标本,国标主要用于检测食品来源标本。对于国标,需对检测标本实施二次增菌,且需以2个温度条件和2种增菌液为前提,具有操作复杂等特点[2]。鉴于此,如何提高实验检测效率,优化实验关键环节,成为学者研究的话题。为此,此文选取驻马店市食品药品检验所2015年1月—2016年2月以 “食品药品鉴定系统能力验证计划”所提供的15件考核样品为对象,对比分析了沙门菌检验方法,取得了一定成效,现将相关报道如下。
1 资料与方法
1.1样品
以“食品药品鉴定系统能力验证计划”所提供的15件考核样品为对象,所以样品均为冻干状,是一种白色微球,且3 mm左右是其直径。
1.2仪器与试剂
①仪器:荧光定量PCR仪;②试剂:缓冲蛋白胨水;四硫酸钠煌绿增菌液;亚硒酸盐胱氨酸增菌液;木糖赖氨酸胆酸盐琼脂;亚硫酸铋;三糖铁琼脂;科玛嘉沙门显色琼脂;诊断血清;VITEK生化试剂。
1.3方法
1.3.1细菌分离培养鉴定 在PT要求指导下,以国标方法为依据,开展检验工作。①前增菌:基于无菌操作下,取BPW1ml,待完全溶解样品后,将BPW添加至10 mL,以36℃1℃为基准,8~18 h为培养时间。②增菌:轻轻晃动经培养的样品混合物,取1 mL放置于10 mLTTB中,以42℃1℃为基准,18~24 h为培养时间。与此同时,取1 mL放置于10 mLSC中,以36℃1℃为基准,18~24 h为培养时间。③分离:各取1环上述2种增菌液,分别放置于BS琼脂平板、XLD琼脂平板和CAS显色平板上,基于36℃1℃下,培养18~24 h。对平板上的菌落生长状况、典型菌落形态进行观察。④生化试验:分别挑取2个以上的典型或可疑菌落,将其接种于三糖铁琼脂上,在斜面划线基础上,进行底层穿刺。针对接种针,可不灭菌,直接将其接种于营养琼脂平板上,以36℃1℃为基准,18~24 h为培养时间。基于营养琼脂平板下,对可疑菌落进行挑取,以VITEK2 Compact操作手册为指导,开展试验工作,并对结果进行判定。若符合生化三塘初筛,则利用VITEK系统,实施生化鉴定。在此基础上,借助沙门多价血清凝集实验,对最终结果进行判定。
1.3.2实时荧光PCR方法 ①制备模板DNA:取1 mL每种增菌液,以8 000 rpm/min为指标,离心5 min,待除去上清后,添加DEPC1mL,并洗涤沉淀。以8000rpm/min为指标,离心5 min,待除去上清后,添加100DEPC水,基于沸水下,进行10 min的加热。以12 000 rpm/min为指标,离心10 min,待除去上清后,以供备用。②荧光PCR反应:12.52PCR反应混合物属于25反应体系范畴,0.2为上、下游引物,2为模板DNA。PCR反应条件:基于95℃下10 min,95℃下15 s,60℃下1 min,以40个循环为标准。每一样本均表现出S型扩增曲线,其菌液浓度随着Ct值的增加而减小。同时,Ct值处于10~35范围内,标志着诊断为阳性,反之,则为阴性。
1.4统计方法
2 结果
2.1分离培养方法检测结果
通过BPW前增菌,所有培养液表现出不同程度上的混浊现象,说明存在菌落。通过TTB和SC二次增菌,相较于前增菌,样品的培养管差异无统计学意义。然而,15件样品中有12件样品存在典型菌落。样品种菌落分布,见表1。

表1 样品种菌落分布
2.2基于前增菌和二次增菌条件下,对比2种增菌液增菌效果
针对不同增菌液二次增菌后增菌效果,如表2所示。
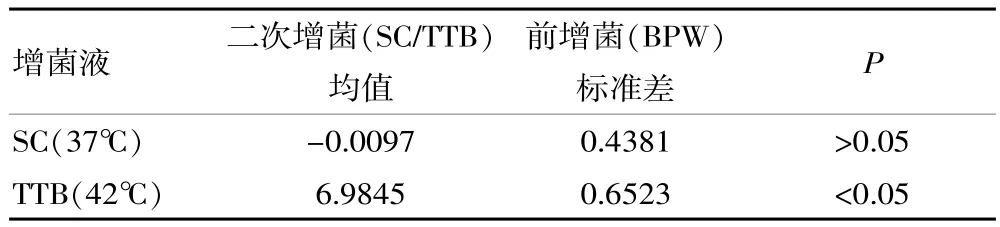
表2 不同增菌液二次增菌后增菌效果对比
3 讨论
沙门菌,是一种食源性致病菌,较为常见。目前,国标检测属于常用的检测方法,其需较长的检测时间,一般情况下,需4~5 d,且需满足2种增菌液和2个温度培养条件,大大增加了人力、物力和材料的耗费[3]。
此研究以 “食品药品鉴定系统能力验证计划”所提供的15件样品为对象,样品来源具有较强的可靠性,在确定初始浓度的前提下,为准确评价增菌条件提供存在浓度差异的样品。同时,此研究利用荧光PCR检测方法[4]对2种菌液增菌效果进行有效评价,在检测细菌DNA精确定量的基础上,对菌液的浓度和增殖效率进行正确反映,其灵敏度、特异性与可靠度均较高,相较于传统分离培养方法,其具有有效区分增菌效果差异的作用。与其他相关报道[6]结果基本一致,该占比达到72.13%。
一般而言,食品样品自身存在物理性质,且蕴藏一定量的致病菌,加之受到诸多杂菌影响,易导致常规检测结果存在误差,影响检测正确率。基于BPW作用下[7],对样品实施富集增菌培养,以达到维持或降低增菌液中pH值的目的,控制杂菌迅速生长繁殖,促使靶菌得以增殖。然而,针对受到物理损伤的样品,例如,冷伤、辐射等,其菌体修复增殖效果并不显著,只有通过二次增菌,例如,TTB、SC等,以满足沙门菌平板分离的灵敏度需求[8]。
提高沙门菌检测敏感度的关键在于有效增菌,对于食物中毒溯源的病原菌,通过前增菌后直接检测,促使其更具科学性与实用性[9]。因为,食物中毒案例中所涉及的留样食品,其与受到低污染的自然食品存在差异,其含有大量致病菌,增加检测难度[10]。此研究样板数量较少,导致研究存在局限性。因此,为提高沙门菌检测质量,还需相关人员进一步研究沙门菌定性检测方法的关键环节。
[1]孙康德,李洁琼,陈福祥,等.食源性沙门菌感染的实验室诊断及鼠伤寒沙门菌同源性分析 [J].检验医学,2012,27(11):913-916.
[2]武利平.光纤倏逝波生物传感器快速检测水中沙门菌和肠炎沙门菌的方法研究[D].北京:中国疾病预防控制中心,2014.
[3]张秀芹.饲料中沙门菌快速检测方法的建立及其分离株的耐药性与致病性分析[D].长春:吉林大学,2014.
[4]郑秋月,战晓微,肖珊珊,等.沙门氏菌MALDI-TOF MS分型方法建立[J].中国公共卫生,2014,30(10):1344-1347.
[5]於颖,王文静,陆晔.PMA-qPCR定量检测畜禽肉类中沙门菌活菌的研究[J].检验医学,2015,30(05):500-506.
[6]曲梅,张新,吕冰,等.沙门菌定性检验方法关键环节评价[J].中国卫生检验杂志,2014(19):2743-2745,2749.
[7]祝儒刚,宋立峰.肉及肉制品中沙门氏菌活细胞的PCR检测研究[J].食品科学,2012.33(16):199-203.
[8]王宇,靳伟东,兰凯,等.荧光定量PCR技术在临床微生物检测中的应用[J].中国卫生标准管理,2015,6(30):151-152.
[9]程洁萍,谭翰清,朱颖梅.TaqMan探针实时荧光PCR快速检测奶粉中沙门氏菌的研究[J].中国热带医学,2015,15(10):1165-1168.
[10]潘玉辉,李玉,蔡秀芝,等.几种主要食源性致病菌荧光定量PCR快速检测方法的建立[J].医学信息,2015,28 (25):78-79.
Analysis of Key Qualitative Test Method of Salmonella
GUO Xiao-huan
Zhumadian Municipal Food and Drug Inspection Institute,Zhumadian,Henan Province,463000 China
R378
A
2096-1782(2016)07-0123-03
10.19368/j.cnki.2096-1782.2016.07.123
郭晓焕(1974.11-),女,河南驻马店人,本科,微生物检验技术中级,专业方向:微生物检验。
2016-04-05)(
2016-04-05)
