高血压大鼠心肌肥厚瞬时外向钾电流的变化比较
2016-09-10张良胜翟超楠刘星河南省永城市人民医院东城区心内科河南永城476600泸州医学院附属医院心内科四川泸州646000
张良胜,翟超楠,刘星.河南省永城市人民医院东城区心内科,河南永城 476600;.泸州医学院附属医院心内科,四川泸州 646000
高血压大鼠心肌肥厚瞬时外向钾电流的变化比较
张良胜1,翟超楠1,刘星2
1.河南省永城市人民医院东城区心内科,河南永城476600;2.泸州医学院附属医院心内科,四川泸州646000
目的比较腹主动脉缩窄模型组(Coarctation of abdominal aorta,CAA)与假手术组(Sham operation,SH)的心肌细胞瞬时外向钾电流的变化。方法2012年1—6月于泸州医学院20只成年大鼠,被随机分成两组:假手术组(Sham operation,SH)(n=10)与腹主动脉缩窄模型组(n=10)(Coarctation of abdominal aorta,CAA)。运用膜片钳技术分别记录两组大鼠心室肌单细胞的Ito,运用OriginPro 8.0,Clampfit 10软件数据分析作图。结果假手术组左心室心肌细胞的Ito电流密度+70 mv时(37.05±5.02)pA/pF比腹主动脉缩窄模型组大鼠+70mv时(16.09±8.91)pA/pF高差异有统计学意义(P<0.05),与假手术组相比,腹主动脉缩窄模型组的Ito的I-V曲线下移明显。结论Ito在高血压心肌肥厚角色,可能是临床严重心律失常的发生原因之一。
高血压大鼠心肌肥厚,膜片钳,瞬时外向钾电流
[Abstract]Objective To investigate the variations of the transient outward potassium current(Ito)on ventricular myocardium between coarctation of abdominal aorta and sham operation.Methods 20 healthy adult rats were divided into sham operation group(SH)(n=10)and coarctation of abdominal aorta group(CAA)(n=10)from January to June in 2012 in Luzhou Medical College.Whole-cell path clamp technique was used to record the unicellular changes of Ito in left ventricular myocytes for SH group and CAA group.Both Clampfit 10 and OriginPro 8.0 software was used for data analysis.Results The Ito current density of left ventricular myocytes was significantly higher in sham operation group (37.05±5.02)pA/pF at+70 mv than in coarctation of abdominal aorta group(16.09±8.91)pA/pF at+70 mv(P<0.05),Compared with sham operation group,the I-V curve of Ito in coarctation of abdominal aorta group was more depressed than in the sham operation group markedly.Conclusion Ito plays an important role in hypertrophic myocardium of hypertensive rats.It may be one of the important reasons of arrhythmia.
[Key words]Hypertrophic myocardium of hypertensive rats,Pacth clamp,Transient outward potassium current
高血压心肌肥厚是机体对血流动力学负荷增加的一种反应,表现为心室壁增厚,心肌重量增加,心肌重构。左心室肥厚常伴有心律失常,心力衰竭等一系列心血管事件,是心血管事件的独立危险因素[1-2]。2012年1—6月该研究建立10例高血压心肌肥厚模型,利用膜片钳技术检测心室肌细胞瞬时外向钾电流(Ito)的变化,以明确Ito电流在高血压心肌肥厚中的变化情况。
1 材料与方法
1.1实验动物与分组
2012年1—6月,将20只清洁Sprague Dawley大鼠随机分为 SH组(10例)与CAA组(10例),Sprague Dawley大鼠购于第三军医大学医学实验动物中心。
1.2试剂与主要仪器
羟乙基哌嗪乙磺酸,乙二醇双四乙酸,氯化钴,天冬氨酸钾,牛磺酸,血清白蛋白,胶原酶II,谷氨酸均为Sigma公司产品,其余为国产分析纯试剂。
膜片钳放大器 (CEZ-2300,Nihon konden,Japan);A/D转换器(Digidata 1322A,Axon Instruments,USA);倒置相差显微镜(WN 203,Narishige,Japan);电极经横式拉制机(P-97 sutter,USA);超声震荡器(JG-4301,China);体视显微镜(S8APO,LEICA,Germany);Millipore超纯水仪 (Elix3/Mini-QBicel,Millipore,USA);Langendorff灌流装置(ML176,Austrilia);LETICA加热装置(LE13206,USA);PH测定仪(EUTECH,USA)。
1.3实验方法
1.3.1高血压心肌肥厚模型制备 按照Roussel E等[3]报道的方法建模。20只SD大鼠随机分成假手术组(n=10),腹主动脉缩窄模型组(n=10),术前用套尾法用大鼠无创血压计测量仪测量大鼠血压,每只测3次,取平均值。同时用3%戊巴比妥钠0.2 mL/100 g腹腔麻醉,沿中线切开腹腔后,推开肠管,暴露后腹膜,于右肾上方分离长约3 mm腹主动脉,穿线结扎,拔出针管,制备腹主动脉缩窄模型,假手术组除了结扎外,其余与腹主动脉缩窄模型组。术后一周套尾法测量大鼠血压≥150 mmHg为造模成功。造模结束,喂养4周。
1.3.2分离心肌细胞按照张良胜[4]等报道的方法分离心肌细胞:①首先用95%O2将酶液、KB液和无钙台氏液饱和30 min,打开恒温浴槽。②冲洗Langendorff系统,时间约10 min。③3%戊巴比妥钠0.2 mL/ 100 g腹腔麻醉成功后,打开大鼠胸腔,取出心脏,心脏固定在Langendorff系统上。④无钙台氏液冲洗,再换成消化酶液,冲洗速度8 mL/min,冲洗时间7~8 min,每分钟取一次心脏组织,取出后装在有KB液的10个小瓶中。⑤剪碎心肌组织块,吸管轻轻吹打,细胞混悬液过滤后4℃冰箱中备用。
1.3.3全细胞膜片钳记录瞬时外向钾电流 按照张良胜等报道的方法记录瞬时外向钾电流。采样方式为Clampex下的Episodic stimulation,采样频率为10 KHz[5-6]。
1.8统计方法
数据用Originpro 8.0进行统计分析实验结果以均数±标准差(±s)表示,两组间比较用t检验,P<0.05认为差异有统计学意义。
2 结果
2.1病理切片结果观察
大鼠病理结果如下:SH组心肌细胞纤维排列整齐,横纹清楚,细胞间隙正常,间质丰富(图1)。CAA组,心肌细胞排列紊乱,心肌细胞增粗肥大,间质水肿(图2)。
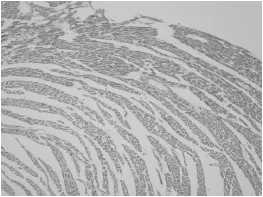
图1 SH组心肌细胞染色(HE,200倍)

图2 CAA组心肌细胞染色(HE,200倍)
2.2各组大鼠血压变化情况
两组达鼠在术前1周和术后4周血压变化值比较,见表1。
表1 各组大鼠血压变化值(±s)

表1 各组大鼠血压变化值(±s)
组别 术前一周(mmHg) 术后4周(mmHg)SH组(n=10)CAA组(n=10)t P 105±4.64 104±6.25 -1.020 0.335 106±6.34 158±6.58 -26.346 0.000
2.3心室肌细胞Ito电流变化
钳制电压在-80 mv,以10 mv为阶跃,-50 mv开始去极化,去极化至+70 mv,钳制时间300 ms引出Ito电流(图3)。分析记录Ito的电流强度,电流密度。
2.3.1电流密度从-40~-20 mv电位下,CAA组Ito电流密度略高于SH组,在钳制电位-10~+70mv,CAA 组Ito密度低于SH组(P<0.05),指令电压+70 mv时SH组(37.05±5.02)pA/pF,CAA组为(16.09±8.91)pA/ pF,差异有统计学意义(P<0.001)(表2)。
表2 各组Ito的电流密度(±s)

表2 各组Ito的电流密度(±s)
注:+70 mv电压下,CAA组与SH组相比差异有统计学意义,t= 16.052,P<0.000。
V(mv)CAA组(n=10)I/C (pA/pF)SH组(n=10)I/C (pA/pF)-50 -40 -30 -20 -10 0 +10 +20 +30 +40 +50 +60 +70 0.14±0.11 0.20±0.30 1.13±1.1 2.15±2.34 3.40±3.35 4.52±4.25 5.60±5.3 7.1±6.22 8.10±7.01 9.30±7.35 10.74±7.91 14.5±9.2 16.09±8.91 0.04±0.01 0.061±0.04 0.47±0.43 1.90±0.80 4.32±2.02 6.72±2.80 8.80±3.10 12.30±4.0 15.07±4.32 21.05±4.6 25.90±5.02 30.11±4.52 (37.05±5.02)*
2.3.2I-V曲线 两组的I-V曲线呈线性依赖性,呈内向整流特性,从指令电压-50~-20 mv,曲线走向相对平缓。从指令电压-20~+70 mv,SH组增幅较大,CAA电流增幅较小,在指令电压+10 mv以后更明显(图3、4)。
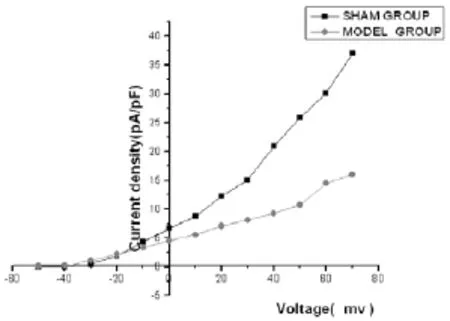
图3 CAA组与SH组心室肌细胞Ito的I-V曲线

图4 各组电流图及Ito刺激方案:A.SH组 B.CAA组 C.Ito刺激方案
3 讨论
原发性高血压是以动脉压升高为重要特征,长期的血压增高严重损伤心脑肾等重要器官,甚至出现生命意外。高血压心肌肥厚是机体对血流动力学负荷增加的一种反应,表现为心室壁增厚,心肌重量增加,心肌重构,心力衰竭等一系列心血管事件,是心血管事件的独立危险因素,病情进展者易导致心律失常和心力衰竭,心律失常的发生可加重心肌损害,恶化心功能,甚至引起患者猝死。
心肌肥厚的造模方法主要有[7]:①物理法:主要通过外界机械力、温度等条件改变,诱发动物形成疾病模型的过程。主要包括:运动导致心肌肥厚、容量负荷法、压力超负荷法和心肌梗死致心肌肥厚。容量负荷法、压力超负荷法和心肌梗死致心肌肥厚均采用手术的方法造模,这些方法造模时间短,价格低廉,重复性好,但创伤大,易造成腹腔感染[8-9]。②化学法:利用各种药物或者化学试剂对机体产生作用,形成心肌肥厚模型。最常用的为药物诱导,操作简单,心肌改变明显,耗时短,心肌改变明显等优点。③生物法:主要通过转基因技术或动物自身遗传因素获得某种疾病模型的方法,主要有转基因心肌肥厚动物模型和自发性高血压大鼠模型。
心肌细胞存在钠钾钙等多种离子通道,这些离子的正常分布和离子流规律活动是维持心肌细胞正常电活动的基础。K+是重要的离子流之一,对动作电位时程的长短具有决定性作用。其中Ito在心肌动作电位(active potential,AP)0相时被激活并参与了AP 1相复极过程。Ito分为Ito1和Ito2,Ito1研究较多,大多时候Ito是指Ito1,Ito1对2相动作电位的起始水平有重要的作用,不但参与Na+-Ca2+交换,也参与了LCa2+通道的活性调节,对动作电位时程有影响[10]。有报道认为Ito的减弱,心室复极时间延长,引发各种心律失常。研究Ito在高血压心肌肥厚中的变化有重要的临床意义。
该研究显示:在钳制电压为+70 mv时,CAA组的电流密度较SH组降低明显,差异有统计学意义(P<0.05),CAA组I-V曲线较SH组I-V曲线下移明显。该研究与刘星[11-12]等报道的瞬时外向钾电流在糖尿病心肌病中的变化结论一致,通过本研究说明当高血压心肌肥厚时,Ito的变化显著,这可能是高血压心肌肥厚易发生心律失常的原因之一。
总之,高血压心肌肥厚除了心肌结构改变外,也存在电活动的改变,其中Ito在高血压心肌肥厚电活动改变扮演着重要角色,研究该离子通道的相关影响因素及改变,利于阐明高血压心肌肥厚电活动的发生发展机制。
[1]Katholi RE,Couri DM.Left ventricular hypertrophy:major risk factor in patients with hypertension:update and practical clinical applications[J].Int J Hypertens,2011,2011:495349.
[2]汪接根,刘应才.醋柳黄酮通过钙调神经磷酸途径抑制心肌肥厚的研究[D].四川:泸州医学院,2013.
[3]Roussel E,Gaudreau E,Plante E,et al.Early reponses of the left ventricle to pressure overload in Wistar rats.[J].Life Sci,2008,82(5-6):265-272.
[4]张良胜,李平,许翔,等.大鼠心室肌细胞急性酶分离及瞬时外向钾电流的记录[J].中国当代医药,2014,21(22):20-22.
[5]张良胜,范忠才.瞬时外向钾电流在糖尿病心肌病电重构中的作用[D].四川:泸州医学院,2013.
[6]王华,曾晓荣.细胞内钙浓度变化对心房肌小电导钙激活钾通道电流的影响[D].四川:泸州医学院,2012.
[7]吴小龙,薛明明,司明明,等.心肌肥厚发生机制及药物治疗的研究[J].医学综述,2015,21(5):803-806.
[8]王超,张萍.高血压左心室肥厚形成机制的研究进展[J].重庆医学,2015,44(22):3143-3146.
[9]程杰坤,李乐.心肌肥厚动物模型建立方法研究进展[J].中国药房,2015,26(25):3584-3587.
[10]陆彤,王如兴,蒋彬.电压门控型钾离子通道家族[J].中国心脏起搏与心电生理杂志,2010,24(3):201-209.
[11]刘星,张良胜.瞬时外向钾电流在糖尿病心肌病电重构中的作用[J].中国当代医药,2014,21(25):4-11.
[12]刘星,张良胜.不同心功能糖尿病心肌病大鼠瞬时外向钾电流的变化及意义[J].山东医药,2015,55(25):16-19.
Comparison of Transient Outward Potassium Current in Hypertrophic Myocardium of Hypertensive Rats
ZHANG Liang-sheng1,ZHAI Chao-nan1,LIU Xing2
1.Department of Cardiology,Yongcheng People’s Hospital of Henan Province,Yongcheng,Henan Province,476600 China;2.Department of Cardiology,Affiliated Hospital of Luzhou Medical College,Luzhou,Sichuan Province,646000 China
R54
A
2096-1782(2016)07-0004-03
10.19368/j.cnki.2096-1782.2016.07.004
张良胜(1980-),男,河南永城人,硕士,主治医师,主要从事心血管内科。
2016-04-05)
