中国3个主栽烟草品种的差异蛋白质组学研究
2016-09-09晏国全余红秀
徐 莹,晏国全,张 扬,余红秀
(复旦大学生物医学研究院,上海 200032)
中国3个主栽烟草品种的差异蛋白质组学研究
徐 莹,晏国全,张 扬,余红秀
(复旦大学生物医学研究院,上海 200032)
【目的】从全蛋白质组学水平研究烟草,筛选具有重要特性的蛋白质,阐明其相关代谢通路,使得烟草的基础科学研究和品种培育工作有所突破。【方法】利用苯酚法提取中国 3个主栽烟草品种红花大金元、K326和云烟87叶片的蛋白质,酶解后采用串联质量标签技术(tandem mass tag,TMT)标记,结合二维液相色谱串联质谱技术(2D LC-MS/MS)对3个烟草品种叶片的蛋白质组成进行分析,运用Proteome Discoverer软件提取谱图后在 MASCOT 搜索引擎上鉴定蛋白质和肽段,并对鉴定的蛋白质进行系统的生物信息学分析,包括数据相关性分析、分层聚类分析和主成分分析,同时按照2倍上下调的原则采用火山图筛选不同品种烟草中表达差异显著的蛋白质,最后利用 KEGG通路分析烟草中重要蛋白质的分布及功能。【结果】鉴定红花大金元、K326和云烟 87烟草样品的蛋白质Group总数为3 079,蛋白质ID数为10 343。从分层聚类分析和主成分分析中蛋白质的整体表达情况可见,K326和云烟87蛋白质表达情况较相似,而红花大金元与前两者相差较大。后续的差异蛋白质筛选也验证了该结果,表现为云烟87和K326之间仅存在29个差异表达的蛋白质,其中13个蛋白质覆盖8条代谢通路,包括类黄酮生物合成,参与类黄酮合成路径的查尔酮合成酶在K326中的相对含量显著高于云烟87。红花大金元和云烟87之间有160个蛋白质差异表达,其中103个蛋白质覆盖42条代谢通路,包括谷胱甘肽代谢,相对定量结果显示谷胱甘肽代谢途径相关的3种酶,谷胱甘肽过氧化物酶、磷脂过氧化氢物谷胱甘肽过氧化物酶和谷胱甘肽S-转移酶在红花大金元中的含量均显著低于云烟87。红花大金元和K326之间存在119个差异蛋白质,其中89个蛋白质覆盖41条代谢通路,包括外源物质细胞色素P450代谢。筛选获得的重要差异蛋白质的相对定量结果显示一些与抗性相关的蛋白质,如蛋白酶抑制剂,在云烟87中的表达量远低于K326和红花大金元,同时结果表明红花大金元中的超氧化物歧化酶含量处于较低水平。【结论】TMT技术结合2D LC-MS/MS可对不同品种烟草的叶片蛋白质进行有效地分离和鉴定,鉴定出的蛋白质大部分是参与光合作用、物质代谢或者与抗逆性相关。
烟草;差异蛋白质组学;串联质量标签;二维液相色谱串联质谱
0 引言
【研究意义】烟草(Nicotiana tabacum),作为中国重要的经济作物[1],实现其质量、抗性等的精确改良和定向育种具有重要意义。随着烟草基因组学的蓬勃发展,日渐发现,仅仅探讨基因是远远不够的,蛋白质作为基因功能的直接体现者和最终执行者,是生物生命活动的基础[2-3]。因此,只有结合烟草基因的表达产物——蛋白质展开深入研究,才能破译其基因组序列中蕴藏的遗传信息,从而揭示烟草生命活动的本质[4]以突破传统育种的技术瓶颈。【前人研究进展】早前关于烟草蛋白质定性定量的研究,均基于二维凝胶电泳(2DE)分离结合基质辅助激光解吸附飞行时间质谱(MALDI-TOF-MS)鉴定的技术,如GHARECHAHI等[5]利用高分辨率二维凝胶电泳检测到930个蛋白点,但由于2DE在技术上存在一些挑战,导致多种可能具有重要功能的痕量调控蛋白难以被分离[6-8]。因此,更先进、更高通量、准确性和灵敏度的技术用于烟草蛋白质组学定性定量的研究显得尤为重要。随着蛋白质组学实验技术的日渐发展,二维凝胶电泳技术被取代,标记技术的发明极大地加速了蛋白质组学向更广和更深的领域发展。蔡永占等[9]报道利用 iTRAQ标记技术开展不同气候条件下云烟87叶片差异表达蛋白分析,最终注释到47个差异表达蛋白质,并分析得出这些蛋白质参与碳代谢、氮代谢和环境响应等生命进程。蔡永占等[10]在2个生态点的烟草叶片中检测到39个差异蛋白点。张柳等[1,11]采用iTRAQ标记方法共检测到烟草不同发育阶段432个差异表达蛋白质,其中注释到308个蛋白质与多种生命过程相关。【本研究切入点】以上研究均是有关不同外界环境或者不同发育阶段烟草的差异蛋白质组学,而利用标记技术开展关于不同烟草品种间差异蛋白质组学的研究却鲜见报道。【拟解决的关键问题】本研究以3个烟草品种红花大金元、K326和云烟87的叶片为研究材料,采用串联质量标签技术(tandem mass tags,TMT)结合液质联用技术,对不同品种烟草的蛋白表达进行比较研究,旨在分析不同烟草品种在蛋白质组学水平上存在的差异,为未来研究和发展烟草生理学奠定坚实的基础,也进一步为烟草品种的改良提供理论依据。
1 材料与方法
1.1 试验材料
红花大金元、K326和云烟87均为中国主栽烟草品种,三者各具特色。红花大金元,因其突出的、无法替代的香型特点而受到各卷烟企业的青睐[12-13],但其易烤性差,高感黑胫病[14-15];云烟 87是由云烟 2号和K326杂交选育而成,综合了双亲的优点[16],K326和云烟 87均易烘烤,中抗黑胫病[15]。烟草品种红花大金元、K326和云烟87的中部叶片,来自湖北中烟工业有限责任公司,种植于湖北恩施州沐抚基地,属中亚热带季风型山地湿润性气候,按照行距120 cm,株距55 cm,采用统一的大田管理措施。移栽后70 d(成熟前期),每个品种随机采集 9株烟草上 9—11叶位的中部叶片,重复采样2次,于4℃冰箱保存备用。
1.2 蛋白质样品的制备
每个烟草品种每份称取1 g叶片,液氮冷冻条件下,在预先冷却的研钵中将材料研磨成细碎的粉末。
1.3 蛋白质提取
林世锋等[17]通过比较 4种总蛋白的提取方法证明苯酚法提取分离得到的蛋白数量较多,杂质较少,分离效果较好,更适合后续分析。因此,利用苯酚法[18]进行叶片全蛋白提取。在离心管中加入3 mL提取缓冲液(500 mmol·L-1Tris-HCl缓冲液、500 mmol·L-1EDTA溶液、700 mmol·L-1蔗糖溶液、100 mmol·L-1KCl溶液,用HCl溶液调pH至8.0,使用前加入β-巯基乙醇和苯甲基磺酰氟,最终浓度分别为2%和1 mmol·L-1),并加入1 g研碎的烟草叶片,涡旋后在冰浴中振荡10 min,再加入等体积的Tris饱和酚,室温下振荡10 min后将样品离心(10 min、5 500 r/min、4℃),分层后最上层的苯酚转移至新的离心管中。在含蛋白质的苯酚液中加入3 mL的提取缓冲液进行反萃取,振荡3 min后涡旋;样品离心(10 min、5 500 r/min、4℃)后转移上层酚相至新离心管中,并加入4倍体积的沉淀液(预冷的0.1 mmol·L-1乙酸铵甲醇溶液)。颠倒振荡离心管,-20℃沉淀过夜。离心沉淀蛋白质(10 min、5 500 r/min、4℃)。离心后,用预冷沉淀液漂洗沉淀3次,最后用预冷丙酮漂洗。每一次漂洗后,样品均要离心(5 min、5 500 r/min、4℃)。真空干燥沉淀,-80℃贮藏充分干燥的蛋白质沉淀。
1.4 蛋白定量
根据 BRADFORD[19]的方法测定提取后的样品蛋白质浓度,以牛血清蛋白(BSA)作为蛋白标准品,作标准曲线,在λ=595 nm时,应用UV mini 1240紫外分光光度计测定出每个蛋白质样品在595 nm波长下的OD值,通过标准曲线方程计算相应蛋白质样品的浓度,剩余样品分装于-80℃冰箱冷藏备用。
1.5 酶解与标记
对提取的蛋白质样品进行还原烷基化处理,打开二硫键以便于蛋白质样品变性并利用蛋白酶进行水解。按照 1∶30比例在蛋白质样品中加入胰蛋白酶,37℃的条件下酶解16 h;TMT标记试剂平衡至室温,每管标记试剂中加入41 μL乙腈,涡旋1 min,离心甩至管底,将标记试剂分别加入对应肽段溶液中,不同样品用不同的同位素标记。126标记云烟蛋白质样品1(Y1),127标记云烟蛋白质样品2(Y2),128标记红花大金元蛋白质样品1(H1),129标记红花大金元蛋白质样品2(H2),130标记K326蛋白质样品1(K1),131标记K326蛋白质样品2(K2)。肽段与标记试剂混匀后,甩至管底,室温静置2 h,加入8 µL 5%羟胺,室温静置15 min以终止反应。将标记好的多个样品混合成一个样品,转移至新的离心管中。对真空抽干标记后的样品进行液相串联质谱分析。
1.6 液质联用
色谱条件:采用 Waters纳升级超高效液相色谱(UPLC®)系统。
第一维色谱条件:高pH流动相A为20 mmol·L-1甲酸铵,pH=10.0(色谱纯氨水调节);高pH流动相B为20 mmol·L-1甲酸铵,90%乙腈,pH=10.0(色谱纯氨水调节)。使用52 µL A相溶解除盐后的标记肽段粉末。在Waters公司H-Class超高压液相色谱系统上使用超高效色谱柱(BEH C18 1.7 µm,2.1 mm×50 mm)进行分离,上样50 µL。流速600 µL·min-1,在紫外光波长为215 nm条件下检测。从2 min开始,每0.5 min收集一管馏分。
第二维色谱Nano LC的洗脱条件及梯度:A液成分:水,0.1%甲酸,B液成分:乙腈,0.1%甲酸,色谱柱:类型C18,规格500 mm×75 µm,孔径100 Å,粒径2 μm,流速:300 nL·min-1,每个馏分溶解于32 µL A相中,上样8 µL,每个馏分运行2 h液质联用分析。
Q-Exactive质谱鉴定:将标记好的酶解产物经二维液相色谱分级分离并脱盐后用 Q-Exactive 质谱仪进行质谱分析。检测方式:离子化模式:正离子模式;离子源电压:1 800 V,毛细管温度:250℃;一级扫描范围:350—1 200 Da;二级扫描范围:依赖于一级母离子质荷比自动选择;碎裂模式:高能碰撞解离(higher energy collision dissociation,HCD)。获得差异表达肽段及其序列,并通过二级质谱中不同TMT的丰度及面积来计算不同样品间差异蛋白质的相对含量。
1.7 蛋白鉴定及数据库查询
运用 Proteome Discoverer软件提取谱图后在MASCOT搜索引擎(Version 2.3)中进行蛋白质和肽段鉴定。查询参数如下:数据库和库容:NCBI,104 349(茄科)。搜库条件:固定修饰设定为半胱氨酸碘脲甲基化;可变修饰为甲硫氨酸氧化、赖氨酸 TMT标记、肽段N端TMT标记;一级搜库误差为10×10-6mol·L-1;二级搜库误差为 50 mmu;最大漏切位点设为2;采用胰酶;使用Percolator算法进行数据卡值保证假阳性率(false positive rate,FDR)小于等于1%。搜索结束后,Proteome Discoverer软件根据Mascot搜索结果和第一步筛选后的谱图进行定量分析。
1.8 生物信息学分析
通过相关性分析、分层聚类分析(hierarchy clustering analysis,HCA)和主成分分析(principal component analysis,PCA)从不同角度对所有鉴定的蛋白质数据进行质量检测评估,并将定量数据按照2倍上下调的原则,利用火山图筛选不同品种烟草的差异蛋白质[20]。最后,利用KEGG通路分析烟草目标蛋白的分布及功能[21]。
2 结果
2.1 蛋白鉴定结果
经质谱鉴定和数据库查询,鉴定红花大金元、K326和云烟87烟草样品的蛋白质Group数为3 079,蛋白质ID数为10 343。
2.2 相关性分析
相关性散点图可通过散点图和数据来衡量样品间的相关性。从图1可以看出,H1和H2的相关性系数为0.966,系数较高表示红花大金元组内数据相关性较好。组间相关性系数低,线性差是可以接受的,说明不同烟叶品种间蛋白质表达谱差异较大。

图1 3种烟草蛋白质组数据的相关性散点图Fig. 1 Correlation scatter diagram of the protein data of three tobacco varieties
2.3 分层聚类分析
分层聚类分析是用3个烟草品种叶片蛋白质的表达值来重新排列蛋白,以识别其中最重要的差异蛋白质,具体是分配数据使其形成层层有严格等级的嵌套型子集,最终构成一个类似于家谱的树状结构[22],从而显示不同烟草品种具有代表性的差异表达蛋白群。通过对全部有定量信息的蛋白质进行分层聚类分析(图 2),蛋白质被分成表达上调(红色)、表达下调(绿色)和表达无差异(黑色)3种集群。组内样本相似度较高,先被聚成同一个亚簇,由于K326和云烟87样本蛋白质表达相似互相聚类,最终形成与红花大金元样本明显不同的一簇。由此可见,K326和云烟87叶片蛋白质表达相似度高,蛋白质表达量的上调与下调较为一致,但二者的蛋白质表达与红花大金元则存在较大差异。

图2 3种烟草蛋白质组的分层聚类分析Fig. 2 Hierarchy clustering analysis for the proteome of three tobacco varieties
2.4 主成分分析
主成分分析是基于原有变量建立两两不相关的反映差异蛋白质组数据原有信息的新变量信息[23],通过主成分分析构建了反映3个不同烟草品种差异蛋白质组信息的三维分析图(图 3),克服变量过多的复杂性,降低鉴定蛋白质的数据至低维度空间。直观地显示了样本的蛋白质组差异,云烟87和红花大金元的组内数据重复性较好,云烟87和红花大金元在第一主成分(component 1)和第三主成分(component 3)上均存在较大差异,在第二主成分(component 2)上差别很小。
2.5 差异蛋白质筛选及KEGG通路分析
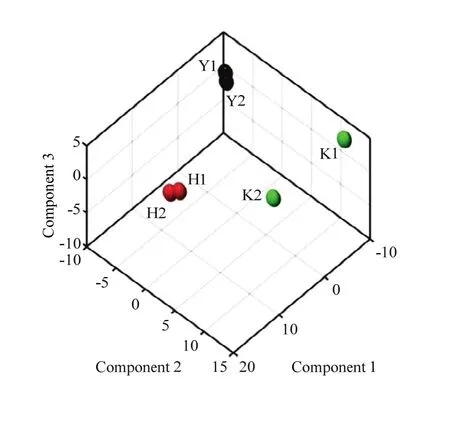
图3 3种烟草蛋白质组的主成分分析Fig. 3 Principal component analysis for the proteome of three tobacco varieties
通过控制2倍上下调来筛选品种间的差异蛋白质并进行KEGG通路分析(表1),K326和云烟87存在29个差异蛋白质(表1,图4-A),其中13个蛋白质覆盖8条代谢通路(表1),包括类黄酮生物合成(图 5)、氨基酸代谢等,并比较得出参与类黄酮合成路径的查尔酮合成酶(chalcone synthase,CHS,EC 2.3.1.74)在K326中的相对含量显著高于云烟87(图6)。红花大金元和云烟87存在160个差异蛋白质(表1,图4-B),其中103个蛋白质覆盖42条代谢通路(表1),包括谷胱甘肽代谢(图7)、TCA循环等,相对定量结果显示谷胱甘肽代谢途径中的谷胱甘肽过氧化物酶(glutathione peroxidase,GP,EC 1.11.1.9),磷脂过氧化氢物谷胱甘肽过氧化物酶(phospholipid hydroperoxide glutathione peroxidase,PHGPx,EC 1.11.1.12)和谷胱甘肽 S-转移酶(glutathione S-transferase,GST,EC 2.5.1.18)3种酶在红花大金元中的含量均显著低于云烟87(图8);K326和红花大金元存在119个差异蛋白质(表1,图4-C),其中89个蛋白质覆盖41条代谢通路(表1),包括外源物质细胞色素P450代谢等。图表中得出不同烟草品种间差异蛋白质的表达情况,也验证了分层聚类分析得出的关于K326和云烟87叶片蛋白质表达相似度高而二者与红花大金元存在较大差异的结果。
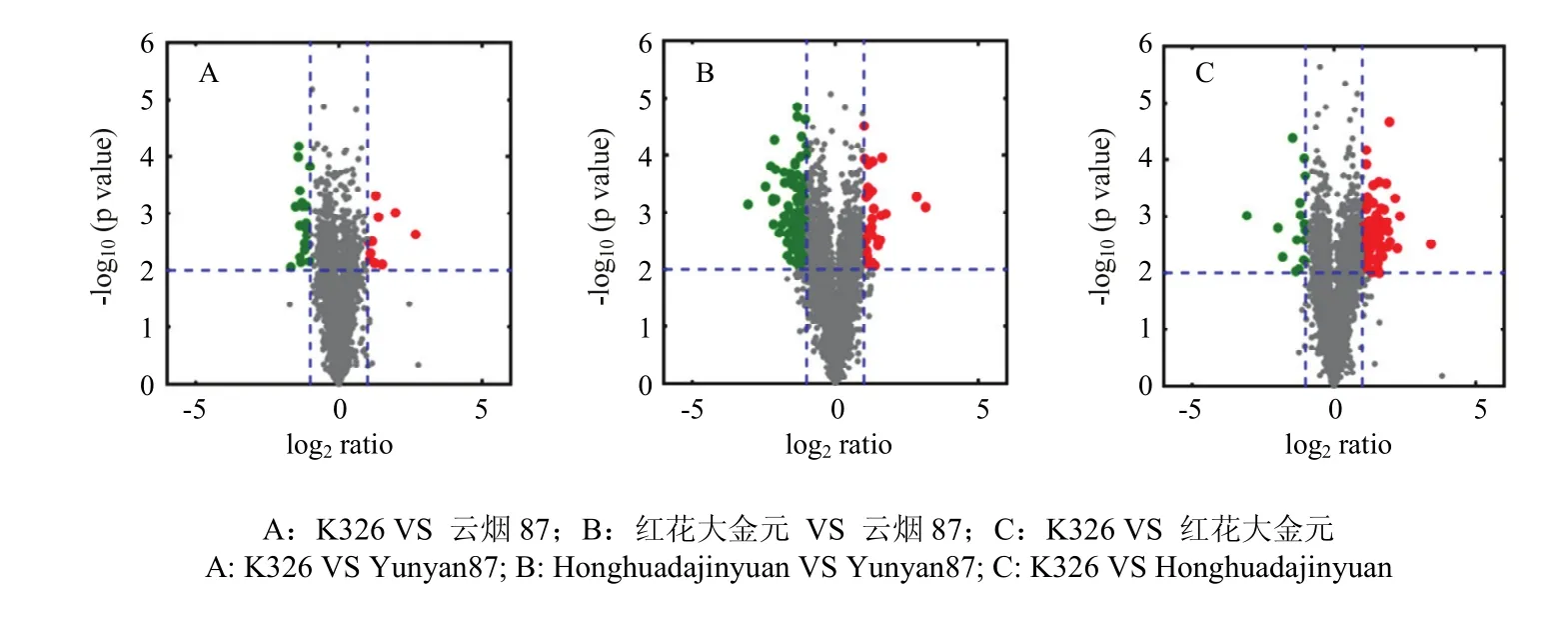
图4 3种烟草差异蛋白质的火山图Fig. 4 Volcano plot of the differentially expressed proteins of three tobacco varieties
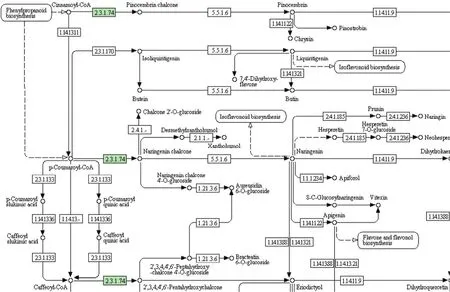
图5 类黄酮生物合成通路部分Fig. 5 Part of flavonoid biosynthesis pathway

表1 3种烟草差异表达蛋白的数目及其覆盖的代谢通路Table 1 Number of differentially expressed proteins and metabolic pathways covered by proteins of three tobacco varieties
其中,对于差异尤为明显的蛋白质进行相对定量分析(图9),云烟87中蛋白酶抑制剂的表达量远低于K326和红花大金元(图9-A),而在超氧化物歧化酶的含量方面则是红花大金元处于劣势(图9-B)。
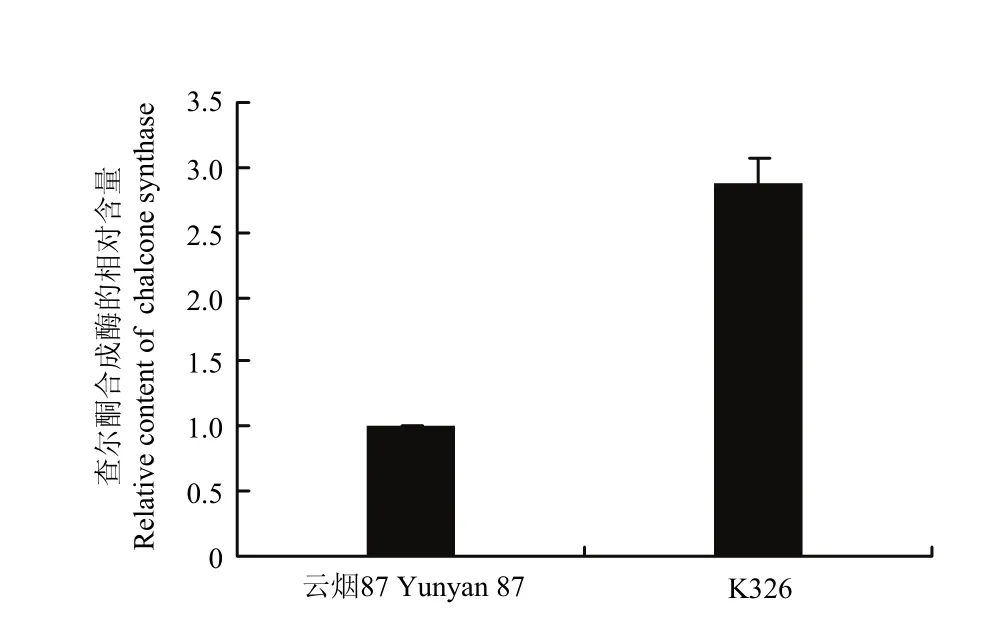
图6 云烟87和K326中查尔酮合成酶相对含量的比较Fig. 6 Comparison of relative content of chalcone synthase between Yunyan87 and K326
3 讨论
本研究运用串联质量标签技术,辅助液质联用鉴定红花大金元、K326和云烟87叶片的差异表达蛋白质,与XIE等[23]报道正常和受到盐胁迫的烟草中共鉴定到5 570个蛋白质、GHARECHAHI等[5]利用高分辨率二维凝胶电泳检测到烟草中930个蛋白点相比,本研究鉴定的蛋白质数量在目前已有报道的烟草蛋白质组学数据中属于规模最大的。
3.1 类黄酮的合成路径
云烟87和K326中存在的差异蛋白质参与图5中的类黄酮合成途径,途径中的查尔酮合成酶被报道是类黄酮合成的第一个关键酶[24]。烟草中的类黄酮化合物被李勇等[25]报道是烟草香味的重要前体物质,其分解产物可提高烟草的香气质量,改善烟草香味品质。表现为在烟叶生长、成熟、调制、醇化以及燃烧过程中转化产生次级产物从而直接影响烤烟的香气质和香气量[24]。类黄酮合成路径中的关键酶查尔酮合成酶在K326中的含量显著高于云烟87(图6),将有利于类黄酮的合成,与邓小华等[26]描述的在相同生态条件下,K326 在香气质和香气量上要优于云烟87的表现相一致。
除此之外,类黄酮在烟株的防御和抗逆机制中发挥关键性的作用[24]。类黄酮化合物是大多数氧自由基的清除剂,在植物生理学中扮演着重要角色,保护植物免受干旱和寒冷胁迫、紫外线辐射或病原体感染等[27],同时,类黄酮还具有潜在的药理价值,如自由基清除、抗氧化、抗炎、抗癌、软化血管以及抗脂质过氧化等[28]。总之,类黄酮化合物除了在植物生长和环境适应中发挥重要功能,还被证明有利于人类健康。
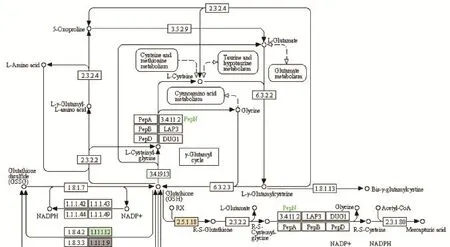
图7 谷胱甘肽代谢通路部分Fig. 7 Part of glutathione metabolism pathway
3.2 谷胱甘肽的代谢通路
红花大金元和云烟87的差异蛋白质覆盖了谷胱甘肽的代谢通路(图 6),该通路通过清除自由基和活性氧,以维持细胞正常代谢过程中活性氧自由基的动态平衡[29]。作为通路的主角,谷胱甘肽是由谷氨酸(Glu)、半胱氨酸(Cys)和甘氨酸(Gly)组成的一种含巯基的小分子肽[30],在细胞中以还原型(GSH)和氧化型(GSSG)2种形式存在[31-32]。谷胱甘肽参与细胞生长、分化、死亡和衰老的调节[33],比如VERNOUX等[34]和CAIRNS等[35]报道拟南芥GSH缺失突变体表型的分析显示GSH参与胚胎和分生组织的生长。GSH在防御和抵抗各种胁迫,如低温、干旱、盐碱、重金属等条件下发挥着至关重要的作用[32,36],是植物逆境胁迫应答中的关键性蛋白[37]。
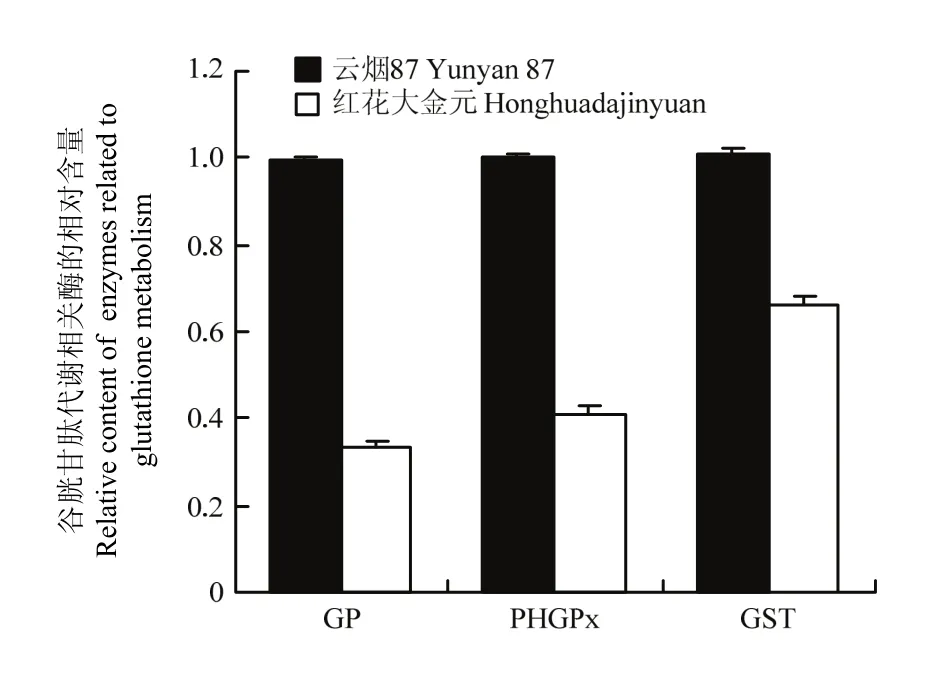
图8 云烟87和红花大金元中与谷胱甘肽代谢相关酶相对含量的比较Fig. 8 Comparison of relative content of enzymes related to glutathione metabolism between Yunyan87 and Honghuadajinyuan
谷胱甘肽过氧化物酶,磷脂过氧化氢物谷胱甘肽过氧化物酶和谷胱甘肽S-转移酶等保护性酶参与谷胱甘肽代谢通路(图 7)。谷胱甘肽过氧化物酶通过还原过氧化氢、有机羟过氧化物或相应醇类以减轻对机体造成的损伤[38]。对于谷胱甘肽代谢通路的理解有利于研究谷胱甘肽及其相关酶类的变化对细胞功能产生的影响[31]。磷脂过氧化氢物谷胱甘肽过氧化物酶又称为谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPx4),是谷胱甘肽过氧化物酶家族中第二个被鉴定的细胞内含硒酶[39],也是GP家族中唯一能还原膜内氢过氧化物的酶[38]。

图9 3种烟草中抗性相关差异蛋白质蛋白酶抑制剂(A)和超氧化物歧化酶(B)相对含量的比较Fig. 9 Comparison of relative content of differentially expressed proteins related to resistance such as proteinase inhibitor (A) and superoxide dismutase (B) in three tobacco varieties
植物中的谷胱甘肽S-转移酶通过催化谷胱甘肽与有毒异源物或氧化产物的亲核加成以促进该类物质的代谢,实现清除或者区域化隔离[40-41]。谷胱甘肽S-转移酶具有多元生物功能,在植物抗逆境胁迫以及维持植物的新陈代谢等方面发挥重要作用[42]。EDWARDS等[43]表明谷胱甘肽 S-转移酶表达的上调可作为植物应对逆境压力的标志之一。3种保护性酶在红花大金元中的含量均显著低于云烟87(图8)。该结果与张树堂[12]和解芬等[44]所报道红花大金元的抗逆性高截然相反,因为逆境条件分为多种多样,一方面谷胱甘肽代谢相关的酶只覆盖了抗性的一部分,另一方面他人的研究是关于抗性的综合性评价,而且烟草的抗逆性与所处的区域环境等也是息息相关,如云烟87在湖北环神农架地区和云南昭通抗赤星病能力均低于 K326和红花大金元[45-46],而在酉阳烟区云烟87的赤星病发病率是检测的10个品种中最低的,低于K326和红花大金元[47]。由此可见,相关酶类对烟草抗逆性的调节过程是复杂的。
3.3 细胞色素P450相关代谢通路
红花大金元和K326的差异蛋白质覆盖的代谢通路涉及细胞色素P450,细胞色素P450是一个庞大而重要的血红素单氧酶超家族,有着广泛的酶底物和相应的功能[48],作用于内质网、线粒体、质体、高尔基体和其他膜性细胞器。该家族不仅参与植物的基本新陈代谢,也参与次生代谢,主要在2个生命过程中发挥功能:(a)次生代谢产物如类黄酮、生物碱、萜类化合物等的生物合成和(b)有毒的外源性化学物质的降解[49-50]。而其中烟草生物碱的合成是其体内有害物质的重要路径,萜类化合物的代谢是烟草香气物质的重要来源。由此可见,细胞色素 P450对于提升烟草香味的间接作用非同小可[50]。从图 10中比较细胞色素P450在红花大金元中含量高于K326,不能否认细胞色素 P450所产生的次生代谢物在红花大金元的独特香味方面所做出的贡献,但究竟是何种代谢产物占主导地位以及细胞色素 P450的具体调控机制均有待下一步的研究与探讨。
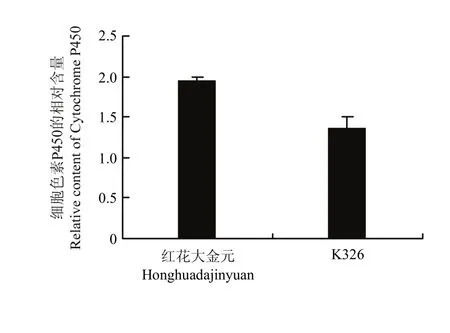
图10 红花大金元和K326中细胞色素P450相对含量的比较Fig. 10 Comparison of relative content of cytochrome P450 between Honghuadajinyuan and K326
3 .4 抗性相关蛋白质的分析
蛋白酶抑制剂(proteinase inhibitor,PI)是一种广泛存在于多种植物中抑制蛋白水解酶的小分子蛋白或多肽[51]。一般分为4类:丝氨酸类、半胱氨酸类、天冬氨酸类和金属类蛋白酶抑制剂[52]。之前有多项证据表明蛋白酶抑制剂具有抗虫性,其通过抑制植食性昆虫蛋白水解酶的活性而在植物防御昆虫的过程中发挥作用,作用的有效性取决于蛋白酶抑制剂与靶向昆虫消化道内主要蛋白酶之间的亲合性和特异性[53]。由于昆虫肠道内多为丝氨酸蛋白酶,因此,丝氨酸类蛋白酶抑制剂与植物的抗虫性关系更为紧密。孙兴华等[54]认为培育蛋白酶抑制剂含量高或易诱导的黄瓜品种有可能是控制有害昆虫南美斑潜蝇的有效途径。HILDER等[55]首次报道 PI在转基因植物的运用是将豇豆中的胰蛋白酶抑制剂转入烟草,产生了相对于非转基因烟草的抗绿棉铃虫的烟草品种。JULIA等[52]也验证了蛋白酶抑制剂可用于提高转基因植物对昆虫的抗性。图9-A中可以看出,红花大金元与K326中蛋白酶抑制剂的含量相差无几,而云烟87中蛋白酶抑制剂的含量几乎不足红花大金元和K326含量的二分之一。鉴于上文实例,云烟87的抗虫性有望通过诱导蛋白酶抑制剂的表达而得到进一步的改善。
超氧化物歧化酶(superoxide dismutase,SOD)是一种抗氧化金属酶[56],是烟草抗逆机制中的关键酶。根据活性位点金属辅助因子的不同分为4个分布广泛且功能重要的亚型:Cu/Zn-SOD、Mn-SOD、Fe-SOD和Ni-SOD[57]。一般通过催化超氧化物自由基生成过氧化氢和氧气来发挥防御氧化损伤的作用。Fe-SOD在烟草中可能与光合作用有关,Mn-SOD可能与线粒体呼吸,胞质中的生化途径有关;同样地,叶绿素中的 Cu/Zn-SOD也与胞质中的生化途径关系紧密[58]。CAMP等[57]表明SOD的表达在胞质和叶绿素亚型抗逆中的重要性,并表明SOD的活性是植物受到氧化胁迫时抗损伤的一个潜在限速因子,其研究结果显示,由AhCuZnSOD超表达导致SOD活性水平的上升可能促进由各种环境引起烟草的氧化损伤的恢复。多项研究[14,59-60]均表明SOD的活性与烟草的抗黑胫病能力呈正相关,并且可将SOD的活性作为鉴别黑胫病抗性的生理生化指标之一,由此可见,SOD对烟草黑胫病防御能力的意义重大。图9-B中显示SOD在红花大金元的表达量均要低于K326和云烟87,而红花大金元是易感黑胫病的[14-15],也就是SOD在抗黑胫病品种K326和云烟87中高表达而在感黑胫病品种红花大金元中低表达,这在某种程度上证实了前人的结论,也有助于进一步展开烟草黑胫病与烟草中关键性酶相关作用机制的研究。
4 结论
K326和云烟 87的蛋白质表达谱存在一定的相似性,而与红花大金元相差较大,差异蛋白质的筛选结果也与之吻合。其中部分差异蛋白质参与了光合作用、能量代谢、抗逆境胁迫等重要路径,在维持烟草正常生理功能,提高生存能力方面发挥关键性作用。
References
[1] 张柳, 王铮, 张亚婕, 林春, 陈严平, 李军营, 毛自朝. 烟草叶片衰老期过程中的蛋白质组学分析. 植物生理学报, 2014, 50(4):488-500.ZHANG L, WANG Z, ZHANG Y J, LIN C, CHEN Y P, LI J Y, MAO Z C. Proteomic analysis of senescing leaf of tobacco. Plant Physiology Journal, 2014, 50(4): 488-500. (in Chinese)
[2] UHRIG R G, MOORHEAD G B. Plant proteomics: Current status and future prospects. Journal of Proteomics, 2013, 88: 34-36.
[3] 柴薇薇, 普晓俊, 乔岩, 杨芳. 蛋白质组学在植物逆境胁迫研究中的进展. 生物学杂志, 2013, 30(6): 70-75. CHAI W W, PU X J, QIAO Y, YANG F. Advances in plant proteomics research under abiotic stress. Journal of Biology, 2013, 30(6): 70-75. (in Chinese)
[4] 刘秋员, 刘峰峰, 甄焕菊, 张军方, 符云鹏. 蛋白质组学研究技术及其在烟草科学研究中的应用前景. 中国农学通报, 2009, 25(2):93-99. LIU Q Y, LIU F F, ZHEN H J, ZHANG J F, FU Y P. Advances in research techniques of proteomics and its application in tobacco scientific research. Chinese Agricultural Science Bulletin, 2009, 25(2):93-99. (in Chinese)
[5] GHARECHAHI J, HAJIREZAEI M, SALEKDEH G H. Comparative proteomic analysis of tobacco expressing cyanobacterial flavodoxin and its wild type under drought stress. Journal of Plant Physiology,2015, 175: 48-58.
[6] 赵凤霞, 高相彬, 王正平, 李海峰, 宋学立, 冀敏. 蛋白质组学技术在烟草研究中的应用进展. 中国烟草学报, 2014, 20(1): 103-110. ZHAO F X, GAO X B, WANG Z P, LI H F, SONG X L, JI M. Research and application of proteomics in tobacco. Acta Tabacaria Sinica, 2014, 20(1): 103-110. (in Chinese)
[7] 崔红, 冀浩, 张华, 邵惠芳, 李东宵, 陈亮. 不同生态区烟草叶片蛋白质组学的比较. 生态学报, 2008, 28(10): 4873-4880. CUI H, JI H, ZHANG H, SHAO H F, LI D X, CHEN L. Comparative analysis of leaf proteomes between tobacco plants growing in different ecological regions of China. Acta Ecologica Sinica, 2008,28(10): 4873-4880. (in Chinese)
[8] 陈宗瑜, 毕婷, 吴潇潇. 滤减UV-B辐射对烤烟蛋白质组变化的影响. 生态学杂志, 2012, 31(5): 1129-1135. CHEN Z Y, BI T, WU X X. Effects of reduced UV- B radiation on the variation of flue-cured tobacco proteome. Chinese Journal of Ecology,2012, 31(5): 1129-1135. (in Chinese)
[9] 蔡永占, 周普雄, 张柳, 王铮, 徐琼华, 杨焕文, 毛自朝. 不同气候条件对“云烟 87”旺长期叶片光合速率及蛋白表达的影响. 中国烟草学报, 2015, 21(1): 39-48. CAI Y Z, ZHOU P X, ZHANG L, WANG Z, XU Q H, YANG H W,MAO Z C. Effects of climate conditions on photosynthetic rate and protein expression in Yunyan 87 leaves at vigorous growth stage. Acta Tabacaria Sinica, 2015, 21(1): 39-48. (in Chinese)
[10] 蔡永占, 周普雄, 李佛琳, 赵昶灵, 林春, 杨焕文, 毛自朝. 不同气候环境中团棵期烟草叶片蛋白质组学分析. 中国农业科学, 2013,46(4): 859-870. CAI Y Z, ZHOU P X, LI F L, ZHAO C L, LIN C, YANG H W, MAO Z C. Proteomic analysis of tobacco rosette stage leaves under different climatic conditions. Scientia Agricultura Sinica, 2013, 46(4): 859-870. (in Chinese)
[11] 张柳. 烟草叶片衰老过程变化的蛋白质组和转录组研究[D]. 昆明:云南农业大学, 2014. ZHANG L. Changes of proteome and transcriptome of tobacco leaf during senescencing process [D]. Kunming: Yunnan Agricultural University, 2014. (in Chinese)
[12] 张树堂. 红花大金元品种品质特征. 湖南农业大学学报(自然科学版), 2007, 33(2): 170-173. ZHANG S T. Explore the feature of quality of Honghuadajinyuan variety. Journal of Hunan Agricultural University(Natural Sciences),2007, 33(2): 170-173. (in Chinese)
[13] 汪健, 杨云高, 王松峰, 俞世康, 孙福山, 王爱华, 程浩, 王林. 烤烟红花大金元上部叶采收方式研究. 中国烟草科学, 2010, 31(2):15-19. WANG J, YANG Y G, WANG S F, YU S K, SUN F S, WANG A H,CHENG H, WANG L. Harvest method of upper leaves of flue-cured tobacco variety Honghuadajinyuan. Chinese Tobacco Science, 2010,31(2): 15-19. (in Chinese)
[14] 王戈, 杨焕文, 赵正雄, 李佛琳, 易建华. 烟草品种防御酶活性对黑胫病菌响应差异. 云南农业大学学报(自然科学), 2012, 27(3):321-326. WANG G, YANG H W, ZHAO Z X, LI F L, YI J H. Response difference of the defence enzymes of flue-cured cultivars to Phytophora parasitica var. nicotiana. Journal of Yunnan Agricultural University (Natural Sciences), 2012, 27(3): 321-326. (in Chinese)
[15] 梁元存, 刘延荣, 王玉军, 王智发, 张广民. 烟草黑胫病菌致病性分化和烟草品种的抗病性差异. 植物保护学报, 2003, 30(2):143-147. LIANG Y C, LIU Y R, WANG Y J, WANG Z F, ZHANG G M. Pathogenicity differentiation of Phytophthora parasitica and the disease resisitance differnence of tobacco against black shank. Acta Phytophylacica Sinica, 2003, 30(2): 143-147. (in Chinese)
[16] 李永平, 王颖宽, 马文广, 谭彩兰. 烤烟新品种云烟87的选育及特征特性. 中国烟草科学, 2001(4): 38-42. LI Y P, WANG Y K, MA W G, TAN C L. Breeding and selecting of a new flue-cured tobacco variety Yunyan87 and its characteristics,Chinese Tobacco Science, 2001(4): 38-42. (in Chinese)
[17] 林世峰, 张拓, 史跃伟, 王东茂, 王志红, 杨志晓, 谢升东, 魏开华,任学良. 烟草根系蛋白质双向电泳样品制备方法的比较. 贵州农业科学, 2012, 40(8): 71-74. LIN S F, ZHANG T, SHI Y W, WANG D M, WANG Z H, YANG Z X,XIE S D, WEI K H, REN X L. Comparison of protein extraction methods for two-dimensional electrophoresis in tobacco root. Guizhou Agricultural Sciences, 2012, 40(8): 71-74. (in Chinese)
[18] ISAACSON T, DAMASCENO C M, SARAVANAN R S, HE Y H,CATALÁ C, SALADIÉ M, ROSE J K. Sample extraction techniques for enhanced proteomic analysis of plant tissues. Nature Protocols,2006, 1(2): 769-774.
[19] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 1976, 72(1/2): 248-254.
[20] 李洪荣, 陈美元, 廖剑华, 蔡志欣, 郭仲杰, 王泽生. 双孢蘑菇子实体采后后熟的差异蛋白质组学分析. 福建轻纺, 2014(1): 38-42. LI H R, CHEN M Y, LIAO J H, CAI Z X, GUO Z J, WANG Z S. Differencial proteomic analysis of postharvest ripening of the fruiting body of agaricus bisporus. Fujian Qing Fang, 2014(1): 38-42. (in Chinese)
[21] 黄瑞, 郑珩. 偏头痛相关酶和KEGG通路分析. 生物信息学, 2014,12(3): 218-226. HUANG R, ZHENG H. Migraine associated enzymes and KEGG pathway analysis. China Journal of Bioinformatics, 2014, 12(3):218-226. (in Chinese)
[22] 刘靖宇, 江玉姬, 谢宝贵, 陈炳智, 廖伟, 邓优锦. iTRAQ结合2D LC-MS/MS技术在草菇不同生长发育时期蛋白质组分析中的应用.微生物学通报, 2012, 39(6): 853-864. LIU J Y, JIANG Y J, XIE B G, CHEN B Z, LIAO W, DENG Y J. Comparative analysis of proteomic profile at different development stages of Volvariella volvacea by iTRAQ-coupled 2D LC-MSMS. Microbiology, 2012, 39(6): 853-864. (in Chinese)
[23] XIE H, YANG D H, YAO H, BAI G, ZHANG Y H, XIAO B G. iTRAQ-based quantitative proteomic analysis reveals proteomic changes in leaves of cultivated tobacco (Nicotiana tabacum) in response to drought stress. Biochemical and Biophysical Research Communications, 2016, 469(3): 768-775.
[24] 李亚培, 杨铁钊, 申培林, 尚晓颍. 烟草黄酮类物质及其与品质的关系. 浙江农业科学, 2010(6): 1391-1396. LI Y P, YANG T Z, SHEN P L, SHANG X Y. Flavonoids in tobacco and its relationship with the quality of tobacco. Journal of Zhejiang Agricultural Sciences, 2010(6): 1391-1396. (in Chinese)
[25] 李勇, 林茜, 逄涛, 师君丽. 超高效液相色谱-串联质谱法定量分析烟叶中的12种类黄酮物质. 色谱, 2015, 33(7): 746-752. LI Y, LIN Q, PANG T, SHI J L. Determination of 12 flavonoids in tobacco leaves using ultra-high performance liquid chromatographytandem mass spectrometry. Chinese Journal of Chromatography, 2015,33(7): 746-752. (in Chinese)
[26] 邓小华, 覃勇, 周米良, 田峰, 田茂成, 张黎明, 杨丽丽. 湘西烟叶香气特性及其区域分布特征. 北京农学院学报, 2013, 28(4): 16-21. DENG X H, QIN Y, ZHOU M L, TIAN F, TIAN M C, ZHANG L M,YANG L L. Aroma characteristics of tobacco leaves from Xiangxi areas and their regional distribution characteristics. Journal of Beijing University of Agriculture, 2013, 28(4): 16-21. (in Chinese)
[27] 邹凤莲, 寿森炎, 叶纨芝, 卢钢. 类黄酮化合物在植物胁迫反应中作用的研究进展. 细胞生物学杂志, 2004, 26(1): 39-44. ZOU F L, SHOU S Y, YE W Z, LU G. Advances in the research on flavonoid biosynthesis and plant stress response. Chinese Journal of Cell Biology, 2004, 26(1): 39-44. (in Chinese)
[28] 乔小燕, 马春雷, 陈亮. 植物类黄酮生物合成途径及重要基因的调控. 天然产物研究与开发, 2009, 21(2): 354-360. QIAO X Y, MA C L, CHEN L. Plant flavonoid biosynthesis pathway and regulation of its important genes. Natural Product Research and Development, 2009, 21(2): 354-360. (in Chinese)
[29] 闫慧芳, 毛培胜, 夏方山. 植物抗氧化剂谷胱甘肽研究进展. 草地学报, 2013, 21(3): 428-434. YAN H F, MAO P S, XIA F S. Research progress in plant antioxidant glutathione. Acta Agrestia Sinica, 2013, 21(3): 428-434. (in Chinese)
[30] GILL S S, ANJUM N A, HASANUZZAMAN M, GILL R, TRIVEDI D K, AHMAD I, PEREIRA E, TUTEJA N. Glutathione and glutathione reductase: A boon in disguise for plant abiotic stress defense operations. Plant Physiology and Biochemistry, 2013, 70:204-212.
[31] 胡文琴, 王恬, 孟庆利. 抗氧化活性肽的研究进展. 中国油脂,2004, 29(5): 42-45. HU W Q, WANG T, MENG Q L. Research advance of antioxidative bioactive peptides. China Oils and Fats, 2004, 29(5): 42-45. (in Chinese)
[32] MAHER P. The effects of stress and aging on glutathione metabolism. Ageing Research Reviews, 2005, 4(2): 288-314.
[33] ZENG F R, QIU B Y, WU X J, NIU S Z, WU F B, ZHANG G P. Glutathione-mediated alleviation of chromium toxicity in rice plants. Biological Trace Element Research, 2012, 148(2): 255-263.
[34] VERNOUX T, WILSON R C, SEELEY K A, REICHHELD J P,MUROY S, BROWN S, MAUGHAN S C, COBBETT C S,MONTAGU M V, INZE D, MAY M J, SUNG Z R. The ROOT MERISTEMLESS1/CADMIUM SENSITIVE2 gene defines a glutathione dependent pathway involved in initiation and maintenance of cell division during postembryonic root development. The Plant Cell, 2000, 12: 97-110.
[35] CAIRNS N G, PASTERNAK M, WACHTER A, COBBETT C S,MEYER A J. Maturation of Arabidopsis seeds is dependent on glutathione biosynthesis within the embryo. Plant Physiology, 2006,141: 446-455.
[36] FRENDO P, BALDACCI-CRESP F, BENYAMINA S M, PUPPO A. Glutathione and plant response to the biotic environment. Free Radical Biology and Medicine, 2013, 65: 724-730.
[37] 李志刚, 许自成, 苏永士, 陈彦春, 胡皓月, 张蕊, 杜娟. 植物谷胱甘肽研究进展. 江西农业学报, 2010, 22(4): 118-121. LI Z G, XU Z C, SU Y S, CHEN Y C, HU H Y, ZHANG R, DU J. Research progress in plant glutathione. Acta Agriculturae Jiangxi,2010, 22(4): 118-121. (in Chinese)
[38] BRIGELIUS-FLOHÉ R, MAIORINO M. Glutathione peroxidases. Biochimica et Biophysica Acta (BBA)-General Subjects, 2013,1830(5): 3289-3303.
[39] 李伟涛, 朱伟杰, 潘善培. 磷脂过氧化氢物谷胱甘肽过氧化物酶与精子成熟. 中华男科学, 2001, 7(2): 109-112. LI W T, ZHU W J, PAN S P. Advances in phospholipid hydroperoxide glutathione peroxidase and sperm maturation. National Journal of Andrology, 2001, 7(2): 109-112. (in Chinese)
[40] 宋长芹, 缪海飞, 朱斌, 佟少明, 李泽昀, 侯和胜. 植物谷胱甘肽-S-转移酶在植物修复中的作用. 安徽农学通报, 2010, 16(7): 56. SONG C Q, MIAO H F, ZHU B, TONG S M, LI Z Y, HOU H S. The role of Glutathione-S-transferase in phytoremediation of plants. Anhui Agricultural Science Bulletin, 2010, 16(7): 56. (in Chinese)
[41] 陈秀华, 王臻昱, 李先平, 朱延明, 刘丽, 陈威, 陈勤. 谷胱甘肽S-转移酶的研究进展. 东北农业大学学报, 2013, 44(1): 149-153. CHEN X H, WANG Z Y, LI X P, ZHU Y M, LIU L, CHEN W, CHEN Q. Research progress on glutathione S-transferases. Journal of Northeast Agricultural University, 2013, 44(1): 149-153. (in Chinese)
[42] 张岩, 胡军, 郭长虹, 徐香玲, 李集临, 胡赞民. 植物谷胱甘肽-S-转移酶的分子生物学研究进展. 哈尔滨师范大学自然科学学报,2007, 23(4): 76-79. ZHANG Y, HU J, GUO C H, XU X L, LI J L, HU Z M. The molecular biology research of glutathione-S-tranferases (GSTs) in plants. Natural Sciences Journal of Harbin Normal University, 2007,23(4): 76-79. (in Chinese)
[43] EDWARDS R, DIXON D P, WALBOT V. Plant glutathione S-transferases: Enzymes with multiple functions in sickness and in health. Trends in Plant Science, 2000, 5(5): 193-198.
[44] 解芬, 马原, 胡琼, 王铎, 杨丽菊. 烤烟品种红花大金元在小哨地区的推广试验研究. 现代农业科技, 2014(20): 53-55. JIE F, MA Y, HU Q, WANG D, YANG L J. Promotion test of flue-cured tobacco varieties of Hongda in the Xiaoshao. Modern Agricultural Science and Technology, 2014(20): 53-55. (in Chinese)
[45] 曹仕明, 李进平, 刘圣高, 陈振国, 许汝冰, 毕庆文, 许树银, 范敬修, 王学龙, 郭力, 汪明. 7个引进烤烟品种在环神农架地区的生态适应性. 贵州农业科学, 2012, 40(7): 60-65. CAO S M, LI J P, LIU S G, CHEN Z G, XU R B, BI Q W, XU S Y,FAN J X, WANG X L, GUO L, WANG M. Ecological adaptability of seven introduced flue-cured tobacco cultivars around Shennongjia region. Guizhou Agricultural Sciences, 2012, 40(7): 60-65. (in Chinese)
[46] 陈晓燕, 刘燕, 付修廷, 李崇禄, 易克, 赵正雄, 杨虹琦. 云南昭通植烟区烤烟品种生态适应性研究. 湖南农业科学, 2012(17): 22-25. CHEN X Y, LIU Y, FU X T, LI C L, YI K, ZHAO Z X, YANG H Q. Ecological adaptability of flue-cured tobacco varieties in Zhaotong tobacco-planting area in Yunnan province. Hunan Agricultural Sciences, 2012(17): 22-25. (in Chinese)
[47] 张文平, 汪代斌, 曾超宁, 张帅. 不同烟草品种对烟草赤星病的抗性比较. 安徽农业科学, 2014, 42(35): 12513-12515. ZHANG W P, WANG D B, ZENG C N, ZHANG S. Comparison on resistance of different tobacco varieties against tobacco brown spot. Journal of Anhui Agricultural Science, 2014, 42(35): 12513-12515. (in Chinese)
[48] DENISOV I G, FRANK D J, SLIGAR S G. Cooperative properties of cytochromes P450. Pharmacology & Therapeutics, 2009, 124(2):151-167.
[49] ZHAO Y J, CHENG Q Q, SU P, CHEN X, WANG X J, GAO W,HUANG L Q. Research progress relating to the role of cytochrome P450 in the biosynthesis of terpenoids in medicinal plants. Applied Microbiology and Biotechnology, 2014, 98(6): 2371-2383.
[50] 解敏敏, 龚达平, 李凤霞, 刘贯山, 孙玉合. 烟草细胞色素P450的基因组学分析. 遗传, 2013, 35(3): 379-387. XIE M M, GONG D P, LI F X, LIU G S, SUN Y H. Genome-wide analysis of cytochrome P450 monooxygenase genes in the tobacco. Hereditas, 2013, 35(3): 379-387. (in Chinese)
[51] 王转花, 杨斌, 张政. 植物蛋白酶抑制剂抗虫基因工程研究进展.植物保护学报, 2001, 28(1): 83-88. WANG Z H, YANG B, ZHANG Z. Recent progress in the genetic engineering of plant proteinase inhibitor anti-insect pests. Acta Phytophylacica Sinica, 2001, 28(1): 83-88. (in Chinese)
[52] JULIA A C, MARILYN A A, DENNIS J B, MALCOLM W,HIGGINS T J V. Transgenic tobacco and peas expressing a proteinase inhibitor from Nicotiana alata have increased insect resistance. Molecular Breeding, 1999, 5: 357-365.
[53] TAMAYO M C, RUFAT M, BRAVO J M, SEGUNDO B S. Accumulation of a maize proteinase inhibitor in response to wounding and insect feeding, and characterization of its activity toward digestive proteinases of Spodoptera littoralis larvae. Planta, 2000, 211(1):62-71.
[54] 孙兴华, 周晓榕, 庞保平, 孟庆玖. 南美斑潜蝇为害对黄瓜叶片中蛋白酶抑制剂活性及葫芦素 B含量的影响. 应用昆虫学报, 2014,51(1): 169-177. SUN X H, ZHOU X R, PANG B P, MENG Q J. Effects of Liriomyza huidobrensis (Blanchard) larval infestation on trypsin and chymotrypsin activity and cucurbitacin B content in cucumber leaves. Chinese Journal of Applied Entomology, 2014, 51(1): 169-177. (in Chinese)
[55] HILDER V A, GATEHOUSE A M R, SHEERMAN S E, BARKER R F, BOULTER D. A novel mechanism of insect resistance engineered into tobacco. Nature, 1987, 300: 160-163.
[56] NIYOMPLOY P, SRISOMSAP C, CHOKCHAICHAMNANKIT D,VINAYAVEKHIN N, KARNCHANATAT A, SANGVANICH P. Superoxide dismutase isozyme detection using two-dimensional gel electrophoresis zymograms. Journal of Pharmaceutical and Biomedical Analysis, 2014, 90: 72-77.
[57] CAMP W V, INZÉ D, MONTAGU M V. The regulation and function of tobacco superoxide dismutases. Free Radical Biology & Medicine,1997, 23(3): 515-520.
[58] NEGI N P, SHRIVASTAVA D C, SHARMA V, SARIN N B. Overexpression of CuZnSOD from Arachis hypogaea alleviates salinity and drought stress in tobacco. Plant Cell Reports, 2015, 34(7):1109-1126.
[59] 江彤, 杨建卿, 高明, 孔俊. 不同抗病性烟草罹黑胫病后几种酶的活性及丙二醛含量的变化. 安徽农业大学学报, 2006, 33(2):218-221. JIANG T, YANG J Q, GAO M, KONG J. Changes of MDA content and activities of some enzymes in tobacco varieties with different disease resistance infected with Phytophthora nicotianae. Journal of Anhui Agricultural University, 2006, 33(2): 218-221. (in Chinese)
[60] 杨建卿, 许大凤, 孔俊, 江彤. 不同烟草品种罹黑胫病后几种酶活性的变化. 合肥工业大学学报(自然科学版), 2005, 28(7): 816-819. YANG J Q, XU D F, KONG J, JIANG T. Change of activities of some enzymes in different tobacco varieties infected with Phytophthora nicotianae. Journal of Hefei University of Technology (Natural Sciences), 2005, 28(7): 816-819. (in Chinese)
(责任编辑 李莉)
Differential Proteomic Research of Three Varieties of Tobacco in China
XU Ying, YAN Guo-quan, ZHANG Yang, YU Hong-xiu
(Institutes of Biomedical Sciences, Fudan University, Shanghai 200032)
【Objective】 In order to strengthen the basic scientific research and cultivation of tobacco, differential proteomics is used to select specific proteins and elucidate metabolic pathways in tobacco. 【Method】 Leaf proteins of three varieties of tobacco in China including Honghuadajinyuan, K326 and Yunyan 87 were extracted by phenol. After digestion the protein profiles of three varieties of tobacco were investigated by using tandem mass tag(TMT) coupled with two-dimensional liquid chromatography tandem mass spectrometry (2D LC-MS/MS). The proteins and peptides from tobacco were identified with MASCOT search engine after spectra extraction in Proteome Discoverer Software. Then, bioinformatics analysis including data correlation analysis, hierarchicalcluster analysis and principal component analysis (PCA) were conducted. Meanwhile, proteins with change ratio of more than 2 fold were defined as differentially expressed tobacco proteins, and they were screened out by volcano plot analysis. Finally, the distribution and function of important proteins in tobacco were analyzed using KEGG pathway analysis. 【Result】 A total of 3 079 proteins in Honghuadajinyuan, K326 and Yunyan 87 were identified and the number of protein ID was 10 343. Protein expression profiles of hierarchical cluster analysis and principal component analysis indicated that K326 and Yunyan 87 were relatively similar,and Honghuadajinyuan was significantly different from the other two. The subsequent protein screening also verified the results. Screening of differentially expressed proteins suggested that there were only 29 proteins differentially expressed between K326 and Yunyan 87. 13 proteins of them covered 8 metabolic pathways including flavonoids biosynthesis. Chalcone synthetase participating in the flavonoids synthesis was significantly higher in K326 than in Yunyan 87. Honghuadajinyuan and Yunyan 87 had 160 differentially expressed proteins. 103 proteins of them covered 42 metabolic pathways including glutathione metabolism. Three kinds of enzymes related to glutathione metabolic pathway including glutathione peroxidase, phospholipid hydroperoxide glutathione peroxidase and glutathione S-transferase were significantly lower in Honghuadajinyuan than in Yunyan 87. Honghuadajinyuan and K326 had 119 differentially expressed proteins. 89 proteins of them covered metabolic pathways such as metabolism of xenobiotics by cytochrome P450. It was indicated that several proteins related to stress resistance such as proteinase inhibitor was much less in Yunyan 87 than in K326 and Honghuadajinyuan, and superoxide dismutase in Honghuadajinyuan was the lowest among the three varieties of tobacco. 【Conclusion】Results of the study revealed that the TMT coupled with 2D LC-MS/MS is a powerful method for isolating and identifying differentially expressed proteins in various tobacco varieties. Most of them are involved in photosynthesis,metabolism or stress resistance.
tobacco; differential proteomics; tandem mass tag; 2D LC-MS/MS
2016-03-14;接受日期:2016-05-20
国家重点基础研究发展计划(“973”计划)(2012AA020201)、烟草化学安徽省重点实验室开放课题(0920140109008)联系方式:徐莹,E-mail:14211510001@fudan.edu.cn。通信作者余红秀,E-mail:hongxiuyu@fudan.edu.cn
