宰后肌肉中肌球蛋白磷酸化调控肌动球蛋白解离作用机制
2016-09-09杜曼婷张彩霞张德权
高 星,李 欣,李 铮,杜曼婷,张彩霞,张德权,丁 武
(1西北农林科技大学食品科学与工程学院,陕西杨凌 712100;2中国农业科学院农产品加工研究所/农业部农产品加工综合性重点实验室,北京 100193)
宰后肌肉中肌球蛋白磷酸化调控肌动球蛋白解离作用机制
高 星1,2,李 欣2,李 铮2,杜曼婷2,张彩霞2,张德权2,丁 武1
(1西北农林科技大学食品科学与工程学院,陕西杨凌 712100;2中国农业科学院农产品加工研究所/农业部农产品加工综合性重点实验室,北京 100193)
【目的】研究宰后肌肉中肌球蛋白磷酸化与肌动球蛋白解离之间的关系,分析其磷酸化水平的变化对肌动球蛋白解离的影响,探究肌球蛋白磷酸化对宰后肌肉肌节长度与嫩度的作用。【方法】取宰后30 min内的羊背最长肌,在4℃条件下分别成熟6、24、48和72 h,通过SDS-PAGE电泳、Pro-Q染色和蛋白质免疫印迹测定肌球蛋白的磷酸化水平和肌动球蛋白解离程度随宰后时间的变化;测定肌动球蛋白ATP酶的活性,分析宰后不同时间点肌球蛋白与肌动蛋白结合作用力的强弱;采用透射电镜分析宰后肌节长度随时间的变化。【结果】研究发现宰后肌肉中肌球蛋白轻链2的磷酸化水平在0.5—48 h快速降低(P<0.05),并在48 h达到最低点,在48—72 h有所升高(P<0.05),但其最终磷酸化水平明显低于初始值。肌动球蛋白的解离程度在宰后初期(0.5—6 h)显著降低(P<0.05),在6—48 h显著升高(P<0.05),并于48—72 h维持稳定,其最终解离程度显著高于宰后0.5 h的初始值。肌动球蛋白ATPase活性在宰后初期(0.5—6 h)略有升高,6—24 h快速上升(P<0.05),并在24 h达到最高点,24—72 h逐渐降低;而肌节长度的变化则与之相反,呈先下降后上升的趋势,并在24 h达到肌节最短点。【结论】羊宰后肌肉中的肌球蛋白轻链2磷酸化水平的变化对肌球蛋白与肌动蛋白的相互作用有较大的影响,且肌节收缩(肌球蛋白与肌动蛋白的相互作用力)与肌动球蛋白的解离(肌球蛋白与肌动蛋白的相互作用量)并不是一个同步的进程。肌球蛋白轻链2的磷酸化修饰负向调控肌动球蛋白解离和肌动球蛋白ATPase活性,导致肌节的收缩与舒张,进而调控肉品最终的嫩度。
磷酸化;肌球蛋白重链;肌球蛋白轻链2;肌动球蛋白;解离;羊背最长肌
0 引言
【研究意义】蛋白质的磷酸化修饰是蛋白质翻译后修饰中最常见、最重要的一种共价键修饰[1],它可以调控靶蛋白的功能、位置及结合特异性[2]。生物体的细胞发育、增殖、信号转导、凋亡、肌肉收缩等大部分生命活动几乎都受蛋白质磷酸化和去磷酸化这一可逆过程的调节[3]。磷酸化的肌球蛋白是维持细胞骨架活性及细胞功能的重要效应因子[4-5]。肌球蛋白轻链周期性的磷酸化与去磷酸化的状态,是细胞发生运动和收缩的必备条件[6],对肌球蛋白与肌动蛋白的相互作用具有重要的调控作用。【前人研究进展】肌球蛋白和肌动蛋白是肌原纤维中含量最丰富的两种蛋白质,分别约占肌原纤维蛋白总量的 50%和 20%[7]。GOLL等[8]提出宰后肌动蛋白与肌球蛋白相互作用的改变,即僵直过程中所形成的肌动球蛋白的解离可能也是导致嫩度改善的原因之一。其他研究也得出了相似结论,牛、羊宰后24 h内肌球蛋白与肌动蛋白相互作用的加强使得肌节长度缩短,肉品嫩度显著降低,而在解僵成熟阶段肌球蛋白和肌动蛋白的结合减弱,使得肌节变长,这可能促进了宰后成熟过程中肌肉嫩度的增加[9]。TAKAHASHI等[10-11]研究也表明,肌节长度的增加说明僵直后肌球蛋白和肌动蛋白之间的相互作用发生改变,弱化了肌原纤维的紧密结构。1973年,PERRIE等[12]首次在兔骨骼肌中发现肌球蛋白轻链2的磷酸化现象,随后人们围绕其磷酸化的形成机制和功能作用做了一系列相关的研究。有研究表明,肌球蛋白轻链2的磷酸化修饰会破坏肌肉粗丝和细丝的相互作用,使肌球蛋白重链头部远离粗丝[13-15],促进了肌球蛋白单体与活跃的收缩细丝的结合,并且调控肌球蛋白的活性[16],同时对肌节的长度也会产生影响[17-18]。【本研究切入点】肌球蛋白轻链2磷酸化会影响肌球蛋白与肌动蛋白的相互作用,但在宰后成熟过程中,肌球蛋白轻链2的磷酸化水平及肌动球蛋白解离是如何变化的,以及如何调控肌动球蛋白解离和肌节收缩的机制并不明确。因此,本研究通过分析宰后肌肉中肌球蛋白磷酸化与肌动球蛋白解离之间的关系,初步探索肌球蛋白的磷酸化修饰对肌动球蛋白解离以及其对肉品嫩度的影响。【拟解决的关键问题】以羊背最长肌(ovine longissimus dorsi)为原料,通过分析宰后肌肉肌球蛋白轻链2的磷酸化水平、肌动球蛋白解离程度、肌动球蛋白 ATPase活性和肌节长度等指标的变化,探究宰后成熟过程中肌肉中肌球蛋白轻链2的磷酸化修饰对肌动蛋白与肌球蛋白相互作用的影响。
1 材料与方法
试验于2015年3—7月在中国农业科学农产品加工研究所肉品质与加工实验室进行。
1.1 材料与试剂
1.1.1 材料 宰后立刻取羊(5只)的背最长肌,剔除可见的筋膜及结缔组织,4℃分别放置 0、6、24、48和72 h时取样,电镜样品放置于2.5%的戊二醛固定液(pH 7.2)中保存;其余样品装于冻存管液氮速冻后,-80℃保存。
1.1.2 试剂 蛋白浓度测定试剂盒购自美国 Pierce公司;三羟甲基氨基甲烷(Tris Base)、十二烷基硫酸钠、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、四甲基乙二胺、ATP酶活性测定试剂盒购自美国Sigma公司;Pro-Q Diamond、SYPRO Ruby染色液购自美国Invitrogen公司;氯化钠、碳酸钠、碳酸氢钠、乙醇、乙酸、乙腈等为国产分析纯试剂,购自国药集团化学试剂有限公司。
1.2 方法
1.2.1 蛋白提取 肌浆及肌原纤维蛋白的提取参照LAMETSCH等[19]的方法:将1 g肌肉组织加入6 mL预冷的蛋白提取液(0.1 mol·L-1Tris,0.01 mol·L-1二硫代苏糖醇(DL-Dithiothreitol,DTT),pH 8.3,蛋白酶抑制剂(50 mL/片),磷酸酶抑制剂(10 mL/片))中,用Ultra Turrax T25匀浆机进行匀浆(2次,15 s/次),然后离心(20 000×g,4℃,30 min),得到上清液(肌浆蛋白溶液)和沉淀(肌原纤维蛋白)。沉淀溶解于 5%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液(60℃)后匀浆 30 s,80℃加热20 min,即得到肌原纤维蛋白溶液。蛋白浓度用二喹啉甲酸(Bicinchoninic acid,BCA)试剂盒测定。
肌动蛋白及肌动球蛋白的提取参考 OKITANI等[20]的方法,并稍作修改:取2 g肉样,加入25 mL Weber-Edsall 溶液(0.6 mol·L-1KCl,0.04 mol·L-1NaHCO3,0.01 mol·L-1Na2CO3,蛋白酶抑制剂50 mL/片,pH 7.2),用Ultra Turrax T25匀浆机匀浆3 次(30 s/次,中间间隔10 s)。匀浆液置于4℃培养箱内,摇床震荡24 h后,用两层尼龙网过滤除去不溶物质,取10 mL溶液,即为总肌动蛋白溶液。取10 mL剩余溶液加入20 mL超纯水稀释,使提取液中KCl的浓度至0.2 mol·L-1,然后4℃摇床振荡60 min ,离心(4℃,15 000×g,20 min),上清液即为游离肌动蛋白溶液。将沉淀溶解于3 mL KCl-Tris溶液中(0.6 mol·L-1KCl,0.02 mol·L-1Tris-HCl,pH 7.2),即为肌动球蛋白溶液。蛋白浓度用BCA试剂盒测定。
1.2.2 肌球蛋白磷酸化水平的测定 将肌原纤维蛋白样品与上样缓冲液等体积混合后在沸水浴中加热 5 min,冷却后离心(12 000×g,1 min),取上清液上样,肌原纤维蛋白的上样量为5 µg。浓缩胶浓度为4%,分离胶浓度为15%(用于分析肌球蛋白轻链2的磷酸化水平),分离胶浓度为7.5%(用于分析肌球蛋白重链的磷酸化水平)。设置初始电压为70 V,当溴酚蓝进入分离胶后,将电压恒定在110 V,继续电泳直至溴酚蓝到达离凝胶底部0.5 cm处。随后进行Pro-Q染色和Ruby染色,染色流程参考陈立娟等[21]的方法。
使用BIO RAD凝胶成像系统对染色后的凝胶拍照,利用Quantity One 4.6.2软件(Bio-Rad,美国)对肌球蛋白重链条带和肌球蛋白轻链2条带的光密度值进行定量,得到对应的Pro-Q Diamond染色光密度值(P)和SYPRO Ruby染色光密度值(T),该条带的光密度值之比P/T即为该条带蛋白的蛋白质磷酸化水平。
1.2.3 肌动球蛋白解离程度的测定 将游离肌动蛋白样品与稀释3倍的总肌动蛋白样品分别和上样缓冲液等体积混合后在沸水浴中加热 5 min,冷却后离心(12 000×g,1 min),取上清液上样,上样量均为6 µL。电泳结束后用半干转膜仪(Bio-Rad,美国)将凝胶中的蛋白转印到聚偏二氟乙烯(Polyvinylidene fluoride,PVDF)膜上,TBS溶液(0.01 mol·L-1Tris,0.15 mol·L-1NaCl,pH 7.5)漂洗(3次,2 min/次)。转印后的 PVDF 膜用封闭液(含0.05% Tween-20、3%牛血清白蛋白的TBS溶液)室温封闭2 h,然后与用封闭液 1∶1 000稀释的肌动蛋白抗体(A4700,Sigma)室温孵育2 h,随后将膜用三羟甲基氨基甲烷缓冲溶液(Tris buffered saline-tween-20,TBST1)(含0.1% Tween-20的TBS溶液)漂洗3次后与二抗(二抗为辣根过氧化酶标记的羊抗鼠IgG,用封闭液1∶5 000稀释)室温孵育2 h,膜用TBST2溶液(0.05 mol·L-1Tris,0.15 mol·L-1NaCl,0.1% Tween-20,pH 7.5)漂洗3次后使用电化学发光(Electrochemiluminescence,ECL)显色剂显色,并使用凝胶成像仪拍照。采用Quantity One软件分析蛋白免疫印迹条带光密度值,用得到的游离肌动蛋白与总肌动蛋白的光密度值之比表示肌动球蛋白的解离程度。
1.2.4 肌动球蛋白 ATPase活性的测定 肌动球蛋白ATPase活性的测定按照ATP酶活性测定试剂盒的说明书进行测定。基本步骤如下:(1)制作磷酸盐标准曲线。(2)根据说明书提供的各反应物添加量添加相应试剂开始样品和对照反应,在25℃反应1 h后添加200 μL Reagent到每个孔中25℃下再孵育30 min,终止酶反应,同时生成比色产物,并在620 nm处测定吸光值。(3)计算:根据公式ΔA620=(A620)样品-(A620)对照计算出吸光值的变化,然后根据绘制的磷酸盐标准曲线,计算样品中无机磷的含量[Pi]。酶活根据下列公式得出。
酶活性(U·L-1)=([Pi](μmol)×40μL)/(10μL×T)
其中40 μL为反应体积,10 μL为样品体积,T为反应时间,1 U酶活是指在试验条件下每分钟催化生成1 μmol无机磷所需要的酶的量。
1.2.5 肌原纤维蛋白超微结构分析 肌原纤维超微结构的观察测定参考 PRATES等[22]的方法并稍作修改。顺着肌纤维方向将待测样品切成大小为5 mm×2 mm×2 mm的细丝,立即放入 2.5%的戊二醛固定液(pH 7.2)中进行前固定,固定48 h后用0.1 mol·L-1的磷酸缓冲液(pH 7.4)冲洗。然后在通风橱中用1%四氧化锇进行后固定,静置2—3 h后,再次用磷酸缓冲液冲洗,然后用乙醇进行梯度脱水(30%、50%、60%、70%、80%、90%、100%),之后再利用无水丙酮置换5次,每次放置7—15 min。脱水后的样品用包埋剂包埋,然后放入烘箱聚合(聚合条件:37℃,12 h;40℃,12 h;45℃,12 h;50℃,12 h;60℃,48 h),随后室温冷却(至少2 d)、修块。修块完成后用UC6型超薄切片机进行超薄切片,醋酸铀-柠檬酸铅双染色,最后用H-7500型透射电镜观察、拍照。利用Image-Pro Plus 6.0软件量取肌节长度。
1.2.6 统计分析 所有试验均做5次重复,每个样品做3次平行,所得数据采用SPSS 19.0统计软件进行方差分析,通过最小显著差异法(least significant difference,LSD)和邓肯氏总重比较法(Duncans Multiple-rang test)进行差异显著性分析,并进行相关性分析。
2 结果
2.1 肌球蛋白磷酸化水平随宰后时间的变化
2.1.1 肌球蛋白重链磷酸化水平随宰后时间的变化对电泳图进行灰度值分析,用磷酸化染色(图 1-A)的光密度值与全蛋白染色(图 1-B)的光密度值之比代表肌球蛋白重链的磷酸化水平,宰后不同时间点肌球蛋白重链的磷酸化水平如图1-C所示。从图中可以看出,宰后肌肉中肌球蛋白重链的磷酸化水平随时间呈现先下降后上升再下降并趋于稳定的趋势,而且宰后6 h及以后各时间点的磷酸化水平均显著低于0.5 h的初始值。肌球蛋白重链的磷酸化水平变化在宰后48 h后基本趋于稳定,宰后72 h肌球蛋白重链的磷酸化水平与初始值0.5 h相比下降了18.8%。说明宰后肌肉中肌球蛋白重链的去磷酸化作用大于磷酸化作用,所以整体呈现出磷酸化水平降低的趋势。
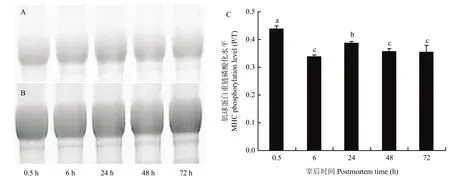
图1 宰后不同时间点肌球蛋白重链的磷酸化水平Fig. 1 Variation of myosin heavy chain phosphorylation level during postmortem
2.1.2 肌球蛋白轻链 2磷酸化水平随宰后时间的变化 对图2-A、B进行光密度值分析,宰后不同时间点肌球蛋白轻链2的磷酸化水平如图2-C所示,宰后肌肉中肌球蛋白轻链2的磷酸化水平在48 h内显著下降,48—72 h显著上升,但是72 h的肌球蛋白轻链2磷酸化水平仍显著低于0.5 h的初始值。说明宰后肌肉中肌球蛋白轻链2的去磷酸化作用起主导作用,整体呈现出肌球蛋白轻链2磷酸化水平显著降低的趋势。
2.2 肌动球蛋白解离程度随宰后时间的变化
利用免疫印迹测定宰后不同时间肌动球蛋白的解离程度,其结果如图3-A、B所示,对图中免疫印迹条带进行灰度值分析,所得结果如图3-C所示。从图中可以看出宰后肌动球蛋白解离程度呈现出先下降后上升然后趋于稳定的趋势。宰后0.5—6 h,肌动球蛋白的解离程度显著下降,说明此阶段肌肉中的肌球蛋白与肌动蛋白大量结合形成肌动球蛋白,整体呈现出一种结合大于解离的现象。而6—48 h,肌动球蛋白的解离程度则显著上升,肌球蛋白与肌动蛋白之间的横桥断裂,肌动球蛋白不断解离形成游离的肌动蛋白和肌球蛋白,呈现出一种解离大于结合的状态。宰后 48—72 h,肌动球蛋白的解离程度无显著差异(P >0.05),此时肌球蛋白和肌动蛋白的结合与解离则处于一种平衡的状态,而且肌动球蛋白的解离程度显著高于初始点0.5 h。

图2 宰后不同时间点肌球蛋白轻链2的磷酸化水平Fig. 2 Variation of myosin light chain 2 phosphorylation level during postmortem
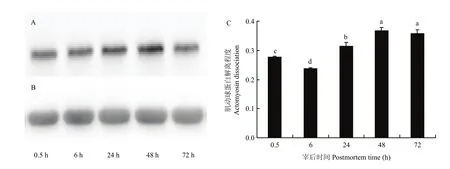
图3 宰后不同时间点肌动球蛋白的解离程度Fig. 3 Variation of actomyosin dissociation degree during postmortem
2.3 肌动球蛋白ATPase活性随宰后时间的变化
肌动球蛋白 ATPase活性代表肌球蛋白和肌动蛋白相互作用力的强弱。宰后不同时间点肌动球蛋白ATPase活性的变化如图4所示,肌动球蛋白ATPase活性随宰后时间呈现先上升后下降的趋势,并且在24 h达到最大值,该点的肌动球蛋白ATPase活性显著高于其他各时间点。宰后0.5—24 h,肌动球蛋白ATPase活性不断增大,说明肌球蛋白与肌动蛋白的相互作用力不断增强;而在24—72 h,肌动球蛋白ATPase活性则不断下降,肌球蛋白与肌动蛋白的相互作用力不断减弱。
2.4 肌节长度随宰后时间的变化
宰后不同时间点肌节样品的透射电镜图如图 5所示,宰后72 h的肌节暗带已经开始变得模糊,说明维持肌节的蛋白已经发生了降解。在宰后 0.5—6 h,肌节长度并未发生显著的变化,6—24 h,肌节长度显著减小,在24 h肌节明显变短;24—48 h,肌节长度显著增大,肌节舒张,48—72 h则维持这种舒张的状态,肌节长度不再发生显著变化,但是舒张后72 h的肌节长度仍然显著低于0.5 h的初始肌节长度(图6)。
2.5 相关性分析
将肌球蛋白重链磷酸化水平、肌球蛋白轻链2磷酸化水平、肌动球蛋白解离程度、肌动球蛋白ATPase活性和肌节长度进行相关性分析,肌动球蛋白ATPase活性与肌节长度之间呈显著负相关(r=-0.890,P<0.05),肌球蛋白轻链2磷酸化水平和肌动球蛋白解离程度呈高度的负相关(r=-0.823),肌球蛋白轻链2的磷酸化水平和肌球蛋白重链磷酸化水平、肌动球蛋白 ATPase活性、肌节长度均有一定的相关性,其相关系数r分别为0.575、-0.522、0.628(表1)。
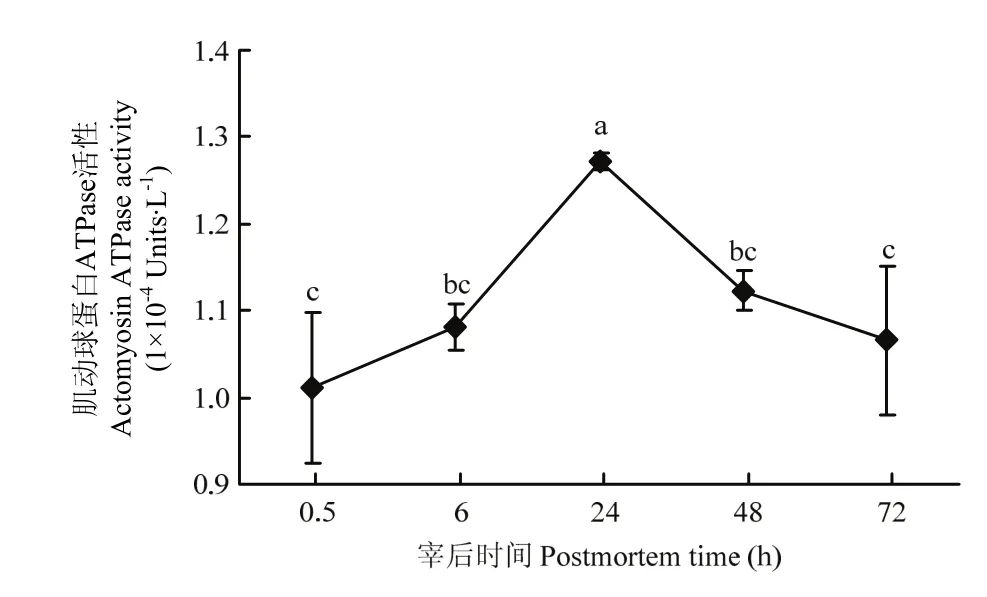
图4 宰后不同时间点肌动球蛋白的ATPase活性Fig. 4 Analysis of actomyosin ATP enzyme activity during postmortem
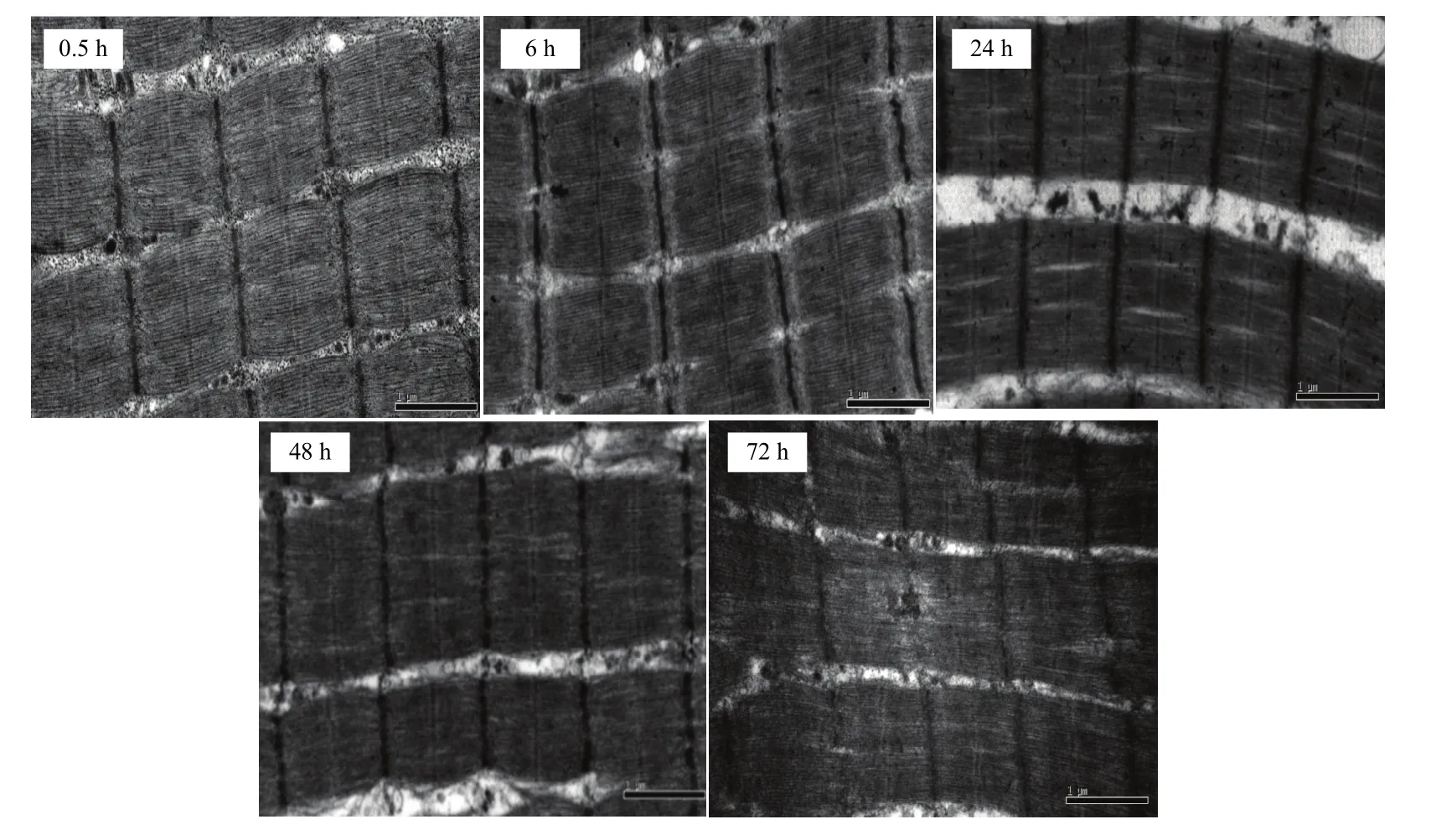
图5 宰后不同时间点透射电镜图(30 000×)Fig. 5 Transmission electron microscopy photos during postmortem
3 讨论
肉品的宰后成熟是一个复杂的生理生化过程,它受肌肉组织结构、骨架蛋白降解及内源酶等多种因素的调控。GOLL等[8]提出宰后肌肉解僵成熟过程中肌动球蛋白的解离也有助于嫩度的改善。研究发现宰后肌球蛋白和肌动蛋白存在两种不同的结合状态,即高亲和态和低亲和态,而且这两种状态是可以相互转化的[23],在宰后不同阶段处于不同的结合状态,这将会影响宰后肉的成熟以及肉品最终的嫩度[24]。
在本研究中也发现了相似的结果,如表1所示,宰后肌动球蛋白 ATPase活性与肌节长度显著负相关(r=-0.890,P<0.05),肌动球蛋白解离程度与肌节长度也具有一定的相关性(r=0.517),且均呈现动态变化。0.5—24 h,肌动球蛋白ATPase活性显著增加,肌动球蛋白解离程度先显著下降随后又显著上升,肌节长度显著下降,肌球蛋白与肌动蛋白相互作用力增大,两者由低亲和态转为高亲和态,同时肌球蛋白与肌动蛋白相互作用的横桥的数量也发生显著的变化,最终导致肌节收缩。这是由于在宰后成熟过程中,动物肌肉组织中ATP的不断消耗和糖原无氧酵解导致pH的下降,最终导致钙泵的功能丧失[25],大量的 Ga2+从肌浆网释放到肌浆中,作用于肌钙蛋白 C,使肌细丝的构象发生变化,暴露出肌动蛋白上与肌球蛋白结合的位点,同时肌动球蛋白ATP酶有规律的水解ATP释放能量[26],促使肌动蛋白与肌球蛋白通过横桥相互结合或解离,导致细丝沿着粗丝发生移动,肌动蛋白与肌球蛋白相互作用力增大,从而致使肌原纤维发生收缩。而在24—72 h,由于蛋白降解、蛋白相互作用等的影响,肌动球蛋白ATPase活性显著降低,肌动球蛋白解离程度显著增加随后保持稳定,肌节长度显著增加,肌球蛋白与肌动蛋白由高亲和态转为低亲和态,诱使肌节舒张,长度增加。

表1 宰后肌动球蛋白解离、肌球蛋白磷酸化水平和肌动球蛋白ATPase活性随时间变化的相关性分析Table 1 Correlation analysis of actomyosin dissociation, myosin phosphorylation and actomyosin ATPase activity during postmortem
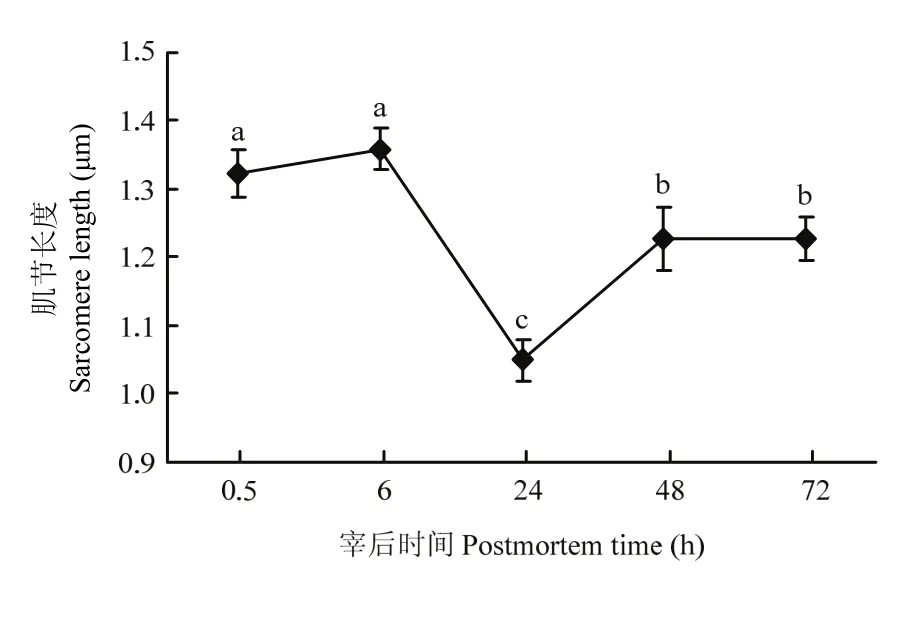
图6 宰后不同时间肌节长度分析Fig. 6 Analysis of the sarcomere length of different postmortem times
肌球蛋白轻链2的磷酸化修饰受肌球蛋白调节轻链激酶、Rho kinase、蛋白激酶A和蛋白激酶C等多种酶的调控[27]。肌球蛋白轻链2的磷酸化作用可以增加肌动球蛋白强结合横桥的数量[28]。本研究发现,在宰后6—24 h,肌肉中肌球蛋白轻链2磷酸化水平的显著下降,肌动球蛋白的解离程度显著增大,肌动球蛋白ATPase活性显著增加,这说明肌球蛋白轻链2的去磷酸化有可能导致了肌球蛋白与肌动蛋白强结合横桥数量的下降,表明在一定的生理条件下,有可能肌球蛋白轻链 2的去磷酸化会阻碍肌球蛋白与肌动蛋白的结合。另外,由表1可知,肌动球蛋白解离程度和肌球蛋白轻链2磷酸化水平呈现高度的负相关,说明肌球蛋白轻链 2的磷酸化在一定程度上可以抑制肌动球蛋白的解离。ALAMO等[13]和BRITO等[14]的研究表明肌球蛋白轻链2磷酸化会破坏肌肉粗、细丝的相互作用,使肌球蛋白重链头部远离粗丝,促进肌球蛋白单体与活跃的收缩细丝的结合,与本研究结果一致。
4 结论
宰后肌肉中的肌球蛋白轻链2的磷酸化水平和肌球蛋白与肌动蛋白间的相互作用均呈动态变化。在宰后6—24 h,肌球蛋白轻链2的磷酸化水平显著下降,肌动球蛋白解离程度显著增加,肌动球蛋白 ATPase活性显著增加,肌节长度显著下降,说明宰后肌球蛋白轻链2磷酸化水平的变化对肌球蛋白与肌动蛋白的相互作用有较大的影响;而且肌节收缩(肌球蛋白与肌动蛋白的相互作用力)与肌动球蛋白的解离(肌球蛋白与肌动蛋白的相互作用量)并不是一个同步的进程。在一定的生理状态下,肌球蛋白轻链2磷酸化修饰负向调控肌动球蛋白解离和肌动球蛋白 ATPase活性,最终导致肉品嫩度下降。
References
[1] 钱小红, 贺福初. 蛋白质组学: 理论与方法. 北京: 北京科学出版社, 2003.
QIAN X H, HE F C. Proteomics: Theory and Methods. Beijing:Beijing Science Press, 2003. (in Chinese)
[2] HUNTER T. Protein kinases and phosphatases: the yin and yang of protein phosphorylation and signaling. Cell, 1995, 80(2): 225-236.
[3] COHEN P. The origins of protein phosphorylation. Nature Cell Biology, 2002, 4(5): E127-E130.
[4] NAKAMURA A, XIE C, ZHANG Y, GAO Y, WANG H H, YE L H,KISHI H, OKAGAKI T, YOSHIYAMA S, HAYAKAWA K,ISHIKAWA R, KOHAMA K. Role of non-kinase activity of myosin light-chain kinase in regulating smooth muscle contraction, a review dedicated to Dr. Setsuro Ebashi. Biochemical and Biophysical Research Communications, 2008, 369(1): 135-143.
[5] CHARDIN P. GTPase regulation: getting aRnd Rock and Rho inhibition. Current Biology, 2003. 13(18): R702-R704.
[6] MATSUMURA F, HARTSHORNE D J. Myosin phosphatase target subunit: Many roles in cell function. Biochemical and Biophysical Research Communications, 2008, 369(1): 149-156.
[7] 尹靖东. 动物肌肉生物学与肉品科学. 北京: 中国农业大学出版社,2011: 64-67.YIN J D. Animal Muscle Biology and Meat Quality. Beijing: China Agricultural University Press, 2011: 64-67. (in Chinese)
[8] GOLL D E, GEESINK G H, TAYLOR R G. Dose proteolysis cause all postmortem tenderization or are changes in the acyin/myosin interaction involved//Proceedings of the 41st International Congress of Meat Science and Technology, 1995: 537-544.
[9] TAYLOR R G, GEESINK G H, THOMPSON V F, KOOHMARAIE M, GOLL D E. Is Z-disk degradation responsible for postmortem tenderization? Journal of Animal Science, 1995, 73(5): 1351-1367.
[10] TAKAHASHI K T, YASUI T. Formation of myofibrillar fragments and reversible contraction sarcomeres in chicken pectoral muscle. Journal of Food Science, 1967, 32(4): 409-413.
[11] TAKAHASHI K, NAKAMURA F, INOUE A. Postmortem changes inthe actin-myosin interaction of rabbit skeletal muscle. Journal of Biochemistry, 1981, 89(1): 321-324.
[12] PERRIE W T, SMILLIE L B, PERRY S B. A phosphorylated light-chain component of myosin from skeletal muscle. The Biochemistry Journal, 1973, 135(1): 151-164.
[13] ALAMO L, WRIGGERS W, PINTO A, BÁRTOLI F, SALAZAR L,ZHAO F Q, CRAIG R, PADRÓN R. Three-dimensional reconstruction of tarantula myosin filaments suggests how phosphorylation may regulate myosin activity. Journal of Molecular Biology, 2008, 384(4): 780-797.
[14] BRITO R, ALAMO L, LUNDBERG U, GUERRERO J R, PINTO A,SULBARÁN G, GAWINOWICZ M A, CRAIG R, PADRÓN R. A molecular model of phosphorylation-based activation and potentiation of tarantula muscle thick filaments. Journal of Molecular Biology,414(1): 44-61.
[15] SHEIKH F, OUYANG K, CAMPBELL S G, LYON R C, CHUANG J,FITZSIMONS D, TANGNEY J, HIDALGO C G, CHUNG C S,CHENG H, DALTON N D, GU Y, KASAHARA H, GHASSEMIAN M, OMENS J H, PETERSON K L, GRANZIER H L, MOSS R L,MCCULLOCH A D, CHEN J. Mouse and computational models link Mlc2v dephosphorylation to altered myosin kinetics in early cardiac disease. The Journal of Clinical Investigation, 2012, 122(4): 1209-1221. [16] KASZA K E, FARRELL D L, ZALLEN J A. Spatiotemporal control of epithelial remodeling by regulated myosin phosphorylation. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(32): 11732-11737.
[17] RASSIER D E, TUBMAN L A, MACINTOSH B R. Caffeine and length dependence of staircase potentiation in skeletal muscle. Canadian Journal of Physiology and Pharmacology, 1998, 76(10/11):975-982.
[18] RASSIER D E. The effects of length on fatigue and twitch potentiation in human skeletal muscle. Clinical Physiology, 2000,20(6): 474-482.
[19] LAMETSCH R, KRISTENSEN L, LARSEN M R, THERKILDSEN M, OKSBJERG N, ERTBJERG P. Changes in the muscle proteome after compensatory growth in pigs. Journal of Animal Science, 2006,84(4): 918-924.
[20] OKITANI A, ICHINOSE N, ITOH J, TSUJI Y, ONEDA Y, HATAE K,MIGITA K, MATSUISHI M. Liberation of actin from actomyosin in meats heated to 65 degrees C. Meat Science, 2009, 81(3): 446-450.
[21] 陈立娟, 李欣, 杨扬, 陈丽, 倪娜, 张德权. 不同嫩度羊肉肌浆蛋白质磷酸化水平随宰后成熟时间变化的研究. 现代食品科技, 2015,31(04): 95-101. CHEN L J, LI X, YANG Y, CHEN L, NI N, ZHANG D Q. Analyzingthe changes in sarcoplasmic protein phosphorylation with respect to postmortem ageing times in mutton with different levels of tenderness. Modern Food Science and Technology, 2015, 31(4): 95-101. (in Chinese)
[22] PRATES J A M, COSTA F J S G E, RIBEIRO A M R, CORREIA A A D. Contribution of major structural changes in myofibrils to rabbit meat tenderisation during ageing. Meat Science, 2002, 61(1): 103-113.
[23] REMEDIOS C G D. MOENS P D J. Actin and the actomyosin interface: A review. Biochimica Et Biophysica Acta, 1995, 1228(2/3):99-124.
[24] HOPKINS D L, Thompson J M. The relationship between tenderness,proteolysis, muscle contraction and dissociation of actomyosin. Meat Science, 2001, 57(1): 1-12.
[25] OUALI A, HERRERA-MENDEZ C H, COULIS G, BECILA S,BOUDJELLAL A, AUBRY L, SENTANDREU M A. Revisiting the conversion of muscle into meat and the underlying mechanisms. Meat Science, 2006, 74(1): 44-58.
[26] SANGER J W, WANG J, HOLLOWAY B, DU A, SANGER J M. Myofibrillogenesis in skeletal muscle cells in zebrafish. Cell Motility and The Cytoskeleton, 2009, 66(8): 556-566.
[27] IKEBE R, REARDON S, MITSUI T, IKEBE M. Role of the N-terminal region of the regulatory light chain in the dephosphorylation of myosin by myosin light chain phosphatase. The Journal of Biological Chemistry, 1999, 274(42): 30122-30126.
[28] MILLER M S, FARMAN G P, BRADDOCK J M, SOTO-ADAMES F N, IRVING T C, VIGOREAUX J O, MAUGHAN D W. Regulatory light chain phosphorylation and N-terminal extension increase crossbridge binding and power output in Drosophila at in vivo myofilament lattice spacing. Biophysical Journal, 2011, 100(7): 1737-1746.
(责任编辑 赵伶俐)
The Mechanism of Myosin Phosphorylation Regulating Actomyosin Dissociation of Skeletal Muscle During Postmortem
GAO Xing1,2, LI Xin2, LI Zheng2, DU Man-ting2, ZHANG Cai-xia2, ZHANG De-quan2, DING Wu1
(1Food Science and Technology, Northwest A&F University, Yangling 712100, Shaanxi;2Institute of Food Science and Technology,Chinese Academy of Agricultural Sciences/Key Laboratory of Agro-Products Processing, Ministry of Agriculture, Beijing 100193)
【Objective】The aim of this study was to investigate the effect of myosin phosphorylation modification on actomyosin dissociation by analyzing the correlation between myosin phosphorylation and actomyosin dissociation, and then reveal the function of myosin phosphorylation to sarcomere length and tenderness during postmortem.【Method】Samples of ovine longissimus dorsi after storage at 4℃ for 6, 24, 48, 72 h were collected for myosin phosphorylation and actomyosin dissociation by SDS-PAGE, Pro-Q Diamond staining and western blotting, actomyosin ATPase activity. And sarcomere length was measured by transmission electron microscope.【Result】The phosphorylation level of myosin light chain 2 decreased sharply from 0.5-48 h (P<0.05), then it increased from 48-72 h, and the final value was lower than the initial phosphorylation value. While to the dissociation of actomyosin, it displayed a gradual decrease from 0.5-6 h and then increased from 6-48 h (P<0.05), finally keptstable during 48-72 h postmortem, and the final dissociation degree was significantly higher than 0.5 h. The actomyosin ATPase activity increased to the highest value at 24 h, followed by gradual decrement from 24 to 72 h. On the contrary, the sarcomere length decreased to the shortest value at 24 h, followed by gradual sarcomere relaxation from 24 to 72 h.【Conclusion】The phosphorylation level of myosin light chain 2 had a great influence on myosin and actin interaction, in addition, the sarcomere contraction (myosin and actin interaction force) and the dissociation of actomyosin (myosin and actin interaction amount)happened out of sync during postmortem. Phosphorylation modification of myosin light chain 2 caused the sarcomere shrinkage and relaxation by negative regulating actomyosin dissociation and actomyosin ATPase activity negatively, which could control the final meat tenderness.
phosphorylation; myosin heavy chain; myosin light chain 2; actomyosin; dissociation; ovine longissimus dorsi
2015-11-16;接受日期:2016-04-01
国家现代肉羊产业技术体系(CARS-39)、国家农业科技创新工程、国家公益性行业(农业)科研专项(201303083)
联系方式:高星,E-mail:gaoxing123work@163.com。通信作者张德权,E-mail:dequan_zhang0118@126.com。通信作者丁武,E-mail:dingwu10142000@hotmail.com
