牛支原体等温扩增冻干试剂盒研究
2016-09-09李佳禾闫新博吴文学
吴 彤,刘 旭,李佳禾,闫新博,张 宁,吴文学
(1南京农业大学生命科学学院,南京 210095;2中国农业大学动物医学院,北京 100193)
牛支原体等温扩增冻干试剂盒研究
吴 彤1,刘 旭2,李佳禾2,闫新博2,张 宁2,吴文学2
(1南京农业大学生命科学学院,南京 210095;2中国农业大学动物医学院,北京 100193)
【目的】牛支原体(Mycoplasma bovis)是导致牛多种疾病综合征的病原体之一,在世界范围广泛流行。为了有效监测此病在中国的流行情况,迫切需要敏感、便捷的诊断试剂产品。【方法】通过构建含有牛支原体uvrC基因片段的重组质粒并转化TOP10感受态细胞,获得重组大肠杆菌rP-uvrC。重组大肠杆菌大量表达并提取重组质粒后,获得质粒浓度为104拷贝/μL的溶液,作为质控用阳性对照品。根据文献报道的浓度配制甜菜碱溶液和显色液(主成份为SYBR Green I和HNB),分别作为冻干品溶解用溶液和等温扩增产物显色溶液。在已建立的牛支原体环介导等温扩增(loop-mediated isothermal amplification, LAMP)检测技术的基础上配制等温扩增试剂,并通过考察等温扩增反应情况在常用的8种冻干疫苗耐热保护剂中选择对等温扩增反应没有影响的3种冻干保护剂,每种保护剂分别选用3种不同的浓度,共设计27种保护剂组方,通过观察冻干品物理性状选择最佳的一组保护剂配制冻干用等温扩增试剂,放到冻干机中测定共晶点,并优化一次干燥升温时间、干燥时间和二次干燥时间。通过对冻干制品物理性状的检验、真空度的检测以及残余水分含量的测定,筛选出一条适合等温扩增试剂的冻干曲线,并以此制备等温扩增试剂冻干品。取一定量等温扩增试剂冻干品、甜菜碱溶液、阳性对照品溶液和显色液,组装成试剂盒。利用6个浓度梯度(100—105个拷贝)重组质粒溶液检测试剂盒的敏感性,利用浓度为104CCU·mL-1的PG-45株、HB-1株、SD-2株牛支原体菌液、108CCU·mL-1的牛鼻支原体和无乳支原体菌液、108CFU·mL-1的多杀性巴氏杆菌和结核分枝杆菌,检测试剂盒的特异性。另外,将等温扩增冻干试剂盒分别置于不同温度下保存,检测其稳定性。【结果】8种冻干保护剂中只有海藻糖、甘露醇和牛血清白蛋白不影响等温扩增反应,在此基础上优选的冻干保护剂配方为 5%海藻糖+1.25%甘露醇+1.25%牛血清白蛋白,等温扩增试剂共晶点为-16℃,一次干燥的升温时间3 h,一次干燥时间6 h,二次干燥时间4 h。组装后的试剂盒最低可检测到10个拷贝数的重组质粒,检验PG45株、HB-1株以及SD-2株牛支原体均为阳性,检验牛鼻支原体、无乳支原体、多杀性巴氏杆菌和结核分枝杆菌均为阴性。试剂盒在20℃保存6个月、37℃保存10 d后,敏感性仍为10个拷贝数,与第0 天相同,推测4℃保存有效期为24个月左右。【结论】笔者研制的等温扩增冻干试剂盒敏感性高、特异性好、稳定性好、操作便捷,适合基层兽医现场检测使用。
牛支原体;等温扩增;冻干;试剂盒;RT-PCR
0 引言
【研究意义】牛支原体(Mycoplasma bovis)是一种感染牛的致病性病原体,可导致牛肺炎、乳腺炎等多种疾病,在世界范围内普遍存在[1-3]。自2008年以来,中国部分地区暴发了以坏死性肺炎为主要特征的传染性牛支原体肺炎疫情,病死率高达10%—50%,给养牛业造成了巨大的经济损失[4-8]。病原分离和鉴定是诊断牛支原体病的经典方法,然而由于牛支原体生长缓慢,从临床样本中初次分离一般需要盲传 2—4代才能通过显微镜在固体培养基上看到菌落,需要数日才能得到检测结果,不仅检出率低,而且检测工作耗时、耗力。因此,研究建立更加敏感、快捷的诊断方法具有重要意义。【前人研究进展】BALL等报道了一种基于单克隆抗体的夹心ELISA方法,用以检测肺组织、鼻拭子以及奶样中的牛支原体病原,但与Real- Time PCR相比,夹心ELISA敏感性较低[9-12]。还有基于单克隆抗体建立的免疫组化方法,用于检测福尔马林固定组织中牛支原体[13-14]。HIGUCHI等建立了一种简单 PCR方法,可以直接检测奶样中的 M. bovis、M. arginini、M. bovigenitalium、M. californicum、M. bovirhinis、M. alkalescens和M. canadense而不需要DNA提取,最低检测浓度为2.5×103CFU·mL-1,与标准PCR方法相同[15]。CREMONESI P等建立的DNA提取和PCR检测方法最低可检测奶和生理盐水10 CFU·mL-1牛支原体或0.25 pg 牛支原体DNA[16]。ROSSETTI等建立了Real-Time PCR方法,对牛支原体的检测限为2.0×103CFU·mL-1,与细菌培养方法相同[17]。SACHSE等通过在Real-Time PCR反应体系中加入牛支原体种特异性探针的方法,不仅敏感性提高到100 CFU·mL-1,而且特异性好[18]。BEN等建立了一种新的 TaqMan单核苷酸多态性(singlenucleotide-polymorphism,SNP)Real-Time PCR方法,检测限可以达到5 fg DNA(约相当于5个牛支体基因组)[19]。上述核酸扩增方法虽然具有敏感性高、特异性好的优点,但是对操作人员的技术水平和仪器设备要求较高,很难在基层推广应用。环介导等温扩增技术(Loop- mediated isothermal amplification, LAMP)只在恒温条件下反应1 h就可以完成,而且敏感性高,特异性强,已广泛用于多种病原的检测[20-21]。刘旭等建立的牛支原体环介导等温扩增快速检测方法的敏感性达到 20 pg,且特异性好[22]。【本研究切入点】牛支原体环介导等温扩增检测方法敏感性高,特异性好,而且对仪器和操作人员的技术水平要求较低,非常适合在基层推广应用。然而,由于等温扩增反应体系中的酶等成分容易降解,不利于长期保存和运输。在疫苗研制过程中,为了便于贮存和冷链运输,通常会通过冷冻干燥的方法制备冻干疫苗,这项技术和工艺已经非常成熟,如果能将等温扩增反应试剂进行冻干,则有利于等温扩增试剂的保存和运输。【拟解决的关键问题】筛选对等温扩增反应没有影响的冻干保护剂,设计并筛选最佳的保护剂配方,优化冻干工艺,对等温扩增试剂进行冻干,通过敏感性、特异性和稳定性试验检验冻干品的质量,最终研制成功牛支原体等温扩增冻干试剂盒。
1 材料与方法
1.1 病原与培养条件
牛支原体PG45株(ATCC)、牛支原体HB-1株(中国农业大学动物疫病快速诊断技术实验室保存)、牛支原体 SD-2株(中国农业大学动物疫病快速诊断技术实验室保存)、牛鼻支原体(ATCC)和无乳支原体(ATCC),均接种于含有2.5%酵母粉和20%马血清的类胸膜肺炎微生物肉汤培养基(PPLO)中,在含有5%CO2的37℃温箱中培养;多杀性巴氏杆菌931株(CVCC),接种于TSB培养基中,37℃条件下培养;牛结核杆菌菌液,周向梅赠送。
1.2 阳性对照品的制备
为了制备敏感性参比品,利用pEASY T1 Simple载体(购自全式金生物技术有限公司)构建含牛支原体的保守性uvrC基因片段的重组质粒,利用引物F:5′-GAATTTACGCAAGAGAATGCTTCA-3′; R: 5′-TC AGGCCTTTGCTACAATGAAC-3′ 进行PCR扩增,目的片段长度1 778 bp。PCR扩增程序:预变性94℃4 min;变性94℃ 30 s,退火51℃ 30 s,延伸72℃ 2 min,35个循环;延伸72℃ 10 min[23]。PCR产物经琼脂糖凝胶电泳分离纯化,连接pEASY T1 Simple载体,转化TOP10感受态细胞(购自全式金生物技术有限公司),获得重组大肠杆菌rP-uvrC。取重组大肠杆菌rP-uvrC,按10%比例接种LBAmp+液体培养基,混合均匀后置37℃、200 r/min摇床中培养16 h后,菌液5 000 r/min离心15 min,弃上清,沉淀用Easy Pure Mini Plasmid Purification Kit(北京全式金生物技术有限公司,产品目录号:EM101-01)提取和纯化重组质粒,经过0.22 μmol·L-1
滤器过滤除菌,用微量分光光度计测定质粒浓度,用双蒸水将重组质粒溶液稀释到104拷贝/μL,分装至冻存管中,0.1 mL/管,作为质控用阳性对照品,4℃保存。
1.4 甜菜碱溶液的制备
根据文献报道的反应体系中甜菜碱浓度[22],取甜菜碱15.0 g置于50 mL容量瓶中,加入双蒸水溶解并定容至50 mL,经过0.22 μmol·L-1滤器过滤除菌,分装至冻存管中,0.4 mL/管,4℃保存。
1.5 显色液的制备
根据文献报道的显色液组成配比[24],用双蒸水将SYBR Green I(10 000×)稀释为800×的溶液5 mL,用双蒸水将HNB粉末溶解并稀释至1.5 mmol·L-1的溶液5 mL。将稀释好的SYBR Green I和HNB以1∶1的体积比混合,经过0.22 μmol·L-1滤器过滤除菌,分装至棕色冻存管中,0.06 mL/管,4℃避光保存。
1.6 等温扩增试剂冻干品的制备
1.6.1 冻干保护剂的初步筛选 参考文献[22]报道方法配制等温扩增试剂。选取常用的冻干疫苗耐热保护剂如蔗糖、海藻糖、甘露醇、山梨醇、甘氨酸、牛血清白蛋白、酪蛋白和水解乳蛋白,作为等温扩增试剂的耐热冻干保护剂原料。向等温扩增试剂中分别加入上述保护剂,其中海藻糖的浓度为10%(质量体积比,w/v),其他物质的浓度均为5%(质量体积比,w/v),以不添加任何保护剂的等温扩增试剂作为对照。-40℃冷冻4 h后,置室温溶解,加入浓度为104拷贝/μL的阳性对照品,恒温仪中63℃反应1 h。反应结束后,采用 2%琼脂糖凝胶电泳检测扩增产物,并据此筛选对等温扩增反应没有影响的冻干保护剂。
1.6.2 保护剂的优化 选择对等温扩增反应的敏感性没有影响的3种物质即海藻糖、甘露醇和牛血清白蛋白,作为保护剂。每种物质选择3种不同的浓度,即海藻糖(等温扩增反应体系的10%、5%、2.5% w/v)、甘露醇和牛血清白蛋白(等温扩增反应体系的 5%、2.5%、1.25% w/v),设计正交试验,共有27种保护剂组方。将配制好的含有冻干保护剂的等温扩增试剂(不含甜菜碱)进行无菌分装,每个西林瓶中加入500μL反应液(相当于25个反应体系)。分装后,将27种不同组方的等温扩增试剂置于Christ冻干机内,按照冻干疫苗的冻干曲线(图 1)进行冷冻干燥,并通过观察冻干品形态选择最佳的一组保护剂。

图1 普遍采用的疫苗冻干曲线Fig. 1 The lyophilizing curve generally used for preparation of vaccines
1.6.3 冻干曲线的优化
(1)等温扩增试剂共晶点的测定 按最佳的冻干保护剂组方配制等温扩增试剂,加至西林瓶中。再将共晶点测试探头伸入西林瓶中的液面下,通过记录软件可以记录等温扩增试剂由液态变为固态过程中电阻率的变化。等温扩增试剂的温度曲线和电阻率曲线的交叉点即为等温扩增试剂的共晶点。
(2)冻干曲线的优化 以筛选出的最佳的一组冻干保护剂的配方为基础,根据等温扩增试剂的共晶点调整冻干曲线,主要针对一次干燥过程中的升温时间、干燥时间和二次干燥中的干燥时间进行优化。通过对冻干制品的物理性状的检验、真空度的检测以及残余水分含量的测定,筛选出一条适合等温扩增试剂的冻干曲线。
1.6.4 等温扩增试剂的冻干 配制等温扩增试剂后加至西林瓶中,每个西林瓶500 μL(相当于25个反应体系),放入冻干机内,根据1.6.3优化的冻干曲线进行冻干。
1.7 等温扩增冻干试剂盒的组装与使用方法
等温扩增冻干试剂盒主要包括等温扩增试剂冻干品、甜菜碱溶液、阳性对照品溶液和显色液。用时将甜菜碱溶液加入等温扩增混合物冻干品中溶解,加至PCR反应管中,每管20 μL。向各PCR管中加入样品液或阳性对照品,同时用纯净水做阴性对照,将显色液加至PCR管盖内侧,封盖,置(63±1)℃反应45 min,颠倒PCR管使显色剂与反应液充分混合,观察混合液颜色变化,阳性对照品为绿色,阴性对照品为褐色。
1.8 敏感性检验
利用天根质粒小提试剂盒提取质粒,通过微量分光光度计(Nanodrop)测定质粒浓度,进行10倍连续倍比稀释,按100—105个拷贝浓度加至等温扩增反应体系中,用等温扩增冻干试剂盒进行扩增,扩增产物可通过颜色变化和琼脂凝胶电泳方法进行检测。
1.9 特异性检验
取牛支原体PG-45株、HB-1株以及SD-2株菌液,活菌计数后用无菌水稀释至104CCU·mL-1。同时,取牛鼻支原体菌(108CCU·mL-1)、无乳支原体菌液(108CCU·mL-1)、多杀性巴氏杆菌(108CFU·mL-1)、结核分枝杆菌(108CFU·mL-1),置水浴中煮沸10 min后冷却,同时用等温扩增冻干试剂盒进行检测,通过颜色变化或琼脂凝胶电泳方法判断阴阳性。
1.10 保存期试验
将等温扩增冻干试剂盒分别置于20℃和37℃保存,定期取试剂盒进行敏感性检测,考察不同条件保存后的敏感性。
2 结果
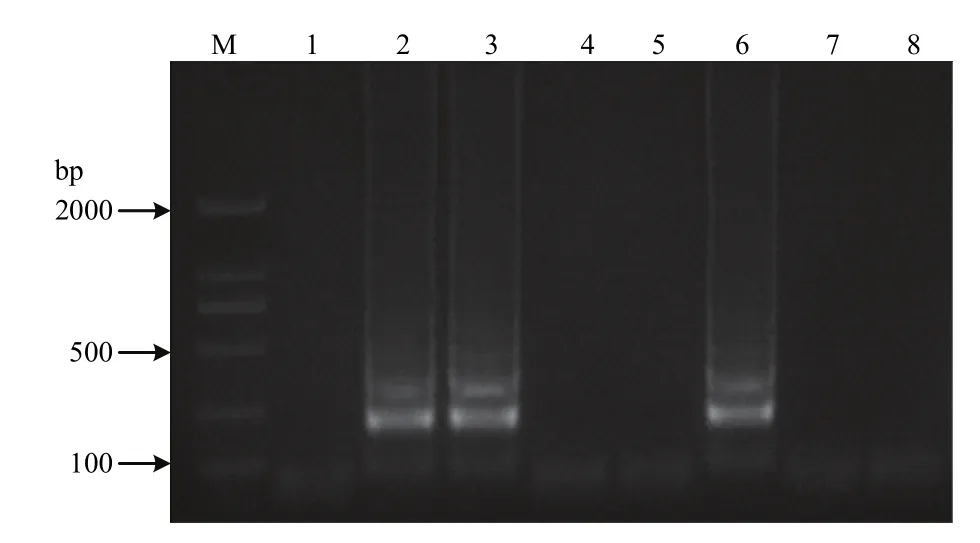
图2 冻干保护剂的初步筛选Fig. 2 Selection of the freeze-drying protective agent
2.1 冻干保护剂的初步筛选
保护剂的初步筛选结果表明,只有添加 10%w/v海藻糖、5%w/v甘露醇或牛血清白蛋白的等温扩增试剂能进行正常的扩增反应(图 2),其它保护剂均会抑制扩增反应。
2.2 等温扩增试剂共晶点的测定
将测试探头置于反应液液面以下,即可在冻干过程中实时监测反应液的电阻率,当反应液由液态逐渐变成固态时,其电阻率会增加。等温扩增试剂的温度曲线(图3中蓝色曲线)和电阻率曲线(图3中紫色曲线)的交点就是其共晶点。冻干保护剂配方为 5%海藻糖+1.25%甘露醇+1.25%牛血清白蛋白的等温扩增试剂共晶点为-16℃。
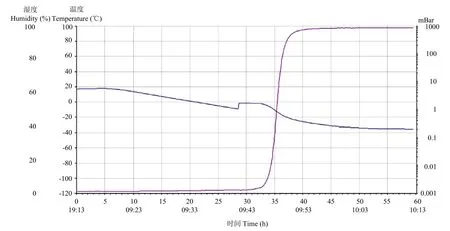
图3 等温扩增试剂共晶点的测定Fig. 3 The eutectic point of the isothermal amplification reagent
2.3 冻干曲线的优化
一次干燥的升温时间、干燥时间以及二次干燥的干燥时间的优化结果分别见表1、表2和表3。一次干燥的升温时间选择2 h和3 h进行试验。结果表明,升温时间为2 h时,虽然制品的外观性状较好,但是通过敏感性试验发现冻干制品的敏感性下降,说明可能是由于升温速度过快,导致Bst DNA聚合酶失活较多;选择3 h时,冻干制品的等温扩增反应体系的敏感性未发生变化,故选择3 h作为一次干燥的升温时间。
由表2可知,一次干燥的干燥时间为24和12 h时,由于干燥时间过长,导致制品表面形态较差,而干燥时间为3 h时,制品的水分含量过高,说明干燥时间过短。由此,选择6 h为一次干燥的干燥时间。

表1 一次干燥不同升温时间获得的冻干品的物理性状Table 1 The heating-up times and the physical characters of the freeze-dried products during the first drying process

表2 一次干燥的干燥时间的优化Table 2 Optimization of the drying time during the first drying process
由表3可知,二次干燥的干燥时间为8 h时,冻干制品的表面出现皲裂,说明干燥时间过长;而干燥时间为2 h时,制品在常温下出现萎缩,说明制品的含水量较高,应该延长干燥时间。因此,选择4 h作为二次干燥的干燥时间。
将上述3个环节进行优化后,得到一条适用于等温扩增试剂的冻干曲线(图 4),冻干的总时间缩短了一倍左右。
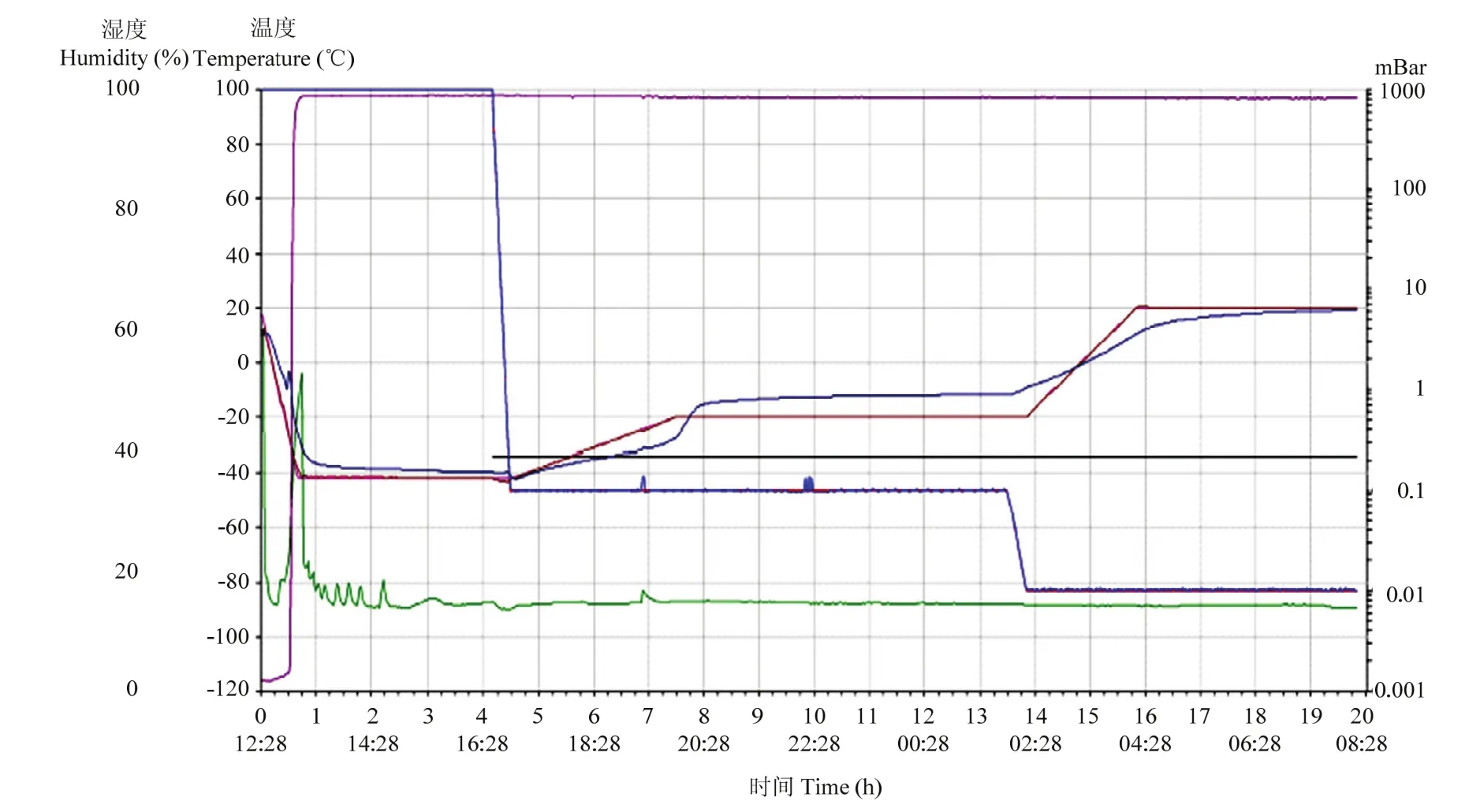
图4 优化后的等温扩增试剂的冻干曲线Fig. 4 Optimized lyophilizing curve of the isothermal amplification reagent

表3 二次干燥的干燥时间的优化Table 3 Optimization of the drying time during the second drying process
2.4 等温扩增冻干试剂盒的敏感性检测
以不同浓度梯度的质粒P-uvrC为模板,利用等温扩增冻干试剂盒检测敏感性,显色与凝胶电泳结果均表明,等温扩增冻干试剂盒最低可检测到10个拷贝的质粒(图5)。
2.5 等温扩增冻干试剂盒的特异性检测
阴性对照显褐色且无条带,阳性对照显绿色且有典型条带,证明对照成立。牛支原体PG45株、HB-1株以及 SD-2株经等温扩增冻干试剂盒检测,均显绿色和典型的梯形条带,判定为阳性;牛鼻支原体、无乳支原体、多杀巴氏杆菌和结核杆菌经试剂盒检测,均显褐色且无典型条带,判定为阴性(图6)。
2.6 等温扩增冻干试剂盒的保存期试验
试验结果如图7所示,等温扩增冻干试剂盒在20℃保存6个月后敏感性为10拷贝,在37℃保存10 d后敏感性也为10拷贝,且均与第0 天结果相同,由此说明,在这两种条件下试剂盒敏感性并未降低,质量稳定。
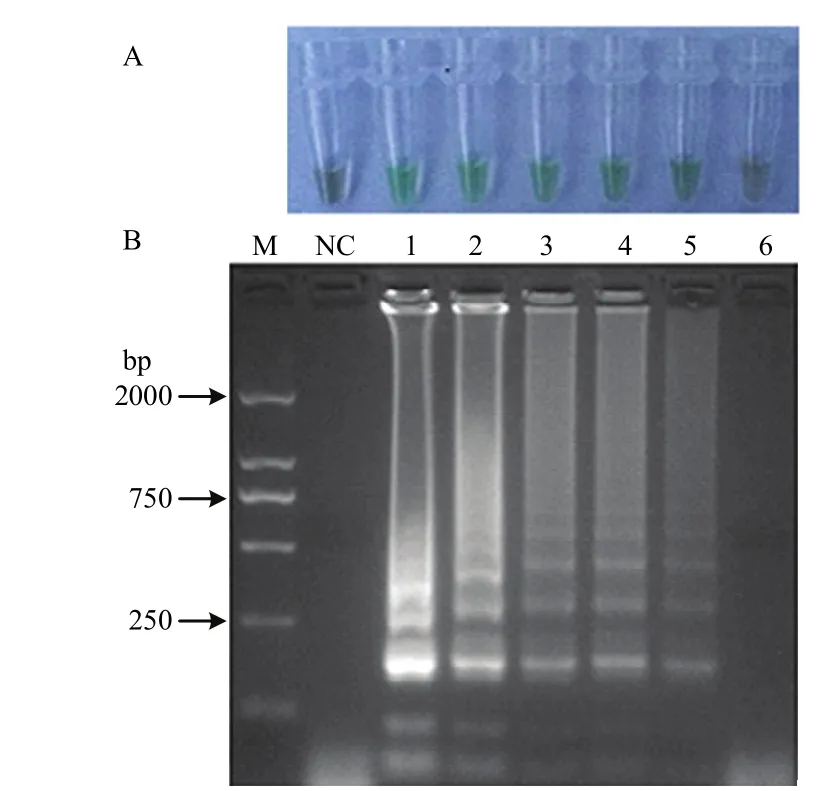
图5 等温扩增冻干试剂盒敏感性检测Fig.5 Sensitivity test of the freeze-dried kit

图6 等温扩增冻干试剂盒特异性检验Fig. 6 Specificity test results of the freeze-dried kit

图7 冻干试剂盒不同保存条件下敏感性试验Fig. 7 Specificity test results of the freeze-dried kit stored under different conditions
3 讨论
环介导等温扩增(LAMP)技术自2003年用于细菌检测以来,在动物传染病病原检测方面得到了广泛研究和应用[25]。如FUKUTA用LAMP检测番茄斑萎病毒的敏感性比PCR高100倍[26]。KUBOKI建立的非洲锥虫LAMP检测方法,不仅可以区分布氏锥虫的4个亚种,而且敏感性也较高[27]。 张跃伟建立的以HNB为终产物显色剂的 RT-LAMP方法最低可检测103拷贝高致病猪繁殖与呼吸综合征病毒,并具有很好的特异性[28]。蒋菲建立的以钙黄绿素与 Mn2+混合溶液为终产物显色剂的 RT-LAMP方法最低可检测103拷贝H9亚型禽流感病毒,较 RT-PCR 方法的敏感性高10倍,且通过对15种H亚型禽流感病毒、新城疫病毒、传染性支气管炎病毒的检测表明该方法具有良好的特异性[29]。李佳禾建立的 LAMP最低可检测到102拷贝的猪胸膜肺炎放线杆菌,敏感性是PCR方法的10倍,并通过对1—10型猪胸膜肺炎放线杆菌和其它18种病原微生物的检测证明有很好的种特异性,对127份临床发病猪的鼻拭子的检出率为 100%;以SYBR Green I与 HNB的混合液为终产物显色剂的LAMP方法最低可检测102拷贝猪肺炎支原体,并通过42株猪肺炎支原体和27种其它病原证明该方法有很好的敏感性和特异性[24,30]。本研究表明,笔者研制的等温扩增冻干试剂盒与 RT-PCR方法的敏感性相同,均能检出最低10个拷贝数的含牛支原体目标基因的重组质粒,并具有很好的敏感性和特异性。为方便结果判定,本研究采用了SYBR Green I与HNB混合液作为显色剂,结果表明阴阳性颜色对比明显,并与琼脂糖凝胶电泳检验一致。由此说明,试剂盒采用显色法检验结果准确、可靠。
冷冻干燥技术是提高生物制品稳定性的通用方法,也为分子诊断试剂的长期保存提供了有效途径。例如,KLATSER等通过在PCR反应试剂中加入5%海藻糖并冻干的方法,使反应试剂在4℃和20℃的条件下可存放一年,甚至在37℃也可以保存3个月之久[31]。李美霞等通过在 LAMP反应试剂中加入15%海藻糖并冻干的办法,使 LAMP反应试剂在25℃下的有效期由12 d延长到至少3个月[32]。为了筛选等温扩增试剂冻干用的保护剂,笔者先将添加有不同保护剂的等温扩增试剂放置在-40℃冻存 4 h,取出溶化后,检测不同浓度阳性质粒溶液,并与不加保护剂的等温扩增试剂进行比对,发现只有海藻糖、甘露醇和牛血清白蛋白对扩增反应敏感性没有影响。商品化的Bst酶溶液中甘油占50%[33],甘油是一种有机溶剂,添加量高时会使等温扩增试剂很难冻结,干燥阶段样品出现鼓泡溶化,无法成型。为此,笔者选用高浓度Super Bst DNA聚合酶,将等温扩增试剂中Bst酶溶液的添加体积减少15倍左右,减少了甘油对冻干的影响。按此方法配制的等温扩增试剂在优化条件下冻干,得到了质量较好的冻干品。各种试验结果也表明,组装的等温扩增冻干试剂盒具有很好的敏感性和特异性,在20℃下可保存至少6个月,在37℃至少可保存10 d,据此推测牛支原体等温扩增冻干试剂盒在2—8℃下可稳定保存24个月左右。
4 结论
综上所述,牛支原体等温扩增冻干试剂优选的冻干保护剂配方为5%海藻糖+1.25%甘露醇+1.25%牛血清白蛋白,共晶点为-16℃,一次干燥的升温时间3 h,一次干燥时间6 h,二次干燥时间4 h。制备的牛支原体等温扩增冻干试剂盒敏感性高、特异性好,2—8℃保存期可达24个月,而且操作简便,非常适合于临床快速检测,具有很好的应用前景。
References
[1] NICHOLAS R A, AYLING R D. Mycoplasma bovis: disease,diagnosis, and control. Research in Veterinary Science, 2003, 74(2):105-112.
[2] MAUNSELL F P, WOOLUMS AR, FRANCOZ D, ROSENBUSCH R F, STEP D L, WILSON D J, JANZEN E D. Mycoplasma bovis infections in cattle. Journal of Veterinary Internal Medicine, 2001,25:772-783.
[3] ADAMU J Y, WAWEGAMA N K, BROWNING, G F, MARKHAM,P F. Membrane proteins of Mycoplasma bovis and their role in pathogenesis. Research in Veterinary Science, 2013, 95:321-325.
[4] 胡长敏, 石磊, 龚瑞, 白智迪, 郭爱珍. 牛支原体病研究进展. 动物医学进展, 2009, 30(8): 73-77.HU C M, SHI L, GONG R, BAI Z D, GUO A Z. Progress on Bovine Mycoplasmosis.Progress in Veterinary Medicine, 2009, 30(8):73-77. (in Chinese)
[5] HAINES D M, MARTIN K M, CLARK E G, JIM G K, JANZEN E D. The immunohistochemical detection of Mycoplasma bovis and bovine viral diarrhea virus in tissues of feedlot cattle with chronic,unresponsive respiratory disease and/or arthritis. The Canadian Veterinary Journal, 2001, 42: 857-860.
[6] SHAHRIAR F M, CLARK E G, JANZEN E, WEST K, WOBESER G.
Coinfection with bovine viral diarrhea virus and Mycoplasma bovis in feedlot cattle with chronic pneumonia. The Canadian Veterinary Journal, 2002, 43: 863-868.
[7] GAGEA M I, BATEMAN K G, VAN DREUMEL T, MCEWEN B J,CARMAN S, ARCHAMBAULT M, SHANAHAN, R A, CASWELL J L. Diseases and pathogens associated with mortality in Ontario beef feedlots. Journal of Veterinary Diagnostic Investigation, 2006, 18:18-28.
[8] NICHOLAS R A. Bovine mycoplasmosis: silent and deadly. The Veterinary Record, 2011, 168: 459-462.
[9] BALL H J, FINLAY D, REILLY G A. Sandwich ELISA detection of Mycoplasma bovis in pneumonic calf lungs and nasal swabs. The Veterinary Record, 1994, 135(22):531-532.
[10] BLACKBURN P, BROOKS C, BALL H J. Filtration of homogenised tissue samples to improve the diagnostic detection of Mycoplasma bovis by sandwich ELISA. The Veterinary Record, 2008, 163(17):514-515.
[11] HELLER M, BERTHOLD E, PFÜTZNER H, LEIRER R, SACHSE K. Antigen capture ELISA using a monoclonal antibody for the detection of Mycoplasma bovis in milk. Veterinary of Microbiology,1993, 37(1-2):127-133.
[12] BELL C J, BLACKBURN P, PATTERSON I A, ELLISON S, BALL H J. Real-time PCR demonstrates a higher prevalence of Mycoplasma bovis in Northern Ireland compared with sandwich ELISA. The Veterinary Record, 2012, 171(16):402.
[13] HERMEYER K, JACOBSEN B, SPERGSER J, ROSENGARTEN R,HEWICKER-TRAUTWEIN M. Detection of Mycoplasma bovis by in-situ hybridization and expression of inducible nitric oxide synthase,nitrotyrosine and manganese superoxide dismutase in the lungs of experimentally-infected calves. Journal of Comparative Pathology,2011, 145(2-3):240-250.
[14] ADEGBOYE D S, RASBERRY U, HALBUR P G, ANDREWS J J,ROSENBUSCH R F. Monoclonal antibody-based immunohistochemical technique for the detection of Mycoplasma bovis in formalin-fixed,paraffin-embedded calf lung tissues. Journal of Veterinary Diagnostic Investigation, 1995, 7(2):261-265.
[15] HIGUCHI H, IWANO H, KAWAI K, OHTA T, OBAYASHI T,HIROSE K, ITO N, YOKOTA H, TAMURA Y, NAGAHATA H. A simplified PCR assay for fast and easy mycoplasma mastitis screening in dairy cattle. Journal of Veterinary Science, 2011, 12(2):191-193.
[16] CREMONESI P, VIMERCATI C, PISONI G, PEREZ G, RIBERA AM,CASTIGLIONI B, LUZZANA M, RUFFO G, MORONI P. Development of DNA extraction and PCR amplification protocols for detection of Mycoplasma bovis directly from milk samples, VeterinaryResearch Communications, 2007, 31(Suppl 1):225-227.
[17] ROSSETTI B C, FREY J, PILO P. Direct detection of Mycoplasma bovis in milk and tissue samples by real-time PCR. Molecular and Cellular Probes, 2010, 24(5):321-323.
[18] SACHSE K, SALAM HS, DILLER R, SCHUBERT E, HOFFMANN B, HOTZEL H. Use of a novel real-time PCR technique to monitor and quantitate Mycoplasma bovis infection in cattle herds with mastitis and respiratory disease, The Veterinary Journal, 2010,186(3):299-303.
[19] BEN SHABAT M, MIKULA I, GERCHMAN I, LYSNYANSKY I. Development and evaluation of a novel single-nucleotide- polymorphism real-time PCR assay for rapid detection of fluoroquinolone-resistant Mycoplasma bovis. Journal of Clinical Microbiology, 2010, 48(8):2909-2915.
[20] NOTOMI T, OKAYAMA H, MASUBUCHI H, YONEKAWA T,WATANABE K, AMINO N, HASE T. Loop-mediated isothermal amplification of DNA. Nucleic Acids Research, 2000, 28:E63.
[21] 黄火清, 郁昂. 环介导等温扩增技术的研究进展. 生物技术, 2012,22(3): 90-94. HUANG H Q, YU A. Advances of loop-mediated isothermal amplification. Biotechnology, 2012, 22(3):90-94. (in Chinese)
[22] 侯轩, 付萍, 张海燕, 张跃伟, 吴文学. 牛支原体的环介导等温扩增快速检测技术研究. 农业生物技术学报, 2012, 20(2):218-224. HOU X, FU P, ZHANG H Y, ZHANG Y W, WU W X. Development of Loop-mediated Isothermal Amplification for Rapid Detection of Mycoplasma bovis. Journal of Agricultural Biotechnology, 2012,20(2):218-224. (in Chinese)
[23] SUBRAMANIAM S, BERGONIER D, POUMARAT F, CAPAUL S,SCHLATTER Y, NICOLET J, FREY J. Species identification of Mycoplasma bovis and Mycoplasma agalactiae based on the uvrC genes by PCR. Molecular and Cellular Probes, 1998, 12(3):161-169. [24] LI J H, MINION F C, PETERSEN A C, JIANG F, YANG S, GUO P P,LI J X, WU W X. Loop-mediated isothermal amplification for rapid and convenient detection of Mycoplasma hyopneumoniae, World Journal of Microbiology Bioanalytic Chemistry, 2013, 29:607-616.
[25] MARUYAMA F, KENZAKA T, YAMAGUCHI N, TANI K, NASU M. Detection of bacteria carrying the stx2 gene by in situ loopmediated isothermal amplification. Applied and Environmental Microbiology, 2003, 69 (8):5023-5028.
[26] FUKUTA S, OHISHI K, YOSHIDA K, MIZUKAMI Y, ISHIDA A,KANBE M. Development of immunocapture reverse transcription loop-mediated isothermal amplification for the detection of tomato spotted wilt virus from chrysanthemum. Journal of Virology Methods,2004, 121(1):49-55.
[27] KUBOKI N, INOUE N, SAKURAI T, DI CELLO F, GRAB DJ,SUZUKI H, SUGIMOTO C, IGARASHI I. Loop-Mediated Isothermal Amplification for Detection of African Trypanosomes. Journal of clinical microbiology, 2003, 41(12):5517-5524.
[28] Zhang Y W, Fu P, Li J H, Jiang F, Li J X, Wu W X. Development of loop-mediated isothermal amplification method for visualization detection of the highly virulent strains of porcine reproductive and respiratory syndrome virus (PRRSV) in China, African Journal of Biotechnology, 2011, 10(61): 13278-13283.
[29] 蒋菲, 黄书林, 徐威, 张跃伟, 刘金华, 吴文学. H9亚型禽流感病毒环介导等温扩增检测方法的建立与荧光显色剂的应用. 农业生物技术学报, 2010, 19(1):191-196. JIANG F, HUANG S L, XU W, ZHANG Y W, LIU J H, WU W X. Detection of H9 avian influenza virus by Loop-mediated Isothermal Amplification and Application of Fluorescent Reagent. Journal of Agricultural Biotechnology, 2010, 19(1):191-196. (in Chinese)
[30] 李佳禾, 李一婧, 付萍, 张跃伟, 黄书林, 郭盼盼, 蒋菲, 吴文学.胸膜肺炎放线杆菌的环介导等温扩增检测方法的研究. 农业生物技术学报, 2009, 17(6):948-953. LI J H, LI Y J, FU P, ZHANG Y W, HUANG S L, GUO P P, JIANG F,WU W X.Detection ofActinobacillus pleuropneumoniae by Newly Developed Loop-mediated Isothermal Amplification Method, 2009,17(6):948-953. (in Chinese)
[31] KLATSER P, KUIJPER S, VAN INGEN C W, KOLK A H. Stabilized,freeze-dried PCR mix for detection of mycobacteria. Journal of Clinical Microbiology, 1998, 36(6):1798-1800.
[32] 李美霞, 张庆利, 刘利平, 黄倢, 谢国驷. 海藻糖对冷冻干燥的LAMP反应体系的保护效果. 渔业科学进展, 2012, 33(5):95-101. LI M X, ZHANG Q L, LIU L P, HUANG J, XIE G S. The protective effects of trehalose on freeze-drying and LAMP reagents storage. Progress in Fishery Sciences, 2012, 33(5):95-101. (in Chinese)
[33] Production Information of Bst DNA Polymerase, Large Fragment,http://www.neb.sg/products/m0275-bst-dna-polymerase-large-fragment.
(责任编辑 林鉴非)
Development of a Freeze-Dried Kit for Isothermal Amplification Assay of Mycoplasma bovis
WU Tong1, LIU Xu2, LI Jia-he2, YAN Xin-bo2, ZHANG Ning2, WU Wen-xue2
(1College of Life Sciences, Nanjing Agricultural University, Nanjing 210095;2College of Veterinary Medicine, China Agricultural University, Beijing 100193)
【Objective】Mycoplasma bovis (M. bovis) is a pathogen related to a variety of syndromes of infected cattle, and itspreads widely in the world. For the survey of the epidemiology of M. bovis in China, simple and sensitive kits are needed.【Method】A recombinant plasmid with the uvrC gene of M. bovis was constructed and transfected into TOP10 competent cell, by which a strain of recombinant Escherichia coli was selected. The recombinant plasmid rP-uvrC was extracted, purified and diluted to the concentration of 104copies/μL, which was used as the positive control. Betaine solution and color developing solution (mixture of SYBR Green I and HNB) were prepared to solve the freeze-dried amplification reagent and visualize the result of the amplification reaction, respectively, according to the published reports. Three kinds of freeze-drying protective agent which did not inhibit the amplification reaction were selected from 8 agents generally used to produce vaccine, then they were combined by different ratios to form 27 combinations, and the best combination was selected according to the physical characters. The isothermal amplification reagent made with the best freeze-drying protective agents were transported to the lyophilizer to detect the eutectic point, and the best heating-up time of the first drying, the first and the second drying times were determined. The best lyophilizing curve was selected to lyophilized the isothermal amplification reagent by testing of the physical characters, vacuum and residual water content. The lyophilized isothermal amplification kit consists of one tube of lyophilized isothermal amplification agent, betaine solution, positive control and color developing solution. The sensitivity of the kit was determined with a series of rP-uvrC solutions (100-105copies),and the specificity was determined with 104CCU·mL-1solutions of M.bovis strains PG-45, HB-1, SD-2, 108CCU·mL-1solutions of M. bovirhinis and M. agalactiae, and 108CFU·mL-1Pasteurella multocida and Tuberculosis mycobacteria, respectively. The steady of the kit was also evaluated under different temperatures.【Result】Among the 8 freeze-drying protective agents, only trehalose,mannitol and bovine serum albumin did not interfere the isothermal amplification reaction, and the best freeze-drying protective agents composition is 5% trehalose +1.25% mannitol +1.25% bovine serum albumin. The eutectic point was -16℃, and the best heating-up time of the first drying was 3h, the first and the second drying times are 6h and 4h, respectively. The detection limit of the freeze-dried kit is 10 copies, 104CCU·mL-1solutions of M.bovis strains PG45, HB-1 and SD-2 showed positive results, 108CCU·mL-1solutions of M. bovirhinis and M. agalactiae, 108CFU·mL-1Pasteurella multocida and Tuberculosis mycobacteria showed negative results. The sensitivity of the kit didn't change even it was stored for 6 months under 20℃ or 10 d under 37℃. So, the shelf life of the freeze-dried kit could be about 24 months.【Conclusion】The above results suggest that the freeze-dried kit has higher sensitivity, specificity and stability, could be used as a point-of-care (POC) test product since it is convenient for storage and very easy for the veterinarians to use in the farms.
Mycoplasma bovis; loop-mediated isothermal amplification; freeze-drying; kit; RT-PCR
2016-03-15;接受日期:2016-06-04
国家公益性行业(农业)科研专项(201203056-2)
联系方式:吴彤,E-mail: labboard@126.com。刘旭,E-mail: liuxu1987@126.com。吴彤与刘旭为同等贡献作者。通信作者吴文学,E-mail: wuwenxue @cau.edu.cn
