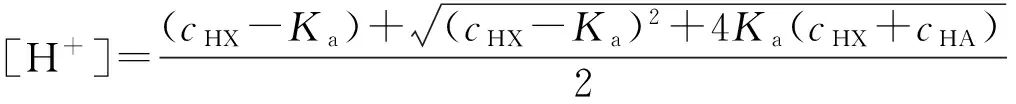双组分溶液体系中[H+]计算与讨论*
2016-09-05赵长春卢菊生刘晓君
赵长春,卢菊生,王 颇,刘晓君
(江苏师范大学化学化工学院,江苏 徐州 221116)
双组分溶液体系中[H+]计算与讨论*
赵长春,卢菊生,王颇,刘晓君
(江苏师范大学化学化工学院,江苏徐州221116)

质子等衡式;强酸弱酸混合溶液;缓冲溶液;弱酸弱酸混合溶液
在分析化学中经常会遇到含有两种主要组分的双组分溶液体系。例如强酸(碱)与弱酸(碱)混合溶液,缓冲溶液的配制,酸碱滴定的终点以及弱酸(碱)的混合溶液等。但是,在目前分析化学教材以及教研论文中关于[H+]的计算,主要涉及单组分体系如强酸(碱),一元弱酸(碱),多元弱酸(碱),两性物质等[1-3]。而对于由两种以及两种以上组分构成的溶液[H+]计算主要涉及缓冲溶液,而对于强酸~弱酸以及弱酸~弱酸体系讨论较少。在此,作者根据物料等衡,质子等衡和电荷等衡角度,推导了常见双组分溶液体系中[H+]的计算公式,并提出了在适当条件下得到的近似式。
1 强酸~弱酸双组分体系中[H+]计算

由于混合溶液呈酸性,水的离解可以忽略,因此可以简化为:
[H+]=cHX+[A-]
(1)
因为A-的分布系数:
(2)
将式(2)带入式(1)可知:
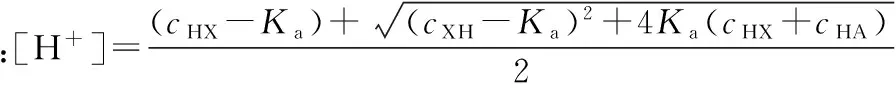
(3)
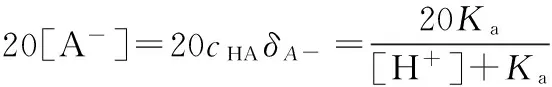
例1:计算含有浓度为1.500×10-3mol·dm-3HCl与0.150 mol·dm-3HAc溶液中的H+离子浓度(已知KHAc=1.8×10-5)。
首先判断HAc的离解是否可以忽略:
故HAc的离解不可忽略,需要采用式(3)计算。因此:

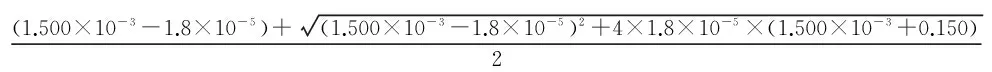
=3.07×10-3mol·dm-3
例2:计算 0.100 mol·dm-3H2SO4溶液中的H+离子浓度(已知Ka2=1.2×10-2)。

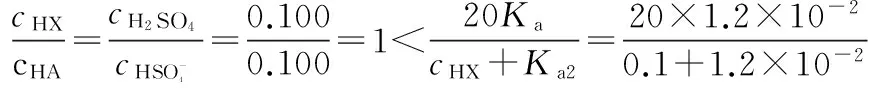
=0.100 mol·dm-3
2 酸碱缓冲溶液中[H+]计算
对于酸碱缓冲溶液中H+离子浓度的计算方法,各个教材都有较为详细的推导过程。但一般是将溶液看成共轭酸~水与共轭碱~水两个体系,列出两个质子等衡式进行推导。若从质子等衡的含义上去理解两个质子等衡式且同时成立,不易被理解与接受。例如对于HA~A-体系,质子等衡式[H+] + [HA]=ca+[OH-]中的ca项从质子得失角度不易理解,此外在同一溶液中同时存在两个PBE也不是十分妥当。这里从物料平衡以及质子等衡角度出发,对缓冲溶液中的氢离子浓度的计算进行尝试。将溶液中HA,A-以及H2O选作零参考,很易得到缓冲溶液的PBE为:
[H+] + [HA]a=[A-]b+ [OH-]
(4)
式中[HA]a表示平衡时,A-接受质子生成HA的浓度,而[A-]b则表示HA失去质子生成A-的浓度。
因此对于ca(HA)来说,溶液平衡时:
ca=[HA]a+[A-]a
(5)
同样地有:
cb=[HA]b+[A-]b
(6)
对于缓冲溶液而言有:ca+cb=[HA]+[A-]
其中
[HA]=[HA]a+[HA]b
(7)
[A-]=[A-]a+[A-]b
(8)
将式(5)带入式(4)可知:[H+]+[HA]b=[OH-]+ca-[HA]a,即:
[H+]+[HA]b+[HA]a=[OH-]+ca
由式(7)可知,[H+]+[HA]=[OH-]+ca,因此可得:
[HA]=ca-[H+]+[OH-]
(9)
类似地,由式(4),(6)和(8)可知:
[A-]=cb+[H+]-[OH-]
(10)
式(9)和式(10)就是教材出现的两个PBE,将两式带入弱酸平衡常数表达式,即可得到缓冲溶液[H+]计算的精确式,即:
从上面推导过程可以看出式(9)和(10)中的ca和cb中的确切概念是模糊的,其具体的含义应该如式(5)和式(6)中的表达,具有较为清晰的概念,可以帮助我们更好地理解质子的得失过程,经过推导同样也可以得到计算[H+]的公式。
3 弱酸~弱酸溶液中[H+]计算
考虑混合弱酸HA,HB,分析浓度和离解常数分别为cHA,KHA,cHB,KHB。将HA,HB和H2O看成零参考,很容易得到溶液中的质子等衡式为:
[H+]=[A-]+[B-]+[OH-]
(11)
根据离解常数,亦可写为:
此为含有[H+]的一元四次方程,需要做近似处理。作为一种近似,对于弱酸HA,有[H+]=[A-],对于弱酸HB,有[H+]=[B-],对于水溶液有[H+]=[OH-],可以得到:
(12)
因此有:
[H+]2=KHA[HA]+KHB[HB]+KW
(13)
(14)
此式即为Ringbom提出的著名的平方加和性原则[4],即当溶液存在多种弱酸时,对各种酸分别计算的氢离子浓度不具有加和性,但溶液中全部弱酸所分别计算的氢离子浓度的平方具有加和性。由于在多种弱酸存在下,[H+]=[A-]=[B-]=[OH-]的成立显然是不可能的,因此式(14)只是计算弱酸混合溶液的近似公式。孙贤祥等[5]利用迭代法计算溶液中的氢离子浓度并与近似式(14)比较,认为近似式的误差与两种酸离解常数比值以及两种酸的浓度比值等均有关系。若体系中HA为较强的弱酸且两者的分析浓度接近时,即当KHA>KHB,5≥cHA/cHB≥0.2成立。若此时KHA/KHB<10且满足cHA/KHA≥0.5或者10 例3:计算0.10 mol·dm-3HAc 和0.10 mol·dm-3HF 混合溶液的氢离子浓度,已知KaHAc=1.8×10-5,KaHF=6.6×10-4。 由于HF为较强的酸,KHA/KHB=6.6×10-4/1.8×10-5<100且cHF/KaHF=0.10/6.6×10-4>4,所以可采用公式(14)计算。 先计算[H+]HAc,由于c/KaHAc=0.10/1.8×10-5>500,cKaHAc=0.10×1.8×10-5>25KW,故用最简式: 再计算[H+]HF,因为c/KaHF=0.10/6.6×10-4<500,cKaHF=0.10×6.6×10-4>25KW,故用近似式: =0.0078 mol·dm-3 因此混合酸溶液的氢离子浓度为: 在分析化学里涉及[H+]计算的内容庞杂,需要结合具体情况,处理各种近似问题,从而获得正确结论。本文提供了解决强酸弱酸,弱酸弱酸二元体系[H+]计算的基本思路,对缓冲溶液的[H+]计算中的PBE提供的另一种思考方法,希望能对普通高校化学相关学科的学习提供一定的帮助,同时也与广大同行交流切磋。 [1]Li Na,John J.Hefferren,Li Ke’an.Quantitative Chemical Analysis[M].北京:北京大学出版社,2009:64-75. [2]任红,曹雪玲,芦菲,等.浅论无机化学中弱酸碱和酸式盐溶液的pH近似计算问题[J].化学教育,2015,36(14):74-76. [3]徐景华.两性物质溶液pH计算[J].大学化学,2006,21(2):65-69. [4]Ringbom A.分析化学中的络合作用[M].武广贞,谢自强,熊士恒,等译.长沙:中南工业大学出版社,1987:163-164. [5]孙贤祥,成和平,陈建海,等.混合弱酸溶液[H+]近似计算式使用条件的研究[J].江苏石油化工学院学报,1997:9(4):31-35. [H+] Calculation and Discussion of Solutions Having Two Components ZHAO Chang-chun,LU Ju-sheng,WANG Po,LIU Xiao-jun (School of Chemistry and Chemical Engineering,Jiangsu Normal University,Jiangsu Xuzhou 221116,China) proton-balance equation; mixture of strong acid and weak acid; buffer solutions; mixture of weak Acids 江苏高校品牌专业建设工程项目资助。 赵长春(1972-),男,副教授,主要从事光谱分析化学研究。 O655.2 A 1001-9677(2016)06-0127-03

4 结 语