P-糖蛋白抑制剂研究进展
2016-09-05张建华孙宝英
雷 燕,张建华,张 明,陈 赓,孙宝英
(内蒙金属材料研究所,内蒙古 包头 014034)
P-糖蛋白抑制剂研究进展
雷燕,张建华,张明,陈赓,孙宝英
(内蒙金属材料研究所,内蒙古包头014034)
化疗是治疗肿瘤的最重要手段之一,但多药耐药的发生是导致化疗失败的重要原因。其中最重要的多药耐药机制之一是肿瘤细胞膜P-糖蛋白的高度表达和它参与的药物外排引起的多药耐药。本文介绍了P-糖蛋白结构、P-糖蛋白转运药物的机制及P-糖蛋白抑制剂的发展。P-糖蛋白抑制剂是逆转多药耐药的重要方法之一,可以有效实现肿瘤多药耐药的逆转。因此,高特异性、低副作用及优良疗效的新型P-糖蛋白抑制剂的研究必将成为未来的研究重点。
P-糖蛋白;多药耐药;多药耐药抑制剂
肿瘤的多药耐药(MDR)由Biedler和Riehm[1]于1970年首次提出,是指肿瘤细胞对某种抗癌药物产生耐药作用以后,对作用靶点、作用机理和化学结构完全不同的抗癌药物也会产生耐药的现象。肿瘤的多药耐药性分为两类,即内在性耐药和获得性耐药,前者是指在化疗前就存在于肿瘤细胞中,即对首次化疗就产生耐药现象;后者是指肿瘤细胞对首次抗癌药物高度敏感,在化疗的过程中,不仅对已经使用过的抗癌药物产生耐药,而且对其他作用机制不同及结构各异的药物也产生耐药的现象[2]。
肿瘤多药耐药发生的机制有很多,且很复杂。在众多关于肿瘤多药耐药产生 机制的 研究中,肿瘤细胞膜P-糖蛋白的高度表达与其介导的药物外排引起的多药耐药机制被最早发现,是目前的研究热点,获得 最为广泛和深入的研究[3]。
1 P-糖蛋白结构
P-糖蛋白(P-gp)最早是由Juliano R L和Ling V[4]于1976年在耐药的中国仓鼠卵巢肿瘤细胞膜上发现的第一个ABC转运蛋白。这种蛋白在人类基因组中,至少包括2个多耐药基因家族:MDR1和MDR2,他们都位于7号染色体长臂(7q21)上,但是只有MDR1的表达与多药耐药相关[5-6]。如图1[7-8]所示,人类的P-糖蛋白分子是一个分子量为170 kD的多肽,由1280个氨基酸、两组近似对称、各含610个氨基酸的串联结构组成,另外60个氨基酸构成两者之间的连接区。

图1P-糖蛋白结构
Fig.1The structure of P-gp
2 P-糖蛋白转运药物的机制
P-糖蛋白能够转运和识别很多药理作用不同和化学结构各异的物质,关于P-糖蛋白和抑制剂或底物之间的相互作用是一个复杂的过程,确切机制迄今尚未完全阐明,仍然存在很大争议。目前人们广泛接受的机制是:当肿瘤细胞与抗癌药物相互作用时,亲脂性药物会和P-糖蛋白结合,ATP则结合到ATP结合区上后,发生水解作用并释放能量,P-糖蛋白借助能量将底物逆浓度差排到细胞外,使细胞内的药物浓度逐渐下降,进而导致化疗药物的功效减弱甚至消失,肿瘤细胞产生多药耐药[9]。其作用机理模型如图3[10]所述,(A)底物(洋红色)从细胞外进入双分子层到达内膜,然后通过敞开的药物结合口袋的大门进入,因与内部残基(蓝绿色)相互作用而被固定;(B)ATP(黄色)与NBDs结合,引起P-糖蛋白构象发生很大变化,将底物和药物结合位点暴露在细胞外,从而将药物泵出,ATP与NBDs结合并水解,P-糖蛋白恢复原来状态。

图2 P-糖蛋白对底物的转运模型
3 P-糖蛋白抑制剂
仔细研究P-糖蛋白作用机制与药物构效关系,利用计算机辅助技术和组合化学的方法,对早期抑制剂进行结构改进和修饰,不断推出新的P-糖蛋白逆转剂,至今已发展到第三代[11]。
P-糖蛋白抑制剂作为逆转MDR的重要方法,已经进行三十多年的研究,依据其选择性大小、药理活性和作用机制等特征,大致分为三代[12]。
3.1第一代P-糖蛋白抑制剂

图3 第一代P-糖蛋白抑制剂的的代表化合物
20世纪80年代,发明了第一代P-糖蛋白抑制剂,主要包括他莫昔芬、环孢素A、氯丙嗪、维拉帕米、奎宁、硝苯地平、噻吩嗪、三茴香基氯乙烯等,其中环孢素A与钙通道阻滞剂维拉帕米是典型代表。在体外实验中,第一代P-糖蛋白抑制剂可以较好逆转逆转肿瘤细胞MDR。但在体内试验中,仅有少数药物对肿瘤耐药有效,且毒性很大,因此不能达到有效抑制MDR所需的浓度。多数第一代P-糖蛋白抑制剂通过竞争抑制P-糖蛋白泵的外排作用发挥功效,与此同时P-糖蛋白抑制剂的浓度会下降。因此,若要保证药物在细胞内维持有效的作用浓度,需确保血清中具有高的抑制剂浓度。然而此类药物通常缺乏P-糖蛋白的特异性,会产生严重的副作用,如维拉帕米的心脏毒性、环孢素A的肾毒性及免疫抑制作用等。因此,第一代P-糖蛋白抑制剂作为逆转剂的临床应用受到很大程度的限制[13]。此外,许多第一代P-糖蛋白抑制剂同时也是其他转运蛋白和酶系统的底物,在化疗药物存在时出现一些不可预测的药物代谢动力学反应。因此,这类抑制剂不能用于临床治疗肿瘤多药耐药。
3.2第二代P-糖蛋白抑制剂
为降低毒性和提高疗效,很多研究者对第一代P-糖蛋白抑制剂结构进行修改,试图提高其逆转活性和适用性,并降低其对正常细胞的毒副作用。于是开发出了第二代耐药逆转剂。第二代P-糖蛋白抑制剂分为两种:其中一种是第一代P-糖蛋白抑制剂的同系物,如环孢菌素类似物伐司朴达(valspodar,PSC833)、右旋维拉帕米(dexverapamil)、右旋尼古地平(dexniguldipine)以及奎尼丁类似物MS-209和托瑞米芬(toremifene)。另一种是新结构化合物,如S-9788、GF-12918、VX-710等。
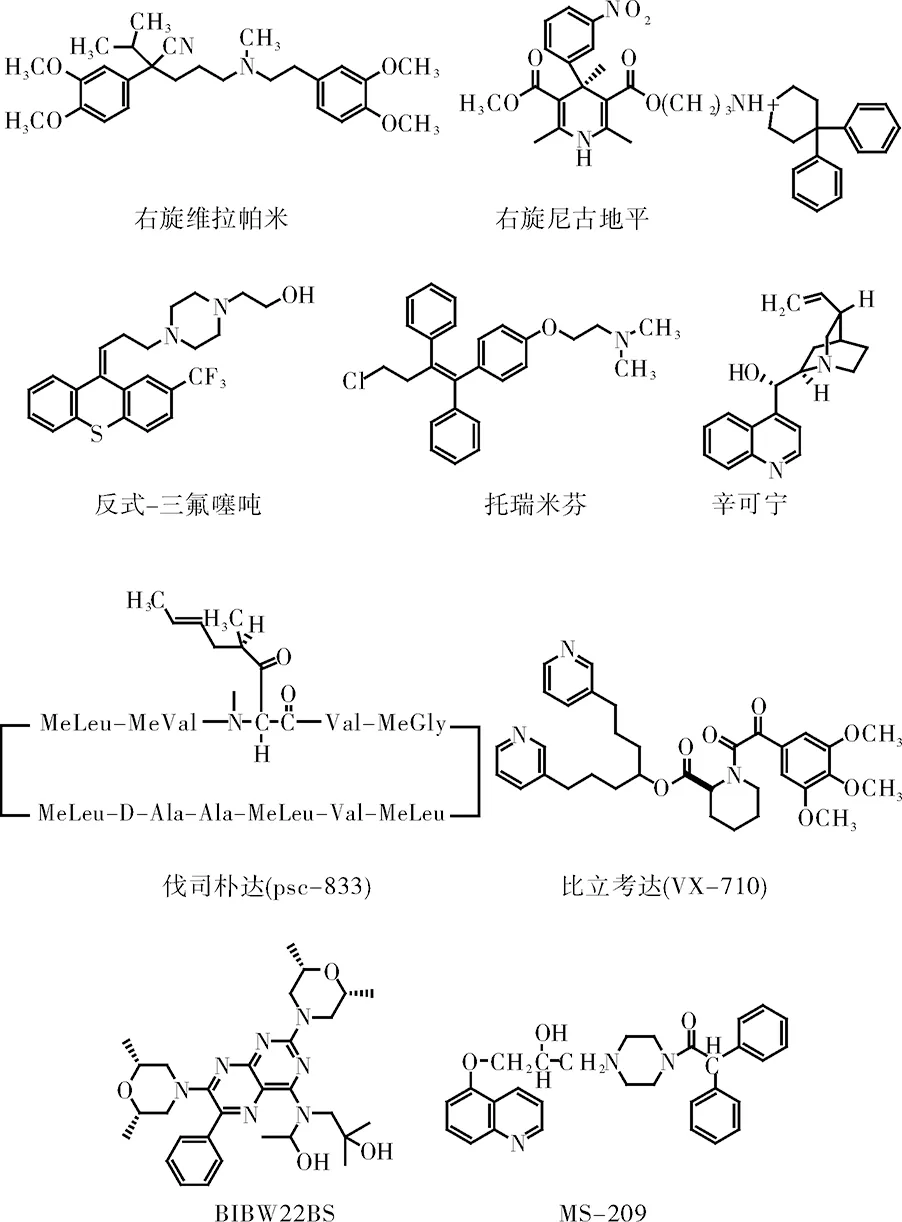
图4 第二代P-糖蛋白抑制剂的代表化合物
伐司朴达是环孢素A的衍生物,没有环孢素A的免疫抑制作用,可以对患者高剂量使用[14-15]。它对P-糖蛋白的抑制作用是环孢素A的2~10倍[16]。PSC 833 和P-糖蛋白的亲和力较高,但是P-糖蛋白转运valspodar,PSC 833的速度非常慢,研究表明:在完整的血清条件下,要完全抑制转运的地高辛和紫杉醇,PSC833的浓度比在临床试验中取得的血浆浓度高[17]。尽管PSC833对P-糖蛋白是一个有效的抑制剂,但PSC833同时也是人体中主要药物代谢酶-细胞色素氧化酶P450 3A4(CYP3A4)的底物。因此,当对患者使用时,它在抑制P-糖蛋白的同时,对CYP3A4降解的药物底物的清除有额外的影响,很多抗癌药物也是P-糖蛋白的底物[18],例如依托泊苷、阿霉素,也被CYP3A4广泛降解[19]。因此,与PSC833联用,能够加强这些抗癌药物的毒性反应,需要降低剂量以保证病人的安全[20]。PSC833的主要毒性是病人站立不稳[21](运动失调)。这些毒副作用和不可预知的药代动力学反应制约了第二代P-糖蛋白抑制剂的临床应用。
3.3第三代P-糖蛋白抑制剂
近年来,随着化学信息学、计算化学、分子药理学及组合化学的发展,多药耐药抑制剂的研究获得飞速发展,现已研制出第三代P-糖蛋白抑制剂,其对P-糖蛋白更具特异性,作用更强。第三代P-糖蛋白抑制剂的主要代表物有Tariquidar(XR9576)、Zosuquidar(LY335979)、S9788、ONT-093(0C144-093)、粉防己碱(Tetrandrine)、Laniquidar(R101933)和Elacridar(GFl20918)等[13]。与第二代P-糖蛋白抑制剂相比,基本消除了上述两个缺陷,即对细胞色素P450同工酶3A4没有影响,已经证实其与细胞毒药物同时使用时对药物代谢没有影响;并且,由于第三代P-糖蛋白抑制剂对P-糖蛋白有高度的特异性,所以不会对其他ABC家族的转运蛋白产生抑制作用,从而避免产生其他副作用[22]。更为重要的是,在临床使用过程中,多数第三代P-糖蛋白抑制剂能够很大程度地降低由于影响其他转运蛋白的活性而导致的抗癌药物药理活性的改变。这类非竞争性P-糖蛋白抑制剂的出现,极大地促进了多药耐药逆转剂的研究,有效提高了抗癌药物的化疗药效[23]。

图5 第三代P-糖蛋白抑制剂的代表化合物
4 结 语
多药耐药是肿瘤化疗失败的主要原因之一。众多研究表明,肿瘤 MDR现象产生的重要原因是P-糖蛋白的过度表达,导致许多亲脂性药物难以进入中枢神经系统发挥有效作用。通过直接降低P-糖蛋白的表达即抑制P-糖蛋白功能来逆转肿瘤细胞的MDR,具有重要的临床应用意义。P-糖蛋白抑制剂可有效抑制P-糖蛋白的过度表达,有效抑制药物外排作用,从而实现肿瘤 MDR的逆转,增加药物在中枢神经系统的浓度。经过多年研究,到目前为止P-糖蛋白抑制剂的开发已历经三代,取得了重大进展,其中第三代P-糖蛋白抑制剂具有最优的临床实用价值。目前临床上使用的多药耐药抑制剂的副作用较大,应用受到一定限制,治疗功效受到很大的抑制。随着科学技术的飞速发展和相关基础理论的深入研究,高特异性、低副作用及优良疗效的新型P-糖蛋白抑制剂的研究必将成为未来的研究重点,以期找到更多克服肿瘤的耐药性的办法,更好地指导临床治疗,使癌症的治疗取得突破性的进展。
[1]Biedler J L,Riehm H.Cellular resistance to actinomycin D in Chinese hamster cells in vitro:cross-resistance,radioautographic,and cytogenetic studies [J].Cancer Research,1970,30(4):1174-1184.
[2]Baird R D,Kaye S B.Drug resistance reversal-are we getting closer [J].European Journal of Cancer,2003,39(17):2450-2461.
[3]chau,M.,Lundberg,A.S.,Baer,M.R.et al.Multidrug resistance(MDR)in AML:Predicting P-glycoprotein(P-gp)function by direct measurement of Drug efflux is more effective than use of Surrogate Efflux indicators [C].Proceedings of The American Association for Cancer Research Annual Meeting.New York:ACM Press,2008,49:768-769.
[4]Juliao RL,Ling V.A surface glycoprotein modulating drug permeability in Chinese hamster ovary cell mutants [J].Biochimica et Biophysica Acta(BBA)-Biomembranes,1976,455(1):152-162.
[5]Callen D F,Baker E,Simmers R N,et al.Localization of the human multiple drug resistance gene,MDR1,to 7q21.1 [J].Human genetics,1987,77(2):142-144.
[6]Chen C,Chin J E,Ueda K,et al.Internal duplication and homology with bacterial transport proteins in the mdr1(P-glycoprotein)gene from multidrug-resistant human cells[J].Cell,1986,47(3):381-389.
[7]李荀.P-糖蛋白抑制剂研究进展[EB/OL].中国科技论文在线[2011-01-14].http://www.paper.edu.cn/releasepaper/content/201101-764.
[8]赵青,黎燕,彭晖.P 糖蛋白与配体相互作用的结构基础及其肿瘤耐药逆转的研究[J].国际药学研究杂志,2010,37(6):439-445.
[9]Suresh V.Ambudkar,In-Wha Kim,Zuben E.Sauna.The power of the pump:Mechanisms of action of P-glycoprotein(ABCB1)[J].European Journal of Pharmaceutical Sciences,2006,27:392-400.
[10]Aller S G,Yu J,Ward A,et al.Structure of P-glycoprotein reveals a molecular basis for poly-specific drug binding [J].Science,2009,323(5922):1718-1722.
[11]康恺,李运曼.P-糖蛋白抑制剂的研究进展[J].药学进展,2004,28(9):405-408.
[12]Thomas H,Coley H M.Overcoming multidrug resistance in cancer:an update on the clinical strategy of inhibiting p-glycoprotein [J].Cancer control,2003,10(2):159-159.
[13]刘念,耿小平,熊茂明.P-糖蛋白抑制剂的研究进展[J].国外医学:药学分册,2006,33(2):107-110.
[14]Sikic B I.Modulation of multidrug resistance:a paradigm for translational clinical research [J].Oncology(Williston Park,NY),1999,13(5A):183-187.
[15]Boesch D,Gavériaux C,Jachez B,et al.In vivo circumvention of P-glycoprotein-mediated multidrug resistance of tumor cells with SDZ PSC 833 [J].Cancer research,1991,51(16):4226-4233.
[16]Te Boekhorst P A W,Van Kapel J,Schoester M,et al.Reversal of typical multidrug resistance by cyclosporin and its non-immunosuppressive analogue SDZ PSC 833 in Chinese hamster ovary cells expressing themdr1 phenotype [J].Cancer chemotherapy and pharmacology,1992,30(3):238-242.
[17]Smith A J,Mayer U,Schinkel A H,et al.Availability of PSC833,a substrate and inhibitor of P-glycoproteins,in various concentrations of serum[J].Journal of the National Cancer Institute,1998,90(15):1611-1166.
[18]Fischer V,Rodríguez-Gascón A,Heitz F,et al.The Multidrug Resistance Modulator Valspodar(PSC 833)Is Metabolized by Human CytochrOCH3P450 3A Implications for Drug-Drug Interactions and Pharmacological Activity of the Main Metabolite [J].Drug metabolism and disposition,1998,26(8):802-811.
[19]Callen D F,Baker E,Simmers R N,et al.Localization of the human multiple drug resistance gene,MDR1,to 7q21.1 [J].Human genetics,1987,77(2):142-144.
[20]McDevitt C A,Callaghan R.How can we best use structural information on P-glycoprotein to design inhibitors [J].Pharmacology & therapeutics,2007,113(2):429-441.
[21]Schinkel A H,Jonker J W.Mammalian drug efflux transporters of the ATP binding cassette(ABC)family:an overview [J].Advanced drug delivery reviews,2012,64:138-153.
[22]马秉亮,吴玉林,刘国卿.P-糖蛋白及对抗P-糖蛋白介导多药耐药的研究现状 [J].中国临床药理学与治疗学,2006,11(1):14-21.
[23]Wang Z,Ravula R,Cao M,et al.Transporter-mediated multidrug resistance and its modulation by Chinese medicines and other herbal products [J].Current drug discovery technologies,2010,7(1):54-66.
Advances of P-glycoprotein Inhibitors
LEI Yan,ZHANG Jian-hua,ZHANG Ming,CHEN Geng,SUN Bao-ying
(Metal Materials Institute of Inner Mongolia,Inner Mongolia Baotou 014034,China)
Although chemotherapy is one of the main methods of cancer therapy,multidrug resistance(MDR)is the main cause of chemotherapy failure.Excessive expression of P-glycoprotein(P-gp)on the tumor cell membrane and its mediated drug efflux caused by multidrug resistance are the most important multidrug resistance mechanisms.The structure of P-gp and the mechanism of P-gp transferring drugs,as well as the advances in P-gp inhibitors,were briefly introduced.P-gp inhibitor is one of the most significant and effective methods that can reverse the MDR of tumor cells.Therefore,new types of P-gp inhibitors,which have characters of high specificity and low side-effects,will be widely focused in the future.
P-glycoprotein; multidrug resistance; multidrug resistance mechanism
R1
A
1001-9677(2016)06-0027-04
