人诱导性多能干细胞的无饲养层培养及鉴定
2016-09-05王欢方煌李潇高书涛周传坤邹银双李锋
王欢 方煌 李潇 高书涛 周传坤 邹银双 李锋
人诱导性多能干细胞的无饲养层培养及鉴定
王欢方煌李潇高书涛周传坤邹银双李锋
目的探索人诱导性多能干细胞(induced pluripotent stem cells,iPSCs)的无饲养层培养方法,并对此方法培养的iPSCs进行鉴定。方法将人iPSCs接种于玻璃粘连蛋白(Vitronectin XF)包被的培养皿上培养,采用EDTA消化传代。倒置显微镜下观察iPSCs的生长状态;碱性磷酸酶(ALP)染色鉴定;采用PCR和免疫荧光检测iPSCs多能性基因SSEA-1、Nanog、Sox2的表达情况。结果倒置显微镜下可见iPSCs呈典型的克隆状生长,克隆呈圆形或椭圆形,边界清晰、整齐;ALP染色结果阳性;PCR结果显示人iPSCs强表达多能性基因SSEA-1、Nanog、Sox2;免疫荧光结果显示多能干细胞特异性指标SSEA-1、Nanog、Sox2均呈阳性。结论无饲养层培养体系培养人iPSCs,细胞能稳定增殖,保持自我更新潜能及多能性。
多能干细胞;细胞培养技术;无饲养层
人诱导性多能干细胞(induced pluripotent stem cells,iPSCs)是一种借助重编程技术获得的多能干细胞[1,2],不仅具有类似于胚胎干细胞(embryonic stem cell,ESC)的增殖能力和多能性[3],可被诱导分化为运动神经元、少突胶质细胞、心肌细胞等[4-6],而且还规避了ESC及成体干细胞面临的伦理道德、法律、难以大量获取等问题,具有更广阔的应用前景[7]。由于iPSCs的饲养层培养法面临步骤繁琐、工作量大、细胞纯化困难等问题,且未达到临床应用的要求[8],因此简单易行的无饲养层培养法更为实用。
本研究采用无饲养层iPSCs培养体系建立人iPSCs系,并对获得的iPSCs进行鉴定,从而为iPSCs的基础研究及临床应用奠定基础。
材料与方法
一、实验材料
1.细胞:人iPSCs购自于北京赛贝生物技术有限公司。
2.主要试剂:人iPSCs无饲养层基础培养基、基础培养基添加剂及解冻完全培养基(PSCeasy,北京);乙二胺四乙酸(EDTA)、二甲基亚砜(DMSO)、碱性磷酸酶(ALP)染色试剂盒(Sigma,美国);玻璃粘连蛋白(Vitronectin XF)试剂盒(Stem cell,加拿大);逆转录试剂盒、PCR试剂盒(Azanno Biotech,瑞典);Trizol(Invitrogen,美国);Nanog兔抗人一抗、SSEA-1小鼠抗人一抗、Sox2小鼠抗人一抗(博奥森,中国);FITC兔抗小鼠二抗(博士德,中国);牛血清白蛋白(BSA)、4%多聚甲醛(谷歌,中国);磷酸缓冲盐(PBS)粉(奥斯丹,中国);抗荧光淬灭剂(碧云天,中国);4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)。
二、细胞培养方法
(一)培养皿的包被
在细胞复苏或传代的前一天进行培养皿包被。Vitronectin XF即配即用,浓度为10 μg/ml,每个培养皿中加入3 ml至完全覆盖培养皿底部,4℃冰箱中静置过夜备用。
(二)配制培养基
于4℃冰箱中解冻基础培养基添加剂,离心后混匀,分装。将添加剂加入基础培养基配制成iPSCs完全培养基,每0.7 ml添加剂与50 ml基础培养基混合。人iPSCs解冻完全培养基可在4℃冰箱中直接解冻备用。
(三)人iPSCs的培养
1.复苏:37℃水浴锅中解冻细胞,剧烈晃动冻存管使冻存液融化至剩余小块冰晶,迅速取出。用75%酒精消毒冻存管,迅速转移至无菌操作台。将细胞悬液转移至含有2 ml iPSCs解冻完全培养基的15 ml离心管中,轻柔吹打2次。室温下,200×g离心5 min。弃上清,加入3 ml解冻完全培养基重悬细胞,再次轻柔吹吸2次,接种到Vitronectin XF包被的培养皿中。显微镜下观察细胞呈4~20个细胞大小的团块。水平十字晃动培养皿使细胞均匀分布。细胞于37℃、5%CO2的恒温细胞培养箱中培养48 h后,更换iPSCs解冻完全培养基为iPSCs完全培养基,继续培养。
2.传代:当iPSCs克隆融合80%或者克隆中央细胞生长不良时按1∶3传代。吸弃培养皿中的iPSCs完全培养基,用不含钙镁的PBS溶液洗涤1次。加入0.5 mmol/L的EDTA溶液至完全覆盖培养皿底面,培养箱中37℃孵育4~5 min,显微镜下观察到克隆内部大部分细胞间出现间隙但尚未完全分离,细胞皱缩成类圆形时,可终止消化。轻柔吸弃EDTA溶液,加入完全培养基,轻柔吹打培养皿中贴附的细胞集落使其脱落,制成4~20个细胞大小的悬液,加入新的Vitronectin XF包被的培养皿中继续培养。
3.冻存:完全培养基和DMSO按9∶1的体积比配制冻存液,置于4℃冰箱中备用。吸弃培养皿中的培养基,无钙镁的PBS溶液轻柔洗涤1次。加入0.5 mmol/L的EDTA溶液至完全覆盖培养皿底面,培养箱中37℃孵育4~5 min,显微镜下观察到克隆内部大部分细胞间出现间隙但尚未完全分离,细胞皱缩成类圆形,可终止消化,轻柔吸弃EDTA溶液,即刻加入4℃的冻存液1 ml,轻柔吹打培养皿贴附的干细胞集落使其脱落,制成4~20个细胞大小的干细胞悬液,将冻存细胞放入程序性冻存盒,于-80℃冰箱中过夜后置入液氮中长期保存。
三、iPSCs的鉴定
(一)PCR检测基因表达
取克隆边缘清晰、生长状态良好的iPSCs,Trizol裂解细胞抽提总RNA,随机引物(表1)逆转录合成cDNA后进行PCR扩增检测多能性基因SSEA-1、Nanog、Sox2的表达。反应条件:94℃预变性30 s,94℃变性5 s,55℃退火15 s,72℃延伸10 s,扩增40个循环。将扩增后产物进行琼脂糖电泳,每个指标设3个复孔。
(二)免疫组化染色及免疫荧光鉴定
1.ALP染色:将iPSCs置于12孔板中培养,形成典型iPSCs克隆后进行ALP染色,染色步骤及方法参照ALP染色试剂盒。
2.免疫荧光:将iPSCs置于Vitronectin XF包被的细胞爬片上进行培养。待形成典型的iPSCs克隆后,用5%多聚甲醛固定15 min,PBS洗涤3次,每次5 min。1%BSA溶液封闭2 h,吸弃封闭液后加入按1∶50稀释的SSEA-1小鼠抗人一抗,将爬片置入4℃冰箱过夜。吸弃一抗,PBS洗涤3次,每次5 min,再加入按1∶100稀释的FITC兔抗小鼠二抗,室温孵育2 h。吸弃二抗,PBS溶液洗涤3次,每次5 min。再加入DAPI染核5 min,吸弃DAPI,PBS洗涤3次,每次5 min。于载玻片上滴20 μl抗荧光淬灭剂,将细胞爬片置于荧光显微镜下观察。采用相同的步骤及一抗、二抗浓度对Nanog和Sox2进行荧光检测。

表1 PCR引物
结果
一、iPSCs的生长
iPSCs克隆呈椭圆形或者圆形,克隆边界清晰,折光性较好。克隆内细胞排列紧密,细胞胞体较小,增殖旺盛。培养3~4 d后可见克隆增大,克隆间可发生接触融合(图1)。
二、iPSCs的鉴定
iPSCs经过多次传代后,PCR检测结果显示其仍高表达多能性基因SSEA-1、Nanog、Sox2(图2)。通过ALP组化染色,可见染色阳性(图3)。SSEA-1、Nanog、Sox2免疫荧光检测结果显示阳性(图4~6),表明人iPSCs具有良好的多能性。
讨论
iPSCs是由日本学者Takahashi等[1]首次借助4个转录因子(Oct4、Sox2、Klf4、c-Myc)重编程成纤维细胞而获得。
早期ESC及iPSCs的培养方法均添加胎牛血清,由于其成分复杂,且不同批次血清的质量不均一,会给细胞培养带来不确定的影响因素[8]。近年来,国内外学者在维持iPSCs多能性的前提下对iPSCs的培养体系及方法进行了不断探索[9,10]。通过简化培养步骤,减少外源性动物蛋白添加,明确培养液的化学成分等方式优化其培养体系,使得无饲养层、化学成分明确的iPSCs培养方法得以应用和发展[8,10-12]。
Vitronectin为人血浆中的一种糖蛋白,浓度为200~400 μg/ml时,促进细胞黏附,对于调控细胞迁移/侵蚀、增殖及组织修复均具有重要作用[13]。本研究中所用的Vitronectin XF为重组人源蛋白,不仅能为iPSCs培养提供成分明确的持久培养环境,而且容易获取,价格低廉[10,14]。EDTA消化传代,较胶原酶、胰酶消化的方式更加温和,对iPSCs损伤小,更易获得大小合适的细胞团块[10]。本研究所用的iPSCs完全培养基为E8改良型培养基。E8培养基在mTeSR1培养体系中去除了β-巯基乙醇及BSA,含有8种明确化学成分,所含蛋白均为人重组蛋白[10],具有化学成分明确、无动物源成分、支持无饲养层培养等优点。无饲养层培养可获得典型的iPSCs克隆,细胞多能性指标高表达,具有向3个胚层细胞分化的能力[10];明确简单的成分避免了对实验因子和药物作用的干扰,同时可保证不同批次培养基的一致性和质量稳定性,提高实验的可重复性[15]。
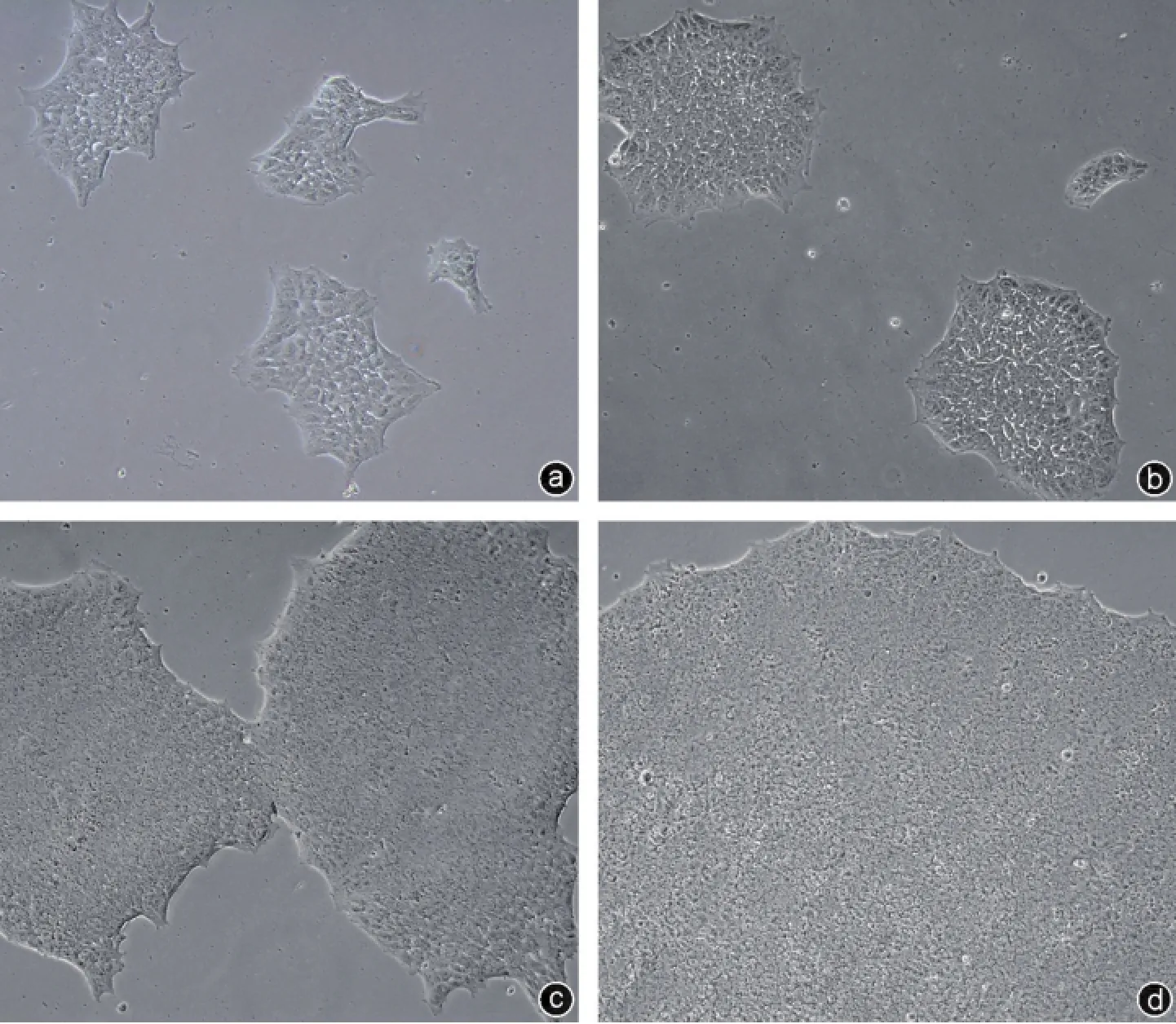
图1 iPSCs的生长状况(×100) a:复苏后第1天,克隆形成;b:复苏后第2天,克隆增大,边缘清晰;c:复苏后第3天,克隆出现接触融合;d:复苏后第4天的iPSCs克隆
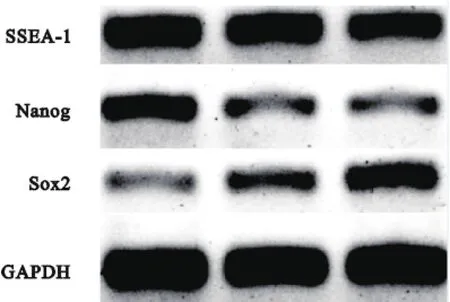
图2 PCR检测多能性基因表达,每个指标3个复孔,可见SSEA-1、Nanog、Sox2高表达
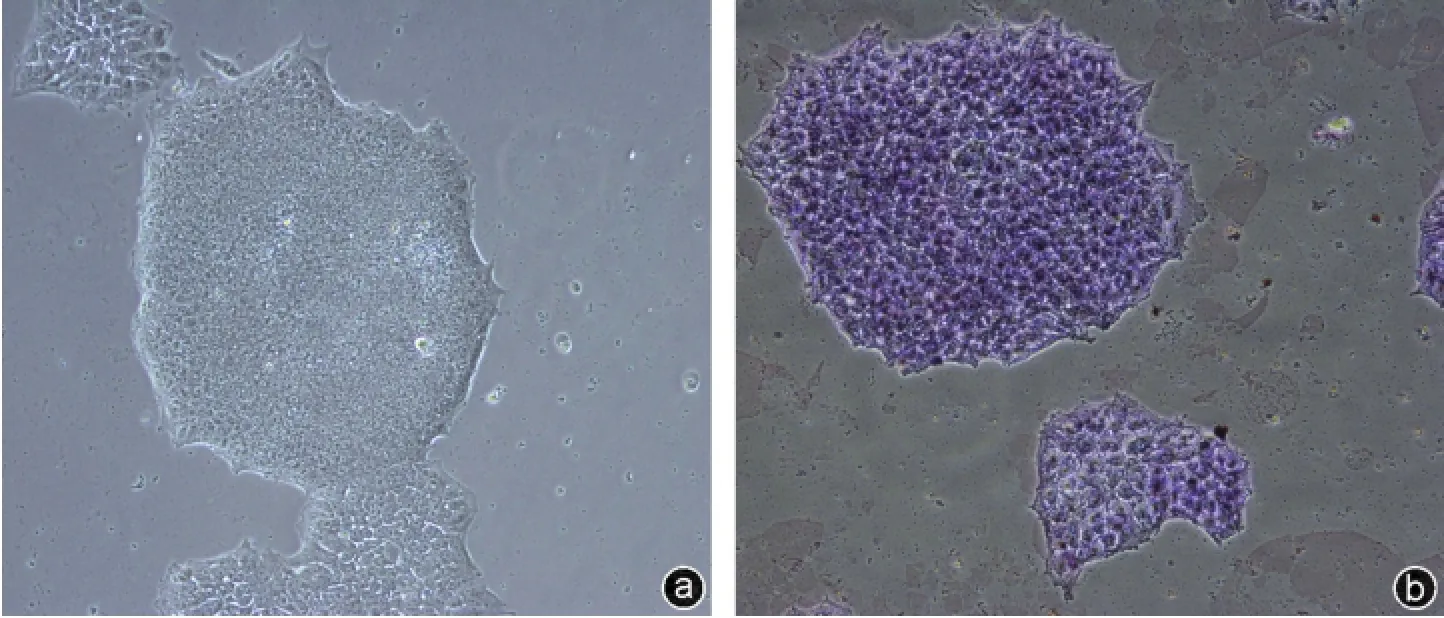
图3 ALP染色结果(×100) a:未行ALP染色的iPSCs克隆;b:ALP染色后的iPSCs克隆
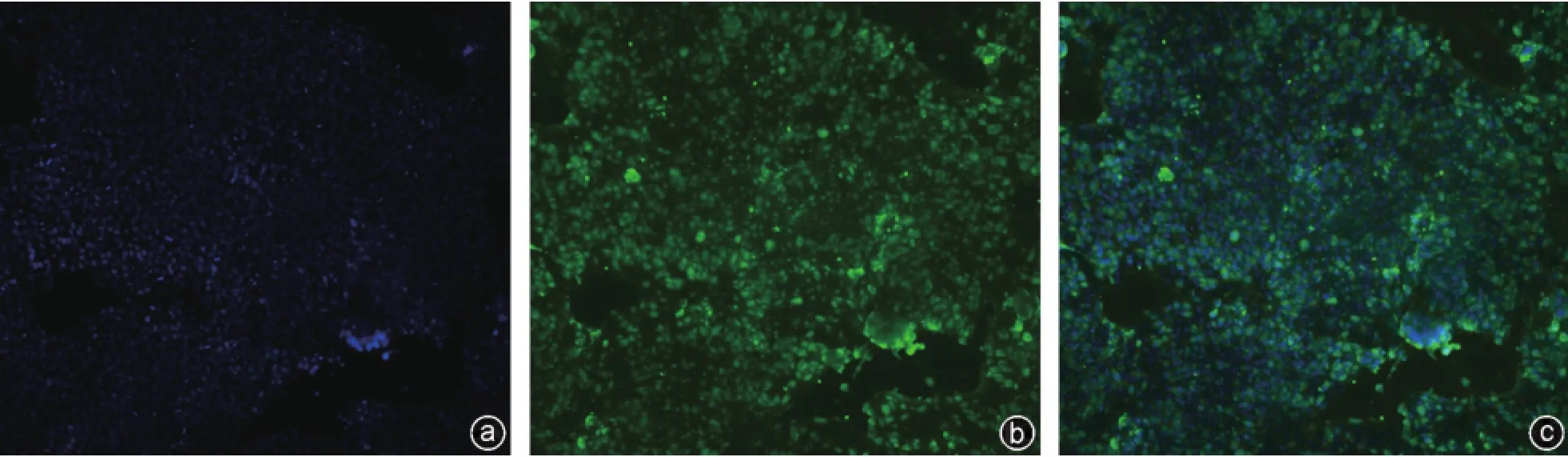
图4 SSEA-1免疫荧光染色(×100) a:DAPI染色;b:SSEA-1荧光染色阳性;c:DAPI/SSEA-1融合图像
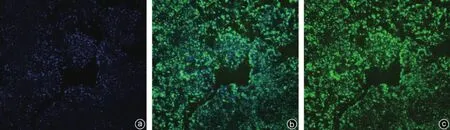
图5 Nanog免疫荧光染色(×100) a:DAPI染色;b:Nanog荧光染色阳性;c:DAPI/Nanog融合图像
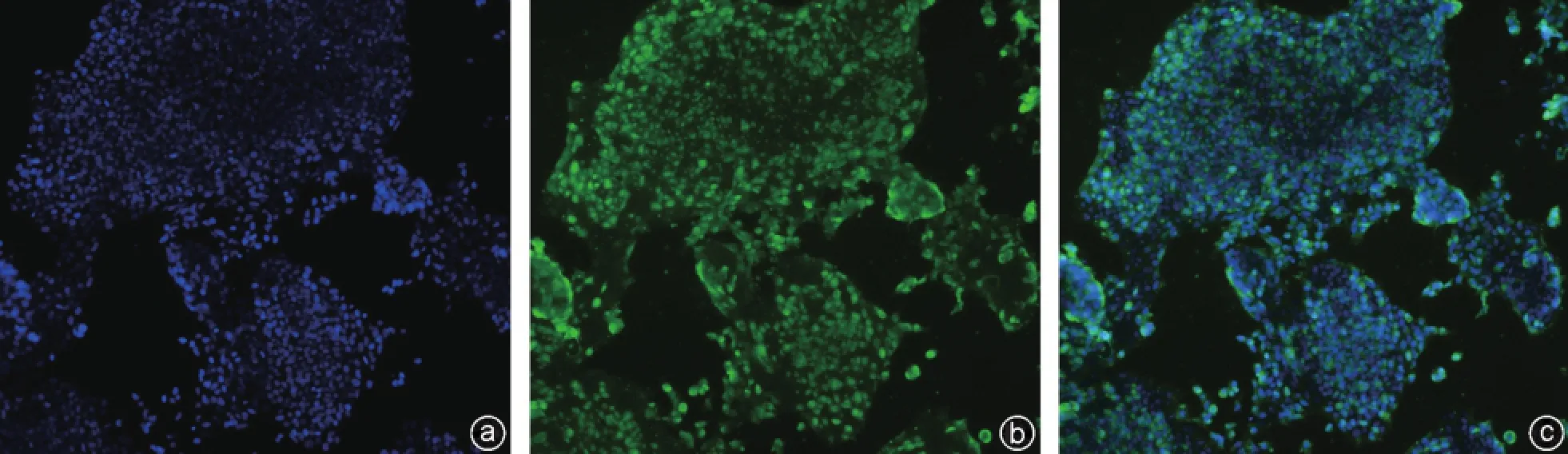
图6 Sox2免疫荧光染色(×100) a:DAPI染色;b:Sox2荧光染色阳性;c:DAPI/Sox2融合图像
本研究为鉴定无饲养层培养获得的iPSCs,通过PCR及免疫荧光鉴定了多潜能干细胞特异性标记物SSEA-1、Nanog、Sox2。SSEA-1即CD15,由Solter等[16]发现,为阶段特异性胚胎抗原之一;Nanog基因可维持ESC的自我更新及全能型[17],iPSCs高表达该基因证实其具有与ESC类似的多潜能性;Sox2是Sox区域Y相关高迁移率蛋白超家族的成员之一,在维持ESC自我更新和多潜能性中具有重要作用[18]。
本研究尚未进行后续的3个胚层分化验证及畸胎瘤形成实验,但通过本研究获得了稳定的iPSCs系,从而为后续诱导iPSCs向不同组织细胞分化的研究提供了研究基础。
[1]Takahashi K,Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,2006,126(4):663-676.
[2]Yu J,Vodyanik MA,Smuga-Otto K,et al.Induced pluripotent stem cell lines derived from human somatic cells[J].Science,2007,318 (5858):1917-1920.
[3]Maherali N,Sridharan R,Xie W,et al.Directly reprogrammed fibroblasts show global epigenetic remodeling and widespread tissue contribution[J].Cell Stem Cell,2007,1(1):55-70.
[4]Karumbayaram S,Novitch BG,Patterson M,et al.Directed differentiation of human-induced pluripotent stem cells generates active motor neurons[J].Stem Cells,2009,27(4):806-811.
[5]Wang S,Bates J,Li X,et al.Human iPSC-derived oligodendrocyte progenitor cells can myelinate and rescue a mouse model of congenital hypomyelination[J].Cell Stem Cell,2013,12(2):252-264.
[6]Fuerstenau-Sharp M,Zimmermann ME,Stark K,et al.Generation of highly purified human cardiomyocytes from peripheral blood mononuclear cell-derived induced pluripotent stem cells[J].PLoS One,2015,10(5):e0126596.
[7]Yamanaka S.A fresh look at iPS cells[J].Cell,2009,137(1):13-17.
[8]Rajala K,Lindroos B,Hussein SM,et al.A defined and xeno-free culture method enabling the establishment of clinical-grade human embryonic,induced pluripotent and adipose stem cells[J].PLoS One,2010,5(4):e10246.
[9]Wang H,Fang H,Dai J,et al.Induced pluripotent stem cells for spinal cord injury therapy:current status and perspective[J].Neurol Sci,2013,34(1):11-17.
[10]Chen G,Gulbranson DR,Hou Z,et al.Chemically defined conditions for human iPSC derivation and culture[J].Nat Methods,2011,8(5):424-429.
[11]Beers J,Gulbranson DR,George N,et al.Passaging and colony expansion of human pluripotent stem cells by enzyme-free dissociation in chemically defined culture conditions[J].Nat Protoc,2012,7(11):2029-2040.
[12]Nishishita N,Muramatsu M,and Kawamata S.An effective freezing/thawing method for human pluripotent stem cells cultured in chemically-defined and feeder-free conditions[J].Am J Stem Cells,2015,4(1):38-49.
[13]Preissner KT,Reuning U.Vitronectin in vascular context:facets of a multitalented matricellular protein[J].Semin Thromb Hemost,2011,37(4):408-424.
[14]Braam SR,Zeinstra L,Litjens S,et al.Recombinant vitronectin is a functionally defined substrate that supports human embryonic stem cell self-renewal via alphavbeta5 integrin[J].Stem Cells,2008,26(9):2257-2265.
[15]Chen G,Hou Z,Gulbranson DR,et al.Actin-myosin contractility is responsible for the reduced viability of dissociated human embryonic stem cells[J].Cell Stem Cell,2010,7(2):240-248.
[16]Solter D,Knowles BB.Monoclonal antibody defining a stage-specific mouse embryonic antigen(SSEA-1)[J].Proc Natl Acad Sci U S A,1978,75(11):5565-5569.
[17]Chambers I,Colby D,Robertson M,et al.Functional expression cloning of Nanog,a pluripotency sustaining factor in embryonic stem cells[J].Cell,2003,113(5):643-655.
[18]Fong H,Hohenstein KA,and Donovan PJ.Regulation of self-renewal and pluripotency by Sox2 in human embryonic stem cells[J].Stem Cells,2008,26(8):1931-1938.
Feeder-free culture and identification of human induced pluripotent stem cells.
WANG Huan,FANG Huang,LI Xiao,GAO Shutao,ZHOU Chuankun,ZOU Yinshuang,LI Feng.Department of Orthopaedics,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China
FANG Huang,E-mail:fanghuangtjh@126.com
ObjectiveTo explore a stable feeder-free culture system of induced pluripotent stem cells (iPSCs)and identify iPSCs cultured through feeder-free system.MethodsiPSCs were plated on the dish which was coated with Vitronectin XF,and passaged by EDTA solution.Morphology of iPSCs was observed under a microscope,and the pluripotency marker ALP,was analyzed.Moreover,the pluripotent genes SSEA-1,Nanog and Sox2 were detected by PCR and inmunofluorescence.ResultsiPSCs formed typical cell clones with clear boundary,and the clones were round or oval.The immunohistochemistry of ALP showed positive reaction.PCR showed that pluripotent genes SSEA-1,Nanog and Sox2 were expressed strongly.Moreover,the immunoinfluorescence analysis of SSEA-1,Nanog and Sox2 revealed positive results.ConclusionFeeder-free iPSCs culture system provides suitable condition for keeping iPSCs proliferation and pluripotency.
Pluripotent stem cells;Cell culture techniques;Feeder-free
10.3969/j.issn.1674-8573.2016.01.012
国家自然科学基金资助项目(81271347)
430030武汉,华中科技大学同济医学院附属同济医院骨科
方煌,E-mail:fanghuangtjh@126.com
2015-06-16)