尿路感染大肠埃希菌耐药和基因型的流行病学分析
2016-08-30徐志刚陈秋媛姜笑笑李雪梅
徐志刚,高 宇,陈秋媛,姜笑笑,李雪梅
(1.重庆市红十字会医院江北区人民医院,重庆 400020;2.第三军医大学附属西南医院,重庆 400038)
尿路感染大肠埃希菌耐药和基因型的流行病学分析
徐志刚1,高宇2,陈秋媛2,姜笑笑2,李雪梅2
(1.重庆市红十字会医院江北区人民医院,重庆 400020;2.第三军医大学附属西南医院,重庆 400038)

目的探讨尿路感染大肠埃希菌的耐药性及基因型,为抗感染治疗提供理论依据。方法收集56株尿路感染大肠埃希菌,采用多位点序列分型方法对细菌进行基因分型,采用琼脂平板倍比稀释法检测细菌的最低抑菌浓度,双纸片协同法检测超广谱β-内酰胺酶,采用PCR扩增ESBLs基因。结果56株大肠埃希菌共分为21个基因型,其中ST405基因型最多占30.4%(17株),其次为ST301基因型。56株大肠埃希菌除对碳青霉烯类、阿米卡星敏感性较高外,对其他抗菌药物均具有较高的耐药性。ST405型菌株对青霉素类药物的耐药率显著高于其他分型菌株(P<0.05)。大肠埃希菌ESBLs检出率为51.8%。PCR扩增结果显示CTX-M和OXA的阳性率分别为48.2%和19.6%,未扩增出其他耐药基因。结论尿路感染大肠埃希菌中对大多数抗菌药物具有较高的耐药性,ST405是最多的基因型。
大肠埃希菌;尿路感染;耐药;基因型;多位点序列分型
尿路感染是最常见的医院感染之一,而大肠埃希菌是尿路感染的最常见病原菌[1],近年来随着抗菌药物的广泛应用,其耐药性也呈增高趋势[2],给临床治疗带来了很大困难。分析医院尿路感染大肠埃希菌的基因分型及耐药性则有益于分析感染细菌的来源,对于感染控制方案的制订和抗菌药物的合理使用都具有重要的临床意义和价值,而目前国内研究多集中在细菌的耐药性方面,很少关注细菌的基因分型[3-4]。因此,本研究以临床尿液分离的大肠埃希菌为研究对象,通过多位点序列分型(multilocus sequence typing, MLST)方法对大肠埃希菌进行基因分型,并分析尿路感染大肠埃希菌的感染特征及耐药性,以期为尿路感染的治疗提供有力的数据支持。
1 研究资料
1.1材料
1.1.1菌株来源及鉴定实验所用56株大肠埃希菌均来源于第三军医大学附属西南医院泌尿外科2012年1月—2013年6月患者的尿液标本,标本收集均在入院48 h,且患者入院前无尿路感染症状。所有菌株均采用梅里埃VITEK2全自动细菌鉴定仪(生物梅里埃公司)进行鉴定。质控菌株大肠埃希菌ATCC 25922和肺炎克雷伯菌ATCC 700603由第三军医大学西南医院药剂科提供。
1.1.2试剂及设备氨曲南、氨苄西林、哌拉西林、头孢他啶、头孢哌酮、头孢吡肟、阿米卡星、亚胺培南、美罗培南、庆大霉素、妥布霉素、环丙沙星、左氧氟沙星和复方新诺明购自中国食品药品检定研究院;头孢他啶、头孢他啶/克拉维酸、头孢噻肟、头孢噻肟/克拉维酸纸片购自英国Oxoid公司;MH培养基购自北京陆桥生物技术有限公司;胰蛋白胨、酵母提取物购自英国Oxoid公司;细菌基因组DNA提取试剂盒和琼脂糖购自Promega公司;引物由Invitrogen公司合成;2×Es Taq MasterMix购自北京康为世纪生物科技有限公司。多点接种仪购自日本佐久间公司;PCR扩增仪、电泳仪和凝胶成像系统购自美国Bio-Rad公司。
1.2方法
1.2.1大肠埃希菌MLST分析采用MLST(包括adk, fumC, gyrB, icd, mdh, purA 和recA 7对管家基因)对大肠埃希菌进行基因分型[5]。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,54~60 ℃退火30 s,72 ℃延伸1 min,30个循环;最后72 ℃延伸10 min。反应产物以1%琼脂糖凝胶电泳,然后回收纯化并测序。测序结果与PubMLST database(http://mlst.warwick.ac.uk/mlst/dbs/Ecoli)进行比对,确定其等位基因谱型及菌株序列型(Sequence type,ST)。
1.2.2大肠埃希菌最低抑菌浓度(MIC)检测采用标准琼脂平板倍比稀释法测定细菌MIC。大肠埃希菌划线接种于M-H琼脂平板,37 ℃培养过夜。挑取细菌菌落于灭菌生理盐水稀释比浊至0.5麦氏单位(约108 CFU/mL),然后以多点接种仪将1~2 μL菌液接种至含药物的M-H琼脂平板,37 ℃孵育18 h。以能够完全抑制细菌生长的最低药物浓度作为MIC。结果判读参照美国国家临床实验室标准委员会(CLSI,2010)标准。大肠埃希菌ATCC25922作为质控菌株。
1.2.3超广谱β-内酰胺酶(ESBLs)检测采用双纸片协同法检测。将大肠埃希菌过夜培养物比浊至0.5麦氏单位,以无菌棉签将菌液均匀涂布于M-H平板,然后将药敏纸片(头孢他啶、头孢他啶/克拉维酸、头孢噻肟、头孢噻肟/克拉维酸)平贴于培养基表面,37 ℃孵育16~18 h进行结果判读。头孢他啶抑菌环≤22 mm或头孢噻肟抑菌环≤27 mm为可疑ESBLs菌株;头孢他啶/克拉维酸抑菌环≥5 mm或头孢噻肟/克拉维酸抑菌环≥5 mm可确认为ESBLs阳性菌株。同时以肺炎克雷伯菌ATCC 700603和大肠埃希菌ATCC 25922作为阳性和阴性对照。
1.2.4常见ESBLs耐药基因的PCR分析常见ESBLs耐药基因引物序列见表1[6-7]。基因组DNA的提取按照细菌基因组DNA提取试剂盒操作说明进行。PCR反应体系(20 μL):2×Es Taq MasterMix 10 μL,引物各0.3 μL,DNA 0.4 μL,ddH2O 9 μL。PCR反应条件为:94 ℃,5 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸30 s,共35个循环;末次循环后于72 ℃延伸10 min。反应产物以1%琼脂糖凝胶(含EB 0.5 μg/mL)电泳,采用凝胶成像系统观察结果。
1.3统计学方法ST405型菌株和非ST405型菌株的耐药差异性比较采用SPSS 17.0软件进行2检验,P<0.05为差异有统计学意义。

表1 大肠埃希菌常见ESBLs耐药基因引物序列
2 结 果
2.1大肠埃希菌MLST分析MLST分析显示56株大肠埃希菌分为21个分型,其中ST405最高,其余基因型均小于5株。见表2。
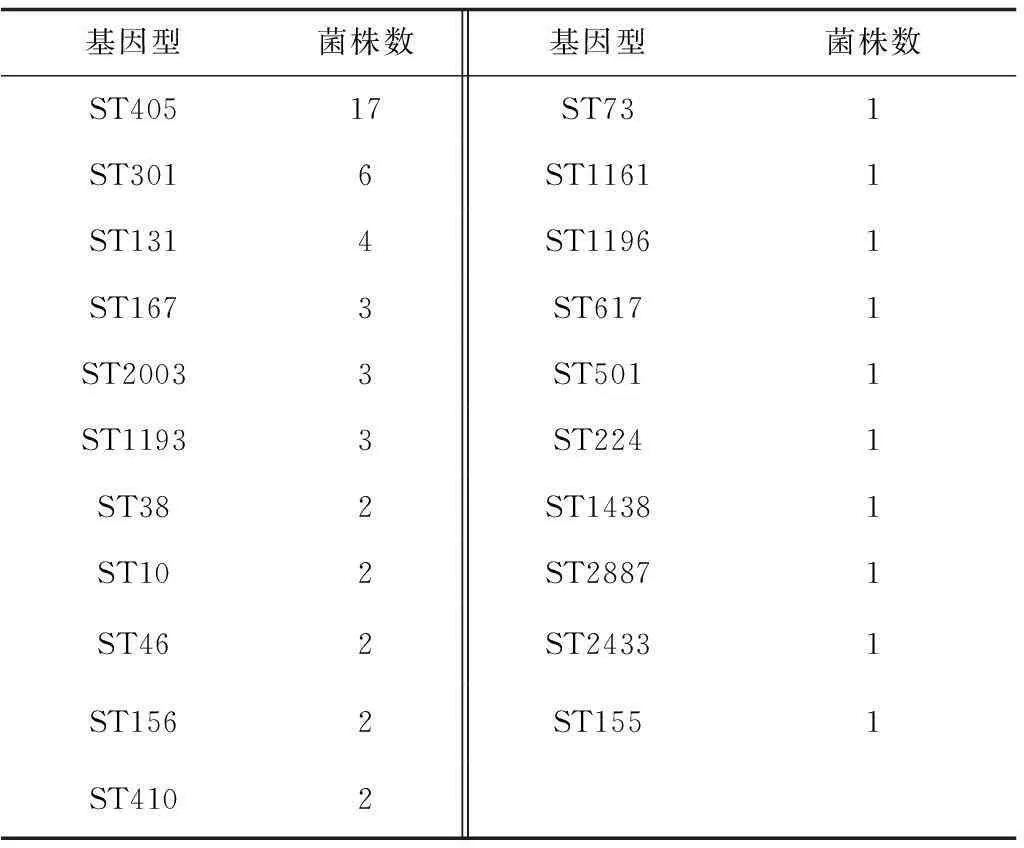
表2 大肠埃希菌MLST分析 株
2.2大肠埃希菌MIC检测结果大肠埃希菌除对碳青霉烯类、阿米卡星敏感率较高外,对其他抗菌药物均具有较高的耐药性。此外,ST405型菌株对青霉素类药物的耐药率均显著高于其他分型菌株(P均<0.05)。见表3。
2.3大肠埃希菌ESBLs及耐药基因检测结果大肠埃希菌ESBLs检出率为51.8%(29/56)。ESBLs耐药基因结果显示CTX-M 和OXA的阳性率分别为48.2%(27/56)和19.6%(11/56),且携带OXA的菌株均携带CTX-M(11/56)。未扩增出其他耐药基因。
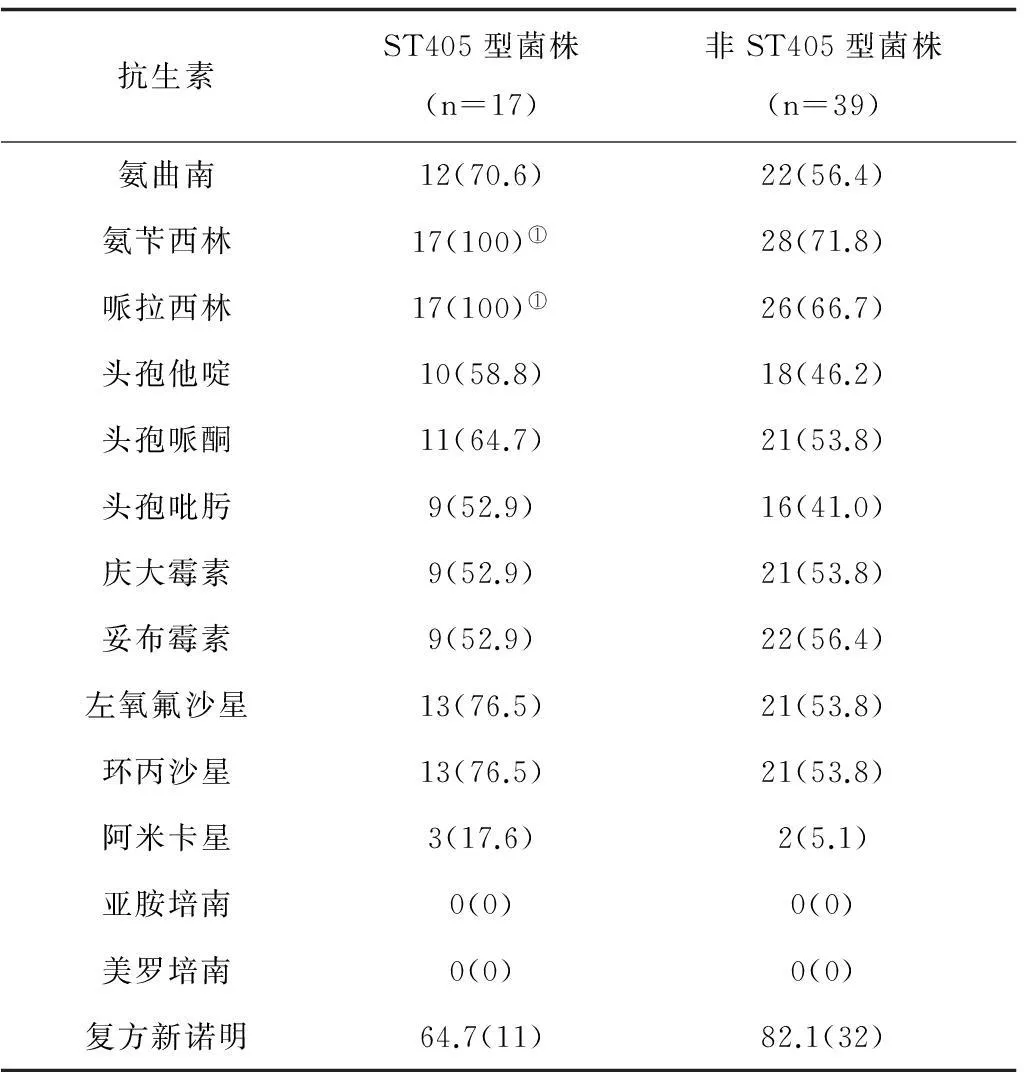
表3 大肠埃希菌对常见抗菌药物的耐药情况 株(%)
注:①与非ST405型菌株比较,P<0.05。
3 讨 论
大肠埃希菌是人体肠道微生物群的重要成员,属于革兰阴性菌,为兼性厌氧菌,也是泌尿系统感染的常见致病菌。大肠埃希菌也是产ESBLs主要代表菌之一,其产酶率达到很高的水平且呈不断上升的趋势,应引起医生的足够重视。本研究结果显示,大肠埃希菌是第三军医大学附属西南医院泌尿外科尿路感染的最常见病原菌,与大部分研究报道结果相同[8-9];而细菌耐药结果显示大肠埃希菌除对碳青霉烯类抗菌药物全部敏感外,对喹诺酮类和β-内酰胺酶类具有较高的耐药性。本研究中大肠埃希菌ESBLs阳性率和耐药率与文献[9-10]研究报道相比处于较高水平,其原因可能是由于西南医院是重庆最大的医院之一,危重患者较多,抗菌药物的使用频率较高,多数转院患者在入院前已经使用抗菌药物治疗。另外流行的ESBLs主要是CTX和OXA型,未发现其他的ESBLs耐药基因,其中CTX基因所占比例最高,为48.2%,与国内报道相似[11],但OXA型的携带比例高于文献[12]报道。
MLST由Maiden等[13]于1998年首次运用于脑膜炎奈瑟菌的分型,后广泛应用于其他细菌、真菌。它是一种基于核酸序列测定的细菌分型方法,结合生物信息学和基因序列测定的方法,通过PCR法扩增多个(6~8个)管家基因内部片段,通过对其序列的测定,来分析菌株的变异及遗传相关性。该方法在流行病的监测及细菌分型、进化等方面的研究具有分辨率高的特点,简便可行、高效可靠,被广泛应用。本研究中MLST结果显示ST405是最多的基因分型,有17株,且所有携带OXA耐药基因的菌株均为ST405,携带OXA耐药基因ST405的流行可能是西南医院OXA耐药基因携带比例高的主要原因。
综上所述,针对泌尿外科患者,应该制定更为严格的细菌感染控制方案;对尿路感染患者,应根据药敏实验结果选择抗菌药物,针对经验诊疗者应根据患者前期抗菌药物使用情况、患者的基本情况等作出综合判断,合理使用抗菌药物;后续应该建立更为完善的细菌耐药分析计划,以期为临床治疗提供更充分的证据。
[1]Wang F,Xing T,Li J,et al.Survey on hospital-acquired urinary tract infection in neurological intensive care unit[J].APMIS,2013,121(3):197-201
[2]Sanchez GV,Adams SJ,Baird AM,et al.Escherichia coli antimicrobial resistance increased faster among geriatric outpatients compared with adult outpatients in the USA,2000-10[J].J Antimicrob Chemother,2013,68(8):1838-1841
[3]曹弟勇,徐彬,陈大斌.尿路感染的病原菌分布特征及耐药性检测分析[J].中国实验诊断学,2010,14(8):1262-1264
[4]杨学军.留置导尿管致尿路感染的菌群分布及药敏结果分析[J].中国误诊学杂志,2002,2(9):1347-1349
[5]Xia S,Fan X,Huang Z,et al.Dominance of CTX-M-type extended-spectrum beta-lactamase (ESBL)-producing Escherichia coli isolated from patients with community-onset and hospital-onset infection in China[J].PLoS One,2014,9:e100707
[6]Pagani L,Dell’Amico E,Migliavacca R,et al.Multiple CTX-M-type extended-spectrum beta-lactamases in nosocomial isolates of Enterobacteriaceae from a hospital in northern Italy[J].J Clin Microbiol,2003,41(9):4264-4269
[7]Dallenne C,Da Costa A,Decre D,et al.Development of a set of multiplex PCR assays for the detection of genes encoding important beta-lactamases in Enterobacteriaceae[J].J Antimicrob Chemother,2010,65(3):490-495
[8]谢诚,包建安,周中心,等.我院泌尿感染致病菌分布及耐药率监测[J].中国药房,2010,21(2):135-136
[9]莫国华,孙龙,陈益明.1272例尿液标本细菌培养结果及耐药性分析[J].中国微生态学杂志,2014,26(3):322-326
[10] 龚德钒.尿路感染的病原分布及耐药性分析[J].中医临床研究,2014,6(24):78-79
[11] 赵晓丽,胡大春,邵剑春,等.产ESBLs大肠埃希菌CTX-M型耐药基因分析[J].中国感染控制杂志,2008,7(1):15-19
[12] Shi H,Sun F,Chen J,et al.Epidemiology of CTX-M-type extended-spectrum beta-lactamase (ESBL)-producing nosocomial-Escherichia coli infection in China[J].Ann Clin Microbiol Antimicrob,2015,14:4
[13] Maiden MCJ,Bygraves JA,Feil E,et al.Multilocus sequence typing: A portable approach to the identification of clones within populations of pathogenic microorganisms[J].Proc Nation Acad Sci USA,1998,95(6):3140-3145
Epidemiology of drug resistance and genotype of Escherichia coli in urinary tract infection
XU Zhigang1, GAO Yu2, CHEN Qiuyuan2, JIANG Xiaoxiao2, LI Xuemei2
(1.Chongqing Red Cross Hospital, Chongqing 400020, China; 2.Southwest Hospital of The Third Military Medical University, Chongqing 400038, China)
Objective It is to investigate the resistance and genotypes of Escherichia coli (E.coli) from urinary tract infections, and provide the theoretical support for the anti-infective treatment.Methods 56 cases of E.coli form urinary tract infections were selected.The minimal inhibitory concentration of E.coli was detected using the agar double dilution method.Extended-spectrum β-lactamases (ESBLs) were detected by double-disk synergy method.The ESBLs genes were detected by PCR amplification.The genotypes of E.coli were determined using multilocus sequence typing.Results A total of 56 strains of E.coli were more sensitive to carbapenems and amikacin, whereas they were highly resistant to the other antimicrobial agents.The resistance rate of ST405 typed strains to penicillin was significantly higher than that of other typed strains (P<0.05).The ESBL-producing E.coli strains accounted for 51.8%.PCR amplification showed that the positive rates of CTX-M and OXA genes were 48.2% and 19.6%, and no other resistance genes were detected.MLST results showed that 56 isolated strains had 21 gene types.The ST405 was the most common genotype accounting for 30.4% (17), followed by the ST301.Conclusion E.coli isolates from urinary tract infections posses high resistance to most antibiotics.ST405 is the most common genotype.
Escherichia coli; urinary tract infections; resistance; genotypes; multilocus sequence typing
徐志刚,男,博士,主治医师,主要研究方向为肿瘤分子遗传学。
10.3969/j.issn.1008-8849.2016.24.007
R-33
A
1008-8849(2016)24-2642-03
2015-09-01
