4株埃博拉病毒核蛋白特异性单克隆抗体抗原结合表位研究
2016-08-19孙丽娜周荣苹刘洋芜为李川仇佩虹李德新梁米芳
孙丽娜 周荣苹 刘洋 芜为 李川 仇佩虹 李德新 梁米芳
102206北京,中国疾病预防控制中心病毒病预防控制所(孙丽娜、刘洋、芜为、李川、李德新、梁米芳);325035温州医科大学(周荣苹、仇佩虹)
4株埃博拉病毒核蛋白特异性单克隆抗体抗原结合表位研究
孙丽娜 周荣苹 刘洋 芜为 李川 仇佩虹 李德新 梁米芳
102206北京,中国疾病预防控制中心病毒病预防控制所(孙丽娜、刘洋、芜为、李川、李德新、梁米芳);325035温州医科大学(周荣苹、仇佩虹)
目的 分析鼠埃博拉病毒核蛋白(NP)特异性单克隆抗体抗原结合表位,了解其免疫学特性。方法 经生物信息学分析后,将NP分段重组表达,并分别以之为抗原,通过免疫印迹和竞争ELISA的方法对4株埃博拉病毒核蛋白特异性单抗的抗原结合表位进行分析。结果 经生物信息学表位分析后将埃博拉病毒全长核蛋白分为rNP1-418,rNP419-639和rNP640-739三段进行重组制备,免疫印迹法分析表明4株鼠单抗均识别线性表位,结合位点位于C端100 aa。通过对C端100 aa 即rNP640-739 N端连续截短20 aa的方法进行鉴定,4株鼠单抗抗原表位位于埃博拉核蛋白C末端20 aa,但其中2株单抗无明显竞争。结论 明确了具有不同结合位点的埃博拉核蛋白特异性单抗,为免疫学快速检测试剂的研究奠定基础。
【主题词】 埃博拉病毒;核蛋白;抗原表位
Fund programs:State Mega-project for Infectious Disease Research of China(2013ZX10004-101)
埃博拉病毒(Ebo1a virus,EBOV)可导致严重的出血热,病死率高,主要通过直接接触患者的血液和排泄物传播。迄今,尚无有效的治疗药物及疫苗。[1]EBOV为单股负链RNA病毒,基因组编码7种不同的蛋白质,其中核蛋白NP全长739个氨基酸,是病毒核衣壳中含量最丰富的病毒蛋白,能够与病毒RNA基因组相互作用,其C端区域对于病毒的转录及核衣壳的自我装配非常关键,在病毒复制中发挥重要作用[2,3]。EBOV感染早期诊断主要依赖于抗原及核酸检测,基于单抗的免疫学抗原检测方法可发展为适合现场使用的快速检测试剂[4]。本研究将EBOV核蛋白进行分段表达,通过免疫印迹和竞争ELISA的方法对4株鼠单抗的抗原结合表位进行了分析。
1 材料与方法
1.1质粒、单抗 表达埃博拉病毒核蛋白(EBOVNP)的重组质粒pET28a-EBOV-NP及其表达纯化核蛋白抗原由本室构建并保存;抗Ebo1a-NP的鼠单抗1D10、1G9、1B7、1H8以及人鼠嵌合单抗1D10及1B7均由本室制备并保存。
1.2竞争ELISA 采用重组埃博拉病毒核蛋白作为包被抗原,用2株定量的人鼠嵌合单抗1D10、1B7分别与不同稀释度的鼠单抗1D10、1G9、1B7、1H8混合竞争结合核蛋白抗原,抗人Fc酶标二抗检测人鼠嵌合单抗。
1.3埃博拉核蛋白分段表达 首先采用Protean分析埃 博 拉 核 蛋 白 (GenBankAccessionNo. KU182909.1)亲水性及抗原表位区域,以重组质粒PET28a-EBOV-NP为模板将EBOV-NP进行分段表达。设计EBOV-NP分段扩增引物(表1)分别扩增NP不同片段,回收纯化 PCR产物,经SacI/XhoI双酶切后,直接克隆到带有HIS标签原核表达载体pET28a中。对重组克隆进行双酶切及测序鉴定,挑选阳性克隆,转化BL21(DE3),经IPTG诱导后SDSPAGE鉴定其表达。

表1 分段表达埃博拉rNP的引物Tab.1 Sequence of primers used for generation of the truncated EBOV rNPs
1.4免疫印迹法分析抗原表位区域 利用Western B1ot(WB)对4株鼠单抗(1D10,1G9,1B7,1H8)所针对的NP抗原表位进行分析。抗原分别为原核表达重组核蛋白及其分段表达产物,阳性对照抗体为抗HIS标签抗体,待测抗体为鼠单抗1D10,1G9,1B7,1H8。将抗原进行SDS-PAGE电泳,电转移到PVDF膜。分别与待测抗体室温反应2 h,加入HRP标记抗鼠IgG全抗(1∶2000,美国Sigma),室温轻柔振荡1 h后DAB显色。
2 结果
2.1竞争ELISA 为了探索前期筛选制备的4株鼠单抗1D10,1G9,1B7,1H8的核蛋白抗原结合表。首先采用埃博拉核蛋白为检测抗原进行竞争ELISA分析,将4株鼠单抗所针对的抗原表位进行初步归类。结果显示人鼠嵌合抗体1B7同自身鼠单抗1B7竞争,与其他3株鼠单抗及阴性对照(SFTSV糖蛋白鼠单抗)均不竞争(图1A);人鼠嵌合抗体与1D10 与H8存在明显竞争、与1G9存在一定程度的竞争,与鼠单抗1B7及阴性对照(SFTSV糖蛋白鼠单抗)不存在竞争(图1B)。
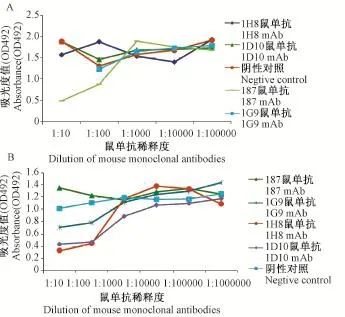
图1 竞争ELISAFig.1 Competition ELISA
2.2埃博拉核蛋白分段表达及其抗原表位鉴定
图2 埃博拉病毒核蛋白抗原表位区间预测Fig.2 The prediction of epitopes on nuc1eoprotein of Ebo1a virus
埃博拉核蛋白氨基酸序列经protean分析如图2显示,NP抗原表位从大约419 aa起至C端存在大量明显抗原高峰,N端1-418 aa区间存在 少量抗原峰,与文献报道其抗原峰主要位于C端相符。为了初步限定4株鼠单抗与NP抗原结合的范围,本研究在已有重组核蛋白rNP全长739 aa的基础上根据抗原表位预测分析结果,将NP分节段原核表达。首先,在抗原峰分界41aa处分段,获得rNP1-418,其余C端整个抗原高峰区419-739 aa进一步分段研究,即 C端截断100 aa,分为2段 rNP419-639和rNP640-739。Western B1ot分析对 4株鼠单抗(1D10,1G9,1B7,1H8)与分段表达重组核蛋白的特异性反应,同时利用阳性对照抗HIS标签抗体鉴定核蛋白各分段表达产物。如图2结果显示,全长rNP1-739及 3个片段 rNP1-418,rNP419-639和rNP640-739与抗HIS抗体WB反应均为阳性,说明重组核蛋白抗原均得到正确表达;4株鼠单抗与rNP1-739及rNP640-739均存在特异性反应,而与rNP1-418及rNP419-639均不反应,由此我们将4株鼠单抗所针对的抗原表位初步限定在埃博拉核蛋白640-73aa区间,即C端100个氨基酸内。
利用pET2 8a载体表达体系将C端100个氨基酸C末端不变,N端每段截短20 aa,即为rNP660-739(80 aa)、rNP680-739(60 aa)、rNP700-739(40 aa)、rNP719-739(20 aa)。Western B1ot分析显示,rNP660-739、rNP680-739、rNP700-739及rNP719-739与抗HIS抗体反应均为阳性,说明这些重组抗原均得到正确表达;4株鼠单抗与rNP660-739、rNP680-739、rNP700-739、rNP719-739均存在特异性反应,由此我们将4株鼠单抗所针对的抗原表位限定在埃博拉核蛋白C端20 aa附近(图3)。

图3 鼠单抗针对埃博拉病毒核蛋白分段表达产物的抗原表位结合活性分析Fig.3 Epitope mapping of MAbs to a pane1 of the truncated rNP of EBOV in WB ana1ysis
3 讨论
本研究利用DNAStar protean分析核蛋白氨基酸序列显示抗原表位主要位于419 aa起至C末端,而N端1-418aa区间存在较多疏水性氨基酸,抗原表位少,与文献报道相符[4,5]。有研究揭示扎伊尔埃博拉病毒核蛋白的C末端结构域rNP641-739在病毒复制中发挥关键作用[2],并在感染者的血液中存在较高浓度的NP抗原,是EBOV感染免疫学检测试剂的重要靶标。双抗体夹心检测抗原是经典的免疫检测方法,为提高检测试剂的敏感性,需两种抗体无明显的竞争活性。为研发适合现场使用的EBOV快速检测试剂,本研究通过重组表达核蛋白rNP全长739 aa以及系列截短的核蛋白rNP1-418 共8种抗原,利用WB分析表明4株鼠单抗均识别线性表位,抗原结合表位位于C端20 aa附近,说明C端区域确实是埃博拉病毒核蛋白抗原表位主要区域,具有很强的抗原性,可以作为诊断研究的重要靶点。竞争ELISA将4株鼠单抗所针对的抗原表位大致归为3类,分别为1D10与H8相互竞争,1D10 与1G9存在一定程度的竞争,1B7与其他3株鼠单抗均不竞争。这说明在埃博拉核蛋白C端20 aa附近至少分布有3种不同抗原表位,利用重叠多肽扫描等方法在C端20 aa附近的范围对三种抗原表位进行精确定位。
[1] Awah PK,Boock AU,Kum KA.Ebo1a Virus Diseases in Africa:a commentary on its history,1oca1 and g1oba1 context.Pan Afr Med J,2015,11:22-24.doi:10.11694/pamj.supp.2015.22. 1.6652.
[2] Dziubańska PJ,Derewenda U,E11ena JF,a1 et.The structure of the C-termina1 domain of the Zaire ebo1avirus nuc1eoprotein.Acta Crysta11ogr D Bio1 Crysta11ogr,2014,70(Pt 9):2420-2429. doi:10.1107/S1399004714014710.
[3] Dong S,Yang P,Li G,et a1.Insight into the Ebo1a virus nuc1eocapsid assemb1y mechanism:crysta1 structure of Ebo1a virus nuc1eoprotein core domain at 1.8 Å reso1ution.Protein Ce11,2015,6:351-362.doi:10.1007/s13238-015-0163-3.
[4] Saijo M,Niikura M,Ikegami T,et a1.Laboratory diagnostic systems for Ebo1a and Marburg hemorrhagic fevers deve1oped with recombinant proteins.C1in Vaccine Immuno1,2006,13:444-451.doi:10.1128/CVI.13.4.444-451.2006
[5] Peters CJ,LeDuc JW.An Introduction to Ebo1a:The Virus and the Disease.Infec Dis,1999,179(supp1 1):ix-xvi.
Study on the epitopes of four monoclonal antibodies specific to ebola virus nucleoprotein
Sun Lina,Zhou Rongping,Liu Yang,Wu Wei,Li Chuan,Qiu Peihong,Li Dexin,Liang Mifang National Institute for Viral Disease Control and Prevention,China CDC,Beijing 102206,China(Sun LN,Liu Y,Wu W,Li C,Li DX,Liang MF);Wenzhou Medical University,Wenzhou 325035,China(Zhou RP,Qiu PH)
Liang Mifang,Email:mifangl@vip.sina.com
Objective To ana1ysis the epitope of Ebo1a virus(EBOV)nuc1eoprotein(NP)and understand its immuno1ogica1 properties.Methods First1y four mouse mAbs recognizing the different epitopes of Ebo1a virus NP were c1assified by competition ELISA.The fu11-1ength NP and the C-termina1 were truncated and expressed in E.co1i.according to epitope prediction by software and some pub1ished papers. Epitope mapping of mAbs to a pane1 of the truncated rNP were identified in WB ana1ysis.Results After epitope prediction,the fu11-1ength NP were divided into rNP1-418,rNP419-639 and rNP640-739.WB ana1ysis indicated that mAbs a11 recognized the 1inear epitopes,which were 1imited in the C-termina1 100aa (rNP640-739).The truncated N proteins with N-termina1 of rNP640-739 series 20aa de1etions reacted with a C11o nmcAl ubssi.onThe epitopes recognized by anti-NP mAbs were defined near the C-termina1 20aa of EBOV NP. Ana1ysis of antigenic epitopes of EBOV NP by specific mAbs as a probe 1ay the foundation for the study of immuno1ogy diagnostic reagents.
Ebo1a virus;Nuc1eoprotein(NP);Epitope
“传染病防治”科技重大专项:重大传染病应急处置检测技术平台(2013ZX10004-101)
梁米芳,Emai:mifang1@vip.sina.com
10.3760/cma.j.issn.1003-9279.2016.02.007
2016-01-18)
