巯基十二硼烷二钠盐的急性毒性与药代动力学研究
2016-08-16李凤林罗志福樊彩云刘子华邓新荣
李凤林,罗志福,樊彩云,刘子华,邓新荣
(中国原子能科学研究院 同位素研究所,北京 102413)
巯基十二硼烷二钠盐的急性毒性与药代动力学研究
李凤林,罗志福,樊彩云,刘子华,邓新荣
(中国原子能科学研究院 同位素研究所,北京102413)
摘要:本研究采用210、300、430、614 mg/kg四个剂量对巯基十二硼烷二钠盐(BSH)进行了急性毒性实验,得到其半数致死量(LD50)为381.94 mg/kg,LD50的95%置信区间为[334.97 mg/kg,435.51 mg/kg]。进行BSH的药代动力学初步研究,根据给药后得到的药时曲线,选用三房室模型拟合得到BSH的半衰期分别为t1/2α=3.6 min、t1/2β=55.8 min、t1/2γ=6.26 h;表观分布容积Vd为3 523.58 mL/kg、药时曲线面积AUC为247.55 hr*μg/mL、清除率CL为3 572.45 mL/hr/kg。在小鼠体内的生物分布结果表明,BSH在血液中清除较快,各器官在注射后30 min达到最大摄取,其在体内主要通过肾脏排泄。以上研究结果可为BSH在国内临床应用的安全性提供实验基础。
关键词:BNCT;BSH;急性毒性;药代动力学;生物分布
硼中子俘获疗法(boron neutron capture therapy, BNCT)是一种二元靶向放疗方法,将含10B的药物通过口服或注射方法引入体内,并使之选择性地聚集在癌细胞中,然后用中子照射病变部位,使10B 发生10B (n,α)7Li 核反应,利用产生的α粒子和7Li 粒子杀死癌细胞[1]。这些粒子均属高传能线密度(linear energy transfer, LET)射线,具有能量高和射程短的特点,产生的α粒子能量可达1.7 MeV,平均LET为200 keV/μm,因此,BNCT需每个癌细胞含有109个10B[1]。Li与α粒子的射程分别为4 μm和9 μm(肿瘤细胞的直径<10 μm),因此在其射程空间内发生的电离反应可杀伤吸收硼化物的癌细胞及与之相邻的细胞,而对正常的组织损害小。目前,BNCT是治疗恶性脑胶质瘤最有效的方法之一[2]。
硼携带剂(含硼药物)是BNCT能否成功的重要条件之一,良好的硼携带剂可被癌细胞选择性吸收,达到靶向给药的目的。对二羟硼苯丙氨酸(p-Boronophenylalanine, BPA)和巯基十二硼烷二钠盐(sodium undecahydro-mercapto-closo-dodecacarborate,BSH)毒副作用很小,在治疗剂量范围内未见化学中毒的报道。BSH是硼簇类化合物,其在生物环境下具有良好的水解和代谢稳定性,含硼量高,在相同的剂量水平下与BPA相比,能够载带更多的10B至肿瘤组织,是目前最有效的BNCT药物之一[3-4]。
1967 年Soloway[5]等合成了BSH,1968年Hatanaka[6]最先将其用于BNCT。1968年到1997年,Hatanaka项目组在日本采用热中子BNCT共治疗脑肿瘤患者149例,计164次,报道中38例Ⅲ-Ⅳ级的胶质瘤患者,5年和10年生存率分别为19%和10%。38例中的16例肿瘤冠状面在6 cm内,5年和10年生存率分别为58%和29%[7-8]。其他类型的脑肿瘤患者的生存期也不同程度的得到了提高。Masunaga等[9]对28 例胶质母细胞瘤患者术前静脉注射50 mg/kg的BSH,测得肿瘤组织与非肿瘤组织的BSH摄取比一直大于3,在肿瘤组织与血液中的浓度比(T/B)约为2.5。目前,美国、德国、日本、芬兰、挪威、瑞典等国家均先后开展了BSH的Ⅰ期或Ⅱ期临床实验,其治疗领域也在不断扩大,如治疗黑色素瘤、甲状腺癌和口腔癌等[9-10]。本文根据相关文献[12-15],对BSH的急性毒性、药代动力学进行初步研究,并进行BSH在正常小鼠体内的生物分布实验,以确定BSH在体内的代谢途径、代谢毒性等信息,拟为该化合物在国内的临床应用提供一定的实验依据。
1 实验材料
1.1主要试剂
3-甲氧基-甲亚胺H:上海金圣化工有限公司产品;盐酸、氢氧化钠、氨水、乙酸、乙酸胺、乙二胺四乙酸二钠(EDTA)、浓硝酸、双氧水、抗坏血酸、注射用生理盐水等均为国药集团化学试剂北京有限公司产品;BSH:白色粉末状,纯度>99%,本实验室根据文献[11]自行合成,结构经核磁、质谱验证结构。
1.2主要仪器
移液器(100~1 000 μL):Socorex产品;移液器(1~5 mL):芬兰Finnpipette;211型pH计:Orion Research产品;UV2450型紫外-可见分光光度计:日本导津;TGL-16L型离心机:上海安亭科学仪器厂;AR2130电子天平:梅特勒-托利多仪器(上海有限公司);手术器械、一次性无菌注射器等北京大学医学部。
1.3实验动物
昆明小鼠,18~20 g,SD大鼠,180~200 g,均由北京华阜康生物科技股份有限公司提供,许可证号:SCXK(京)2014-0004。
2 实验方法
2.1BSH急性毒性
通过预实验确定正式实验选取50只小鼠,雌雄各半,随机分为五组,一组为空白对照组,其余四组按210、300、430、614 mg/kg四个剂量(各组剂间比为0.7)分别尾静脉注射BSH注射液,空白对照组尾静脉注射生理盐水,给药后连续观察14 d。观察记录动物毒性反应情况,记录每组小鼠死亡数,剖检死亡小鼠,肉眼观察各主要脏器有无明显变化,脏器出现体积、颜色、质地等改变时,记录并进行病理组织学检查。存活小鼠连续观察14 d后处死,剖检,肉眼观察主要脏器有无明显变化,脏器出现体积、颜色、质地等改变时,保存异常脏器标本,并保留空白对照组的同一脏器标本进行病理组织学比较检查。
2.2BSH药代动力学
2.2.1注射剂量
参考BSH临床用药途径,选用静脉注射给药方式。根据急性毒性实验结果,设计BSH静脉注射给药的低剂量组为62.5 mg/kg,中剂量组为125 mg/kg,高剂量组为250 mg/kg。
2.2.2溶液配制
(1) BSH注射液。准确称取BSH 适量,加生理盐水溶解稀释至所需浓度,使低剂量浓度为25 mg/mL,中剂量浓度为50 mg/mL,高剂量浓度为100 mg/mL。所配溶液过0.22 μm无菌滤膜过滤,备用。
(2) 3-甲氧基-甲亚胺H溶液。称取0.27 g 3-甲氧基-甲亚胺H,用0.5 mol/L NaOH溶液完全溶解,再加入0.6 g抗坏血酸,用HCl调节pH为5.7±0.2,定容至30 mL,聚丙烯瓶中保存。
(3) 乙酸-乙酸胺缓冲溶液。称取100.0 g乙酸胺溶于400 mL蒸馏水中,并加入冰醋酸28 mL调节溶液pH为5.7±0.2,加水定容至500 mL。
(4) EDTA溶液(2%)。称取1.0 g EDTA,加40 mL蒸馏水加热溶解,用4 mol/L NaOH溶液调节pH至8,定容至50 mL。
2.3.3实验分组
取大鼠18只,随机分成高、中、低3个剂量组,每组6只。各剂量组BSH浓度分别为250、125、62.5 mg/kg。大鼠尾静脉注射给药0.5 mL,分别于0 min(药前)和5 min、15 min、30 min、1 h、2 h、3 h、6 h、9 h(药后),眼底静脉丛采血,每次0.8 mL~1.0 mL,采血后4 000 r/min离心5 min制备血清,分装2管,每管0.15 mL,-20 ℃保存,备用。
2.3.4血药浓度检测
(1) 生物样品处理
取血清0.15 mL加50 μL水润湿,加0.5 mL浓硝酸消解过夜,再加0.2 mL H2O2继续消解,待无气泡产生时,于100 ℃加热至溶液近干,待测。
取组织先制成匀浆,然后称取质量不大于0.1 g的样品,加50 μL水润湿,加0.5 mL浓硝酸消解过夜,再加0.2 mL H2O2继续消解,待无气泡产生时,于100 ℃加热至溶液近干,待测。
(2) 血清标准曲线
准确称取一定量BSH,分别配制BSH浓度为334、167、83.5、41.75、20.88 μg/mL的系列标准溶液。依次吸取上述标准溶液0.1 mL分别置于5个离心管中,用水做空白,依次加入0.15 mL鼠血清,充分混匀,按消解血清的方法消解后,依次加入0.25 mL EDTA溶液,0.5 mL乙酸-乙酸胺缓冲溶液,0.5 mL 3-甲氧基-甲亚胺H溶液,加水稀释至2.5 mL,反应40 min后,于430 nm处测量吸光度,得标准曲线y=0.136 15x+0.018 64,R2=0.999,线性关系良好。依据此标准曲线,待测生物样品湿法消解后,即可用已建立的3-甲氧基-甲亚胺H为显色剂的紫外-可见分光光度法测定生物样本中BSH的含量[16]。
2.3.5BSH在正常小鼠体内生物分布
取昆明小鼠30只,随机分为6组,每组5只,其中一组为空白组,不注射BSH溶液,其余5组每只小鼠经尾静脉注射BSH注射液100 μL(BSH 的注射剂量为100 mg/kg),分别于给药后5 min、30 min、1 h、2 h和3 h断颈处死动物,取血及心、肝、脾、肺、肾、胃、肠、脑和头皮等组织,湿法消解后按配制标准曲线的方法配制待测溶液,用已建立的紫外-可见分光光度法测量各组织中的硼含量,计算单位质量组织中摄取的BSH量(以μg B/g组织表示)。所得结果进行统计学分析,得出BSH在小鼠体内的生物分布。
2.3.6数据处理及药代动力学参数计算
实验数据采用winnonlin5.2药代动力学软件拟合分析,计算得到BSH的主要药代动力学参数,t1/2为消除半衰期,Vd为表观分布容积,AUC为血药浓度-时间曲线下面积,CL为清除率等。
3 结果与讨论
3.1BSH急性毒性
3.1.1BSH给药后临床指征
614 mg/kg剂量组给药后动物呼吸急促,有强直性抽搐,翻正反射消失,无眼睑反射,全部即刻死亡,解剖后肺部有稍许充血现象,其他脏器无明显异常;430 mg/kg剂量组给药后5 min至5 h内共有7只动物死亡,该7只小鼠给药后呼吸急促,有强直性抽搐,翻正反射消失,部分小鼠给药后几小时内仍有微弱呼吸,有眼睑反射,但5 h内均相继死亡,解剖后各脏器无明显异常;成活的3只小鼠给药后亦出现呼吸急促,强直性抽搐现象,有翻正反射,放回笼中仍俯卧不动,成困倦昏睡状态,但对外界刺激有反应,几小时后恢复正常状态直至14天观察期结束。300 mg/kg剂量组给药后只有1只小鼠呼吸急促,俯卧震颤,翻正反射消失,2 min后死亡,解剖后各脏器无明显异常,其余小鼠给药后,呼吸、运动等功能均正常,给予水、粮后正常饮水进食,未出现明显中毒迹象;210 mg/kg剂量组和空白对照组给药后,全部小鼠呼吸、运动等功能均正常,给予水、粮后正常饮水进食,未出现中毒迹象。
3.1.2BSH给药后死亡情况和数据统计
根据BSH给药后死亡率数据(见表1),用寇氏法计算BSH的半数致死率(LD50)为381.94 mg/kg,LD50的95%置信区间为[334.97 mg/kg,435.51 mg/kg]。各剂量组小鼠给药后,存活动物在整个观察期间,毛色、呼吸、运动、饮水进食、排泄等状态均正常,与空白对照组体重增长无显著性差异。
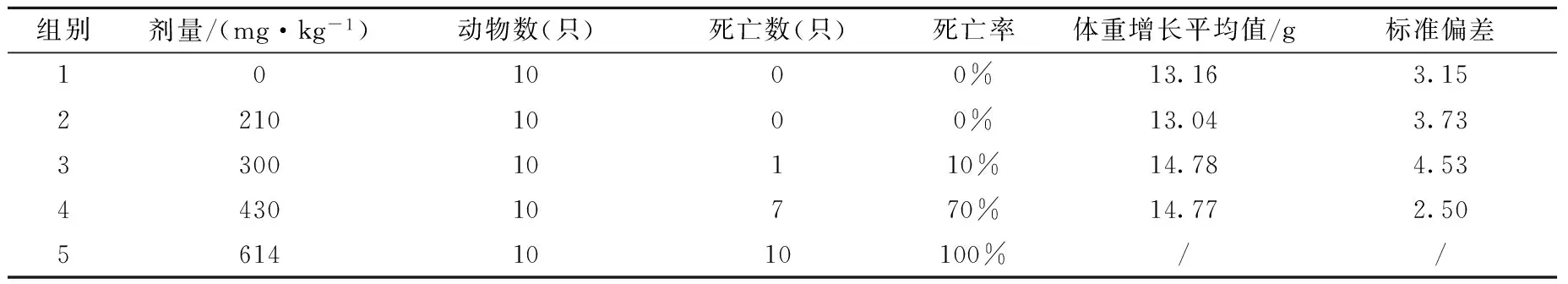
表1 BSH给药后死亡及体重变化情况Table 1 The statistics of death and weight of the mice after BSH injection
3.1.3BSH给药后解剖和病理切片检查
BSH在给药后除去即刻死亡及第2天死亡的动物,在连续观察期中没有再出现动物死亡,观察期结束后对所有剂量组小鼠进行解剖,部分小鼠在打开胸腔时肺部出现血块,614 mg/kg剂量组小鼠、300 mg/kg剂量组雄鼠5号以及210 mg/kg剂量组雄鼠4号脾脏与其他小鼠脾脏相比较大,614 mg/kg剂量组1号小鼠肾脏部分疑似有充血现象,且肾盂颜色发暗,其余小鼠无肉眼可见性异常及病变。将发现病变小鼠的组织及高剂量组即614 mg/kg剂量组小鼠心、肝、脾、肺、肾、胃、脑等脏器用4%福尔马林固定,同时取空白对照组小鼠相应器官,送检做病理切片检验,脏器切片对比图示于图1。送检的病理切片结果显示,614 mg/kg剂量组肝脏的肝窦有轻度充血、见到转移红细胞、中央静脉扩张,肝细胞出现小叶,提示高剂量组BSH对小鼠肝脏造成一定毒性影响;614 mg/kg剂量组脾脏的巨噬细胞数量有所增多、肾小球毛细血管充血且肾球囊有纤维素渗出;614 mg/kg剂量组小鼠大脑噬神经元内有胶质细胞侵入,神经元细胞体积稍有增大、胞浆基质增多,表明高剂量BSH对神经元有一定毒性。由以上结果提示,BSH可能的毒性靶器官为肾脏、脾脏、肝脏、中枢神经元。
3.2BSH药代动力学分析
用winnonlin5.2药代动力学软件进行数据处理,得到BSH注射溶液(125 mg/kg)静脉注射后的BSH药物浓度-时间曲线示于图2。由图2可见,BSH在体内代谢呈三房室模型[15],并由此拟合分析BSH的相关药代动力学参数。

图1 BSH给药后主要脏器病理切片对比图Fig.1 The compare of pathology slice of main organs after injecting BSH
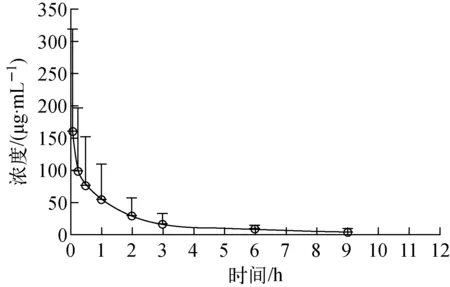
图2 BSH药物浓度-时间曲线(n=6)Fig.2 The concentration-time curve of BSH (n=6)
用winnonlin5.2药代动力学软件,拟合分析所得到的BSH的相关药代动力学参数列于表2,由此得到BSH在体内的半衰期分别为t1/2α=3.6 min、t1/2β=55.8 min、t1/2γ=6.26 h;表观分布容积Vd为3 523.58 mL/kg、药时曲线面积AUC为247.55 h*μg/mL、清除率CL为3572.45 mL/h/kg。药代动力学参数表明,BSH在体内吸收、消除均比较快,在62.5~250 mg/kg剂量范围内,其在大鼠体内的动力学过程呈线性动力学特征。
3.3BSH在正常小鼠体内生物分布
给药后,BSH在小鼠体内主要器官的单位质量组织中摄取的硼浓度列于表3。由表3可以看出,尾静脉注射BSH后,各器官在注射后30 min达到最大摄取,血,肾,肠,头皮中摄取较高,在血液中清除较快;肾中分布较高,表明BSH主要通过泌尿系统排泄;头皮中含量较高,与文献报道吻合。
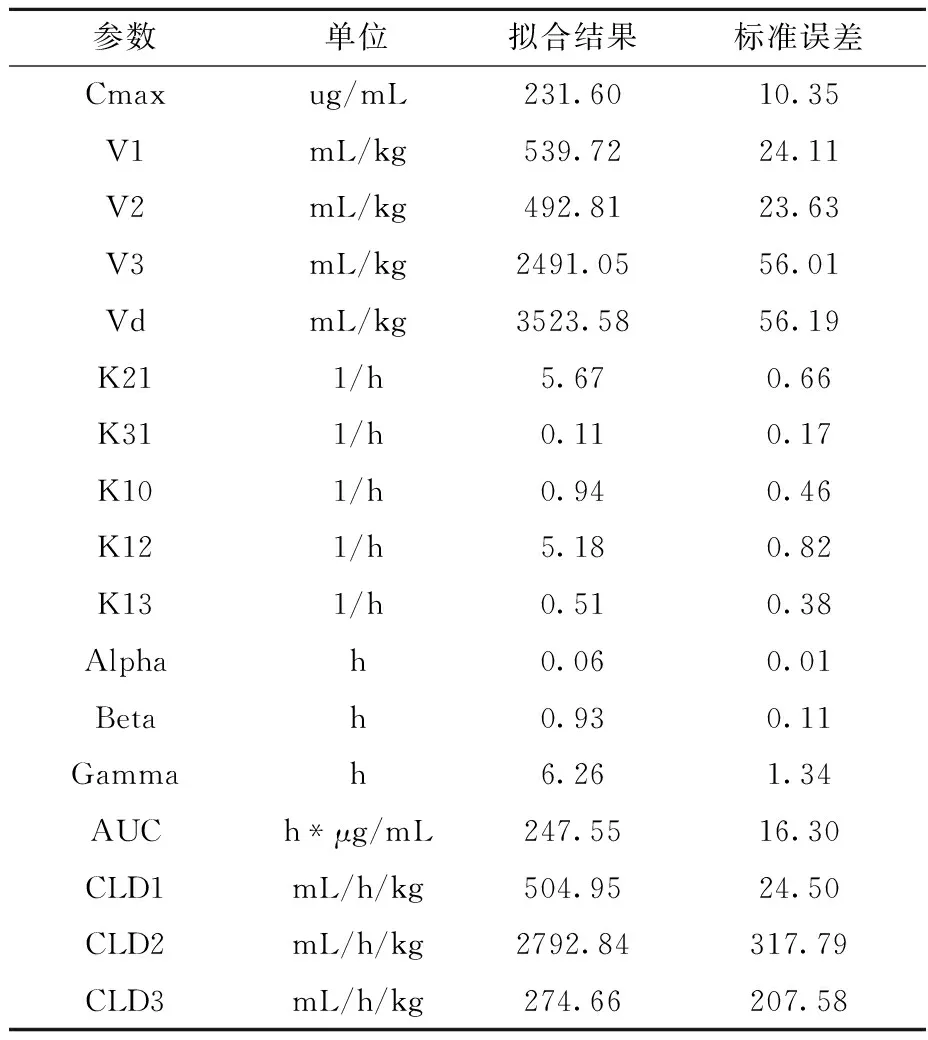
表2 BSH药代动力学参数Table 2 The pharmacokinetics parameter of BSH
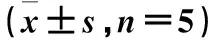
表3 BSH在正常小鼠体内生物分布Table 3 The biodistribution of the BSH in normal mice ±s, n=5)
4 结论
本文对所合成BSH进行了急性毒性研究和大鼠体内药代动力学研究,得到了BSH的半数致死量LD50为381.94 mg/kg,该数据为BSH临床用药的剂量设计提供了实验依据;病理切片结果提示BSH给药后潜在的毒性靶器官为肾脏、脾脏、肝脏、中枢神经元等,因此该药物临床给药后应重点监测这些器官的生理生化变化,以评估该药物对这些器官造成的可能的损伤以及需要采取的预防保护措施;在大鼠内的药代动力学研究表明,BSH在动物体内消除符合三房室模型,得到了相关的药代动力学参数,所得参数与相关文献[12-15]报道基本吻合,数据显示BSH在大鼠体内吸收、分布、消除较快,在62.5~250 mg/kg剂量范围内,体内动力学呈线性动力学特征;生物分布实验表明,BSH血液中清除较快,各器官在注射后30 min达到最大摄取;肾脏,肠,头皮中的摄取相对较高,肾脏摄取较高说明BSH主要通过泌尿系统排泄,肠道摄取较高表明BSH部分进入消化系统代谢,头皮摄取较高可能与BSH分子中含有巯基有关。以上研究揭示了BSH在体内的吸收、分布、代谢以及毒性信息,为BSH在国内临床应用的安全性提供实验基础。
参考文献:
[1]Barth R F, Coderre J A, Vicente G H, et al. Boron neutron capture therapy of cancer: current status and future prospects[J]. Clin Cancer Res, 2005, 11(11): 3 987-4 002.
[2]Farr L E, Sweet W H, Robertson J S, et al. Neutron capture therapy with boron in the treatment of glioblastoma multiforme[J]. Am J Roentgenol, 1954, 71: 279-291.
[3]Barth R F, Yang W, Coderre J A. Rat brain tumor models to assess the efficacy of boron neutron capture therapy: a critical evaluation[J]. J Neuro-oncol, 2003, 62(1): 61-74.
[4]Oterson B, Haritz D, Grochulla M, et al. Binding and distribution of Na2B12H11SH on cellular and subcellular level in tumor tissue of glioma patients in boron neutron capture therapy[J]. J Neuro-oncol, 1997, 33(1/2): 131-139.
[5]Soloway A H, Hatanaka H, Davis M A. Penetration of brain and brain tumor. Ⅶ. Tumor binding sulfhydryl boron compounds[J].J Med Chem, 1967, 10(4): 714-717.
[6]Hatanaka H. A revised boron neutron capture therapy for malignant brain tumors-Ⅱ in clinical result with the patients excluding previous treatments[J]. J Neuro-oncol, 1975, 209(2): 81-94.
[7]Hatanaka H, Nakagawa Y. Clinical results of long-surviving brain tumor patients who underwent boron neutron capture therapy[J]. Int J Radiat Oncol Biol Phys, 1994, 28(5): 1 061-1 066.
[8]Nakagawa Y, Hatanaka H. Boron neutron capture therapy——clinical brain tumor study[J]. J Neuro-oncol, 1997, 33(1/2): 105-115.
[9]Masunaga S, Nagasawa H, Hiraoka M. The usefulness of 2-nitroimidazole-sodium borocaptate-10B conjugates as10B-carriers in boron neutron capture therapy[J]. Appl Radiat Isot, 2004, 61 (5): 953-958.
[10]Garabalino M A, Heber E M, Hughes A M, et al. Biodistribution of sodium borocaptate (BSH) for boron neutron capture therapy (BNCT) in an oral cancer model[J].Biophysik, 2013, 52(3): 351-361.

[12]Christopher R G, Alfred E S, Barth R F, et al. Pharmacokinetics of sodium boroncaptate: a critical assessment of dosing paradigms for boron neutron capture therapy[J]. J Neuro-oncol, 2003, (62): 157-169.
[13]Fairchild R G, Kahl S B, Laster B H, et al. In vitro determination of uptake, retention, distribution, biological efficiency, and toxicity of boronated compounds for neutron capture therapy: a comparison of porphyrins with sulfhydryl boron hydrides[J].Cancer Res, 1990, 50(16) : 4 860-4 865.
[14]Ceberg C P, Brun A, Kahl S B, et al. A comparative study on the pharmacokinetics and biodistribution of boronated porpyrin(BOPP) and sulfhydryl boron hydride (BSH)in the RG2 rat glioma model[J]. Journal of Neurosurgery, 1995, 83(1): 86-92.
[15]Haselsberger K, Radner H, Pendl G. Boron neutron capture therapy: boron biodistribution and pharmacokinetic of Na2B12H11SH in patients with glioblastoma[J].Cancer Res, 1994, 54: 6 318-6 320.
[16]李凤林,罗志福,邓新荣,等. 分光光度法测量生物组织中BPA含量[J]. 同位素,2013,26(3):163-169.
Li fenglin, Luo zhifu, Deng xinrong, et al. Determinate the BPA in biological samples by spectrophotometry[J]. J Isotopes, 2013, 26(3): 163-169(in Chinese).
收稿日期:2016-02-17;修回日期:2016-03-17
作者简介:李凤林(1983—),女,山东潍坊人,助理研究员,放射性药物专业 通信作者:罗志福,研究员,E-mail: luozhifu@ciae.ac.cn
中图分类号:R817
文献标志码:A
文章编号:1000-7512(2016)03-0164-06
doi:10.7538/tws.2016.29.03.0164
The Acute Toxicity and Pharmacokinetics of the BSH
LI Feng-lin,LUO Zhi-fu, FAN Cai-yun, LIU Zi-hua, DENG Xin-rong
(theDepartmentofIsotopes,ChinaInstituteofAtomicEnergy,Beijing102413,China)
Abstract:In this study, the acute toxicity of BSH was studied at doses of 210, 300, 430, 614 mg/kg, and the LD50was calculated at 381.94 mg/kg. A three-compartment model system was used to evaluate the pharmacokinetics of the BSH, and the pharmacokinetic parameters, such as t1/2,Vd, AUC, CL of BSH were calculated: t1/2α=3.6 min, t1/2β=55.8 min, t1/2γ=6.26 h, Vd=3 523.58 mL/kg, AUC= 247.55 hr*μg/mL, CL=3 572.45 mL/hr/kg. The biodistribution of the BSH was studied in normal mice, from which the characteristics of biodistribution of BSH was analyzed.
Key words:BNCT; BSH; acute toxicity; pharmacokinetics; biodistribution
