蛹虫草基质多糖的急性毒性及亚慢性毒性研究
2016-12-08高晨阳吴雨龙江海涛汪振炯
高晨阳++吴雨龙++江海涛++汪振炯++王仁雷++华春
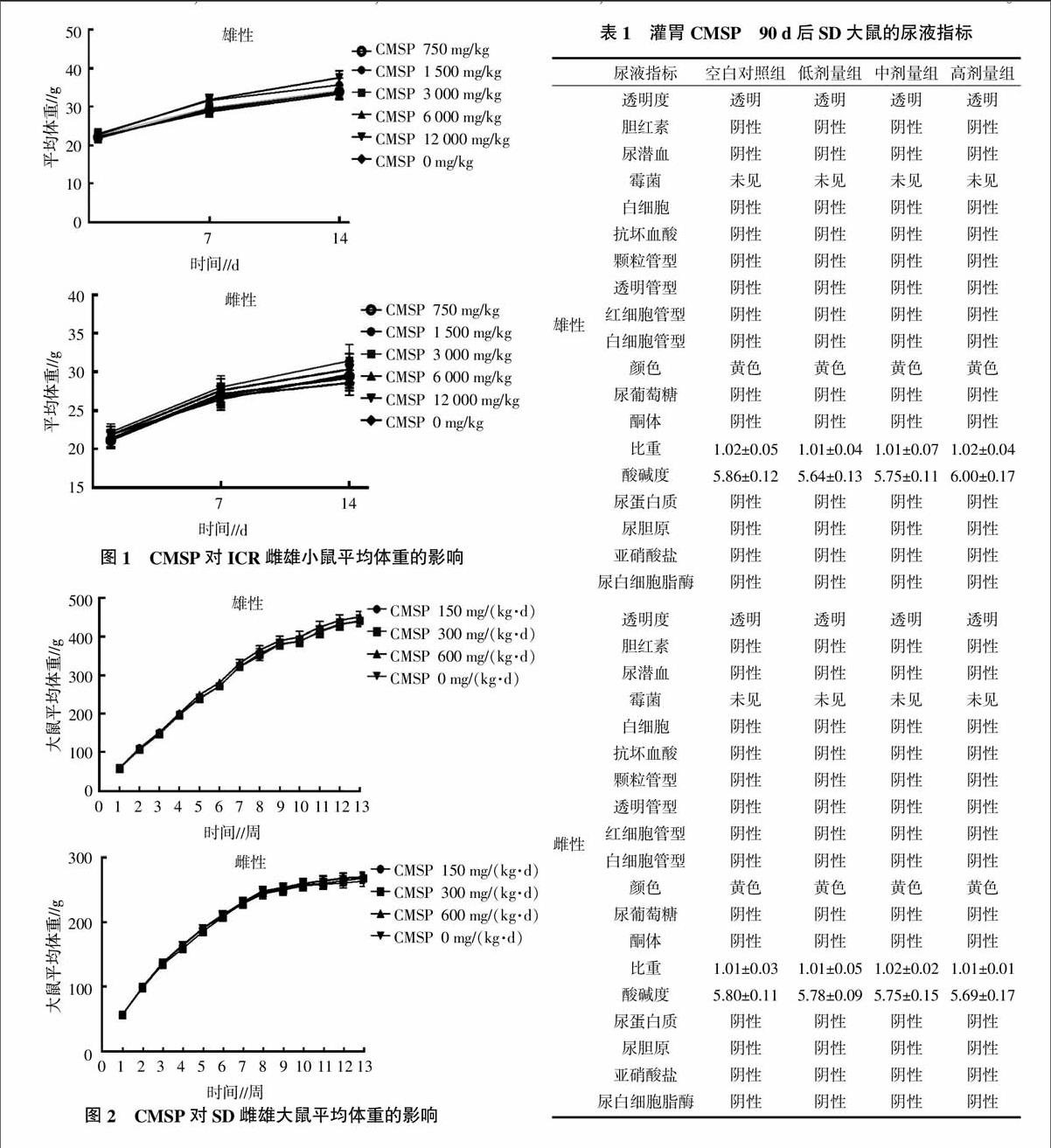

摘要:以急性毒性试验和亚慢性毒性试验研究蛹虫草基质多糖(Cordyceps militaris stroma polysaccharides,CMSP)的安全性,急性毒性试验采用ICR小鼠120只,随机分成6组,设空白对照组和不同剂量CMSP试验组(750、1 500、3 000、6 000、12 000 mg/kg)。亚慢性毒性试验采用SD大鼠80只,随机分成4组,设空白对照组和低、中、高3个剂量CMSP试验组(150、300、600 mg/kg)。结果表明,在14 d的观察中,急性毒性试验中各组小鼠未出现中毒症状和死亡情况,且灌胃剂量超过10 000 mg/kg。亚慢性毒性试验中,试验各组与空白对照组在体重增加、摄食量、血液指标、血液生化指标、尿常规、脏器指数及组织病理相比无明显差异,由此可知,CMSP实际为无毒物,且对大鼠未观察到有害作用水平为600 mg/(kg·d)。
关键词:蛹虫草基质多糖;急性毒性;亚慢性毒性
中图分类号:S567.3+9;R114 文献标识码:A 文章编号:0439-8114(2016)18-4776-07
DOI:10.14088/j.cnki.issn0439-8114.2016.18.036
蛹虫草(Cordyceps militaris)又称北虫草,属于子囊菌门的真菌。在东南亚地区,蛹虫草常被作为中药或滋补品使用,这主要因其与传统名贵中药冬虫夏草有相似的活性成分和药理作用[1,2]。据报道,蛹虫草富含多种功能活性物质,如虫草多糖、虫草素、抗菌和抗肿瘤的腺苷衍生物、抗真菌素、L-色氨酸等[3,4]。蛹虫草多糖是蛹虫草的主要活性物质之一,纯化的蛹虫草多糖具有多种生物活性,如抗氧化、抗肿瘤、抗炎、降血脂、调节免疫、延缓衰老等作用[5-9]。目前,蛹虫草主要通过人工栽培进行大量生产[10],有研究表明收获蛹虫草后的废基质中的多糖含量约为子实体的2~4倍,同样具有较好的抗氧化及保肝作用[11,12]。尽管蛹虫草作为一种重要的药食两用的真菌被人们长期广泛地使用,但有关蛹虫草基质多糖安全性的研究尚未见报道。因此,为研制开发保健食品或天然药物,有必要对蛹虫草基质多糖进行系统的安全性评价。本研究通过急性毒性试验及亚慢性毒性试验对蛹虫草基质多糖进行安全性评价,为蛹虫草基质多糖的进一步开发利用提供科学依据。
1 材料与方法
1.1 材料与试剂
蛹虫草基质多糖(Cordyceps militaris stroma polysaccharides,CMSP)由南京晓庄学院食品科学学院食品工程研究室提供。
ICR小鼠,动物合格证号:SCXK(苏)2012-0004,质量18~25 g,扬州大学比较医学中心提供。SD大鼠,动物合格证号:SCXK(苏)2014-0001,质量50~70 g,南京市江宁区青龙山动物繁殖场提供。
1.2 仪器与设备
RE-3000型旋转蒸发器、SHZ-Ⅲ型循环水真空泵(上海亚荣生化仪器厂);台式冷冻干燥机(美国LABCONCO公司);高速冷冻离心机(美国热电公司);NIKON 50i型生物显微镜(日本尼康公司);全自动血液分析仪(法国COMPACT公司);AU5800型全自动生化分析仪(美国Beckman Coulter公司)。
1.3 方法
1.3.1 蛹虫草基质多糖的制备 准确称取5.0 g蛹虫草基质粉末于烧杯中,加入200 mL水,混匀,再加入2 000 U/mg的纤维素酶2.5 mL,调节pH到4.8,然后50 ℃水浴1.5 h,再转移至80 ℃水浴2 h,然后再进行超声波(超声40 Hz,100%输出功率,温度30 ℃)处理40 min,4 200 r/min离心10 min,收集上清液。将沉淀按上述步骤提取2次,将收集到的上清液旋转蒸发到一定体积,采用Sevag法除蛋白质,除去蛋白质后的溶液用95%的乙醇在4 ℃冰箱中醇沉过夜,经抽滤,浓缩,经DE-52柱层析及Sephadex G-100凝胶柱层析,收集多糖液,经浓缩,冷冻干燥得蛹虫草基质多糖。
1.3.2 经口的小鼠急性毒性试验 取ICR小鼠120只,雌雄各半,体重18~25 g,在室温22 ℃±3 ℃、湿度30%~70%、自由摄食、饮水的饲养条件下,适应性饲养5 d 后,随机分成6组,每组20只,其中第Ⅰ~Ⅴ组为试验组,第Ⅵ组为空白对照组,正式给药前禁食8 h,不禁水。采用改良寇氏法[13],根据预试验的剂量,Ⅰ~Ⅴ组分别以750、1 500、3 000、6 000、12 000 mg/kg,5个不同剂量组进行灌胃染毒,分3次灌胃染毒溶解于蒸馏水中的蛹虫草基质多糖,每次间隔8 h。空白对照组同样分3次灌服相同体积的蒸馏水。染毒1 h后对小鼠的活动情况进行观察,当天需进行多次密切观察(特别染毒后4 h内),以后每天注意观察,连续观察14 d,记录小鼠的进食、活动、大小便、精神等全身反应状况及死亡情况。分别在第1、7、14天时称量各组小鼠体重。试验结束后,剖检存活小鼠,观察主要脏器是否有病变[13,14]。
1.3.3 经口的大鼠亚慢性毒性试验 取SD大鼠80只,雌雄各半,体重50~70 g,在室温26 ℃±4 ℃、湿度40%~60%、自由摄食、饮水的饲养条件下,适应性饲养5 d后,随机分成4组,每组20只,其中第Ⅰ~Ⅲ组为试验组,分为低、中、高三个剂量组,第Ⅳ组为空白对照组,正式给药前禁食8 h,不禁水。Ⅰ~Ⅲ组分别以150(低剂量)、300(中剂量)、600 mg/(kg·d)(高剂量)的剂量每天经口灌胃染毒1次,连续灌胃90 d。空白对照组灌服相同体积的蒸馏水。染毒期间,每天观察大鼠的一般情况[包括被毛光泽、精神状态、饮食、活动、行为、体重变化(定期称重)等],并记录。试验结束当天(第90天),将大鼠放入代谢笼中,收集尿液,备检。试验结束后(第91天),大鼠麻醉后腹主动脉取血,测定血液常规指标和血液生化指标;快速处死大鼠后进行剖检,详细检查和记录各脏器的眼观变化,取心、肝、脾、肺、肾等脏器称重,并计算脏器指数[14]。
脏器指数=■×100%
1.3.4 组织病理学研究 将取得的大鼠心、肝、脾、肺、肾等脏器用生理盐水洗净,擦干,10%中性福尔马林固定,石蜡包埋,切片,苏木素-伊红(HE)染色,镜检各组织切片的病理形态学变化。
1.3.5 统计学分析 所有试验数据以平均值±标准差(χ±SD)表示,采用Spss 17.0软件进行分析。统计学分析采用单因素方差分析法及t检验法分析各组之间的差异,P<0.05为显著性标准。
2 结果与分析
2.1 急性毒性试验结果
在灌服不同剂量CMSP后,各组小鼠活动正常,未出现竖毛、惊厥等症状。在观察期内,CMSP各剂量组小鼠被毛光滑有光泽,精神状态较好,呼吸顺畅,走动正常,未出现搔鼻、尖叫、出汗、流涎等症状,眼、耳、鼻、口、生殖道未见有血性分泌物,与空白对照组小鼠比较状态无明显差异,未出现明细中毒症状。在1~14 d内,每组小鼠体重明显增加(包括空白对照组),但灌服CMSP的各组小鼠体重增加更明显(图1)。对试验组与空白对照组存活小鼠进行病理剖检,主要脏器未观察到肉眼可见的病理变化。表明CMSP未对小鼠造成急性毒性作用。
2.2 亚慢性毒性试验结果
2.2.1 大鼠一般情况的观察 在灌服不同剂量CMSP的90 d中,各组大鼠行为正常,正常采食和饮水,被毛光洁有色泽,眼、耳、鼻、口未见脓状分泌物,精神状态良好,大小便正常,生长发育良好,均未出现明显中毒症状。与空白对照组比较,试验组大鼠体重增长无明显差异(图2)。表明CMSP未对大鼠的生长发育及体重增长产生不良影响。
2.2.2 CMSP对大鼠尿液指标的影响 在试验末期,分别收集雌雄大鼠尿液进行检测,结果显示CMSP低、中、高各剂量组与空白对照组比较,未观察到有明显变化的指标,且雌性大鼠与雄性大鼠的各项指标也无明显差异(表1)。表明在90 d喂养试验中,CMSP未引起大鼠的尿液指标产生明显变化。
2.2.3 CMSP对大鼠血液常规指标的影响 在连续给药90 d后,分别收集雌雄大鼠血液进行分析。结果表明,CMSP低、中、高各剂量组对雌雄大鼠血液常规指标无不良影响;CMSP各剂量组在白细胞计数、淋巴细胞百分比、单核细胞百分比、红细胞计数、血小板计数等血液指标上与空白对照组相比无明显差异(表2)。表明在90 d喂养试验中,CMSP未对大鼠的各项血液常规指标产生不良影响。
2.2.4 CMSP对大鼠血液生化指标的影响 在连续给药90 d后,分别收集雌雄大鼠血液经离心得血浆进行生化指标分析,结果显示CMSP低、中、高各剂量组对雌雄大鼠血液生化指标无不良影响;CMSP各剂量组在谷丙转氨酶、谷草转氨酶、总蛋白、白蛋白、球蛋白等血液生化指标上与空白对照组相比无明显差异(表3)。表明在90 d喂养试验中,CMSP未对大鼠的各项血液生化指标产生不良影响。
2.2.5 CMSP对大鼠脏器指数的影响 在连续给药90 d后,分别剖解雌雄大鼠脏器进行称重,计算脏器指数,结果见表4。经统计分析,除CMSP中剂量组雄性大鼠的脾脏指数外,CMSP低、中、高3个剂量组与空白对照组比较,脏器指数无显著性差异。CMSP中剂量组雄性大鼠脾脏指数明显高于空白对照组(P<0.05,表4),但CMSP高剂量组雄性大鼠脾脏指数与空白对照组相比无明显差异,且CMSP中剂量组雌性大鼠脾脏指数与空白对照组相比无明显差异。此外,CMSP低、中、高3个剂量组的其他脏器指数与空白对照组比较无明显差异。表明在90 d喂养试验中,CMSP未对大鼠的脏器指数产生不良影响。
2.2.6 组织病理学检查 在连续给药90 d后,分别剖解雌雄大鼠脏器进行检查,除了CMSP中剂量组部分雄性大鼠的脾脏有肿胀现象外,CMSP低、中、高3个剂量组与空白对照组的脏器均未发现明显的病变。组织病理学检查发现,除CMSP中剂量组少数雄性大鼠脾脏出现与受试物(CMSP)不相关的改变外,其余各组动物脏器均未出现明显的病变(图3)。
3 讨论
蛹虫草废基质中含有丰富的功能性物质——多糖。多糖具有广泛的药理作用和保健作用,如具有抗氧化、抗肿瘤和保肝等作用[15-17],但缺乏系统的毒理学研究。因此,有必要对蛹虫草基质多糖进行毒理学评价。在毒理学评价系统中,急性毒性和亚慢性毒性是两个重要的组成部分。一般情况下,受试物在经过这两种毒理学评价后就能使人们对该受试物的毒性有所了解。
急性毒性试验是研究和评价受试物安全性的第一步工作,通过急性毒性试验可了解动物肌体一次较大剂量接触受试物所产生的毒性特征和毒性强度,获得受试物最基本的毒理学参数,为进一步的毒性试验和毒理学研究奠定基础。本研究采用改良寇氏法,通过小鼠经口给药设计了急性毒性试验,检测了蛹虫草基质多糖的急性毒性。在灌服CMSP剂量超过10 000 mg/kg的情况下,未引起小鼠死亡,未出现不良症状,未引起小鼠的体重和饮食的异常变化;剖检存活小鼠后,未见心、肝、脾、肺、肾等主要脏器出现肉眼可见的明显病变,根据中国食品毒理学经口急性毒性分级标准,CMSP属于实际无毒物,不必测定其半数致死量(LD50)[13]。
亚慢性毒性试验是对试验动物较长期接触受试物所致生物学效应的深入研究,是受试物安全性毒理学评价的必做试验,可获得更多的毒理学信息和重要的毒理学参数。本试验结果显示,在90 d经口的大鼠亚慢性毒性试验中未出现大鼠死亡情况,未出现临床不良症状。CMSP各剂量组大鼠在体重增长方面虽然略高于空白对照组,但属于正常变化范围内,不具有临床意义。有研究表明许多中草药提取物因具有药理学作用如抗氧化性能够增加身体重量[18,19]。
尿蛋白和尿葡萄糖是反应肾脏功能的重要指标。正常尿液中含少量小分子蛋白质和微量的葡萄糖,普通尿常规检查测不出,当肾脏受损后,肾小球的滤过作用和肾小管的重吸收功能被破坏,蛋白质和葡萄糖进入尿液,导致尿中蛋白质和葡萄糖含量增加,尿常规检查可以测出,蛋白尿和糖尿是肾脏病的常见表现[20]。本研究结果显示,CMSP各剂量组和空白对照组的尿蛋白和尿葡萄糖均为阴性,因此长时间口服CMSP对大鼠肾脏无毒性作用。
血常规分析是最基本的血液检验,主要是检查血液方面的问题,如是否有感染,是否贫血,是否有血液疾病。由动物试验获得血液系统变化的数据对人类是否中毒具有较高的预测价值[21]。本研究结果显示,CMSP各剂量组大鼠血常规指标与空白对照组比较无显著性差异,因此CMSP不影响大鼠的造血功能和白细胞的形成。
谷丙转氨酶(ALT)和谷草转氨酶(AST)是存在于动物肝脏中的重要血清酶,是评价肝功能的重要指标,临床上常通过监测其浓度来发现肝脏疾病。ALT是一种胞质酶,在肝脏中浓度很高,AST是存在于肝组织的线粒体和胞浆中的酶,当肝细胞受损时,ALT和AST就会进入血液,因此,血清中这两种酶浓度升高是肝脏受到损害的一种应答反应[22,23]。总胆红素也影响着肝脏的各种功能,血清中总胆红素的升高是肝脏受损的重要标志,也可能是胆道梗阻的标志[24]。据报道,血清蛋白水平的升高表明肝脏组织受损,而血清蛋白水平降低则反映肝脏慢性损伤[24,25]。本研究结果显示,CMSP各剂量组在ALT、AST、总胆红素及血清蛋白水平与空白对照组比较无明显差异,因此CMSP不会引起肝毒性。此结果可以通过试验组与空白对照组肝脏的组织病理学检查得到进一步证明。肾功能可以通过血清中肌酐、尿酸、尿素氮、钠、钾、钙及氯的水平来评估。肌酐是机体骨骼肌中磷酸肌酸分解代谢的有害物质,当肾功能受损时,血清中肌酐水平上升[26]。尿酸水平的升高主要是由于结晶体或结石堵塞尿路引起肾小管和肾实质毒性作用的结果,过高的尿酸浓度会使肾脏结构和功能发生恶化[27]。本研究结果显示,CMSP各剂量组在肌酐、尿酸、尿素氮、钠等水平与空白对照组比较无明显差异,因此CMSP不会引起中毒性肾损害。此结果同样可以通过试验组与空白对照组肾脏的组织病理学检查得到进一步证实。
脏器指数在一定程度上可以反映受试物对脏器的影响,尤其是毒性的重要指标[28]。本研究结果显示,CMSP中剂量组雄性大鼠脾脏指数明显高于空白对照组,因为该组中有4只大鼠脾脏肿大,考虑原因可能是由于在饲养期间相互争斗导致咬伤而引起的。另外,CMSP高剂量组雄性大鼠脾脏指数与空白对照组相比无明显差异,且CMSP中剂量组雌性大鼠脾脏指数与空白对照组相比无明显差异。此外,CMSP低、中、高3个剂量组的其他脏器指数与空白对照组比较无明显差异。因此,CMSP未对大鼠的脏器指数产生不良影响。组织病理学检查结果显示,除CMSP中剂量组有4只雄性大鼠脾脏肿大外,其余各组动物脏器均未发现异常变化,说明CMSP安全无毒。
综上所述,CMSP实际为无毒物,且对大鼠未观察到有害作用水平为600 mg/(kg·d),具有较好的开发应用前景。
参考文献:
[1] GAI G Z,JIN S J,WANG B,et al. The efficacy of Cordyceps militaris capsules in treatment of chronic bronchitis in comparison with Jinshuibao capsules[J].Chinese Journal of New Drugs,2004,13:169-171.
[2] 王建芳,杨春清.蛹虫草有效成分及药理作用研究进展[J].中医药信息,2005,22(5):30-32.
[3] DAY C P. Treatment of alcoholic liver disease[J].Liver Transplantation,2007,13(12):69-75.
[4] 柴建萍,白兴荣,谢道燕,等.蛹虫草主要有效成分及药理功效[J].云南农业科技,2003,18(4):22-23.
[5] 桂仲争,滕国琴,贾俊强,等.蛹虫草食药用开发价值[J].中国食物与营养,2012,18(3):70-73.
[6] WANG M,MENG X Y,YANG R l,et al. Cordyceps militaris polysaccharides can improve the immune efficacy of Newcastle disease vaccine in chicken[J].International Journal of Biological Macromolecules,2013,59(8):178-183.
[7] CHA J Y,AHN H Y,CHO Y S,et al. Protective effect of cordycepin-enriched Cordyceps militaris on alcoholic hepatotoxicity in Sprague-Dawley rats[J].Food and Chemical Toxicology, 2013,60(10):52-57.
[8] CHEUNG J K,LI J,CHEUNG A W,et al. Cordysinocan,a polysaccharide isolated from cultured Cordyceps,activates immune responses in cultured T-lymphocytes and macrophages: Signaling cascade and induction of cytokines[J].Journal of Ethnopharmacology,2009,124(1):61-68.
[9] RAO Y K,FANG S H,WU W S,et al. Constituents isolated from Cordyceps militaris suppress enhanced inflammatory mediators production and human cancer cell proliferation[J]. Journal of Ethnopharmacology,2010,131(2):363-367.
[10] 朱雅红,颜 辉,桂仲争.蛹虫草多糖对四氯化碳诱导大鼠原代肝细胞损伤的保护作用研究[J].蚕业科学,2009,35(1):106-110.
[11] 刘苏萌,王丽娟,司艳红,等.蛹虫草基质粗多糖提取及抗氧化活性测定[J].食品科技,2009,34(7):179-181.
[12] 江海涛,吴雨龙,王仁雷,等.蛹虫草基质多糖对酒精所致小鼠急性肝损伤的保护作用[J].食品科学,2014,13(35):57-60.
[13] 李建科.食品毒理学[M].北京:中国计量出版社,2012.
[14] 王心如.毒理学实验方法与技术[M].北京:人民卫生出版社,2014.
[15] 于 溢,安家彦,马军香.蛹虫草胞外多糖的提取和纯化[J].大连轻工业学院学报,2000,19(4):268-270.
[16] WANG Z Y,WANG C Y,QUAN Y. Extraction of polysaccharides from Phellinus nigricans mycelia and their antioxidant activities in vitro[J].Carbohydrate Polymers,2014,99(2):110-115.
[17] ISABEL C F R,SANDRINA A H,FILIPA S R,et al. Chemical features of Ganoderma polysaccharides with antioxidant, antitumor and antimicrobial activities[J].Phytochemistry,2014, 114(4):38-55.
[18] AHLEM S,KHALED H,WAFA M,et al. Oral administration of Eucalyptus globulus extract reduces the alloxan-induced oxidative stress in rats[J].Chemico-Biological Interactions,2009, 181(1):71-76.
[19] MANGATHAYARU K,UMADEVI M,REDDY C U. Evaluation of the immunomodulatory and DNA protective activities of the shoots of Cynodon dactylon[J].Journal of Ethnopharmacology,2009,123(1):181-184.
[20] 孔宪如,史光英,徐志刚,等.2型糖尿病患者尿蛋白排泄率与肌酐清除率关系分析[J].临床内科杂志,2010,2(27):114-116.
[21] OLSON H,BETTON G,ROBINSON D,et al. Concordance of the toxicity of pharmaceuticals in humans and in animals[J].Regulatory Toxicology and Pharmacology,2000,32(1):56-67.
[22] TENNEKOON K H,JEEVATHAYAPARAN S, KURUKULASOORIYA A P,et al. Possible hepatotoxicity of Nigella sativa seeds and Dregea volubilis leaves[J].Journal of Ethnopharmacology,1991,31(1):283-289.
[23] EVAN G O.Animal Clinical Chemistry:A Practical Guide for Toxicologists and Biomedical Researchers[M].Boca Raton:CRC Press,2009.
[24] RASEKH H R,NAZARI P,KAMLI-NEJAD M,et al. Acute and subchronic oral toxicity of Galega officinalis in rats[J]. Journal of Ethnopharmacology,2008,116(1):21-26.
[25] SOLOMON F E,SHARADA A C,DEVI P U. Toxic effects of crude root extract of Plumbago rosea(Rakta chitraka) on mice and rats[J].Journal of Ethnopharmacology,1993,38(1):79-84.
[26] TORTORA G J,DERRICKSON B. Principles of Anatomy and Physiology[M].John Wiley& Sons,Inc.:United States of America,2009.
[27] 臧路平,刘志刚,吴新荣.高尿酸血症发病机制及其药物治疗研究进展[J].医药导报,2011,30(1):69-73.
[28] 向丽华,陈燕萍,张 智,等.24味有毒中药长期毒性实验对大鼠脏器指数的影响[J].中国中医基础医学杂志,2006,12(1):35-36,52.
