寡聚对苯乙炔与多肽拮抗剂RM26的偶联及131I标记研究
2016-08-16周志军卓连刚王关全
蹇 源,周志军,卓连刚,赵 鹏,廖 伟,王关全,刘 宁
(1.四川大学 原子核科学技术研究所 辐射物理及技术教育部国家重点实验室,四川 成都 610064;2.中国工程物理研究院,四川 绵阳 621900)
寡聚对苯乙炔与多肽拮抗剂RM26的偶联及131I标记研究
蹇源1,2,周志军2,卓连刚2,赵鹏2,廖伟2,王关全2,刘宁1
(1.四川大学 原子核科学技术研究所 辐射物理及技术教育部国家重点实验室,四川 成都610064;2.中国工程物理研究院,四川 绵阳621900)
摘要:结合寡聚对苯乙炔(oligo p-phenylene ethynylene, OPE)较强细胞膜穿透能力和多肽拮抗剂RM26对PC-3癌细胞的高亲和性,设计合成OPE-RM26偶联物。采用Iodogen涂管法对偶联物进行131I标记,得到标记率为95%的放射性标记物131I-OPE-RM26,室温下放置24 h后其放化纯度仍大于90%,具有良好的体外稳定性。研究结果为制备具有靶点识别、膜穿透性、射线杀伤的多功能放射性药物提供参考。
关键词:寡聚对苯乙炔;多肽拮抗剂;偶联反应;131I标记
2005年,美国新墨西哥州大学的Lu等[1]首次报道了一种对细菌具有光诱导杀伤作用的聚苯乙炔衍生物(poly phenylene ethynylene,PPE),该发现引起了关注,并进行了进一步研究[2-5]。Zhou等[6]发现寡聚对苯乙炔(oligop-phenylene ethynylene, OPE)具有出色的抗菌性能;Wang等[7]利用电子/光学显微镜和小角X射线散射(SAXS)技术研究黑暗条件下PPE和OPE对大肠埃希氏菌(Escherichiacoli,E.coli)的抗菌行为,结果显示PPE改变了细菌外层膜结构并导致细菌膜塌陷,OPE插入细菌膜使内溶物释放出来导致细菌破裂。
肿瘤细胞与正常细胞具有明显不同的分子生物学特征,很多肿瘤细胞会过度表达一些生物分子[8-10]。促胃泌素多肽受体(GRP-R)在早期的新肿瘤细胞和侵入式前列腺癌细胞中均过度表达,比正常组织高出20倍左右[11]。因此,以癌细胞的GRP-R为靶点,GRP类似物为靶向基团,通过放射性同位素标记,合成能专一识别癌细胞GRP-R的放射性药物具有积极意义。目前,部分GRP-R激动剂完成了临床前研究,99mTc标记药物已经应用于单光子发射计算断层扫描(SPECT)显像[12-13];以18F和64Cu 标记的正电子发射断层扫描(PET)分子显像药物也已进入临床实验阶段[14]。但是基于GRP 受体识别治疗用放射性药物研究进展较为缓慢,Lantry等[15]合成了一种改进的GRP类似物,在临床实验中表现出一定的治疗潜力,但其剂量高(1.4~4 μg/kg),在胰腺中高浓度富集,副作用较大[16];Ginj等[11,17]发现,虽然多肽拮抗剂不能有效地内化,但具有更高的受体亲和性与更低的检出限,据此合成放射性标记的拮抗剂demobesin 1,其体内性质优于99mTc标记的激动剂药物demobesin 4;Mansi等[18]研究激动剂111In-DOTA-AMBA和拮抗剂111In-DOTA-RM1对裸鼠的抗癌性能(PC-3),结果显示111In-DOTA-RM1在肿瘤摄取、肿瘤/正常组织放射性摄取比以及药物的肿瘤滞留时间等方面优于111In-DOTA-AMBA;Kroll等[19]合成了包含GRP-R激动剂(AMBA)和拮抗剂(RM1)双功能基的分子,通过调控AMBA和RM1的距离,得到具有激动剂和拮抗剂双重优点的新型治疗药物。
为获得具有靶点识别、膜穿透性、射线杀伤的放射性药物,本研究拟将具有细胞膜穿透性的OPE分子与多肽拮抗剂RM26偶联后进行I-131标记,研究该放射性药物的稳定性,为新型放射性药物研发提供参考。
1 实验材料
1.1仪器
Mini-Scan型TLC薄层放射性扫描仪:美国Bioscan公司;微量电子天平:AE200,瑞士 Ettler公司;电子天平:JA2003A,上海精天电子仪器有限公司。
1.2试剂
Na131I(1.48×1012Bq /L):成都中核高通公司; 寡聚对苯乙炔(OPE):本项目组合成,并经核磁共振(NMR)和质谱(MS)表征;(Tyr)3-RM26:安徽国泰公司合成;放射性薄层层析纸:Whatman No. 1纸;其他试剂均为分析纯,Aladdin试剂公司提供。
2 实验方法
2.1OPE-RM26合成
寡聚对苯乙炔(OPE)分子结构示于图1。OPE-RM26的合成路线示于图2。称取(Tyr)3-RM26(32 mg, 0.017 mmol)溶解于水和乙腈的混合溶剂(V水∶V乙腈=1∶1)中,加入0.034 mmol的缩合剂BOP(Benzotriazole-1-yl-oxy-tris-(dimethylamino)-phosphonium hexafluorophosphate)或EDI((N1-((ethylimino)methylene)-N3,N3-dime-thylpropane-1,3-diamine))和0.085 mmol的DIAP(Di-Isoamyl Phosphate),室温下搅拌30 min,加入EO-OPE(NH2)(10 mg, 1.2 mmol),室温下反应过夜。
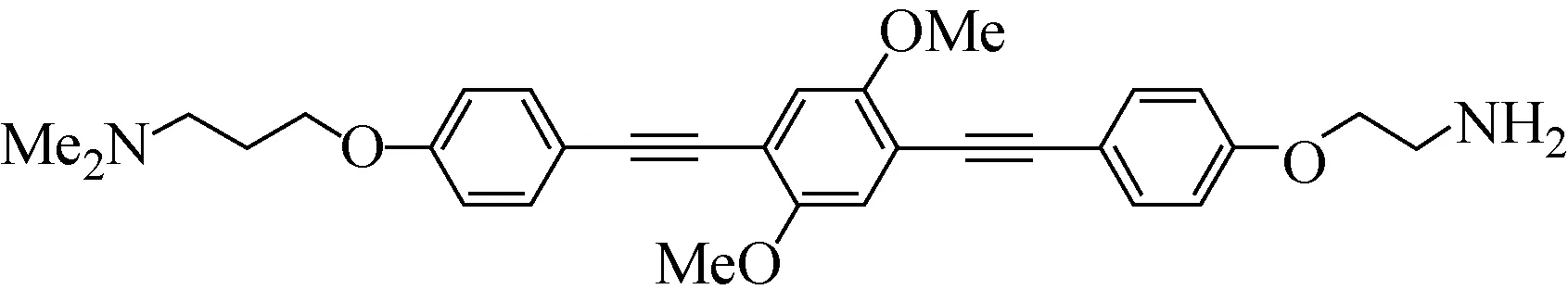
图1 OPE分子结构示意图Fig.1 Schematic structures of the OPE molecular
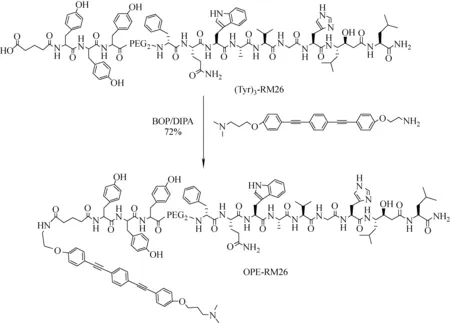
图2 OPE-RM26的合成路线Fig.2 Synthesis method of OPE-RM26
2.2OPE-RM26放射性标记
将0.1 mg OPE-RM26或(Tyr)3-RM26溶解于100 μL NaH2PO4/Na2HPO4缓冲溶液中(pH=5.2),得到1 g/L的待标溶液。取适量Iodogen(1,3,4,6-四氯-3A,6A-二苯基八氢咪唑并[4,5-D]咪唑-2,5-二酮)溶解于含二氯甲烷的离心管中,真空状态下快速抽干溶剂,依次加入100 μL待标化溶液(OPE-RM26或(Tyr)3-RM26),10 μL Na131I(9.62×106Bq)溶液。10 min后取10 μL反应液,分别点样在Whatman纸和硅胶板上,并在不同展开体系展开后用TLC薄层仪扫描计数,计算标记物的放化纯度。用pH=5.2缓冲溶液浸润C-18柱后加入反应体系溶液,用相同缓冲溶液淋洗直至不再有放射性活度,得到水相,将淋洗液换为乙醇,淋洗2 mL后测量各相放射性活度,计算标记率。为优化标记条件,考察pH、反应时间、温度、多肽用量对标记率的影响。
2.3标记物体外稳定性
取0.15 mL I-131标记的多肽溶液(约9.62×106Bq),用1 mL 0.9% NaCl溶液稀释,20 ℃下放置24 h。采用2.2中方法计算放化纯度,考察标记化合物的体外稳定性。
3 结果与讨论
3.1OPE-RM26合成
半制备HPLC分离(Agilent 1100,H2O∶90%~40%,CH3CN:10%~60%),冷冻干燥后得到白色固体粉末26.8 mg,产率:72%。MS ESI测定相对分子质量M+2H+为:2 420.02。
多次OPE与多肽的偶联反应结果表明,常规的偶联剂如HATU(O-(7-Azabenzotriazol-1-yl)-N,N,N′,N′-tetramethyluronium hexafluorophosphate)和HBTU(O-Benzotriazole-N,N,N′,N′-tetramethyluronium hexafluorophosphate)无法偶联,只有在BOP或者EDC体系中才能得到。另外,由于EO-OPE(NH2)是从Boc保护的EO-OPE前体得到,直接采用反应产物EO-OPE(NH2)·HCOOH与多肽偶联反应,质谱结果显示,得到EO-OPE(NH2)与羧酸的酯化产物,多肽原料不参与反应,即使加入过量的DIPA中和羧酸也不能改变产物。因此,只能在裸露的氨基端与多肽进行偶联。
3.2OPE-RM26放射性标记
3.2.1确定淋洗剂
在I-131标记的对照实验中,Na131I溶液和Iodogen氧化的Na131I溶液确认氧化前后I-及其氧化产物的Rf值,通过与多肽反应体系对比确认标记多肽的Rf值;同时,采用C-18柱分离不同相对分子质量的标记物进行确认(测量水洗和乙醇淋洗后得到洗液的放射性活度)。结果表明,碘化钠和氧化后的碘容易用PBS缓冲溶液淋洗,多肽只能部分被乙醇淋洗,用其他溶剂,如乙腈、二氯甲烷、甲醇等进行淋洗,效果并不明显,考虑到乙腈和二氯甲烷等会产生细胞毒性,最终采用乙醇淋洗剂。各相中的放射性滞留列于表1,由表1可知,(Tyr)3-RM26-131I和OPE-RM26-131I的溶解度较低,采用C-18柱进行分离时都发生了拖尾显像,2 mL乙醇冲洗的条件下,只有少部分的标记物被淋洗下来。
3.2.2优化标记条件
在OPE-RM26和(Tyr)3-RM26的标记实验中,考察pH、反应时间、温度、多肽的用量对标记率的影响。pH变化对标记率的影响变化曲线示于图3,由图3可知pH变化对多肽分子标记率的影响较小;其他标记条件反应时间、温度、多肽用量对反应的标记率几乎没有影响。最终实验结果表明,OPE-RM26和(Tyr)3-RM26在10 min、pH=7.4、20 ℃、多肽量50 μg进行标记,标记率大于90%。
3.2.3标记率及放化纯度
I-131标记化合物的Whatman纸薄层色谱图示于图4。丙酮作展开剂相时,Na131I原液出峰时间为0.95 min(图4a);当还原剂Iodogen存在时,在0.35 min的位置出现新峰,为被还原的131I,在0.95 min仍有大量的Na131I残留(图4b);(Tyr)3-RM26标记物的出峰时间为0.35 min,标记率约为95%(图4c);OPE-RM26标记物的出峰时间为1.15 min,标记率约95%(图4d),OPE-RM26溶解度较小导致其出峰时间较晚。
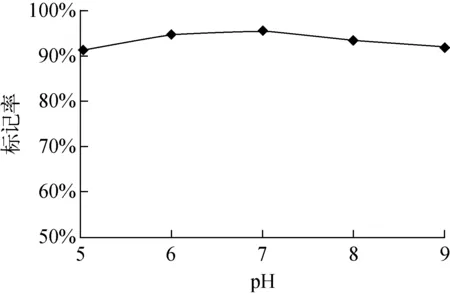
图3 pH对(Tyr)3-RM26标记率的影响Fig.3 (Tyr)3-RM26 labeling ratio curve with pH
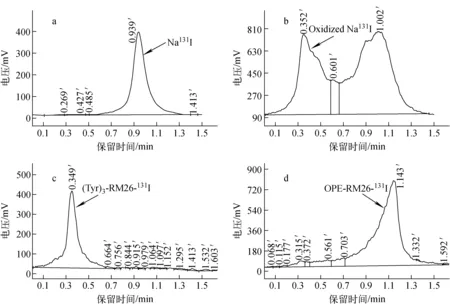
a—Na131I;b—Oxidized Na131I;c—(Tyr)3-RM26-131I; d—OPE-RM26-131I图4 I-131标记化合物的Whatman纸薄层色谱图a—Na131I;b—Oxidized Na131I;c—(Tyr)3-RM26-131I; d—OPE-RM26-131I Fig.4 Thin layer chromatograms of I-131 labeled compounds
标记过程中,由于加入多肽的量远大于Na131I的量,导致产物的放化纯度较低,尝试采用HPLC进行纯化,但标记物浓度太低且标记后产物与原料极性相似,很难完全分离。
3.3标记物稳定性
通过C-18柱进行分离测量各组分的放射性活度,计算24 h后标记化合物的放化纯度,考察标记物稳定性,结果列于表2。

表2 标记物稳定性(n=3)Table 2 Stability of labeled compounds (n=3)
由表2可知,与刚标记完的OPE-RM26分子比较,24 h后其放化纯度没有明显下降(90%以上)。表明合成的I-131标记OPE-多肽类分子具有良好的体外稳定性,为后续的生物细胞实验及动物体内实验奠定了良好的基础。
3 小结
将OPE分子与多肽拮抗剂RM26偶联合成OPE-RM26,结果显示,以EDC或BOP作为偶联剂可制备OPE-RM26,产率为72%。采用Iodogen涂管法对OPE-RM26偶联物进行I-131标记,标记产物20 ℃放置24 h,放化纯度仍大于90%。本研究为制备具有靶点识别、膜穿透性、射线杀伤的多功能放射性药物奠定基础。
致谢:感谢西南医科大学核医学科提供的实验场所和仪器设备。
参考文献:
[1]Lu L, Rininsland F H, Wittenburg S K, et al. Biocidal activity of a light-absorbing fluorescent conjugated polyelectrolyte[J]. Langmuir, 2005, 21: 10 154-10 159.
[2]Ogawa K, Chemburu S, Lopez G P, et al. Conjugated polyelectrolyte-grafted silica microspheres[J]. Langmuir, 2007, 23: 4 541-4 548.
[3]Corbitt T S, Sommer J R, Chemburu S, et al. Conjugated polyelectrolyte capsules: light-activated antimicrobial micro “Roach Motels”[J]. ACS Appl Mater Interface, 2009, 1: 48-52.
[4]Xing C F, Xu Q L, Tang H W, et al. Conjugated polymer/porphyrin complexes for efficient energy transfer and improving light-activated antibacterial activity[J]. J Am Chem Soc , 2009, 131: 13 117-13 124.
[5]Yuan H X, Chong H, Wang B, et al. Chemical molecule-induced light-activated system for anticancer and antifungal activities[J]. J Am Chem Soc , 2012, 134: 13 184-13 187.
[6]Zhou Z J, Corbitt T S, Parthasarathy A, et al. “End-Only” functionalized oligo (phenylene ethynylene)s: synthesis, photophysical and biocidal activity[J]. J Phys Chem Lett, 2010, 1: 3 207-3 212.
[7]Wang Y, Corbitt T S, Jett S D, et al. Direct visualization of bactericidal action of cationic conjugated polyelectrolytes and oligomers[J]. Langmuir, 2012, 28: 65-70.
[8]Niu Y, Chang T M, Yeh S, et al. Differential androgen receptor signals in different cells explain why androgen-deprivation therapy of prostate cancer fails[J]. Oncogene, 2010, 29(25): 3 593-3 604.
[9]Tosoian J S, Loeb P S A, Beyond. The Past, present and future of investigative biomarkers for prostate cancer[J]. The Scientific World Journal, 2010, 10: 1 919-1 931.
[10]Mohler J. Prostate cancer[J]. Journal of the National Comprehensive Cancer Network, 2010, 8(2): 162-200.
[11]Ginj M. Radiolabeled somatostatin receptor antagonists are preferable to agonists for in vivo peptide receptor targeting of tumors[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(44): 16 436-16 441.
[12]Wiele C V D, Dumont F, Broecke R V, et al. Technetium-99m RP527, a GRP analogue for visualisation of GRP receptor-expressing malignancies: a feasibility study[J]. European Journal of Nuclear Medicine, 2000, 27(11): 1 694-1 699.
[13]Nock B . Tc-99m Demobesin 1, a novel potent bombesin analogue for GRP receptor-targeted tumour imaging[J]. European Journal of Nuclear Medicine and Molecular Imaging, 2003, 30(2): 247-258.
[14]Hoffman T J, Smith C J. True radiotracers: Cu-64 targeting vectors based upon bombesin peptide[J]. Nuclear Medicine and Biology, 2009,36(6): 579-585.
[15]Lantry L E. Lu-177-AMBA: Synthesis and characterization of a selective Lu-177-labeled GRP-R agonist for systemic radiotherapy of prostate cancer[J]. Journal of Nuclear Medicine, 2006, 47(7): 1 144-1 152.
[16]Maddalena M E . Lu-177-AMBA Biodistribution, radiotherapeutic efficacy, imaging, and autoradiography in prostate cancer models with low GRP-R expression[J]. Journal of Nuclear Medicine, 2009, 50(12): 2 017-2 024.
[17]Cescato R. Bombesin receptor antagonists may be preferable to agonists for tumor targeting[J]. Journal of Nuclear Medcine, 2008, 49: 318-326.
[18]Mansi R, Fleischmann A, Mäcke H. Targeting GRPR in urological cancers-from basic research to clinical application[J]. Nature Reviews Urology, 2013, 10: 235-244.
[19]Kroll C, Mansi R, Braun F. Hybrid bombesin analogues: combining an agonist and an antagonist in defined distances for optimized tumor targeting[J]. J Am Chem Soc, 2013, 135(45): 16 793-16 796.
收稿日期:2016-03-31;修回日期:2016-06-02
基金项目:国家自然科学基金项目(21571164)
作者简介:蹇源(1971—),四川眉山人,研究员,主要从事同位素制备与应用、放射性药物研究 通信作者:刘宁,教授,E-mail: nliu720@scu.edu.cn
中图分类号:TL92+3
文献标志码:A
文章编号:1000-7512(2016)03-0158-06
doi:10.7538/tws.2016.29.03.0158
Coupling Reaction of Oligop-Phenylene Ethynylene and Peptide Antagonist RM26 Labeling with131I
JIAN Yuan1,2, ZHOU Zhi-jun2, ZHUO Lian-gang2, ZHAO Peng2, LIAO Wei2,WANG Guan-quan2, LIU Ning1
(1.InstituteofNuclearScienceandTechnology,KeyLaboratoryofRadiationPhysicsandTechnology
(SichuanUniversity),MinistryofEducation,SichuanUniversity,Chengdu610064,China;2.InstituteofNuclearPhysicsandChemistry,
ChinaAcademyofEngineeringPhysics,Mianyang621900,China)
Abstract:Investigations reveale that oligo p-phenylene ethynylene (OPE) molecule can insert into cell membrane, which leads to its cellular internization capacility. Antagonists have high cancer cell affinity, high uptake in cancer cells and fast clearance in normal tissue, these capabilities have attracted much research interest in radiopharmaceutical development. Combining the strong cell-penetrating ability and high affinity of Gastrin-releasing peptide which is overexpressed in the PC-3 cells, the thesis designed and synthesized unsymmetric OPE(NH2) molecule. Then the OPE(NH2) molecule was followed by the coupling reaction with RM26 peptide to obtain the OPE-RM26, and (Tyr)3-RM26 was also got for controling study. After that, the (Tyr)3-RM26 and OPE-RM26 were radiolabeled with I-131 to give high radiolabeling yields that could up to 95%. The radiolabeling compound was stable after 24 h storage at room temperature. These labeled compounds are ready for animal in-vivo experiment. It is expected that OPE-RM26-131I has multi-properties with targeting membrane crossing fire of radioactive elements. The molecule may fast travel to the target tissue and bind to GRP receptor and internalized into cancer cells. The casade process will give rise to its cancer cell toxicity due to longer retention and more killing effect of ray’s irradiation to cancer cells. In this way, OPE-RM26-131I can achieve better anti-cancer ability.
Key words:oligo p-phenylene ethynylene; peptide antagonist; coupling reaction; I-131 labeling
