有氧运动预处理对全脑缺血再灌注大鼠再生相关因子的影响①
2016-08-12孙竹梅李建民王国立赵雅宁陈长香赵旭王静
孙竹梅,李建民,王国立,赵雅宁,陈长香,赵旭,王静
·基础研究·
有氧运动预处理对全脑缺血再灌注大鼠再生相关因子的影响①
孙竹梅1,李建民1,王国立1,赵雅宁1,陈长香1,赵旭1,王静2
目的探讨有氧运动预处理对脑缺血大鼠脑组织海马区生长相关蛋白-43(GAP-43)、Nogo-A的影响。方法120只Sprague-Dawley大鼠平均分为假手术组、脑缺血再灌注组和有氧运动预处理组。改良Pulsinelli四血管阻断(4-VO)法制备脑缺血再灌注模型。分别在缺血后6 h、1 d、3 d、7 d各取5只大鼠,HE染色观察大鼠海马组织神经细胞形态变化,免疫组化法检测海马组织GAP-43、Nogo-A表达;另5只大鼠RT-PCR法检测GAP-43、Nogo-A水平。结果与脑缺血再灌注组相比,有氧运动预处理组的神经元密度、GAP-43蛋白和mRNA表达水平明显升高(P<0.01),Nogo-A蛋白和mRNA表达水平明显降低(P<0.01)。结论有氧运动预处理可促进脑缺血再灌注后神经元细胞存活和轴突再生,与上调脑组织海马区GAP-43表达并下调Nogo-A表达有关。
脑缺血再灌注;有氧运动;生长相关蛋白-43;Nogo-A;大鼠
[本文著录格式]孙竹梅,李建民,王国立,等.有氧运动预处理对全脑缺血再灌注大鼠再生相关因子的影响[J].中国康复理论与实践,2016,22(7):759-764.
CITED AS:Sun ZM,Li JM,Wang GL,et al.Effect of aerobic exercise preconditioning on growth-associated protein-43 and Nogo-A in rats after cerebral ischemia/reperfusion[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(7):759-764.
缺血性脑血管病是我国常见病,严重威胁人类健康[1-4]。脑缺血所导致的神经元损伤是诱发神经功能缺失的关键所在。有研究表明,脑缺血发生前进行运动训练能使脑组织对后续发生的严重损伤产生耐受,对大脑神经功能有保护作用[5-6]。
轴突的形成、生长和准确投射对神经再生有重要作用[7]。内源性再生相关因子,如生长相关蛋白-43 (growth-associated protein-43,GAP-43),是调节轴突形成新联系和引导轴突生长的一种快速转运胞膜磷酸蛋白[8-9]。在髓鞘相关蛋白神经突起生长抑制分子中,Nogo-A对神经生长具有强烈的抑制作用[7,10]。本研究观察有氧运动预处理的脑缺血模型大鼠海马区GAP-43、Nogo-A的表达变化及神经细胞丢失,初步探讨有氧运动预处理在全脑缺血大鼠神经元损伤中的作用。
1材料和方法
1.1试剂和仪器
多克隆GAP-43抗体、多克隆Nogo-A抗体:北京博奥森生物技术有限公司。兔二步法检测试剂盒:北京中杉金桥生物科技有限公司。One Step SYBR®PrimeScriptTMPLUS RT-PCR Kit,RNAiso Plus:大连宝生物工程有限公司。引物:上海生工生物工程股份有限公司。ZH-PT型计算机控制动物实验跑台:安徽正华生物仪器设备有限公司。5417R冷冻离心机:德国EPPENDORF公司。旋涡混匀器:江苏海门市麒麟医用仪器厂。
1.2实验动物分组和处理
120只3月龄雄性Sprague-Dawley大鼠,北京维通利华公司提供,许可证号SCXK(京)2003-003,体质量230~310 g。平均分成假手术组、脑缺血再灌注组、有氧运动预处理组,每组40只。脑缺血再灌注组应用改良Pulsinelli四血管阻断(4-VO)法[5]制备全脑缺血模型。动物术前禁食12 h,10%水合氯醛300~350 mg/kg腹腔注射麻醉。颈正中切口,分离双侧颈总动脉,在其下置线备用。大鼠翻正并用立体定位仪固定头颈部,枕后部正中切口,暴露双侧第一颈椎横凸翼孔,直视下电凝其下通过的椎动脉2~4 s,使其永久闭塞。大鼠缝皮回笼。24 h后以无创性微动脉夹夹闭双侧颈总动脉,10 min后松开动脉夹。脑电图检测缺血后呈直线、大鼠缺血30~60 s内昏迷,翻正反射消失、双侧瞳孔放大为造模成功。
假手术组分离暴露血管,不电凝椎动脉,不夹闭颈总动脉。
运动预处理组于每日9:00开始跑台运动,跑台坡度0°,先以10 m/min、15 m/min、20 m/min持续10 min适应性训练7 d,而后以20 m/min持续30 min训练14 d[11]。训练后同脑缺血再灌注组法造模。
每组平均分为6 h、1 d、3 d和7 d亚组,每亚组10只。
1.3组织标本制备
各时间点取5只大鼠,10%水合氯醛300~350 mg/kg腹腔注射麻醉,4%多聚甲醛心脏灌流固定,冠状切取背侧海马切片,约厚2 mm,4%多聚甲醛4℃固定24 h。常规梯度乙醇脱水,二甲苯透明,浸蜡包埋,切片厚4 μm,45℃恒温箱中烤干。同一层面相同切片行HE染色和免疫组织化学染色。
切片常规脱蜡、脱水,HE染色,中性树胶加盖玻片封固,在光学显微镜(40×10)下观察。
1.4免疫组织化学染色
切片常规脱蜡至去离子水,滴加复合消化液后37℃温箱孵育20 min,PBS洗涤,加3%H2O2封闭内源性过氧化物酶15 min,PBS洗涤。滴加兔抗大鼠GAP-43和Nogo-A多克隆抗体(1∶300),4℃过夜;PBS洗涤,滴加生物素化二抗(兔二步法检测试剂盒pv6001)37℃40 min,PBS洗涤;DAB显色,苏木精轻度复染,脱水透明,封片。用0.01 mol/L PBS代替一抗孵育作为阴性对照。应用Motic-6.0图像采集及图像分析系统,在相同光镜倍数(40×10)下每只大鼠选5张脑组织切片,每张切片随机取5个不重叠视野,计算每个视野阳性细胞数及棕黄色颗粒细胞,取均数。
1.5PCR
另5只大鼠于造模后各时间点活剪断头处死。冰上取出海马组织,加入RNAiso Plus液1 ml匀浆,室温静置5 min,12,000 r/min 4℃离心5 min,取上清移至1.5 ml离心管内。加入RNAiso Plus溶液容积20%的氯仿,震荡混匀,室温静置5 min,12,000 r/min 4℃离心15 min,取上清液,加入RNAiso Plus溶液体积0.5~1倍的异丙醇;室温静置10 min,12,000 r/min 4℃离心10 min,弃上清,用与RNAiso Plus溶液等量的75%乙醇清晰沉淀,7500 r/min 4℃离心5 min,弃上清,干燥(不可加热),溶解于DEPC处理水30 μl中,测量OD 260/280值,根据OD 260计算RNA浓度。-80℃保存。
参照CenBank公布的GAP-43、Nogo-A和GAPDH序列,由上海生工生物技术有限公司合成引物。
GAPDH:上游3'-CTC CCA TTC CRC CAC CTT TG-5';下游3'-CCACCACCC TGT TGC TGAG-5'
GAP-43:上游3'-CCC AAG CTT CCA TGC TGT GCT GTA TGA G-5';下游3'-GGG TAC CCT CAG GCATGT TCT TGG TC-5'
Nogo-A:上游3'-GGG AAG GAT AGT GAA GGC AGA-5';下游3'-AGG GAAAGT GTT TGC TGT GG-5'
应用 ABI PRISM®7000和 Applied Biosystems7500 Fast Real-Time PCR System,配置反应体系为20 μl的反应液。42℃ 5 min,95℃ 10 s;40℃、95℃各5 s,60℃ 31 s。将GAPDH cDNA模板10倍梯度稀释,以相同反应体系和条件进行扩增,形成以循环数为横坐标,荧光值为纵坐标的扩增曲线,设定循环阈值,扩增曲线与循环阈值的交点称为临界循环数(Ct)。采用2-△△Ct计算基因表达相对浓度。
1.6统计学分析
2结果
2.1HE染色
假手术组神经元结构正常,细胞核规则,核仁清晰。与假手术组比较,脑缺血再灌注组神经元细胞胞体呈三角形,核皱缩深染,包浆嗜伊红,存活神经元数量随缺血时间延长而减少,3 d时坏死情况最为显著。有氧运动预处理组存活神经元数量明显高于脑缺血再灌注组,细胞核固缩深染及水肿情况减轻。见图1、表1。
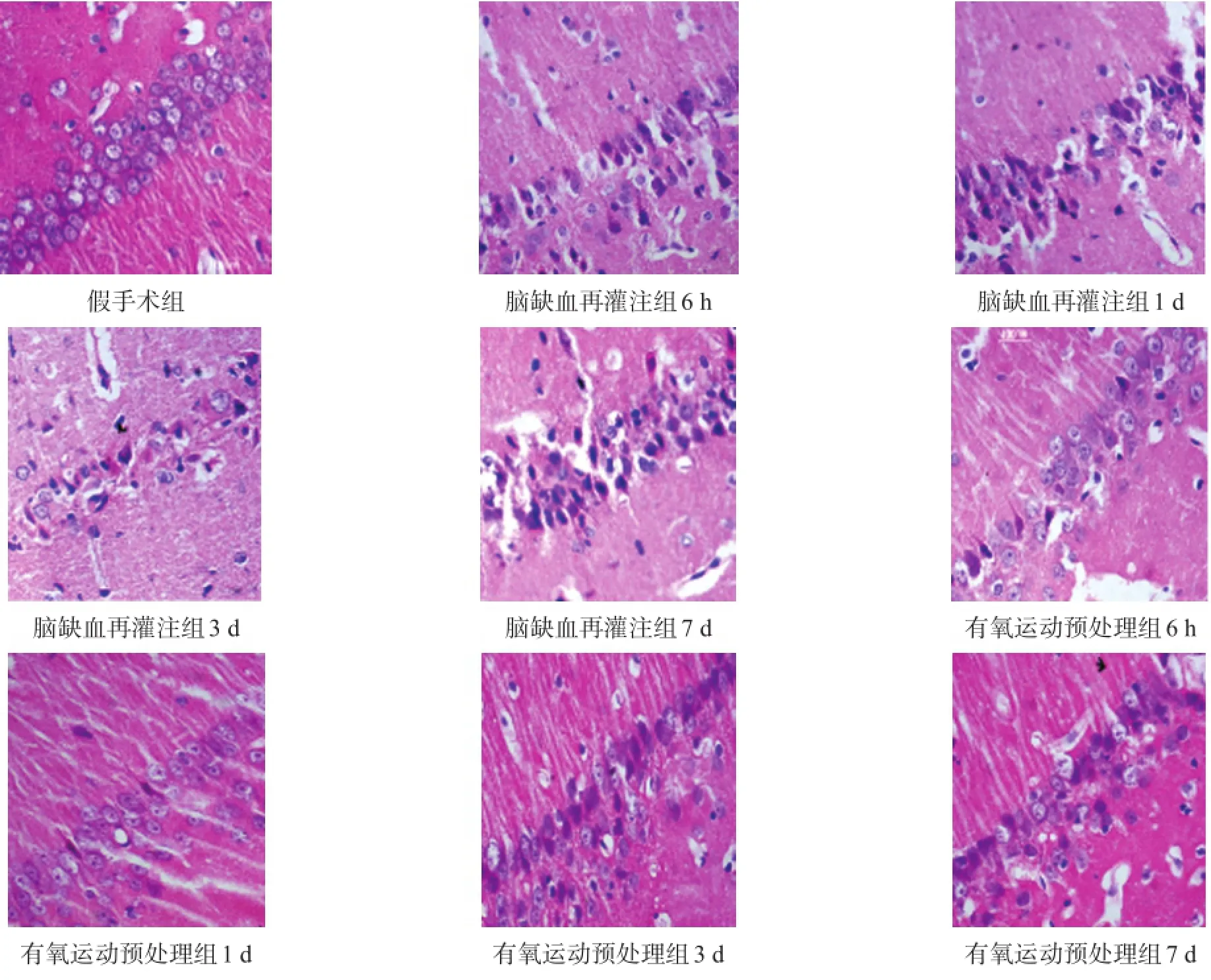
图1 各组海马区神经元(HE染色,400×)
2.2免疫组化染色
GAP-43、Nogo-A阳性表达主要位于细胞核,胞质可见细小棕黄色颗粒。假手术组GAP-43、Nogo-A弱表达。与假手术组比较,脑缺血再灌注组GAP-43、Nogo-A表达增加(P<0.05)。有氧运动预处理组GAP-43蛋白表达水平更高(P<0.05),并随时间延长呈递增趋势。有氧运动预处理组Nogo-A在6 h时水平最低,1 d时水平最高,然后呈下降趋势,但各时间点均低于脑缺血再灌注组(P<0.05)。见图2、表2,图3、表3。
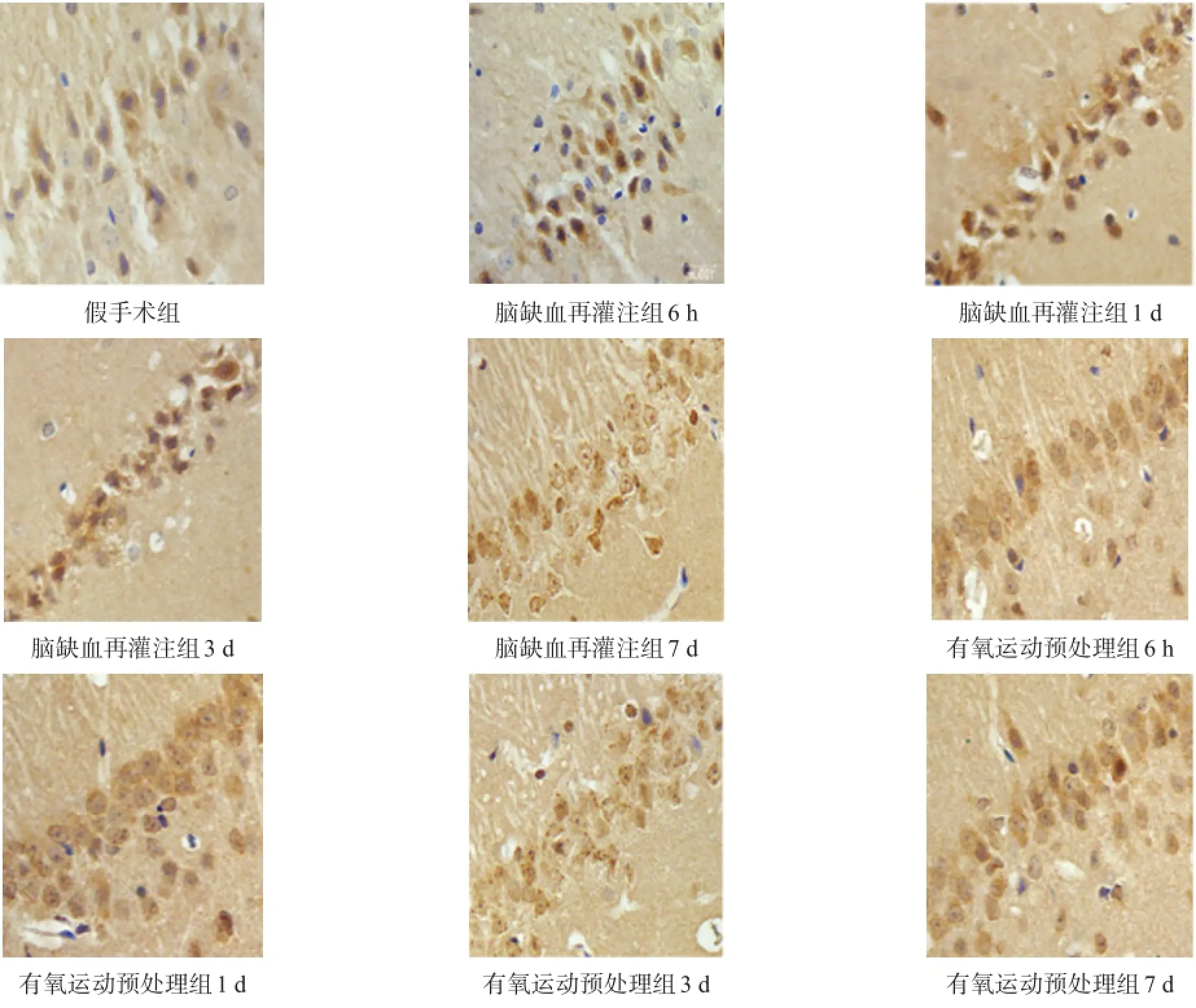
图2 各组海马区GAP-43表达(免疫组化染色,400×)
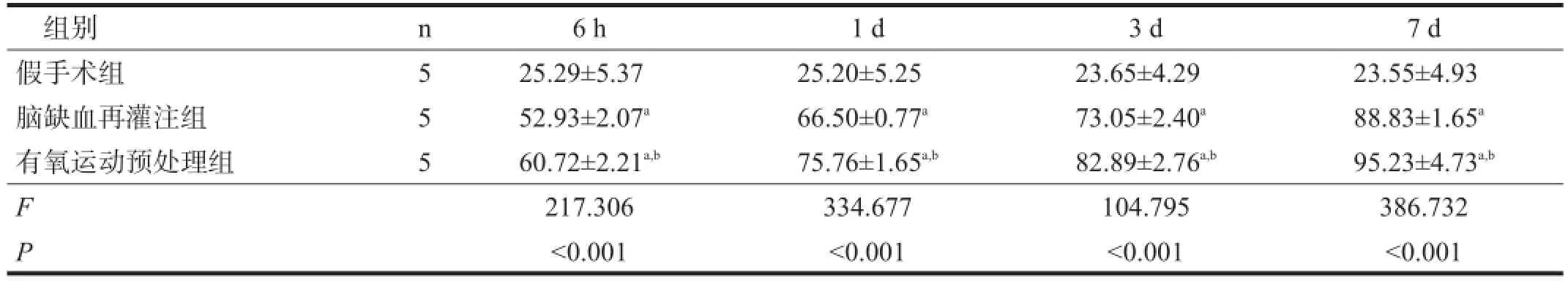
表2 各组大鼠海马区GAP-43免疫阳性细胞数比较
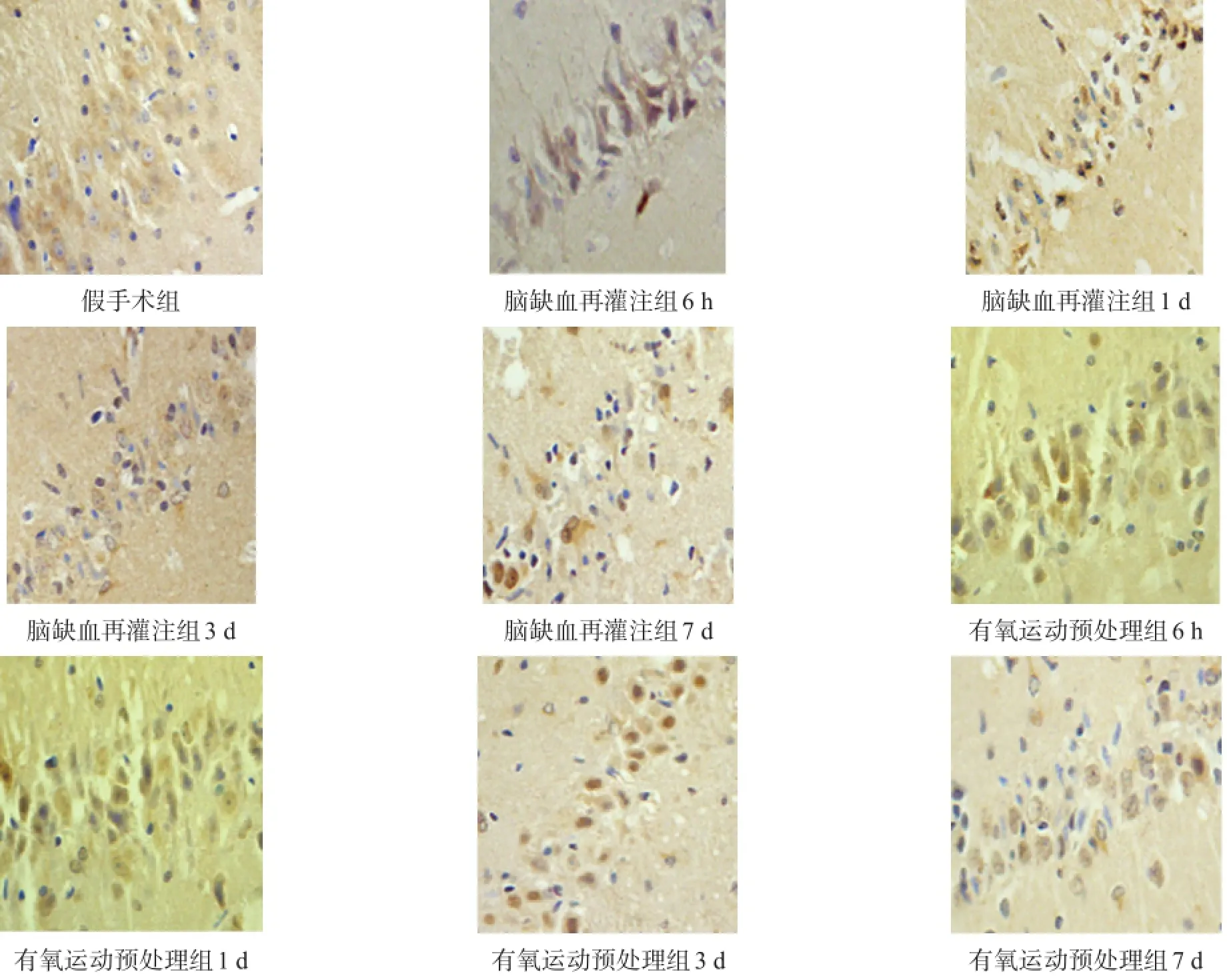
图3 各组海马区Nogo-A表达(免疫组化染色,400×)
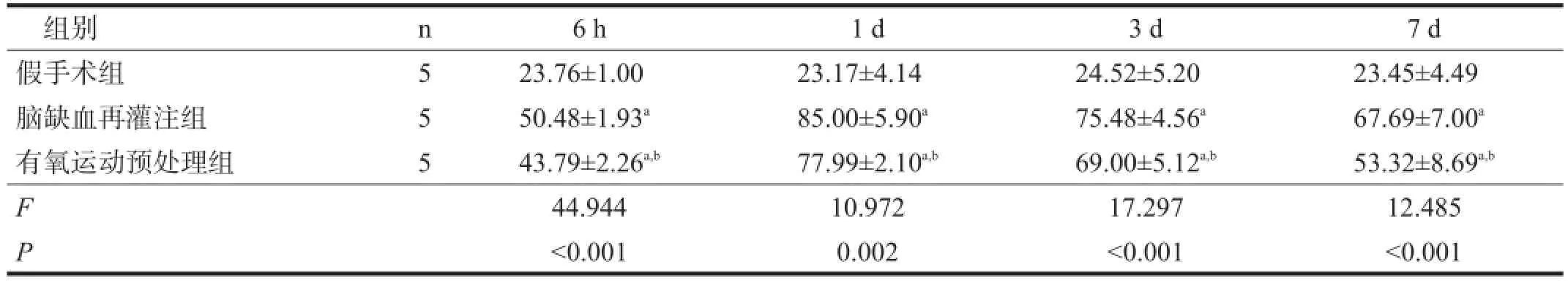
表3 各组大鼠海马区Nogo-A免疫阳性细胞数比较
2.3PCR
与假手术组比较,脑缺血再灌注组各时间点GAP-43、Nogo-A mRNA表达水平明显增加(P<0.01)。有氧运动预处理组GAP-43 mRNA表达水平明显更高(P<0.01),Nogo-A mRNA表达在6 h时明显减少,并在1 d时达低值,3 d时有所上升,7 d时达高值,但仍明显低于脑缺血再灌注组(P<0.01)。见表4、表5。
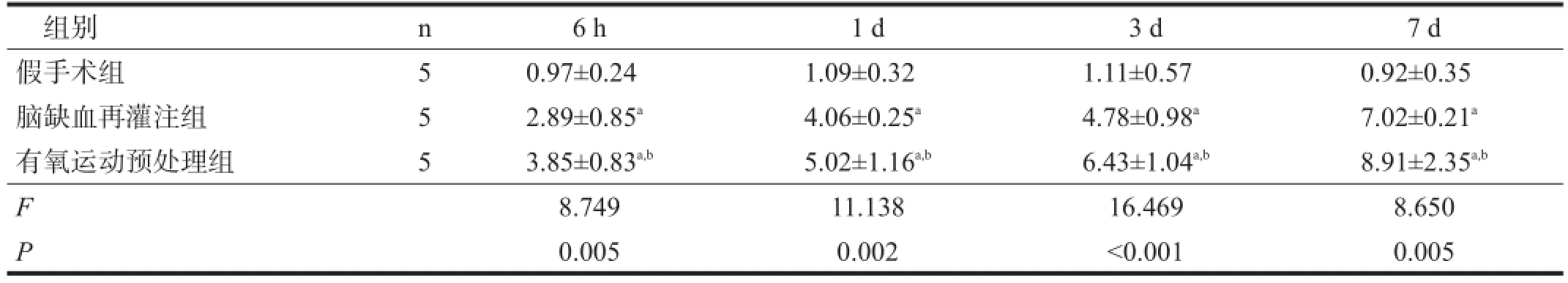
表4 各组大鼠海马区GAP-43 mRNA表达比较(2-△△Ct)
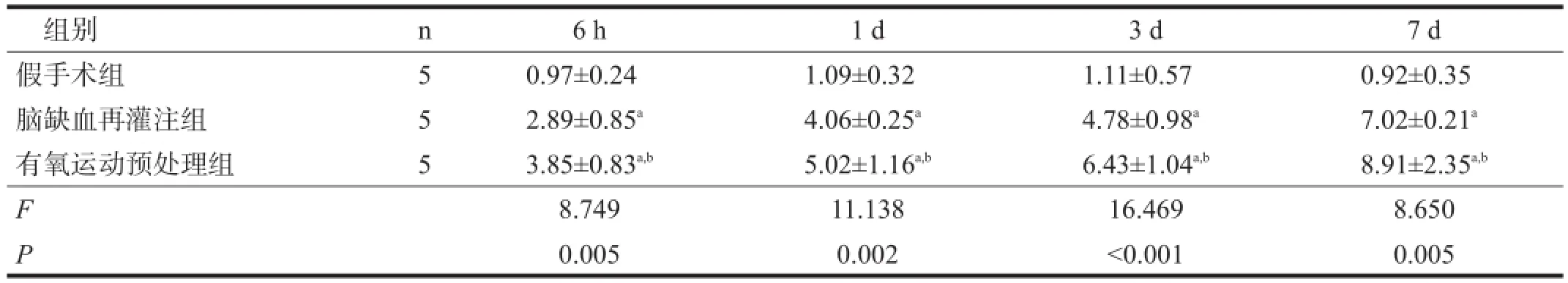
表5 各组大鼠海马区Nogo-AmRNA表达比较(2-△△Ct)
3讨论
本研究显示,有氧运动训练预处理能对缺血再灌
注脑组织起保护作用。为探究其机制,我们观察大鼠海马区GAP-43与Nogo-A的表达变化。
GAP-43是神经组织特异性磷酸蛋白质,是神经元发育及神经生长、再生标志蛋白[7,12-13]。神经突起生长抑制因子Nogo-A是一种神经轴突生长相关蛋白,是抑制中枢神经结构重塑与再生的主要物质[14-18]。有学者发现,针康法、淫羊藿苷以及低氧疗法等上调脑缺血区皮层GAP-43表达,促进脑缺血大鼠神经再生和功能恢复[14,17-18];电针、康复训练、中药、Nogo-A受体拮抗剂等抑制Nogo-A的表达,可增强存活脑区神经元的修复再生,部分重建丧失的神经功能[19-22]。
本研究显示,有氧运动预处理能上调脑缺血再灌注大鼠脑组织GAP-43表达,抑制Nogo-A表达,使其在更短时间内降至较低水平。李超等证实,跑笼训练可促使脑梗死大鼠抓握力恢复,梗死灶周围神经元数量显著增多,Nogo-A蛋白水平表达下降,改善轴突生长的微环境[23]。与本研究结果一致。
综上所述,运动训练可保护脑缺血再灌注大鼠神经元,其机制可能与上调GAP-43并抑制Nogo-A的表达以促进轴突生长有关。
[1]崔海瑛.迷迭香酸对局灶性脑缺血再灌注损伤小数的脑保护及作用机制研究[D].石家庄:河北医科大学,2014.
[2]Western H.Altered living:coping,hope and quality of life after stroke[J].Br J Nurs,2007,16(20):1266-1270.
[3]Ozkul A,Sair A,Akyol A,et al.Effects of lithium and lamotrigine on oxidative-nitrosative stress and spatial learning deficit after global cerebral ischemia[J].Neurochem Res,2014,39(5):853-861.
[4]Chang YK,Chu CH,Wang CC,et al.Effect of acute exercise and cardiovascular fitness on cognitive function:an event-related cortical desynchronization study[J].Psychophysiology,2015,52(3):342-351.
[5]Tahamtan M,Allahtavakoli M,Abbasnejad M,et al.Exercise preconditioning improves behavioral functions following transient cerebral ischemia induced by 4-vessel occlusion(4-VO)in rats[J].Arch Iran Med,2013,16(12):697-704.
[6]朱路文,叶涛,吴孝军,等.运动预处理对脑缺血再灌注大鼠血清炎症因子水平的影响[J].中国康复理论与实践,2015,21(1):22-25.
[7]Latchney SE,Masiulis I,Zaccaria KJ,et al.Developmental and adult GAP-43 deficiency in mice dynamically alters hippocampal neurogenesis and mossy fiber volume[J].Dev Neurosci,2014,36(1):44-63.
[8]王富鸿.长期不同负荷运动对大鼠学习记忆能力及海马GAP-43基因表达的影响[D].成都:成都体育学院,2012.
[9]De Moliner K,Wolfson M,Perrone-Bizzozero N,et al.GAP-43 slows down cell cycle progression via sequences in its 3'UTR[J].Arch Biochem Biophys,2015,571:66-75.
[10]Shi WQ,Zheng GY,Chen XD,et al.The expression of bFGF,GAP-43 and neurogenesis after cerebral ischemia/reperfusion in rats[J].Zhongguo Ying Yong Sheng Li Xue Za Zhi,2013,29(1):63-67.
[11]孙竹梅,赵雅宁,李建民,等.不同强度运动对脑缺血再灌注大鼠学习能力及氧自由基代谢的影响[J].中国康复理论与实践,2015,21(1): 26-30.
[12]Tikhomirova MS,Karpenko MN,Kirik OV,et al.GAP-43 and its proteolytic fragment in spinal cord cells of rats with experimental autoimmune encephalomyelitis[J].Ross Fiziol Zh Im I M Sechenova,2015,101(1):74-84.
[13]Westmoreland SV,Annamalai L,Lentz MR,et al.Growth associated protein-43 and ephrin b3 induction in the brain of adult SIV-infected rhesus macaques[J].J Neurovirol,2011,17(5):455-468.
[14]唐强,朱路文,邢艳丽,等.针康法对脑缺血大鼠运动功能及GAP-43、Nogo-A表达的影响[J].针灸临床杂志,2015,31(1):55-57.
[15]Wälchli T,Pernet V,Weinmann O,et al.Nogo-A is a negative regulator of CNS angiogenesis[J].Proc Natl Acad Sci U S A,2013,110(21): E1943-E1952.
[16]Enkel T,Berger SM,Schönig K,et al.Reduced expression of nogo-A leads to motivational deficits in rats[J].Front Behav Neurosci,2014,8: 10.
[17]金其贯,吴尚琳,王云峰,等.低氧和运动训练对大鼠学习记忆能力的影响及其与海马突触可塑性的关系[J].体育科学,2015,35(1):54-59.
[18]徐成成,张鹏飞,丁新生,等.淫羊藿苷对脑缺血大鼠PTEN和GAP-43蛋白表达的影响[J].中风与神经疾病杂志,2015,32(1):4-7.
[19]伍芳,龚标,李学智,等.电针对局灶性脑梗死大鼠Nogo-A及其受体NgR和运动诱发电位的影响[J].第三军医大学学报,2013,35(3): 228-232.
[20]Dupuis L,Pehar M,Cassina P,et al.Nogo receptor antagonizes p75NTR-dependent motor neuron death[J].Proc Natl Acad Sci U S A,2008,105(2):740-745.
[21]崔乃松.针康法对脑缺血大鼠运动功能及缺血区皮质Nogo-A表达的影响[D].哈尔滨:黑龙江中医药大学,2013.
[22]刘丽星.三七总皂苷调节MCAO大鼠Nogo-A/RhoA通路及保护AP25-35诱导SH-SY5Y细胞损伤的机制[D].北京:北京中医药大学,2014.
[23]李超,温红梅,窦祖林,等.运动训练对脑梗死大鼠运动功能及Nogo-A/NgR1/Rho-A表达的影响[J].中国康复医学杂志,2013,28(10): 894-903.
Effect of Aerobic Exercise Preconditioning on Growth-associated Protein-43 and Nogo-A in Rats after Cerebral Ischemia/Reperfusion
SUN Zhu-mei1,LI Jian-min1,WANG Guo-li1,ZHAO Ya-ning1,CHEN Chang-xiang1,ZHAO Xu1,WANG Jing2
1.North China University of Science and Technology,Tangshan,Hebei 063000,China;2.Kailuan General Hospital,Tangshan,Hebei 063000,China
Correspondence to ZHAO Ya-ning.E-mail:zyning789@126.com
Objective To observe the effect of aerobic exercise preconditioning on growth-associated protein-43(GAP-43)and Nogo-A in rats after cerebral ischemia/reperfusion.Methods Sprague-Dawley rats were equally divided into sham group(n=40),cerebral ischemia/ reperfusion group(n=40)and aerobic exercise preconditioning group(n=40),and global cerebral ischemia model was formed with modified four-vessel occlusion.The rats was sacrificed six hours,one day,three days and seven days after ischemia,respectively.The hippocampus neural cells were observed in five rats with HE staining and immunohistochemistry of GAP-43 and Nogo-A,and the other five rats were tested with RT-PCR of GAP-43 and Nogo-A.Results Compared with those in the cerebral ischemia/reperfusion group,the apoptotic neurons and expression of GAP-43 significantly increased all the time points in the aerobic exercise preconditioning group(P<0.01),while the expression of Nogo-A decreased(P<0.01).Conclusion Aerobic exercise preconditioning can promote the regeneration of neuronal cells and axon after cerebral ischemia/reperfusion injury,which is related to the regulation of GAP-43 and Nogo-A.
cerebral ischemia/reperfusion;aerobic exercise;growth-associated protein-43;Nogo-A;rats
R743.32
A
1006-9771(2016)07-0759-06
10.3969/j.issn.1006-9771.2016.07.004
1.河北省卫生厅课题(No.ZD2010106);2.唐山市科技计划项目(No.14130220B)。
1.华北理工大学临床医学院,河北唐山市063000;2.唐山市开滦总医院,河北唐山市063000。作者简介:孙竹梅(1988-),女,河北唐山市人,硕士,护师,主要研究方向:神经修复。通讯作者:赵雅宁。E-mail:zyning789@126.com。
2016-02-22
2016-04-14)
