乙酰左旋肉碱对急性脊髓损伤大鼠细胞自噬、凋亡及运动功能的影响①
2016-08-12孟庆峰张明超卢伟毕云龙范仲凯
孟庆峰,张明超,卢伟,毕云龙,范仲凯
乙酰左旋肉碱对急性脊髓损伤大鼠细胞自噬、凋亡及运动功能的影响①
孟庆峰1,2,张明超1,卢伟1,毕云龙1,范仲凯1
目的旨在检测乙酰左旋肉碱(ALC)对大鼠急性脊髓损伤(SCI)后微管相关蛋白1轻链3(LC3)-Ⅱ、细胞凋亡及运动功能的影响。方法成年雌性Sprague-Dawley大鼠36只随机分为假手术组(Sham组)、单纯脊髓损伤组(SCI组)、ALC治疗组,每组12只。Allen法建立大鼠T10脊髓损伤模型。损伤后3 d行BBB运动评分;取脊髓组织,Western blotting和免疫荧光标记技术检测LC3-Ⅱ表达,TUNEL法观察细胞凋亡。结果与Sham组相比,SCI组LC3-Ⅱ明显升高(P<0.01),细胞凋亡显著增加(P<0.001),BBB评分显著降低(P<0.001);与SCI组相比,ALC组LC3-Ⅱ显著升高(P<0.001),细胞凋亡显著降低(P<0.001),BBB评分明显提高(P<0.01)。结论ALC可能通过增强大鼠脊髓损伤后细胞自噬,减少细胞凋亡,促进大鼠运动功能恢复。
急性脊髓损伤;乙酰左旋肉碱;自噬;凋亡;大鼠
[本文著录格式]孟庆峰,张明超,卢伟,等.乙酰左旋肉碱对急性脊髓损伤大鼠细胞自噬、凋亡及运动功能的影响[J].中国康复理论与实践,2016,22(7):754-758.
CITED AS:Meng QF,Zhang MC,Lu W,et al.Effects of acetyl-l-carnitine on autophagy,apoptosis,and locomotor function after acute spinal cord injury in rats[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(7):754-758.
急性脊髓损伤(acute spinal cord injury,ASCI)是一个全球性医学难题,严重危害人类健康。脊髓损伤是一个复杂的病理生理过程,近年来研究表明,细胞自噬作为全身应激反应的重要组成部分[1],在脊髓损伤后脊髓神经元中明显增强[2],对脊髓损伤的发生发展起着重要作用[3-4]。细胞自噬是细胞利用溶酶体降解自身受损细胞器和大分子物质并再循环利用的过程,在细胞的存活、分化及稳态中发挥关键作用,是真核细胞特有的生命现象[5]。乙酰左旋肉碱(acetyl-L-carnitine,ALC)可以通过血脑屏障[6],能促进脂肪酸进入线粒体,在能量代谢中发挥着重要作用。有研究证实ALC在脊髓损伤中保护运动神经元[7-9]。本研究检测ALC对大鼠ASCI后细胞自噬及凋亡的影响,旨在探究ALC对大鼠ASCI保护作用的机制。
1材料与方法
1.1主要材料与仪器
ALC:SIGMA-ALDRICH。微管相关蛋白1轻链3(light chain 3,LC3)-Ⅱ抗体2775S:CELL SIGNALING TECHNOLOGY公司。鼠来源β-Actin(C4)sc-47778、山羊抗小鼠IgG-HRP sc-2005、山羊抗兔IgG-HRP sc-2004:SANTA CRUZ公司。IFKine Red AffiniPure Donkey Anti-Rabbit IgG(H+L)A24421:ABBKINE公 司 。 NormalDonkeySerum017-000-121:JACKSON IMMUNORESEARCH公司。增强型ECL化学发光检测试剂盒WBKLS0100、PVDF膜:MILLIPORE公司。In Situ Cell Death Detection Kit,TMR red 12156792910:ROCHE。OCT 4583:美国樱花SAKURA公司。电泳仪、全自动酶标仪:BIO-RAD公 司 。 Dounce匀 浆 器 : WHEATEN。-80℃超低温冰箱:THERMO公司。高速冷冻离心机:EPPENDORF公司。BT100-1L蠕动泵:保定兰格恒流泵有限公司。冰冻切片机、荧光显微镜DMI4000B:LEICA公司。
1.2实验动物与分组
健康雌性Sprague-Dawley大鼠36只,体质量250~300 g,由辽宁医学院实验动物中心提供。大鼠适应性喂养1周后,采用随机数字表法分为假手术组(Sham组)、单纯脊髓损伤组(SCI组)、ALC治疗组(ALC组),每组12只。Sham组只暴露T10节段脊髓,不打击。SCI组、ALC组采用Allen方法制备ASCI模型[10]。SCI组和ALC组在脊髓打击后15 min分别腹腔注射生理盐水或ALC 300 mg/kg[9]。各组大鼠均分为两个亚组,每个亚组6只,于损伤后3 d,一亚组检测大鼠Basso-Beattle-Bresnahan(BBB)运动评分[11]和Western blotting法检测LC3-Ⅱ,另一亚组免疫荧光标记技术检测LC3-Ⅱ和TUNEL法观察细胞凋亡情况。
1.3模型制备
大鼠戊巴比妥钠40 mg/kg腹腔注射麻醉,俯卧位固定于手术台上,定位T10棘突位置。背部正中剃毛,暴露皮肤,常规消毒,铺无菌洞巾,切开皮肤;刀柄分离棘突两侧肌肉,暴露棘突及椎弓板;咬骨钳咬除棘突及椎板,暴露T10节段脊髓,保证硬脊膜完整。采用Allen打击器[10],能量20 g×2.5 cm,出现脊髓充血、双下肢痉挛抖动、尾巴痉挛性摆动,视为造模成功。逐层缝合肌肉和皮肤。
1.4BBB评分
造模后3 d,将动物置于宽阔活动场地自由活动5 min,观察其后肢运动情况,左右两侧分别评分,取平均值。由不参与动物分组与治疗但熟悉评分标准的2位观察者同时独立评分,取平均值。
1.5Western blotting
BBB评分后,大鼠戊巴比妥钠40 mg/kg腹腔注射麻醉,快速取脊髓节段T9-11,生理盐水冲洗干净。BCA法测蛋白浓度,10%SDS-PAGE电泳分离,转印至PVDF膜;1%BSA室温封闭1 h,分别加LC3-Ⅱ一抗(1∶1000)、β-Actin一抗(1∶1000)4℃孵育过夜;TBST充分洗膜;山羊抗兔和山羊抗小鼠IgG二抗(1∶2000)室温孵育2 h;TBST充分洗膜;增强型ECL化学液发光,凝胶成像系统曝光。用Image J软件分析LC3-Ⅱ和β-Actin的灰度值,计算其比值。
1.6免疫荧光标记检测
造模后3 d,大鼠4%多聚甲醛灌流固定,取T9-11节段,30%蔗糖脱水2 d。每段脊髓组织取打击点为中心4 mm,冷冻切片机中包埋后连续横行切片,厚5 μm。加正常驴血清封闭1 h,滴加LC3-Ⅱ一抗(1∶500),4℃孵育过夜。加入荧光二抗标记的驴抗兔IgG(1∶500),4℃孵育过夜。DAPI染色2 min,洗片,甘油封片。避光条件下于荧光显微镜下观察。每段脊髓组织取6张切片,在40×10倍视野下随机选不重叠的6个视野,计数LC3-Ⅱ阳性细胞占总细胞的比例。
1.7荧光TUNEL检测
冰冻切片方法同上。组织切片按照荧光TUNEL试剂盒操作,荧光显微镜下观察。每张切片在40×10倍视野下随机选取打击周边区不重叠的6个视野,计数凋亡细胞数(胞核呈红色)和细胞总数(胞核呈蓝色),计算凋亡细胞占总细胞的比例。
1.8统计学分析
采用SPSS 19.0软件包进行统计学分析。所得数据均以(±s)表示。多组间比较采用单因素方差分析,两两比较采用LSD-t检验。显著性水平α=0.01。
2结果
2.1Western blotting
与Sham组相比,SCI组LC3-Ⅱ蛋白表达显著升高(P<0.001);与SCI组相比,ALC组LC3-Ⅱ蛋白表达显著升高(P<0.001)。见图1、表1。
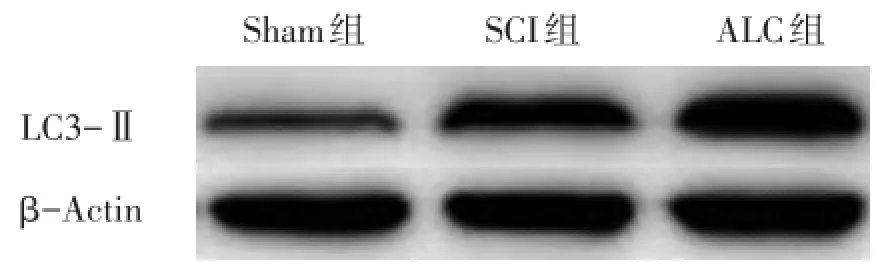
图1 各组大鼠LC3-Ⅱ蛋白表达
2.2LC3-Ⅱ免疫荧光
各组脊髓切片内均可见LC3-Ⅱ阳性表达。与Sham组相比,SCI组LC3-Ⅱ阳性细胞比升高(P<0.01);与SCI组相比,ALC组LC3-Ⅱ阳性细胞比显著升高(P<0.001)。见图2、表1。
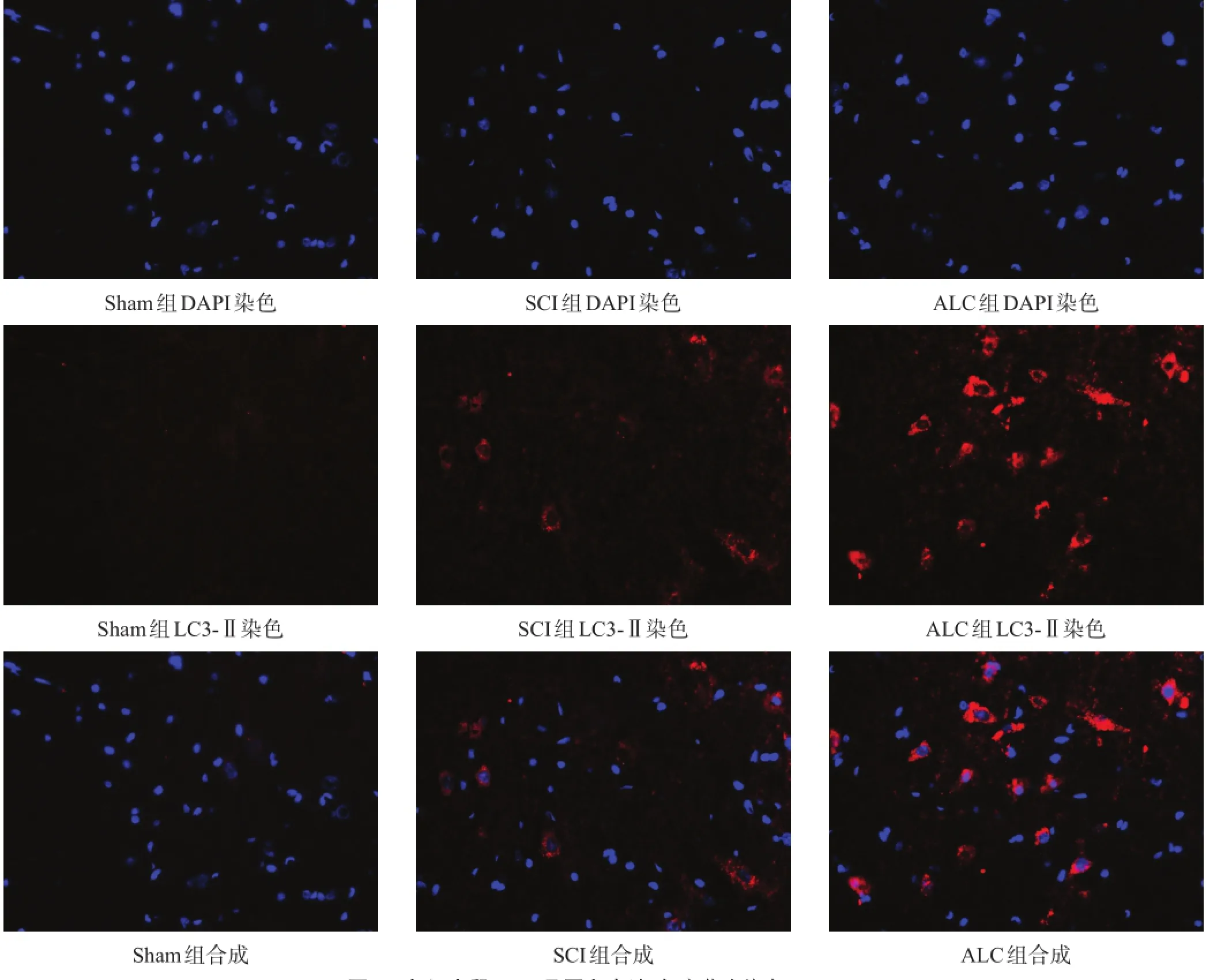
图2 各组大鼠LC3-Ⅱ蛋白表达(免疫荧光染色,400×)
2.3TUNEL免疫荧光
各组脊髓切片内均可见凋亡细胞。与Sham组相比,SCI组凋亡细胞比显著增多(P<0.001);与SCI组相比,ALC组凋亡细胞比显著降低(P<0.001)。见图3、表1。
2.4BBB评分
损伤前,各组大鼠BBB评分均为21.00分。与Sham组相比,SCI组BBB评分显著降低(P<0.001);与SCI组相比,ALC组BBB评分明显升高(P<0.01)。
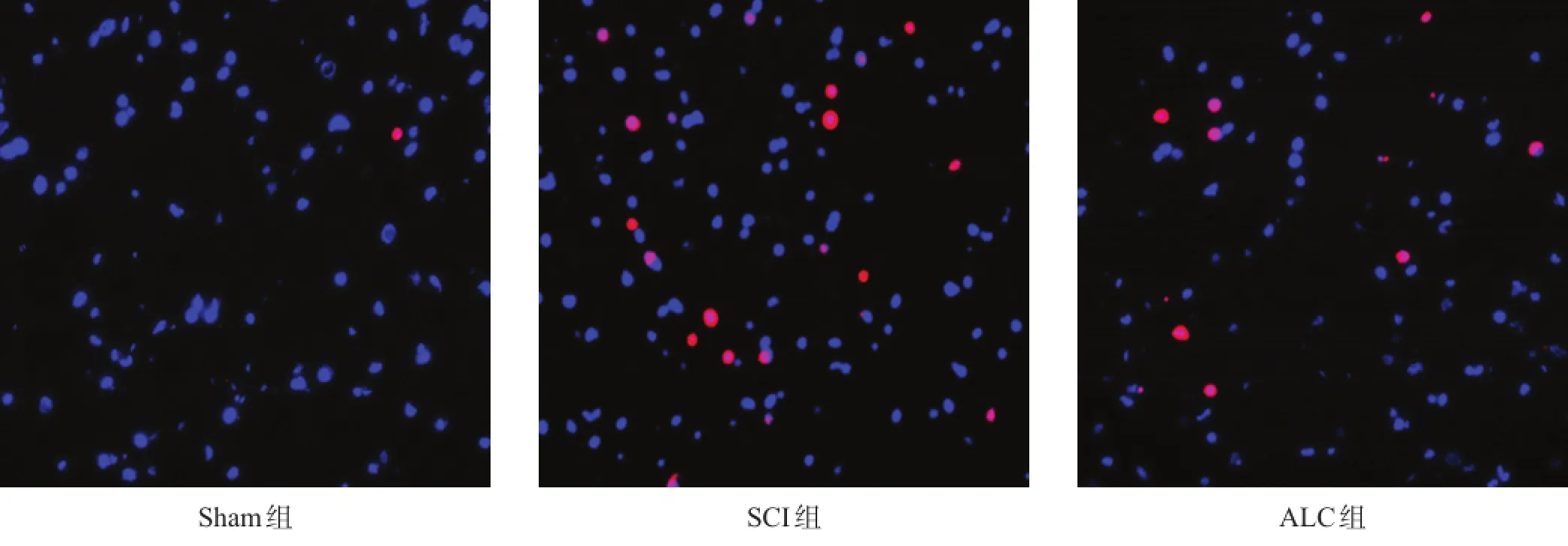
图3 各组大鼠细胞凋亡情况(TUNEL染色,400×)
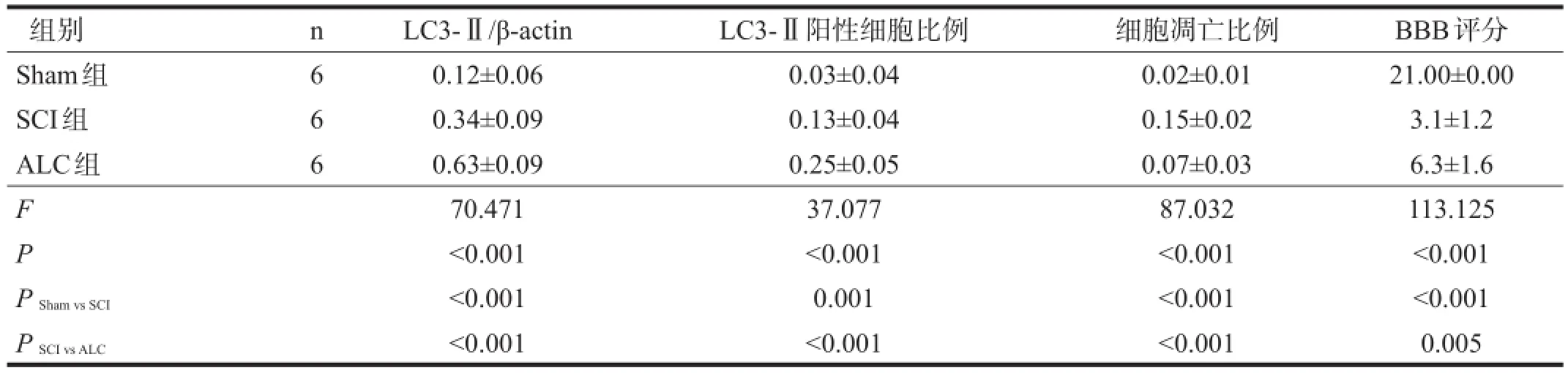
表1 各组LC3-Ⅱ表达、细胞凋亡及BBB评分比较
3讨论
细胞自噬将细胞内无用的长寿命蛋白质、细胞器等运送至溶酶体,降解成有生物活性的小分子,并重新利用,从而维持细胞内环境稳定[5]。正常情况下,细胞自噬低水平表达;而当机体内环境稳态发生变化或受到外界各种刺激时,自噬水平上调。细胞通过此过程清除胞内有害或过剩的细胞器以及异物,同时提高细胞对低氧、能量短缺的耐受力,对细胞起一定的保护作用[12]。
近来许多研究证实自噬在神经系统损伤短期内的神经保护作用。Zhang等发现,脑外伤后细胞自噬被激活,在急慢性期均发挥神经细胞损伤与修复的作用[13]。Erlich等研究显示,脑损伤后,增强自噬可以减少神经细胞凋亡及退行性病变[14]。Sekiguchi等发现,增强自噬可以明显减轻大鼠脊髓损伤后神经组织损伤,显著恢复神经功能[15]。
自噬体膜上标志性蛋白质包括LC3、Atg12与Atg5复合体等,其中LC3-Ⅰ和LC3-Ⅱ蛋白是由哺乳动物中酵母Atg8基因的同源物编码的蛋白,参与细胞自噬过程中自噬体的形成。当细胞发生自噬时,LC3-Ⅰ与磷脂酰乙醇胺结合,形成LC3-Ⅱ,进而定位于自噬体膜上,其含量多少与自噬体数目成正比,因此LC3-Ⅰ/Ⅱ是目前公认检测细胞自噬的最重要标志蛋白,是观察细胞自噬现象、研究自噬活性最可靠的指标[3,16]。本研究显示,大鼠脊髓损伤后3 d,LC3-Ⅱ表达明显增高,表明脊髓组织内细胞自噬被激活,支持Yu等的研究[17]。
ALC是线粒体内膜的组成部分,包含乙酰基和左旋肉碱两部分。左旋肉碱在人的大脑、肝脏和肾脏中合成[18]。ALC可以穿过血-脑屏障[19],并在大脑缺血再灌注损伤中发挥神经保护作用[20-21]。最近研究发现,ALC在脊髓损伤中明显发挥着神经保护作用[8-9],但保护机制尚不明确。本研究显示,ALC可提高大鼠脊髓损伤后细胞自噬水平,也明显抑制细胞凋亡。支持Levine等的研究[12]。结合BBB评分,ALC可能通过促进大鼠急性脊髓损伤后细胞自噬,抑制细胞凋亡,从而减轻神经损伤,促进运动功能恢复。
综上所述,ALC可能通过促进细胞自噬发挥抑制细胞凋亡来促进运动功能恢复。这为脊髓损伤的临床药物靶点治疗提供了重要的线索,给脊髓损伤患者带来了希望。干预细胞自噬可能成为未来治疗脊髓损伤的新方法。
[1]Kroemer G,Marino G,Levine B.Autophagy and the integrated stress response[J].Mol Cell,2010,40(2):280-293.
[2]Kanno H,Ozawa H,Sekiguchi A,et al.Spinal cord injury induces upregulation of beclin 1 and promotes autophagic cell death[J].Neurobiol Dis,2009,33(2):143-148.
[3]Hou H,Zhang L,Tang P.Acute spinal cord injury in rats should target activated autophagy[J].J Neurosurg Spine,2014,20(5):568-577.
[4]Kanno H,Ozawa H,Sekiguchi A,et al.The role of autophagy in spinal cord injury[J].Autophagy,2009,5(3):390-392.
[5]Klionsky DJ,Emr SD.Autophagy as a regulated pathway of cellular degradation[J].Science,2000,290(5497):1717-1721.
[6]Parnetti L,Gaiti A,Mecocci P,et al.Pharmacokinetics of iv and oral acetyl-l-carnitine in a multiple dose regimen in patients with senile dementia of alzheimer type[J].Eur J Clin Pharmacol,1992,42(1):89-93.
[7]Karalija A,Novikova LN,Kingham PJ,et al.Neuroprotective effects of n-acetyl-cysteine and acetyl-l-carnitine after spinal cord injury in adult rats[J].PLoS One,2012,7(7):e41086.
[8]Patel SP,Sullivan PG,Lyttle TS,et al.Acetyl-l-carnitine treatment following spinal cord injury improves mitochondrial function correlated with remarkable tissue sparing and functional recovery[J].Neuroscience,2012,210:296-307.
[9]Patel SP,Sullivan PG,Lyttle TS,et al.Acetyl-l-carnitine ameliorates mitochondrial dysfunction following contusion spinal cord injury[J].J Neurochem,2010,114(1):291-301.
[10]Li G,Jia Z,Cao Y,et al.Mitochondrial division inhibitor 1 ameliorates mitochondrial injury,apoptosis,and motor dysfunction after acute spinal cord injury in rats[J].Neurochem Res,2015,40(7):1379-1392.
[11]Basso DM,Beattie MS,Bresnahan JC.A sensitive and reliable locomotor rating scale for open field testing in rats[J].J Neurotrauma,1995,12(1):1-21.
[12]Levine B,Klionsky DJ.Development by self-digestion:Molecular mechanisms and biological functions of autophagy[J]. Dev Cell,2004,6(4):463-477.
[13]Zhang YB,Li SX,Chen XP,et al.Autophagy is activated and might protect neurons from degeneration after traumatic brain injury[J].Neurosci Bull,2008,24(3):143-149.
[14]Erlich S,Alexandrovich A,Shohami E,et al.Rapamycin is a neuroprotective treatment for traumatic brain injury[J].Neurobiol Dis,2007,26(1):86-93.
[15]Sekiguchi A,Kanno H,Ozawa H,et al.Rapamycin promotes autophagy and reduces neural tissue damage and locomotor impairment after spinal cord injury in mice[J].J Neurotrauma,2012,29(5):946-956.
[16]Levine B,Kroemer G.Autophagy in the pathogenesis of disease[J].Cell,2008,132(1):27-42.
[17]Yu D,Li M,Ni B,et al.Induction of neuronal mitophagy in acute spinal cord injury in rats[J].Neurotox Res,2013,24(4): 512-522.
[18]Acetyl-l-carnitine[J].Altern Med Rev,1999,4(6):438-441.
[19]Petruzzella V,Baggetto LG,Penin F,et al.In vivo effect of acetyl-l-carnitine on succinate oxidation,adenine nucleotide pool and lipid composition of synaptic and non-synaptic mitochondria from cerebral hemispheres of senescent rats[J].Arch Gerontol Geriatr,1992,14(2):131-144.
[20]Martin E,Rosenthal RE,Fiskum G.Pyruvate dehydrogenase complex:Metabolic link to ischemic brain injury and target of oxidative stress[J].J Neurosci Res,2005,79(1-2):240-247.
[21]Liu K,Sun Y,Gu Z,et al.Mitophagy in ischaemia/reperfusion induced cerebral injury[J].Neurochem Res,2013,38(7): 1295-1300.
Effects of Acetyl-l-carnitine on Autophagy,Apoptosis,and Locomotor Function afterAcute Spinal Cord Injury in Rats
MENG Qing-feng1,2,ZHANG Ming-chao1,LU Wei1,BI Yun-long1,FAN Zhong-kai1
1.Department of Orthopedics,First Affiliated Hospital of Liaoning Medical College,Jinzhou,Liaoning 121001,China;2.Department of Orthopedics,Fushun Central Hospital,Fushun,Liaoning 113006,China
Correspondence to FAN Zhong-kai.E-mail:fanzk_ln@163.com
Objective To observe the effects of acetyl-l-carnitine(ALC)on autophagy,apoptosis and motor function after acute spinal cord injury(ASCI)in rats.Methods Thirty-six adult female Sprague-Dawley rats were randomly divided into sham operation group(Sham group,n=12),simple spinal cord injury group(SCI group,n=12),ALC treatment group(ALC group,n=12).Spinal cord injury model at the level of T10segment was established using Allen's method.They were assessed with Basso-Beattle-Bresnahan(BBB)scale three days after injury.Then the rats were sacrificed,and the expression of microtubule associated protein 1 light chain 3(LC3)-II in spinal cord was detected with Western blotting and immunofluorescent labeling,and the number of apoptotic cells were assessed with TUNEL staining.Results The expression of LC3-II and the number of apoptotic cells increased in SCI group compared with those in Sham group(P<0.01),while the BBB score decreased(P<0.001).The expression of LC3-II increased and the number of apoptotic cells decreased in ALC group compared with those in SCI group(P<0.001),while the BBB score increased(P<0.01).Conclusion ALC may promote autophagy,and inhibit apoptosis to improve the locomotor function afterASCI.
acute spinal cord injury;acetyl-l-carnitine;autophagy;apoptosis;rats
10.3969/j.issn.1006-9771.2016.07.003
R651.2
A
1006-9771(2016)07-0754-05
1.辽宁省高等学校优秀人才支持计划项目(No.LJQ2014091);2.辽宁医学院校长基金项目(No.XZJJ20130204)。
1.辽宁医学院附属第一医院骨科,辽宁锦州市121001;2.抚顺市中心医院骨科,辽宁抚顺市113006。作者简介:孟庆峰(1976-),男,汉族,辽宁抚顺市人,硕士研究生,副主任医师,主要研究方向:脊髓损伤机制及治疗。通讯作者:范仲凯,男,副教授。E-mail:fanzk_ln@ 163.com。
2016-02-29
2016-04-28)
