褪黑素对脊髓损伤大鼠突触可塑性的作用①
2016-08-12荆瀛黎刘小野白帆董浩陈惠
荆瀛黎,刘小野,白帆,董浩,陈惠
褪黑素对脊髓损伤大鼠突触可塑性的作用①
荆瀛黎1,2,3,4,刘小野5,白帆1,2,3,4,董浩1,2,3,4,陈惠1,2,3,4
目的探讨褪黑素对脊髓损伤后突触可塑性的影响。方法雌性Sprague-Dawley大鼠54只分为假手术组(n=18)、对照组(n=18)和褪黑素组(n=18)。采用改良Allen法复制大鼠T10中度损伤模型(10 g×25 mm)。免疫荧光法检测运动神经元数目,尼氏染色检测神经元中尼氏小体表达;Western blotting检测神经纤维丝-200(NF-200)、脑源性神经营养因子(BDNF)、突触素Ⅰ和神经生长相关蛋白-43(GAP-43)的表达。结果术后7 d,与假手术组相比,对照组、褪黑素组运动神经元数、神经元中尼氏小体、NF-200、BDNF、突触素Ⅰ和GAP-43表达下降;与对照组相比,褪黑素组运动神经元数、神经元中尼氏小体、NF-200、BDNF、突触素Ⅰ和GAP-43的表达明显增加(P<0.01)。结论褪黑素能够修复损伤的突触可塑性,可能是促进运动功能恢复的机制。
脊髓损伤;突触可塑性;褪黑素;大鼠
[本文著录格式]荆瀛黎,刘小野,白帆,等.褪黑素对脊髓损伤大鼠突触可塑性的作用[J].中国康复理论与实践,2016,22(7): 774-778.
CITED AS:Jing YL,Liu XY,Bai F,et al.Effects of melatonin on synaptic plasticity after spinal cord injury in rats[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(7):774-778.
突触是神经环路中相邻神经元之间进行信息传递和加工的关键结构;在中枢神经系统中,整个神经元表面积60%~80%被突触所占据[1-2]。突触可塑性是指突触连接在形态和功能上的修饰,主要是指突触在一定条件下调整功能、改变形态和增减数目的能力,包括突触传递效能的变化和突触结构的改变[3-4]。目前对脊髓损伤的研究主要集中在损伤后脊髓神经功能的修复和重建,其中对突触可塑性的研究已成为神经康复领域的热点和重点。
褪黑素是由松果体分泌的一种分布广泛的吲哚胺类神经递质化合物,具有强大的调节免疫内分泌、抗炎、抗氧化、抗肿瘤、抗衰老等功能。褪黑素在脑损伤和脊髓损伤模型中有神经保护作用[5-6]。本研究选择与突触可塑性密切相关的神经元细胞结构,检测褪黑素对神经纤维丝-200(neurofilament-200,NF-200)、脑源性神经营养因子(brain-derived neurotrophic factors,BDNF)、突触素Ⅰ(synapsin I)、生长相关蛋白-43 (growth-associated protein-43,GAP-43)等的影响,为临床褪黑素治疗脊髓损伤及其继发性损伤提供理论依据。
1材料与方法
1.1主要试剂
褪黑素(Melatonin):美国SIGMA公司,用1%乙醇配成10 mg/ml。兔单克隆NeuN抗体、兔多克隆NF-200抗体、兔多克隆突触素Ⅰ抗体、兔多克隆GAP-43抗体:美国ABCAM公司。FITC-标记的山羊抗兔抗体:美国INVITROGEN公司。HRP-标记的山羊抗兔二抗:美国SANTACRUZ公司。
1.2实验动物和分组
SPF级健康雌性Sprague-Dawley大鼠54只,体质量(200±20)g,购自首都医科大学实验动物中心,许可证号SCXK(京)2012-0001。饲养于有空调的房间,人工控制光照12 h∶12 h光/暗周期,温度(22±2)℃,相对湿度(55±10)%。食物和水自行摄取。分为假手术组、对照组和褪黑素组,每组18只。实验方案已获得首都医科大学实验动物伦理委员会批准。
1.3方法
1.3.1模型制备
采用改良Allen打击装置制作中度脊髓损伤模型。大鼠苯巴比妥钠35 mg/kg腹腔注射麻醉,俯卧位固定在手术台上,备皮,常规消毒,以T10为中心行后正中线纵行切口,显露T9-11棘突及椎板,切除T10椎板。以脊髓后正中血管为中心,10 g打击棒自25 mm高自由落下撞击T10脊髓,并压迫脊髓1 min。打击后鼠尾出现无规则痉挛性摆动、大鼠损伤平面以下完全瘫痪为成功标志。术毕用青霉素盐水冲洗伤口,逐层缝合组织。早晚各按压排尿1次,直至恢复排尿反射。
假手术组只切除椎板,不打击脊髓。
术后30 min内,褪黑素组予褪黑素10 mg/kg腹腔注射,对照组予同体积1%乙醇。每天2次,共7 d。假手术组不给药。
1.3.2运动功能评定
分别在损伤后1 d、2 d、3 d、4 d和7 d对各组大鼠采用BBB评分法[7]进行评分。
1.3.3免疫荧光染色
术后7 d,各组取6只大鼠,苯巴比妥钠35 mg/kg腹腔注射麻醉。4%PFA灌流,取出脊髓,4%PFA后固定4 h,30%蔗糖脱水过夜。冰冻切片机切片,厚20 μm。PBS漂洗玻片;4%BSA 37℃封闭非特异性抗原30 min;加兔单克隆NeuN抗体(1∶100),4℃过夜;PBS漂洗玻片;加FITC-标记的山羊抗兔抗体(1 ∶100),37℃孵育60 min;漂洗玻片;加入防淬灭剂,荧光显微镜下观察、拍照。
1.3.4尼氏染色
同前法取材,冰冻切片;梯度酒精分别脱水1 min;蒸馏水浸洗玻片2次;0.1%焦油紫染液37℃水浴120 min;蒸馏水浸洗玻片3次;冰醋酸乙醇(0.75 ml∶300 ml)分色2 min;100%酒精脱水4 min;二甲苯透明4 min;中性树胶封片;显微镜下观察,拍照。
1.3.5Western blotting
各组6只大鼠,苯巴比妥钠35 mg/kg腹腔注射麻醉,以打击点为中心取脊髓组织1 cm,剪碎,加裂解液冰浴60 min。14000 g离心10 min,BCA法定量蛋白。样品于12%SDS-PAGE凝胶电泳分离,转至PVDF膜,加兔多克隆NF-200抗体、兔多克隆突触素Ⅰ抗体、兔多克隆GAP-43抗体,结合上含有辣根过氧化酶的抗兔IgG,ECL显色。ChemiDoc MP System获取图像,以β-actin为内参,Quantity One软件测定条带的相对光密度。
1.3.6图像分析[8]
从损伤中心向前后各延伸0.5 mm,每5张切片取1张,荧光显微镜20倍视野下对脊髓横断面目标位置拍照。用Image Pro Plus 7.0分析NeuN阳性神经元数目和尼氏小体灰度值。
1.4统计学分析
利用SPSS 17.0软件对数据进行统计学分析。计数资料用(±s)表示,符合正态分布的用t检验或单因素方差分析,非正态分布资料用秩和检验。显著性水平α=0.05。
2结果
2.1运动功能
损伤后1~4 d,褪黑素组BBB评分与对照组间无显著性差异(P>0.05);损伤后7 d,褪黑素组BBB评分明显高于对照组(P<0.01)。见表1。
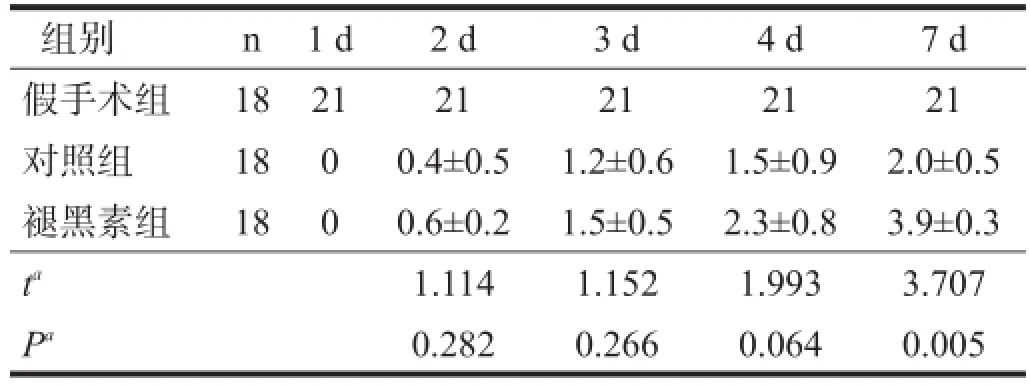
表1 脊髓损伤后7 d内各组BBB评分比较
2.2运动神经元
假手术组脊髓前角运动神经元胞体较大,轴突较多。对照组灰质中NeuN阳性神经元数目降低,大部分出现皱缩,染色质浓染,轴突变性。褪黑素组NeuN阳性神经元数增加。见图1、表2。
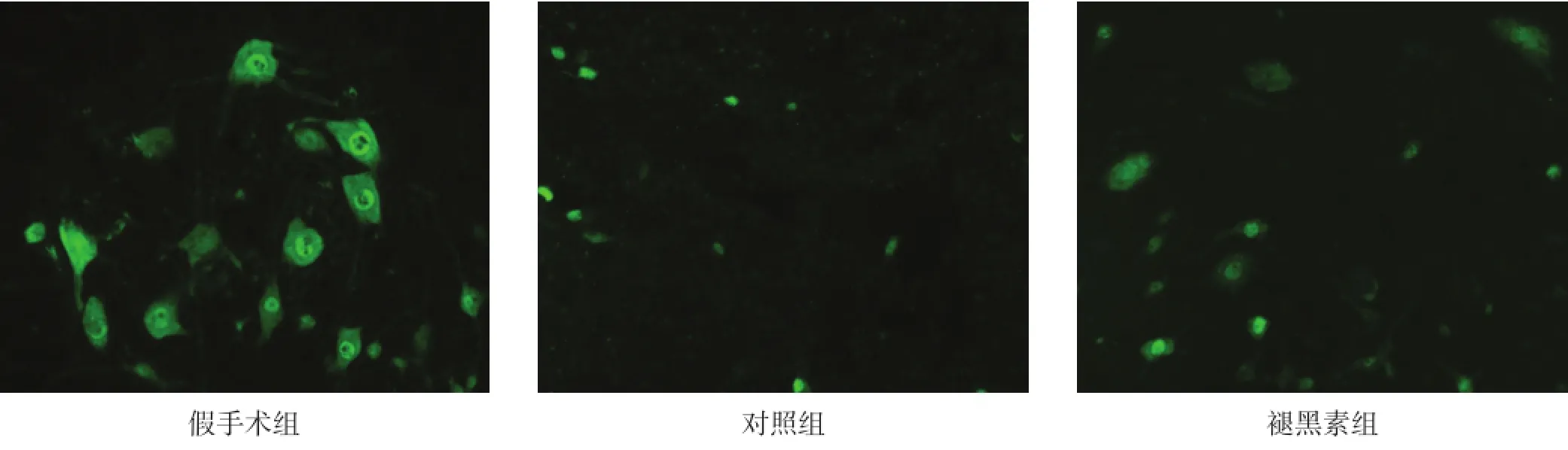
图1 各组脊髓神经元(NeuN染色,20×)
尼氏染色观察,对照组神经元中尼氏小体较假手术组明显减少甚至溶解,染色浅淡或着色不均;褪黑素组尼氏小体有所增加。见图2、表2。
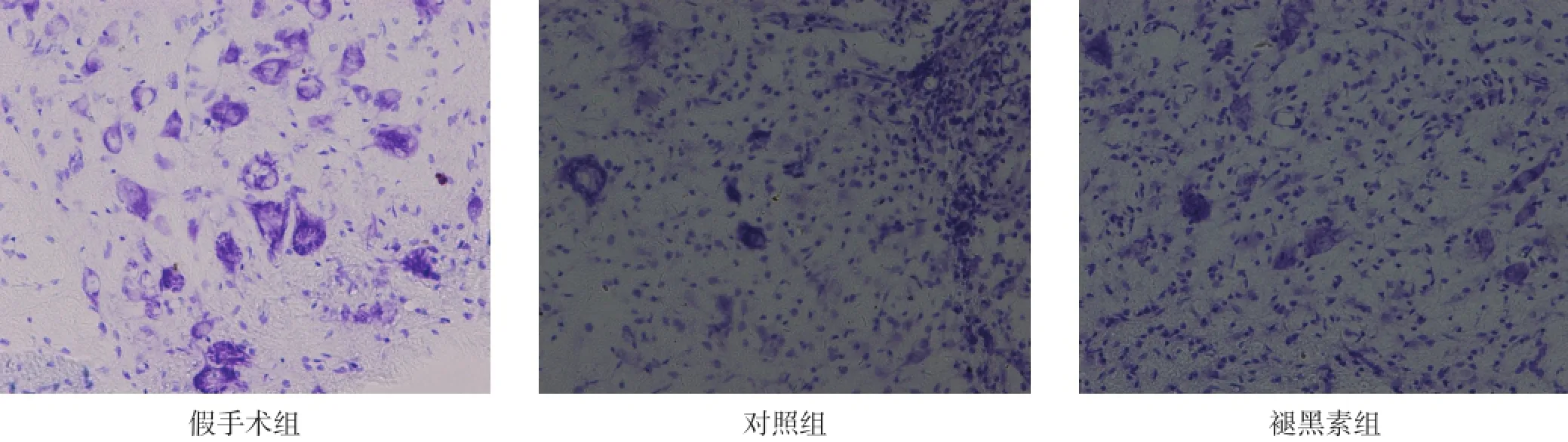
图2 各组脊髓神经元尼氏小体(尼氏染色,20×)
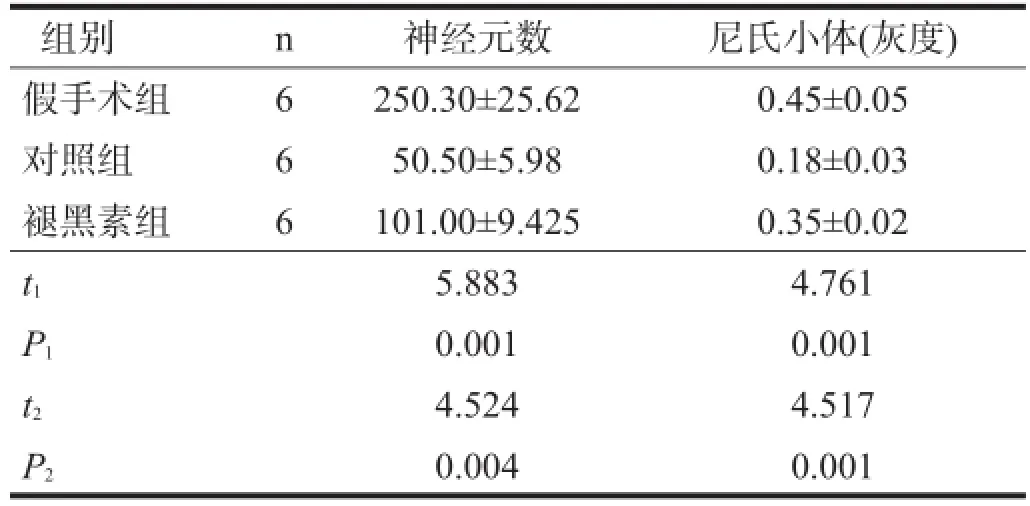
表2 各组运动神经元数及尼氏小体比较
2.3Western blotting
对照组NF-200、BDNF、突触素Ⅰ和GAP-43表达水平较假手术组下降(P<0.05),褪黑素组NF-200、 BDNF、突触素Ⅰ和GAP-43水平较对照组上升(P<0.05)。见图3、表3。
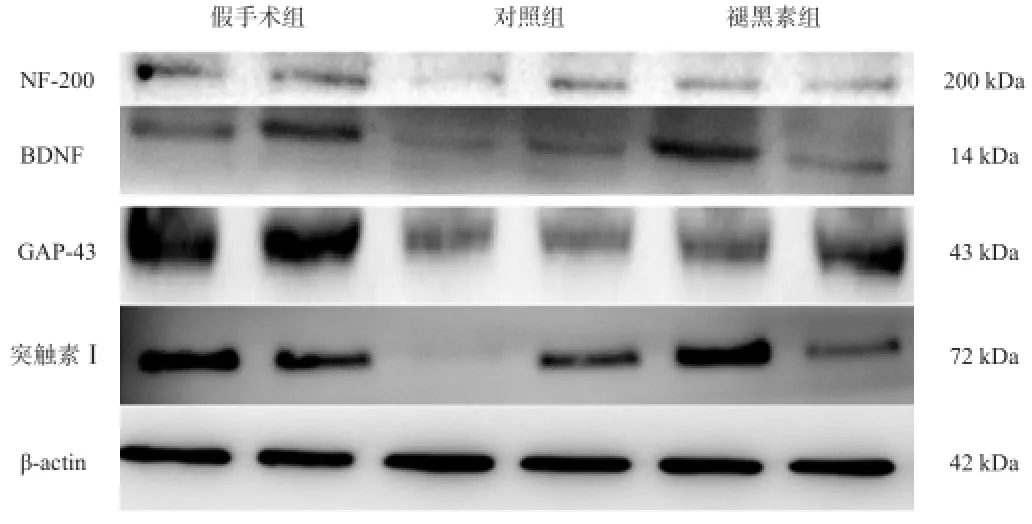
图3 各组Western blotting结果
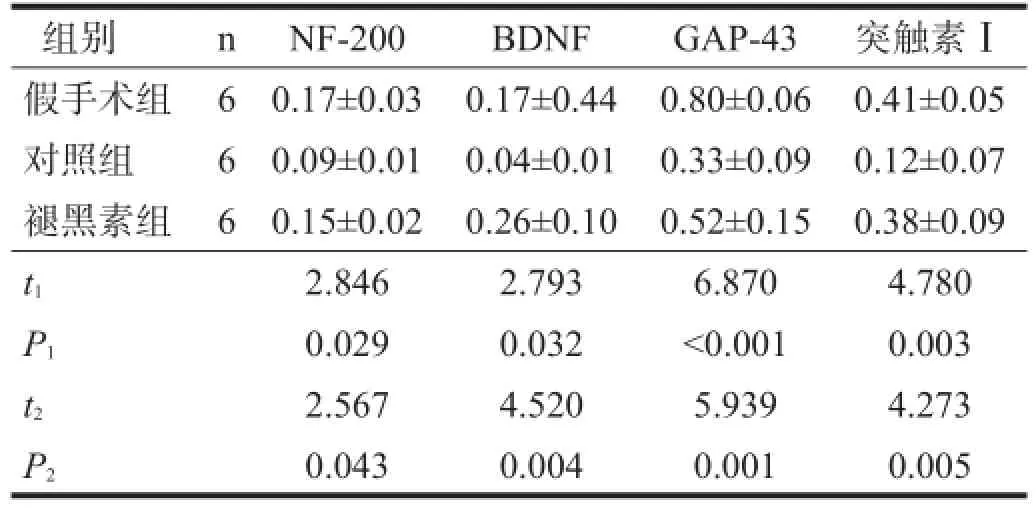
表3 各组Western blotting结果比较(相对光密度)
3讨论
本研究显示,脊髓损伤后,支持神经功能和神经可塑性的分子系统受到削弱;而在损伤后30 min内给予褪黑素能发挥保护作用,促进运动功能恢复,显著增加突触可塑性相关蛋白表达。
尼氏小体的主要功能是合成蛋白质,包括复制细胞器、产生与神经递质有关的蛋白质和酶[9-10]。尼氏小体的多少可以反映神经细胞生物信息传递能力的强弱[11]。脊髓损伤后,前角运动神经细胞合成蛋白质及相关酶的能力明显下降,细胞固缩,结构改变,神经细胞接收和传递信息的能力减弱。给予褪黑素后,大鼠脊髓前角运动神经细胞增加,尼氏小体也随之增加支持褪黑素对神经元的保护作用。
NF是构成神经元胞体和神经轴突细胞骨架的主要成分,在神经系统发育、神经系统损伤后修复及神经退行性疾病中起重要作用[12]。NF基因转录的调控对NF的表达至关重要,尤其是在神经再生和神经退行性疾病中[13]。按相对分子质量,NF可分为NF-68、NF-140和NF-200三种。正常情况下,NF-200只存在于轴突中;轴突损伤后,轴突的延长和重构可以被重新诱导,NF-200是重要的诱导合成蛋白之一[14-15]。研究发现,脊髓损伤后,在多种诱导因子的作用下,损伤区神经元合成大量NF-200,有利于神经再生[15-16]。褪黑素增加脊髓损伤后NF-200表达,改善神经元的形态,在神经系统轴浆运输和可塑性方面发挥重要作用。
脊髓损伤降低损伤区BDNF水平,这可能是多种机制的综合结果,如神经冲动的输入减少、邻近区域的映射降低,BDNF的产生也可能受生长抑制剂如髓鞘相关糖蛋白的影响[17-18]。BDNF是强有力的突触促进剂,也是神经可塑性的启动者[19-22]。GAP-43是轴突再生的标志物,被用于观察中枢神经系统随时间的再生过程,有效的干预可促进GAP-43标记轴突纤维的生长[23-24]。回归分析显示,在脊髓半切模型中,突触素与后肢运动功能的恢复有很强的相关性[25]。本研究显示,褪黑素能有效逆转损伤造成的BDNF、GAP-43和突触素的降低。
因此,褪黑素神经保护作用的重要机制可能涉及突触可塑性的修复。
[1]Menon V,Musial TF,Liu A,et al.Balanced synaptic impact via distance-dependent synapse distribution and complementary expression of AMPARs and NMDARs in hippocampal dendrites[J].Neuron,2013,80(6):1451-1463.
[2]O'Rourke NA,Weiler NC,Micheva KD,et al.Deep molecular diversity of mammalian synapses:why it matters and how to measure it[J].Nat Rev Neurosci,2012,13(6):365-379.
[3]Lohmann C,Kessels HW.The developmental stages of synaptic plasticity[J].J Physiol,2014,592(Pt 1):13-31.
[4]Henley JM,Wilkinson KA.AMPA receptor trafficking and the mechanisms underlying synaptic plasticity and cognitive aging[J].Dialogues Clin Neurosci,2013,15(1):11-27.
[5]Shinozuka K,Staples M,Borlongan CV.Melatonin-based therapeutics for neuroprotection in stroke[J].Int J Mol Sci,2013,14 (5):8924-8947.
[6]Wang Z,Ma C,Meng CJ,et al.Melatonin activates the Nrf2-ARE pathway when it protects against early brain injury in a subarachnoid hemorrhage model[J].J Pineal Res,2012,53 (2):129-137.
[7]Basso DM,Beattie MS,Bresnahan JC.A sensitive and reliable locomotor rating scale for open field testing in rats[J].J Neurotrauma,1995,12(1):1-21.
[8]Loy DN,Crawford CH,Darnall JB,et al.Temporal progression of angiogenesis and basal lamina deposition after contusive spinal cord injury in the adult rat[J].J Comp Neurol,2002,445 (4):308-324.
[9]Wang BG,Zhu QS,Man XX,et al.Ginsenoside Rd inhibits apoptosis following spinal cord ischemia/reperfusion injury[J]. Neural Regen Res,2014,9(18):1678-1687.
[10]Jing L,Wang JG,Zhang JZ,et al.Upregulation of ICAM-1 in diabetic rats after transient forebrain ischemia and reperfusion injury[J].J Inflamm(Lond),2014,11(1):35.
[11]Meng XJ,Wang F,Li CK.Resveratrol is neuroprotective and improves cognition in pentylenetetrazole-kindling model of epilepsy in rats[J].Indian J Pharm Sci,2014,76(2):125-131.
[12]Lin AC,Holt CE.Function and regulation of local axonal translation[J].Curr Opin Neurobiol,2008,18(1):60-68.
[13]Wang HT,Wu MF,Zhan ChN,et al.Neurofilament proteins in axonal regeneration and neurodegenerative diseases[J].Neural Regen Res,2012,7(8):620-626.
[14]Ding P,Liu M,Gu XS,et al.Effect of nerve regeneration factor on GAP-43HE and NF-L gene expression in dorsal root ganglia cell[J].J Chin Pharm Univ,2001,32(3):231-234.
[15]Korshunova I,Mosevitsky M.Role of the growth-associated protein GAP-43 in NCAM-mediated neurite outgrowth[J]. Adv Exp Med Biol,2010,663:169-182.
[16]Emery DL,Royo NC,Fischer I,et al.Plasticity following injury to the adult central nervous system:is recapitulation of a developmental state worth promoting[J].J Neurotrauma,2003,20(12):1271-1292.
[17]Ghiani CA,Ying Z,de Vellis J,et al.Exercise decreases myelin-associated glycoprotein expression in the spinal cord and positively modulates neuronal growth[J].Glia,2007,55(9): 966-975.
[18]Filbin MT.Myelin-associated inhibitors of axonal regeneration in the adult mammalian CNS[J].Nat Rev Neurosci,2003,4(9):703-713.
[19]Tanaka J,Horiike Y,Matsuzaki M,et al.Protein synthesis and neurotrophin-dependent structural plasticity of single dendritic spines[J].Science,2008,319(5870):1683-1687.
[20]Gómez-Pinilla F,Ying Z,Roy RR,et al.Afferent input modulates neurotrophins and synaptic plasticity in the spinal cord[J].J Neurophysiol,2004,92(6):3423-3432.
[21]Gulino R,Gulisano M.Involvement of brain-derived neurotrophic factor and sonic hedgehog in the spinal cord plasticity after neurotoxic partial removal of lumbar motoneurons[J]. Neurosci Res,2012,73(3):238-247.
[22]Chen S,Wu B,Lin J.Effect of intravenous transplantation of bone marrow mesenchymal stem cells on neurotransmitters and synapsins in rats with spinal cord injury[J].Neural Regen Res,2012,7(19):1445-1453.
[23]Chen M,Xiang Z,Cai J.The anti-apoptotic and neuro-protective effects of human umbilical cord blood mesenchymal stem cells(hUCB-MSCs)on acute optic nerve injury is transient[J]. Brain Res,2013,1532:63-75.
[24]Fouad K,Vavrek R,Cho S.A TrkB antibody agonist promotes plasticity following cervical spinal cord injury in adult rats[J]. J Neurotrauma,2010.[Epub ahead of print].
[25]Gulino R,Dimartino M,Casabona A,et al.Synaptic plasticity modulates the spontaneous recovery of locomotion after spinal cord hemisection[J].Neurosci Res,2007,57(6):148-156.
Effects of Melatonin on Synaptic Plasticity after Spinal Cord Injury in Rats
JING Ying-li1,2,3,4,LIU Xiao-ye5,BAI Fan1,2,3,4,DONG Hao1,2,3,4,CHEN Hui1,2,3,4
1.Capital Medical University School of Rehabilitation Medicine,Beijing 100068,China;2.Institute of Rehabilitation Science of China,China Rehabilitation Research Center,Beijing 100068,China;3.Center of Neural Injury and Repair,Beijing Institute for Brain Disorders,Beijing 100068,China;4.Beijing Municipal Key Laboratory for Neural Injury and Rehabilitation,Beijing 100068,China;5.Beijing Friendship Hospital,Capital Medical University,Beijing 100050,China
Correspondence to CHEN Hui.E-mail:chenhui55299@163.com
Objective To observe the effects of melatonin on synaptic plasticity impaired by spinal cord injury in rats.Methods A total of 54 female Sprague-Dawley rats were divided into sham group(n=18),control group(n=18)and melatonin group(n=18).Spinal cord injury model was established with modified Allen's method at T10(10 g from 25 mm height).The number of neurons and the expression of the Nissl body were detected with immunofluorescence and Nissl staining.The expression of neurofilament-200(NF-200),brain-derived neurotrophic factors(BDNF),Synapsin I and growth-associated protein-43(GAP-43)was detected with Western blotting.Results Seven days after injury,the number of motoneurons,the expression of Nissl body in motoneurons,and the expression of BDNF,Synapsin I and GAP-43 decreased in the control group compared with those in the sham group,and they increased in the melatonin group compared with those in the control group.Conclusion Melatonin can repair the impaired synaptic plasticity,which might promote the functional recovery after spinal cord injury.
spinal cord injury;synaptic plasticity;melatonin;rats
10.3969/j.issn.1006-9771.2016.07.007
R651.2
A
1006-9771(2016)07-0774-05
1.北京脑重大疾病研究院科研促进项目(No.PXM2014_014226_000016)11421311;2.神经损伤与康复北京市重点实验室2015年度科技创新基地培育与发展专项项目(No.Z151100001615055);3.中央级公益性科研院所基本科研业务费专项资金项目(No.2015CZ-12)。
1.首都医科大学康复医学院,北京市100068;2.中国康复研究中心中国康复科学所,北京市100068;3.北京脑重大疾病研究院神经损伤与修复研究所,北京市100068;4.神经损伤与康复北京市重点实验室,北京市100068;5.首都医科大学附属北京友谊医院,北京市100050。作者简介:荆瀛黎(1983-),女,山东烟台市人,博士研究生,主要研究方向:病理生理。通讯作者:陈惠(1955-),女,研究员,主要研究方向:神经生物学。E-mail:chenhui55299@163.com。
2015-12-09
2016-03-01)
