高压氧对脑外伤外源性骨髓间充质干细胞归巢的影响①
2016-08-12刘杨丁政唐朝正周苏键卢晓欣彭慧平
刘杨,丁政,唐朝正,周苏键,卢晓欣,彭慧平
高压氧对脑外伤外源性骨髓间充质干细胞归巢的影响①
刘杨1,丁政1,唐朝正1,周苏键2,卢晓欣2,彭慧平1
目的探讨高压氧治疗对脑外伤大鼠外源性骨髓间充质干细胞(BMSCs)归巢的影响。方法采用Ficoll密度梯度离心法分离、培养BMSCs,应用流式细胞仪对第三代BMSCs表面标志CD29、CD90、CD45、CD11b进行鉴定,细胞膜荧光探针CM-DiI对BMSCs进行示踪处理。36只Sprague-Dawley大鼠分为假手术组(A组,n=6)、模型组(B组,n=6)、BMSCs移植组(C组,n=12)、高压氧+BMSCs组(D组,n=12),分别于移植后1 d、3 d取脑组织标本,冰冻切片,荧光显微镜下观察示踪后BMSCs归巢的数量和部位;Western blotting检测基质细胞衍生因子1(SDF-1)及其受体CXCR4的蛋白表达。结果受伤侧大脑半球,尤其是受损脑组织周围,荧光标记BMSCs更为集中;同一时间点D组BMSCs归巢数量明显高于C组(P<0.01);C、D组3 d时BMSCs归巢数量均明显高于1 d时(P<0.01)。D组SDF-1、CXCR4的蛋白表达水平高于C组(P<0.05)。结论高压氧治疗可以促进外源性BMSCs归巢至大鼠受损脑组织,其作用与SDF-1/CXCR4信号轴的表达增强相关。
脑外伤;高压氧;骨髓间充质干细胞;归巢;大鼠
[本文著录格式]刘杨,丁政,唐朝正,等.高压氧对脑外伤外源性骨髓间充质干细胞归巢的影响[J].中国康复理论与实践,2016,22(7):769-773.
CITED AS:Liu Y,Ding Z,Tang CZ,et al.Effects of hyperbaric oxygen on homing of exogenous bone marrow mesenchymal stem cells after traumatic brain injury[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(7):769-773.
脑外伤(traumatic brain injury,TBI)是一种由于创伤所致的脑部损伤,也是目前世界范围内一个重要的公共卫生和社会经济问题[1]。它与糖尿病、高血压病等已被世界卫生组织列入21世纪流行病谱。脑外伤有着极高的死亡率和致残率,全世界每年有5700万人发生脑外伤,其中1000万人因脑外伤而死亡或住院,同时脑外伤也是导致全世界45岁以下人群死亡和残疾的最主要因素[2-3]。
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是一类早期未分化的成体干细胞,具有定向迁移到炎症或损伤区域的特性[4]。其取材来源于成年的骨髓组织,因而不涉及道德和伦理方面的问题,目前已获批准作为干细胞治疗药物试用于临床。研究表明,BMSCs在抑制炎症反应、参与免疫调节、恢复血脑屏障的完整性、促进神经功能恢复等方面具有重要作用。然而,BMSCs在体内含量仅占骨髓内单核细胞总数的0.001%~0.01%,需要进行体外扩增和移植。采取有效手段提高归巢效率成为BMSCs发挥治疗作用的前提[5-6]。
本课题组前期研究发现,高压氧治疗通过促进内源性BMSCs归巢至受损脑组织,从而加快脑外伤大鼠神经功能恢复[7]。还有大量基础研究证实,高压氧治疗可增加受损区域归巢因子基质细胞衍生因子1 (stromal cell-derived factor 1,SDF-1)及其受体CXCR4的表达水平。本研究探讨高压氧治疗对脑外伤大鼠外源性BMSCs归巢的影响及其机制。
1材料和方法
1.1实验动物与材料
清洁级雄性Sprague-Dawley大鼠:南京军区福州总医院比较医学科。荧光显微镜:OLYMPUS公司。CO2培养箱、BCA蛋白定量试剂盒、全波长酶标仪:THERMO公司。超净工作台:苏州净化设备厂。CYQ-32高压氧舱:烟台冰轮高压氧舱有限公司。淋巴细胞分离液:天津市灏洋生物制品科技有限责任公司。DMSO:SIGMA公司。L-DMEM培养基、磷酸盐缓冲液(PBS)、青霉素-链霉素混合溶液、0.25%胰蛋白酶:HYCLONE公司。胎牛血清:GIBCO公司。CM-DiI:LIFE TECHNOLOGIES公司。PE或FITC标记兔抗大鼠CD29、CD90、CD45、CD11b单克隆抗体及其同型对照抗体,FACSAria流式细胞仪:BD公司。β-actin抗体:北京全式金生物技术公司。CXCR4抗体、SDF-1抗体:ABCAM公司。SDS-PAGE制胶试剂:碧云天生物技术研究所。PVDF膜:MILLIPORE公司。
1.2方法
1.2.1BMSCs的分离和培养
颈椎脱臼法处死大鼠,体质量(100±20)g,75%酒精浸泡10 min,转移到清洁工作台。无菌条件下取双侧后肢股骨和胫骨,钝性分离骨表面肌肉组织,用止血钳分别咬开胫骨和股骨两端,注射器抽取L-DMEM培养基反复冲洗股骨和胫骨骨髓腔至骨发白。Ficoll密度梯度离心法分离BMSCs,倒置相差显微镜下计数,调整细胞浓度为2×105/ml,加入细胞完全培养基5 ml(含10%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素),移液器反复吹打离心管,至管底无沉淀,细胞均匀分布。接种于25 cm2塑料培养瓶(原代细胞,记为P0),置37℃、体积分数5%CO2、饱和湿度培养箱中培养。48 h后半量换液,去掉悬浮细胞,以后每3天全量换液1次,倒置相差显微镜观察BMSCs生长情况(细胞形态、贴壁及融合情况)。
1.2.2BMSCs鉴定
培养箱中取出第3代BMSCs(P3),移液器吸出完全培养基,PBS洗涤2次,胰酶混合液消化2~3 min,加入完全培养基终止消化;1000 r/min离心5 min,弃上清,PBS洗涤3次,制成1×106/ml单细胞悬液;分别加入CD29-PE、CD90-FITC、CD45-PE、CD11b-PE单克隆抗体及其同型对照抗体各5 μl,室温避光孵育30 min;1000 r/min离心5 min,PBS冲洗2次去除未标记成分,加入PBS 1 ml重悬细胞,流式细胞仪检测(每次计数10,000个细胞)。
1.2.3BMSCs示踪
取P3代BMSCs,按说明书操作流程用荧光染料CM-DiI对BMSCs细胞膜进行示踪处理。每1 ml细胞培养液加入CM-DiI标记液5 μl,吹打制成细胞悬液。培养箱孵育30 min,1000 r/min离心5 min,弃上清;PBS洗2次。取少量细胞爬片,荧光显微镜观察。
1.2.4动物模型制备及分组
36只大鼠体质量(250±40)g,分为假手术组(A组,n=6)、模型组(B组,n=6)、BMSCs移植组(C组,n=12)和高压氧+BMSCs组(D组,n=12)。
动物术前禁食8 h,禁水2 h。腹腔注射10%水合氯醛3 ml/kg腹腔注射麻醉,以角膜反射和翻正反射消失确定为麻醉成功。常规去毛消毒,固定于脑立体定位仪上,沿正中线切开皮肤,在冠状缝后2.0 mm,矢状线右侧1.5 mm处用颅骨钻钻开直径约5 mm骨窗,保持硬脑膜完整。将自由落体打击器固定于骨窗处,20 g下击锤从40 cm高自由坠落冲击撞杆头,造成大鼠右侧顶叶中度脑挫裂伤。局部压迫止血,骨蜡封闭骨窗,缝合头皮。造模过程中和动物苏醒期间注意保暖。造模后笼中饲养,提供充足的水和食物,自由活动。
A组只切开皮肤、打开骨窗、骨蜡封闭并缝合头皮,不行打击。
造模后24 h,BMSCs移植前行神经功能缺损评分(Neurological Severity Scores,NSS)。
1.2.5BMSCs移植
C组和D组造模后24 h,尾静脉注射示踪处理后的BMSCs(1×106,200 μl),分别于移植后1 d、3 d提取脑组织标本。
1.2.6高压氧干预
D组在BMSCs移植后6 h内置高压氧舱,纯氧洗舱5 min,匀速加压15 min至0.2 MPa(2.0 ATA),稳压50 min,保持通风(流速5 L/min),避免CO2积聚。舱内氧浓度控制在90%以上。匀速减压20 min至常压出舱。每天1次。
1.2.7荧光显微镜观察
不同干预后大鼠以10%水合氯醛3 ml/kg腹腔注射麻醉,生理盐水200~300 ml快速心脏灌流,预冷的4%多聚甲醛缓慢灌流固定脑组织。取出脑组织,4%多聚甲醛中过夜,10%、30%蔗糖逐级脱水,冰冻切片机切片,厚6 μm,每只动物随机切取5张,滴加抗荧光淬灭封片液封片,荧光显微镜下观察示踪后BMSCs归巢的数量和部位。
1.2.8Western blotting
称取冷冻脑组织约20 mg,每10 mg脑组织加入蛋白混合裂解液200 μl(含RIPA裂解液、蛋白酶抑制剂),玻棒匀浆,冰上裂解15 min,4℃ 13000 r/min离心20 min,收集上清液至EP管,-80℃保存。
按说明书应用BCA蛋白定量法在酶标仪上测定所提蛋白的浓度,SDS-PAGE制胶、电泳、转膜。将PVDF膜置5%牛血清白蛋白(BSA)中,室温封闭1 h;根据Marker标记切取相应分子量大小的PVDF膜,加入一抗,4℃孵育过夜;TBST洗膜3次,每次10 min;加入辣根过氧化物酶(HRP)标记的二抗,室温孵育1 h;TBST洗膜3次,每次10 min;PBS洗膜3次,每次5 min。采用ECL化学发光法,于暗室中显影和定影。Quantity One软件测量其灰度值。
1.3统计学分析
2结果
2.1BMSCs培养及鉴定
骨髓中分离出的单个核细胞培养12 h后开始贴壁生长;BMSCs呈圆形或纺锤形,与成纤维细胞外观相似。经过换液和传代,BMSCs纯度不断提高,P3代BMSCs大小、形态及排列趋于一致,呈长梭形旋涡状、放射状生长。流式细胞仪测定,CD29阳性率95.8%、CD90阳性率99.3%、CD11b阳性率1.0%、CD45阳性率1.3%。CD29、CD90阳性表达高,CD11b、CD45阳性表达低,BMSCs纯度较高。
2.2NSS
与A组相比,B组、C组和D组NSS评分明显升高(P<0.01),B组、C组和D组之间无显著性差异(P>0.05)。见表1。
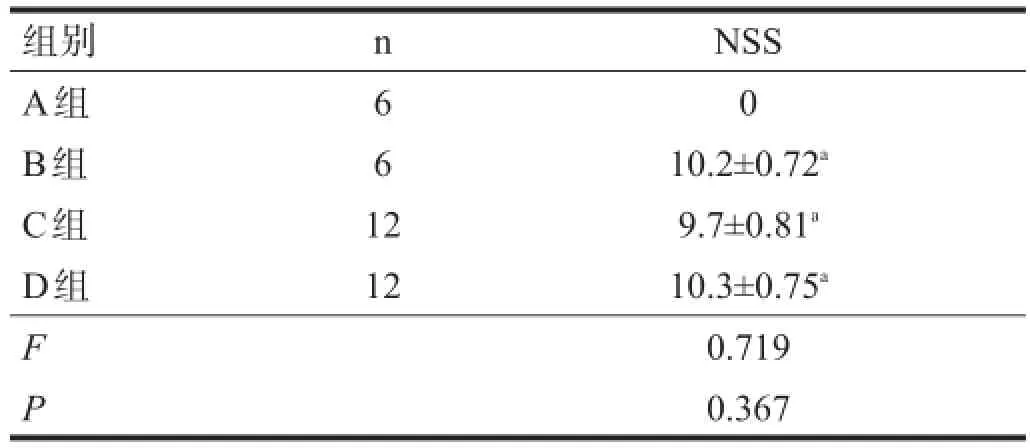
表1 各组大鼠NSS评分
2.3BMSCs归巢
双侧大脑半球均可观察到示踪处理后的BMSCs,受伤侧大脑半球,尤其是受损脑组织周围,荧光标记的BMSCs更为集中。同一时间点,D组BMSCs归巢数量明显高于C组(P<0.01);C、D两组移植后3 d时BMSCs归巢数量均显著高于1 d时(P<0.001)。见表2。
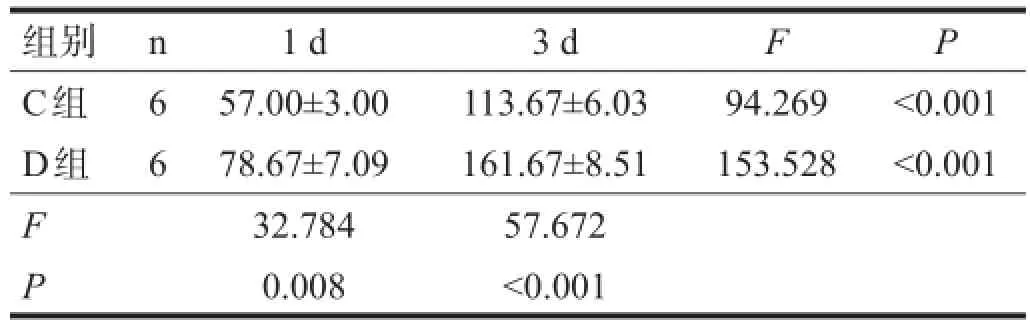
表2 BMSCs归巢的数量
2.4Western blotting
不同时间点,C、D组SDF-1和CXCR4表达水平均高于A、B组(P<0.05),D组高于C组(P<0.05)。见表3、表4。
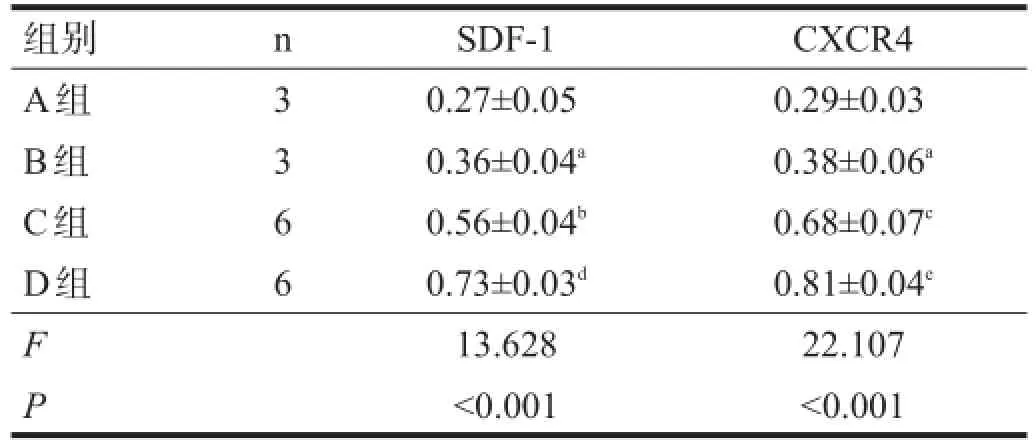
表3 移植后1 d时各组SDF-1和CXCR4蛋白表达
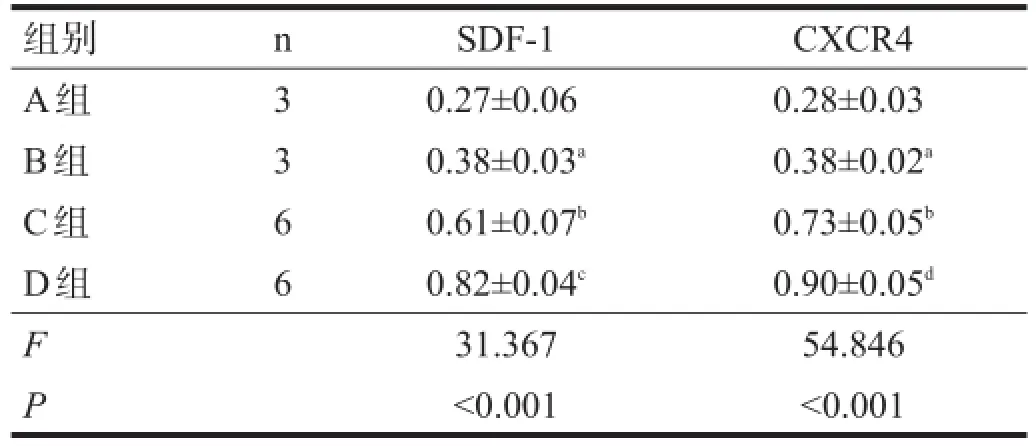
表4 移植后3 d时各组SDF-1和CXCR4蛋白表达
3讨论
脑外伤患者的死亡率是其他部位外伤死亡率的10倍。预计到2020年,脑外伤将成为全球三大疾病之一[8]。随着现代医学诊疗技术的发展,尤其是影像学技术和显微神经外科技术的创新和应用,脑外伤患者的死亡率有明显降低,但幸存者中留下许多后遗症,如运动障碍、言语障碍、焦虑、抑郁、认知功能障碍、人格改变等[9-11]。进一步探讨脑外伤后综合治疗方案,对提高患者生活质量、降低致残率具有积极意义。
干细胞是一类具有自我复制更新的多潜能细胞,可分为成体干细胞和胚胎干细胞。BMSCs是成体干细胞中的一类多能干细胞,属于中胚层时期发育的早期细胞,可以分化为神经细胞、心肌细胞、成骨细胞、内皮细胞等多种细胞。研究表明,人BMSCs可在体外传40代仍保持干细胞特性,是比较理想的干细胞移植的种子细胞[12]。
目前BMSCs的分离纯化方法主要有四种:免疫磁珠分离法、流式细胞仪分离法、密度梯度离心法和全骨髓贴壁培养法[13-14]。前两种方法由于尚未发现特异性很强的表面标志分子,加之价格较昂贵,提取过程相对繁琐,大范围推广应用仍然受限;后两种方法提取纯度虽然略低,但操作简便,价格便宜,目前仍是BMSCs分离的主要方法,其中密度梯度离心法分离的P0代细胞相对较纯,对细胞活性的影响小[15]。本研究采用Ficoll密度梯度离心法,分离出的细胞经贴壁培养及传代后,能够获得纯度较高的干细胞,符合BMSCs细胞形态学标准。经流式细胞仪鉴定,其表面抗原与公认的结果一致。
通常我们将器官或组织中可以调节干细胞自我更新与分化间平衡的微环境称作壁龛(niche)。细胞外基质作为壁龛的主要结构,在启动和维持干细胞功能方面起着重要的生理作用,对细胞黏附、增殖、迁移、分化和生存都有着重要影响[16]。居住于细胞外基质环境中的BMSCs不仅接受来自细胞外基质的信号,还通过分泌细胞外基质成分和酶,引起蛋白质及生长因子的蛋白水解修饰,从而维持BMSCs生长环境的动态平衡。
外源性BMSCs经动、静脉移植后,在正常生物内具有向多组织归巢的倾向,如脑、骨髓、肺、肝、脾等;但在炎症或损伤情况下,BMSCs具有定向迁移到受损区域的特性。本世纪初,Saito等通过静脉移植的方式对标记后的BMSCs进行体内移植,首次证明BMSCs具有归巢的能力;其后的研究对此也有陆续报道。BMSCs归巢的具体机制尚未完全明确。一般认为,归巢与白细胞趋化作用类似。Li等发现,人BMSCs脑内迁移主要通过胼胝体-外囊-室管膜下层通路,进而分化为神经细胞和星形胶质细胞[17]。本研究显示,脑外伤大鼠受损脑组织周围荧光标记的BMSCs集中分布,再次验证BMSCs具有向炎症或损伤区域归巢的特性。
SDF-1是BMSCs分泌的一种趋化因子,属于趋化因子家族中CXC亚族,即CXCL12。研究发现,SDF-1与其特异性受体CXCR4组成的SDF-1/CXCR4信号轴在BMSCs归巢中发挥着关键性作用[18-19]。一般情况下,CXCR4在BMSCs膜表面仅为3.9%,且随着体外培养时间的延长逐渐降低,其余部分大量存在于BMSCs的胞质内(83%~98%)[20]。在炎症、组织损伤、趋化因子等因素刺激下,CXCR4在细胞膜的表达水平明显上调,有利于促进干细胞归巢和组织修复。Yu等在大鼠心肌梗死后BMSCs移植的研究中发现,SDF-1和CXCR4在心肌缺血部位的表达水平显著增加,并进一步证明SDF-1/CXCR4信号轴是通过激活PI3K/Akt通路,促进BMSCs向心肌缺血坏死区的归巢[21]。该调节机制也在急性肾损伤的移植研究中得到证实[22]。
氧气是细胞氧化和代谢所必需的环境因素,对细胞的生存、迁移、增殖、分化以及维持机体生命活动具有重要意义。长期低氧可能加速细胞衰老,影响认知功能,导致肿瘤细胞的增殖和分化。高压氧治疗的作用机制十分复杂,目前尚未完全阐明,其中最重要的机制是高压氧可增加血液及组织中的物理溶解氧,提高氧分压,促进细胞的有氧代谢和ATP合成[23]。大量基础和临床研究表明,高压氧能抑制炎症反应,刺激血管和神经形成,对干细胞的动员、增殖和分化有积极影响。有研究发现,高压氧治疗可通过上调SDF-1/CXCR4的表达水平,促进新生血管形成,从而提高皮瓣移植的存活率[24]。还有研究指出,适宜的高压氧疗程对于促进BMSCs归巢至关重要[25]。
本研究显示,高压氧治疗能促进外源性BMSCs归巢至大鼠受损脑组织,其作用与SDF-1/CXCR4信号轴的表达增强密切相关。由于本研究在BMSCs移植后观察时间较短,未能对其分化及神经功能恢复情况做深入研究。BMSCs归巢后的多向分化、神经功能恢复及高压氧疗程方面尚有待进一步探讨。
[1]丁政,唐朝正,卢晓欣,等.高压氧在脑外伤治疗中的临床应用研究[J].中华航海医学与高气压医学杂志,2014,21(6):429-432.
[2]Roozenbeek B,Maas AI,Menon DK.Changing patterns in the epidemiology of traumatic brain injury[J].Nat Rev Neurol,2013,9(4): 231-236.
[3]Vink R,Bullock MR.Traumatic brain injury:therapeutic challenges and new directions[J].Neurotherapeutics,2010,7(1):1-2.
[4]李兵奎,曾彬,常巍,等.骨髓间充质干细胞静脉移植对脊髓损伤大鼠生长相关蛋白-43表达的影响[J].中国康复理论与实践,2015,21 (12):1391-1396.
[5]Kang SK,Shin IS,Ko MS,et al.Journey of mesenchymal stem cells for homing:strategies to enhance efficacy and safety of stem cell therapy[J].Stem Cells Int,2012,2012:342968.
[6]Ziadloo A,Burks SR,Gold EM,et al.Enhanced homing permeability and retention of bone marrow stromal cells by noninvasive pulsed focused ultrasound[J].Stem Cells,2012,30(6):1216-1227.
[7]周苏键,谭耀武,刘咏武栎,等.高压氧对创伤性颅脑损伤大鼠神经保护作用及骨髓间充质干细胞归巢因子表达的影响[J].中华航海医学与高气压医学杂志,2015,22(5):347-351.
[8]Chung P,Yun SJ,Khan F.A comparison of participation outcome measures and the International Classification of Functioning,Disability and Health Core Sets for traumatic brain injury[J].J Rehabil Med,2014,46 (2):108-116.
[9]Spitz G,Maller JJ,O'Sullivan R,et al.White matter integrity following traumatic brain injury:the association with severity of injury and cognitive functioning[J].Brain Topogr,2013,26(4):648-660.
[10]Isaac L,Main KL,Soman S,et al.The impact of depression on Veterans with PTSD and traumatic brain injury:a diffusion tensor imaging study[J].Biol Psychol,2015,105:20-28.
[11]Waljas M,Iverson GL,Lange RT,et al.A prospective biopsychosocial study of the persistent post-concussion symptoms following mild traumatic brain injury[J].J Neurotrauma,2015,32(8):534-547.
[12]Chang CP,Chio CC,Cheong CU,et al.Hypoxic preconditioning enhances the therapeutic potential of the secretome from cultured human mesenchymal stem cells in experimental traumatic brain injury[J].Clin Sci(Lond),2013,124(3):165-176.
[13]Zhang L,Chan C.Isolation and enrichment of rat mesenchymal stem cells(MSCs)and separation of single-colony derived MSCs[J].J Vis Exp,2010,(37).pii:1852.
[14]Pierini M,Dozza B,Lucarelli E,et al.Efficient isolation and enrichment of mesenchymal stem cells from bone marrow[J].Cytotherapy,2012,14(6):686-693.
[15]Chang Y,Hsieh PH,Chao CC.The efficiency of Percoll and Ficoll density gradient media in the isolation of marrow derived human mesenchymal stem cells with osteogenic potential[J].Chang Gung Med J,2009,32(3):264-275.
[16]Chen XD.Extracellular matrix provides an optimal niche for the maintenance and propagation of mesenchymal stem cells[J].Birth Defects Res C Embryo Today,2010,90(1):45-54.
[17]Li JM,Zhu H,Lu S,et al.Migration and differentiation of human mesenchymal stem cells in the normal rat brain[J].Neurol Res,2011,33 (1):84-92.
[18]Liu X,Duan B,Cheng Z,et al.SDF-1/CXCR4 axis modulates bone marrow mesenchymal stem cell apoptosis,migration and cytokine secretion[J].Protein Cell,2011,2(10):845-854.
[19]Marquez-Curtis LA,Janowska-Wieczorek A.Enhancing the migration ability of mesenchymal stromal cells by targeting the SDF-1/CXCR4 axis[J].Biomed Res Int,2013,2013:561098.
[20]Yagi H,Soto-Gutierrez A,Parekkadan B,et al.Mesenchymal stem cells:Mechanisms of immunomodulation and homing[J].Cell Transplant,2010,19(6):667-679.
[21]Yu J,Li M,Qu Z,et al.SDF-1/CXCR4-mediated migration of transplanted bone marrow stromal cells toward areas of heart myocardial infarction through activation of PI3K/Akt[J].J Cardiovasc Pharmacol,2010,55(5):496-505.
[22]Liu N,Tian J,Cheng J,et al.Migration of CXCR4 gene-modified bone marrow-derived mesenchymal stem cells to the acute injured kidney[J].J Cell Biochem,2013,114(12):2677-2689.
[23]Ding Z,Tong WC,Lu XX,et al.Hyperbaric oxygen therapy in acute ischemic stroke:a review[J].Interv Neurol,2014,2(4):201-211.
[24]Liu X,Liang F,Yang J,et al.Effects of stromal cell derived factor-1 and CXCR4 on the promotion of neovascularization by hyperbaric oxygen treatment in skin flaps[J].Mol Med Rep,2013,8(4):1118-1124.
[25]Lee YS,Chio CC,Chang CP,et al.Long course hyperbaric oxygen stimulates neurogenesis and attenuates inflammation after ischemic stroke[J].Mediators Inflamm,2013,2013:512978.
Effects of Hyperbaric Oxygen on Homing of Exogenous Bone Marrow Mesenchymal Stem Cells after Traumatic Brain Injury
LIU Yang1,DING Zheng1,TANG Chao-zheng1,ZHOU Su-jian2,LU Xiao-xin2,PENG Hui-ping1
1.Fujian University of Traditional Chinese Medicine,Fuzhou,Fujian 350100,China;2.Department of Rehabilitation Medicine,Fuzhou General Hospital of Nanjing Command,PLA,Fuzhou,Fujian 350025,China
Correspondence to PENG Hui-ping.E-mail:361140072@qq.com
Objective To investigate the effects of hyperbaric oxygen(HBO)on homing of exogenous bone marrow mesenchymal stem cells(BMSCs)after traumatic brain injury(TBI)in rats.Methods BMSCs were isolated and cultured with Ficoll density gradient centrifugation,and the surface markers(CD29,CD90,CD45,CD11b)of the third generation were identified with flow cytometry.The authenticated BMSCs were processed by the cell membrane fluorescent probe CM-DiI before transplantation.Thirty-six Sprague-Dawley rats were divided into Sham group(n=6),TBI group(n=6),BMSCs group(n=12),HBO+BMSCs group(n=12).The number and locations of homing of tracing BMSCs were observed under fluorescent microscope after frozen sections,and the expression of stromal cell-derived factor 1(SDF-1)and CXC chemokine receptor type 4(CXCR4)proteins were detected with Western blotting one and three days after BMSCs transplantation.Results The fluorescence-labeled BMSCs focused on the injured hemisphere,especially around the damaged brain tissue.The number of homing was more in HBO+BMSCs group than in BMSCs group at the same time(P<0.01),and increased in both groups three days after transplantation compared with those of one day after transplantation(P<0.01).The expression of SDF-1 and CXCR4 protein were more in HBO+ BMSCs group than in BMSCs group(P<0.05).Conclusion HBO can promote the exogenous BMSCs homing to damaged brain tissue in rats after traumatic brain injury,which is related to the enhancement of SDF-1/CXCR4 axis.
traumatic brain injury;hyperbaric oxygen;bone marrow mesenchymal stem cells;homing;rats
10.3969/j.issn.1006-9771.2016.07.006
R651.1
A
1006-9771(2016)07-0769-05
1.南京军区福州总医院专项基金项目(No.2011-009);2.南京军区福州总医院创新团队基金项目(No.2014CXTD08)。
1.福建中医药大学,福建福州市350100;2.南京军区福州总医院康复医学科,福建福州市350025。作者简介:刘杨(1989-),女,汉族,江西吉安市人,硕士研究生,主要研究方向:神经系统疾病与损伤的康复。通讯作者:彭慧平,男,硕士,主任医师,副教授。E-mail: 361140072@qq.com。
2016-04-11
2016-05-20)
