山羊流产嗜衣原体广东株的鉴定及分子特征分析
2016-07-27王玲玲刘永杰郑海学张克山刘湘涛
王玲玲,刘永杰,郑海学,张克山,刘湘涛
山羊流产嗜衣原体广东株的鉴定及分子特征分析
王玲玲,刘永杰,郑海学,张克山,刘湘涛
中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,国家口蹄疫参考实验室,兰州730046
摘要:目的确诊疑似羊衣原体感染的病例,分析羊衣原体分子特征。方法从广东某羊场采集疑似羊流产嗜衣原体病例的子宫内羊水,采用现场病理解剖观察、病料触片吉姆萨染色、显微镜观察、特异性目的基因ompA扩增和序列测定及遗传进化关系分析等方法进行了该病例的确诊及病原分子特征分析。结果现场解剖发现和羊流产嗜衣原体感染症状极其吻合,吉姆萨染色后显微镜观察可见衣原体特有的特征,自病料中扩增出特异性目的基因片段,表明该病例为山羊感染流产嗜衣原体引起。基因序列遗传进化分析表明该流产嗜衣原体(GenBank登录号KP984478)与2013年公布的中国贵州分离株KF130872遗传关系最近(同源性为99.1%),属于同一进化分支,与2002年公布的德国分离株AJ004873遗传关系最远(同源性为98.2%)。结论本研究为山羊流产嗜衣原体的最新流行病学动态奠定了基础。
关键词:流产嗜衣原体;鉴定;分子特征分析
Supported by the National Natural Science Foundation of China(No. 31201914), the China Post Doctoral Science Foundation(No. 2013M530683), and the China Agriculture Research System(No. CARS-39)
羊流产衣原体病又称为母羊地方性流产,是流产嗜衣原体(Chlamydophilaabortus,C.abortus)引起的一种接触性人兽共患传染病[1-2]。衣原体科分为衣原体属(Chlamydia)和嗜衣原体属(Chlamydophila),流产嗜衣原体曾经被称为鹦鹉热衣原体血清1型,是引起山羊和绵羊繁殖障碍的重要原因[3-4]。本病在许多国家和地区均有发生[5-6],母羊感染流产衣原体后一般表现为隐性感染,直到发生妊娠后出现流产、早产、死产或产弱羔,新生羔羊发生脑炎、关节炎,种公羊发生睾丸炎、附睾炎[7]。女性感染本病主要表现是盆腔炎[8],孕妇感染后可造成流产、早产、死产,严重者可发生脓毒败血症,对孕妇的生命安全有严重威胁[9-10]。
由于本病与布病等疾病临床症状的相似性,且感染后有较长的潜伏期[11],所以仅靠临床症状观察,病理剖检等常规方法确诊还有一定困难,需配合一些实验室诊断方法才能确诊。目前,衣原体病的实验室诊断通常采用染色和镜检、补体结合试验、间接血凝试验、ELISA、PCR扩增等,其中PCR检测因其快速灵敏而被广泛使用[12-13]。ompA基因是衣原体的主要外膜蛋白基因,常用于衣原体的鉴定和进化分析[14-15]。本文从广东某羊场的疑似病例中采取病料并进行了病理切片染色、ompA基因的扩增以及基于ompA基因的遗传进化分析。
1材料与方法
1.1材料病料取自广东某羊场疑似衣原体感染的流产母羊的羊水、胎儿胎衣等。
1.2方法
1.2.1现场病理剖检现场观察流产母羊胎盘、子宫等的病变情况,流产胎儿的皮肤、黏膜等的病变情况
1.2.2病理切片吉姆萨染色将采集的患病羊的羊水进行直接涂片,用甲醇固定3 min,吉姆萨染色液染色30 min后,用纯化水洗脱。晾干后置于显微镜下观察。
引物设计 根据GenBank上C.abortusompA基因序列设计ompA基因特异性扩增引物,上游引物:5′-ATGAAAAAACTCTTGAAATCG-3′,下游引物:5′-TTAGAATCTGAATTGAGCA。引物由上海生工有限公司合成。
1.2.3ompA基因扩增用DNA提取试剂盒从病料中提取DNA,用上述引物进行PCR扩增。反应体系为DNA聚合酶(5 U/μL)0.25 μL,10×buffer 5μL,dNTP mixture 4 μL,上下游引物(20 μmol/μL)各1 μL,ddH2O 33.75 μL。反应条件:95 ℃ 预变性 5 min ;94 ℃变性 50 s,52 ℃退火 50 s,72 ℃ 延伸 1 min , 35 个循环后, 72℃延伸10 min。反应结束后取 5 μL 扩增产物进行琼脂糖凝胶电泳,检测扩增结果。
1.2.4序列测定及分析经电泳检测片段大小合适的扩增产物附上下游引物送出测序。利用MEGA软件将测序确证的ompA基因序列与GenBank中已公布的其他菌株ompA序列进行比对,并进行基因序列同源性分析和遗传进化关系分析。
2结果
2.1剖检变化对发病羊进行剖检,可见病羊胎衣不下,子宫内膜出血、坏死,胎儿全身水肿等羊流产嗜衣原体感染的典型症状(图1)。

A:胎衣不下; B:胎儿全身水肿;C:子宫内膜出血坏死
2.2羊水吉姆萨染色将采集的流产母羊的羊水涂片、固定、染色后,显微镜下可观察到圆形或椭圆形的包涵体(图2)。
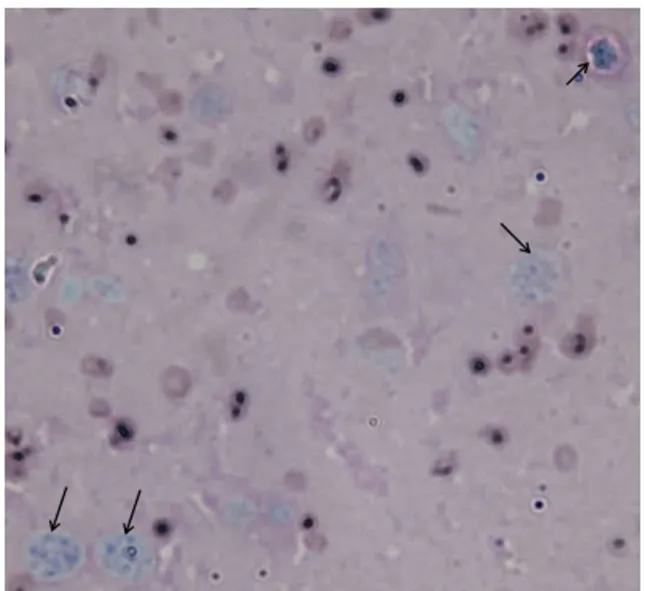
→示意包涵体
2.3ompA基因扩增用上述特异性引物进行PCR扩增,结束后进行琼脂糖凝胶电泳,得到大小约为1 200 bp的片段,符合预期结果(图3)。
2.4序列测定及分析 序列测定结果显示ompA基因全长1 170 bp,GC含量为44.36%,编码390个氨基酸。将该基因序列提交GenBank获得序列号KP984478。将该序列和已经公布的ompA序列用MEGA软件进行比对分析并构建系统进化树(从1~1 058 bp),结果表明本次测定的流产嗜衣原体与已公布的流产嗜衣原体ompA基因序列同源性为98.2%~99.1%,与AJ004873同源性最低,与KF130872同源性最高(图2)。对17个NCBI的编号进行列表,并标注相关信息(表1)。
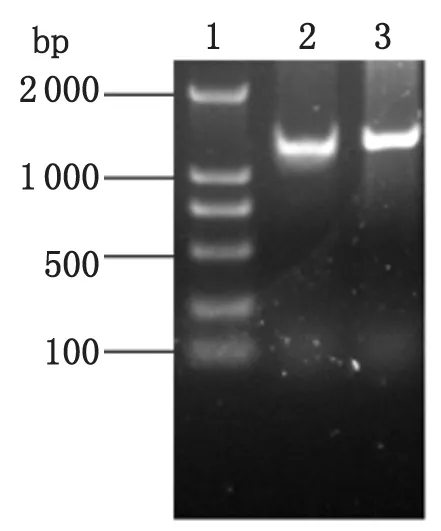
图3 羊流产衣原体ompA基因扩增
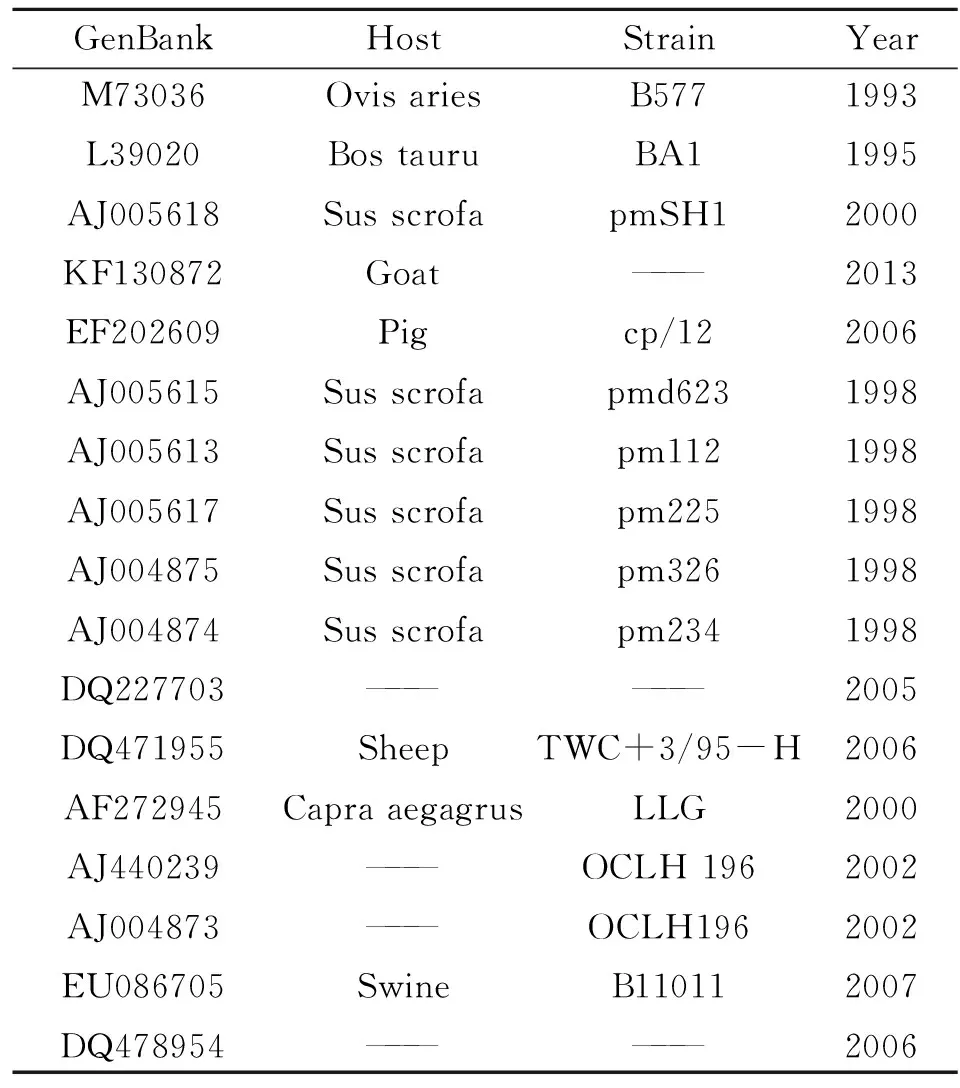
GenBankHostStrainYearM73036L39020AJ005618KF130872EF202609AJ005615AJ005613AJ005617AJ004875AJ004874DQ227703DQ471955AF272945AJ440239AJ004873EU086705DQ478954OvisariesBostauruSusscrofaGoatPigSusscrofaSusscrofaSusscrofaSusscrofaSusscrofa———SheepCapraaegagrus——————Swine———B577BA1pmSH1———cp/12pmd623pm112pm225pm326pm234———TWC+3/95-HLLGOCLH196OCLH196B11011———19931995200020132006199819981998199819982005200620002002200220072006
注:“——”表示无相关信息。
Note:“——”Denotes no information.
3讨论
肉羊的集约化、规模化发展是养羊业的一大趋势,但传染病带来的危害也更为严重。羊流产嗜衣原体感染引起的羊地方性流产主要通过呼吸道或消化道传播,是导致羊繁殖障碍的主要原因之一,严重影响着养羊业的发展和相关从业人员的身体健康,近年来已逐渐引起关注[16-17]。前期研究表明,我国多个省份的羊衣原体感染率普遍较高,其中甘肃90.00%,宁夏67.74%,湖北60.00%,山东52.75%,吉林51.91%,并且不同年份的感染率呈上升趋势[18]。
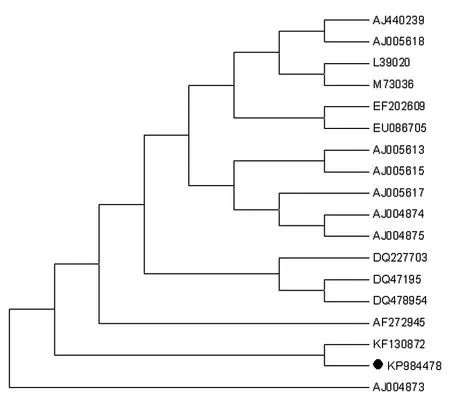
图4 广东分离株ompA基因遗传进化分析
疾病的快速诊断及分子特征分析可以了解疫病的分布规律,掌握本地的疫病流行情况以及流行株,从而针对性的制定方案预防疾病的发生,对于流行病学研究及疫病防控具有重要意义[19]。PCR检测由于快速、灵敏、简便等优点在衣原体病的诊断中得到广泛应用。ompA基因编码40 kDa的衣原体主要外膜蛋白,主要起到离子通道的作用,参与能量转换[4,20-21]。羊流产衣原体病的分子生物学诊断中大多采用以ompA基因为对象。
为确诊该羊场的疑似衣原体感染病例,作者进行了衣原体病原学检测,从切片中观察到圆形或椭圆形的包涵体,PCR扩增出流产嗜衣原体的ompA基因。结合临床症状将疑似病例确诊为流产嗜衣原体感染。遗传进化分析表明本次分离鉴定的流产嗜衣原体菌株与2013年公布的中国贵州分离株KF130872遗传关系最近,属于同一进化分支。目前关于流产嗜衣原体的分子流行病学研究还较少,本次测定并提交的ompA基因序列为该病原的分子流行病学研究积累了资料,对于了解我国目前羊流产嗜衣原体的分子流行病学特点具有重要意义。
参考文献:
[1]Pospischil A, Thoma R, Hilbe M, et al. Abortion in woman caused by caprineChlamydophilaabortus(Chlamydiapsittaciserovar 1)[J]. Swiss Med Wkly, 2002, 132(5-6): 64-66. DOI: 2002/05/smw-09911
[2]Meijer A, Brandenburg A, de Vries J, et al.Chlamydophilaabortusinfection in a pregnant woman associated with indirect contact with infected goats[J]. Eur J Clin Microbiol Infect Dis, 2004, 23(6): 487-490. DOI: 10.1007/s10096-004-1139-z

[4]Thomson NR, Yeats C, Bell K, et al. TheChlamydophilaabortusgenome sequence reveals an array of variable proteins that contribute to interspecies variation[J]. Genome Res, 2005, 15(5): 629-640. DOI: 10.1101/gr.3684805
[5]Kalender H, Kilic A, Eroksuz H, et al. Identification ofChlamydophilaabortusinfection in aborting ewes and goats in Eastern Turkey[J]. Revue De Medecine Veterinaire, 2013, 164(6): 295-301.
[6]Farias AEM, Higino SSS, Azevedo SS, et al. Epidemiological characterization and risk factors associated withChlamydophilaabortusinfection in sheep in Brazilian semiarid[J]. Pesquisa Veterinaria Brasileira, 2013, 33(3): 286-290.
[7]Chen PY. Veterinary Lemology[M]. Beijing: China Agriculture Press, 2006, 201-205.(in Chinese)
陈溥言. 兽医传染病学[M]. 北京: 中国农业出版社,2006:201-205.
[8]Wheelhouse N, Longbottom D. Endemic and emerging chlamydial infections of animals and their zoonotic implications[J]. Transbound Emerg Dis, 2012, 59(4): 283-291.DOI: 10.1111/j.1865-1682.2011.01274.x
[9]Walder G, Meusburger H, Hotzel H, et al.Chlamydophilaabortuspelvic inflammatory disease[J]. Emerg Infect Dis, 2003, 9(12): 1642-1644.
[10]Walder G, Hotzel H, Brezinka C, et al. An unusual cause of sepsis during pregnancy- Recognizing infection withChlamydophilaabortus[J]. Obstet Gynecol, 2005, 106(5): 1215-1217.DOI: 10.1097/01.Aog.0000161060.69470.9c
[11]Longbottom D, Livingstone M, Maley S, et al. Intranasal infection withChlamydiaabortusinduces dose-dependent latency and abortion in sheep[J]. PLoS One, 2013, 8(2): e57950.DOI: 10.1371/journal.pone.0057950
[12]Tian DY, Liu ZX, Li J, et al. Preliminary investigation ofChlamydophilaabortusin intensive pig farms[J]. China Anim Husband Vet Med, 2012, 39(1): 210-213.(in Chinese)
田德雨,刘哲翔,李靖,等. 集约化养猪场嗜流产衣原体病流行状况的初步调查[J]. 中国畜牧兽医, 2012, 39(1): 210-213.
[13]Song ZQ, Qiu CJ, Zhou JZ, et al. Establishment of an indirect ELISA diagnostic method based on the outer membrane protein A(OmpA) of bovineChlamydophiliaabortus[J]. Chin Vet Sci, 2010, 40(7): 696-700.(in Chinese)
宋竹青,邱昌庆,周继章,等. 奶牛流产衣原体OmpA抗原间接ELISA检测方法的建立[J]. 中国兽医科学, 2010, 40(7): 696-700.
[14]Zhang L, Wang YZ, Yan MH, et al. Research on the PCR method to detect ovineChlamydiaabortus[J]. Tianjin Agr Sci, 2009, 15(20): 14-16.(in Chinese)
张莉 王英珍, 鄢明华,等. 羊流产衣原体的PCR检测方法研究[J]. 天津农业科学, 2009, 15(20): 14-16.
[15]Miao ZC, Hasi AGL, Zhao YF, et al. Cloning and sequence analysis of the major outer membrane protein gene of ovine abortion strain ofChlamydiapasittaci[J]. Acta Veterinaria et Zootechnia Sinica, 2001, 32(1): 86-91.(in Chinese)
苗振川,哈斯阿古拉, 赵亚芳,等. 羊流产衣原体主要外膜蛋白基因的克隆与序列分析[J]. 畜牧兽医学报, 2001, 32(1): 86-91.
[16]Pan Q, Pais R, Ohandjo A, et al. Comparative evaluation of the protective efficacy of two formulations of a recombinantChlamydiaabortussubunit candidate vaccine in a mouse model[J]. Vaccine, 2015, 33(15): 1865-1872. DOI: 10.1016/j.vaccine.2015.02.007
[17]Sargison ND, Truyers IG, Howie FE, et al. Identification of the 1B vaccine strain ofChlamydiaabortusin aborted placentas during the investigation of toxaemic and systemic disease in sheep[J]. N Z Vet J, 2015, 1-11. DOI: 10.1080/00480169.2015.1018365
[18]ChengWW, Peng JW, Zhang KS, et al. Surveillance and analysis is ofChlamydiaseroprevalence from goat and sheep in some regions, China[J]. Chin J Zoonoses, 2013, 31(5): 472-474.(in Chinese)
成伟伟,彭靖雯,张克山,等. 我国一些地区羊衣原体血清流行病学调查分析[J]. 中国人兽共患病学报, 2013, 31(5): 472-474.
[19]Wang CJ, Yang HG. Engaged in animal disease epidemiology investigation and raise the level of the animal disease prevention and control[J]. Chin J Vet Med, 2013, 9(1): 4.(in Chinese)
王长江, 杨会国. 深入开展动物疫病流行病学调查工作提高动物疫病防控水平[J]. 中国兽医杂志, 2013, 9(1): 4.
[20]Wyllie S, Ashley RH, Longbottom D, et al. The major outer membrane protein ofChlamydiapsittacifunctions as a porin-like ion channel[J]. Infect Immun, 1998, 66(11): 5202-5207.
[21]Igietseme JU, Eko FO, Black CM. Contemporary approaches to designing and evaluating vaccines againstChlamydia[J]. Expert Rev Vaccines, 2003, 2(1): 129-146. DOI: 10.1586/14760584.2.1.129
DOI:10.3969/j.issn.1002-2694.2016.01.004
通讯作者:张克山, Email:zks009@126.com
中图分类号:R374
文献标识码:A
文章编号:1002-2694(2016)01-0017-04
Corresponding author:Zhang Ke-shan, Email:zks009@126.com
收稿日期:2015-07-13;修回日期:2015-11-17
Identification and molecular characteristic of Chlamydophila abortus Guangdong strain in goats
WANG Ling-ling,LIU Yong-jie,ZHENG Hai-xue,ZHANG Ke-shan,LIU Xiang-tao
(LanzhouVeterinaryResearchInstituteofChineseAcademyofAgricultureScience,StateKeyLaboratoryofVeterinaryEtiologicalBiology,NationalFoot-and-MouthDiseaseReferenceLaboratory,Lanzhou730046,China)
Abstract:To identify suspected goats enzootic abortion cases and analyze the molecular characteristic of the pathogen, tissue samples were collected and detected by pathology examination, GIMSA dying assay, microscopic examination, specific gene amplification and sequencing, and the phylogenic tree based on gene ompA was performed. Results showed that the pathologic changes were similar with Chlamydophila abortus (C. abortus) infection, the typical characters of Chlamydia infection were observed by microscope after GIMSA dying and specific gene ompA was amplified by PCR, indicating the disease was caused by C. abortus. Gene ompA sequence was submitted to GenBank and obtained accession number KP984478. Phylogenetic tree analysis revealed that the C. abortus strain identified had a closest genetic relationship with KF130872 isolated from Guizhou in 2013(with 99.1% homology), and had the farthest relationship with AJ004873 published in 2002(with 98.2% homology). Results of this paper laid the foundation for epidemiologic further study on C. abortus.
Keywords:Chlamydophila abortus; identification; molecular characteristic analysis
国家自然科学基金(NSFC-31201914),中国博士后科学基金(2013M530683), 国家现代肉羊产业技术体系(CARS-39)联合资助
