细粒棘球蚴和多房泡球蚴在人体内蛋白质表达谱初步分析
2016-07-27张耀刚李超群毋德芳曹得萍
张耀刚,李超群,毋德芳,曹得萍
细粒棘球蚴和多房泡球蚴在人体内蛋白质表达谱初步分析
张耀刚,李超群,毋德芳,曹得萍
青海大学医学院病原生物教研室,西宁810001
摘要:目的初步掌握流行于青海省细粒棘球绦虫幼虫棘球蚴(原头节、囊壁、囊液)和多房棘球绦虫幼虫泡球蚴在中间宿主人体内蛋白质表达情况。方法利用SDS-PAGE和 Western-blot分析棘球蚴原头节、囊壁、囊液蛋白质和泡球蚴总蛋白表达谱。结果细粒棘球蚴原头节的蛋白质浓集在分子量72 kDa处,囊壁的蛋白质浓集在72 kDa、26 kDa和17 kDa 处,囊液的蛋白浓集在72 kDa、43~55 kDa、26 kDa和17 kDa;泡球蚴总蛋白质浓集在分子量72 kDa、55~72 kDa和26 kDa处。结论不同地区细粒棘球蚴在人体内蛋白的表达存在差异;不同亚种泡球蚴原头节蛋白的表达存在差异。
关键词:细粒棘球蚴;多房泡球蚴;蛋白质表达谱
Supported by the National Natural Science Foundation of China (No. 81360255) and the Chunhui Project of the Ministry of Education (No. 2012-Z082)
棘球蚴病(Echinococcosis),俗称包虫病,是一种由棘球绦虫的幼虫寄生于动物和人体内而引起的人兽共患寄生虫病[1]。我国最常见的是细粒棘球蚴感染所致的囊型包虫病和多房棘球蚴感染所致的泡型包虫病。由于两种绦虫是同属,存在多种共同抗原组分,在免疫诊断中存在交叉反应,从而给两种疾病的鉴别诊断带来困难[2]。分析棘球蚴和泡球蚴的蛋白表达谱有助于了解棘球蚴和泡球蚴的抗原成分,为抗包虫疫苗的研制提供基础数据支持。而目前分析细粒棘球蚴原头节、囊壁、囊液和多房棘球蚴总蛋白表达谱的研究鲜有报道。本研究拟运用SDS-PAGE和 Western-blot技术对细粒棘球蚴原头节、囊壁、囊液和多房泡球蚴总蛋白质成分进行初步研究,分析棘球蚴和泡球蚴总蛋白质表达情况,为深入了解细粒棘球绦虫幼虫和多房棘球幼虫的蛋白代谢途径以及发育过程奠定基础。
1材料与方法
1.1实验标本本实验所用人体包虫病标本来源于青海省西宁市各大医院外科手术病人。
1.2细粒原头节、囊壁和囊液总蛋白的制备
1.2.1原头节总蛋白的制备取0.5 mL原头节(约5 000个)加入2 mL非变性蛋白裂解液(40 mmol/L Tris-HCl、适量蛋白酶抑制剂),振荡混匀。冰上超声粉碎2 min(60周,每次30 s,间隔10 s),4 ℃振荡3 h,以使组织充分裂解,显微镜下检查原头节已破碎完全,4 ℃,12 000×g离心40 min。取上清,-80 ℃保存备用。
1.2.2囊壁总蛋白的制备剪取大约2 g棘球蚴囊壁用0.1 mol/L PBS液洗涤3次,剪碎,加入2 mL非变性蛋白裂解液(40 mmol/L Tris-HCl、适量蛋白酶抑制剂),振荡混匀。冰上超声粉碎2 min(60 W,每次30 s,间隔10 s),4 ℃振荡3 h,以使组织充分裂解,显微镜下检查囊壁已破碎完全,4℃,12 000×g离心40 min。取上清,-80 ℃保存备用。
1.2.3囊液总蛋白的制备取2 mL的棘球蚴囊液,4 ℃,12 000×g离心30 min。取上清,-80 ℃保存备用。
1.3泡球蚴总蛋白的制备剪取泡球蚴标本0.5 g加入2 mL非变性蛋白裂解液(40 mmol/L Tris-HCl、适量蛋白酶抑制剂),振荡混匀。冰上超声粉碎2 min(60 W,每次30 s,间隔10 s),4 ℃振荡3 h,以使组织充分裂解,显微镜下检查组织已破碎完全,4 ℃,12 000×g离心40 min。取上清,-80 ℃保存备用。
1.4SDS-PAGE和Western-blot使用SDS-PAGE和Western-blot分析棘球蚴原头节、囊壁和囊液及泡球蚴总蛋白质表达谱,使用Bradford蛋白浓度测定试剂盒(碧云天试剂公司) 测定蛋白浓度,并将各样本浓度稀释至相同,SDS-PAGE上样量为15 μL;采用本室保存的棘球蚴和泡球蚴患者血清进行Western-blot分析。
2结果
2.1利用SDS-PAGE分析细粒棘球蚴原头节、囊壁和囊液总蛋白质的蛋白表达谱采用本室保存的棘球蚴患者血清进行Western-blot分析。原头节的蛋白质浓集在分子量72 kDa处,囊壁的蛋白质浓集在72 kDa、26 kDa和17 kDa 处,囊液的蛋白浓集在72 kDa、43~55 kDa、26 kDa和17 kDa。结果详见图1。
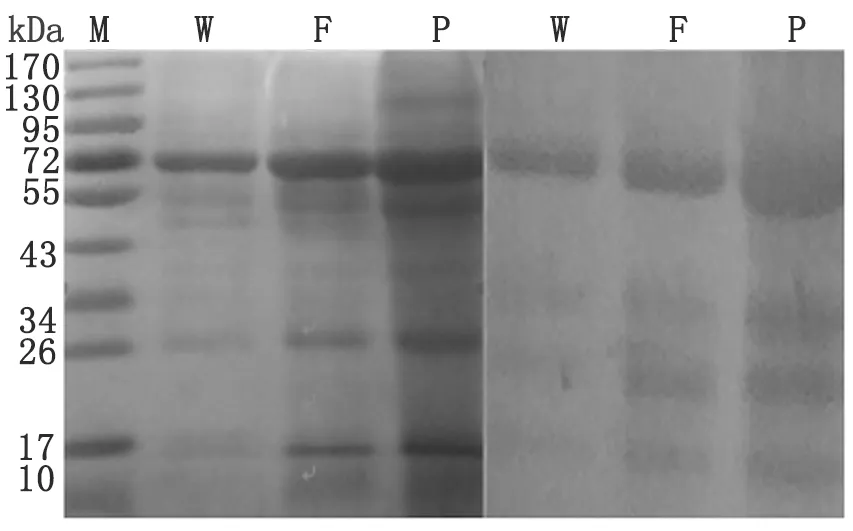
W: cyst wall; F: cyst fluid; P: protoscolices.
2.2利用SDS-PAGE分析多房棘球绦虫幼虫泡球蚴总蛋白质的蛋白表达谱,采用本室保存的泡球蚴患者血清进行Western-blot分析。蛋白质浓集在分子量72 kDa、55~72 kDa和26 kDa处。结果详见图2。
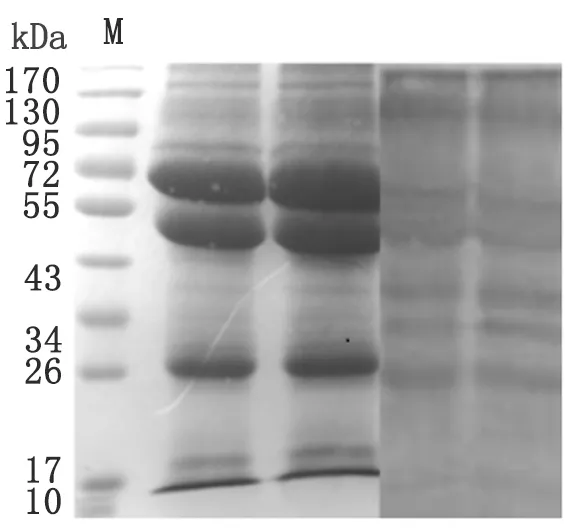
图2 泡球蚴总蛋白质的蛋白表达谱的SDS-PAGE和Western-blot
3讨论
蛋白质在细胞中有多种功能,包括结构上的支持作用、构成收缩系统以及参与分子转运,它们有的作为激素、有的作为毒素,更多的具有抗原性;另一些尤其是免疫球蛋白是免疫系统的关键组分。另外一个大的群体酶,能够催化细胞中的蛋白质基本合成和降解反应。
细粒棘球蚴原头节、囊壁、囊液的蛋白主要浓集于72 kDa,这与Li[3]等的研究结果是一致的,但三者之间也存在着一定的差异,囊壁的蛋白质除72 kDa外,在26 kDa和17 kDa处也有表达,而囊液的蛋白在43-55 kDa、26 kDa和17 kDa均有表达。显示出囊液的表达谱更宽。Wang XY[4]等所研究的细粒棘球蚴14-3-3蛋白质的分子量为24-33 kDa,与本研究的结果囊壁和囊液26 kDa的蛋白质是比较接近的。而Zhang Q[5]等对宁夏细粒棘球蚴囊液蛋白的SDS-PAGE电泳结果显示蛋白质主要分布在43-97.4 kDa 与 14.0 kDa,与本研究结果略有差异,本次研究发现,细粒棘球蚴囊液在26 kDa处亦有表达,这可能是由于生存环境的不同导致细粒棘球蚴囊液的蛋白的表达出现差异,也可能是不同基因型之间囊液蛋白的表达存在差异,这还有待进一步研究。
本研究多房泡球蚴总蛋白浓集在分子量72 kDa、55~72 kDa和26 kDa处,与Cao Y[6]、Ueno M[7]的结果差异不大,而内蒙古欧洲多房棘球绦虫原头节蛋白的分子量为10~120 kDa,表达范围更广[8],表明不同亚种泡球蚴原头节蛋白的表达存在差异。
本研究中Western-blot鉴定的蛋白质均为总蛋白,打算在以后的研究中通过二维电泳和质谱分析技术鉴定更全面的有关棘球蚴原头节、囊壁、囊液蛋白质点的表达谱。进一步研究在棘球蚴原头节、囊壁、囊液中表达的这些蛋白质对棘球蚴生命代谢的影响,将为在蛋白质水平上探索治疗药物开发,致病机制的研究理论提供依据。也可将这些蛋白分子用作候选抗原,研究其免疫保护性,有助于研发有关棘球蚴的有效疫苗。
参考文献:
[1]Zeng XM, Guan YY, Wu WP. Epidemiological distribution characteristics of Echinococcosis[J]. Chin J Zoonoses, 2014, 30(4): 413-417. DOI: 10.3969/j.issn.1002-2694.204.04.014 (in Chinese)
曾祥嫚, 官亚宜, 伍卫平.棘球蚴病的流行病学分布特征[J].中国人兽共患病学报, 2014, 30(4): 413-417.
[2]Ahn CS, Han XM, Bae YA, et al. Alteration of immunoproteome profile of Echinococcus granulosus hydatid fluid with progression of cystic echinococcosis[J]. Parasit Vectors, 2015, 8(10): 1-10. DOI: 10.1186/s13071-014-0610-7
[3]Li JY, Wang XF, Zhang ZQ, et al. Analysis of the chemical components of hydatid fluid fromEchinococcusgranulosus[J]. Rev Soc Bras Med Trop, 2013, 46(5): 605-610. DOI: 10.1590/0037-8682-0154-2013
[4]Wang XY, Chen WJ, Li XR, et al. Identification and molecular characterization of anovel signaling molecule 14-3-3 epsilon inClonorchissinensisexcretory/secretory products[J]. Parasitol Res, 2012, 110: 1411-1420. DOI: 10.1007/s00436-011-2642-7
[5]Zhang Q, Li JY, Zhao JQ, et al. Proteomics study on hydatid cyst fluid ofEchinococcusgranulosus[J]. Med Pharm J Chin PLA, 2013, 25(12): 48-51. DOI: 10. 3969/j.issn.2095-140X.2013.12.013 (in Chinese)
张倩, 李居怡, 赵嘉庆, 等.细粒棘球蚴囊液蛋白质组学的分析研究[J].解放军医药杂志, 2013, 25(12): 48-51.
[6]Cao Y, Qiao DR, Jiang Y, et al. Studies on antigens of several parasites by SDS-PA-GE protein electrophoresis[J]. J Sichuan Univ (Nat Sci Ed), 2002, 39(1): 142-145. DOI: 10.3969/j.issn.0490-6756.2002.01.030 (in Chinese)
曹毅, 乔代蓉, 蒋彦, 等.几种寄生虫抗原组分的SDS-PAGE电泳比较分析[J].四川大学学报(自然科学版), 2002, 39(1): 142-145.
[7]Ueno M, Kuroda N, Yahagi K, et al. Analysis of antibody responses by commercial western blot assay in horses with alveolar echinococcosis[J]. J Vet Med Sci., 2012, 74(6): 813-815. DOI: 10.1292/jvms.11-0552
[8]Lu XF. Studies on the proteome ofEchinococcusmultilocularisprotoscolece[D]. Xianmen: Xiamen University, 2007. DOI: 10.7666/d.y1343803 (in Chinese)
鲁晓风.多房棘球绦虫原头节蛋白质组学研究[D].厦门大学, 2007.
DOI:10.3969/j.issn.1002-2694.2016.01.005
通讯作者:曹得萍,Email:qhmccdp@163.com
中图分类号:R383.3
文献标识码:A
文章编号:1002-2694(2016)01-0021-03
Corresponding author:Cao De-ping, Email: qhmccdp@163.com
收稿日期:2015-03-06;修回日期:2015-09-30
Preliminary protein expression profiling analysis on human hydatid and alveolar hydatid in Qinghai Province
ZHANG Yao-gang,LI Chao-qun,WU De-fang,CAO De-ping
(DepartmentofPathogenicBiology,MedicalCollegeofQinghaiUniversity,Xining810001,China)
Abstract:The aim of this study was to analyze the preliminary protein expression profiling on human Echinococcus granulosus metacestode (protoscoleces, cyst wall and cyst fluid) and Echinococcus multilocularis metacestode. To investigate the profiles at the protein expression level, SDS-PAGE and Western-blot were carried out to detect the protein expressing profiles of human hydatid (protoscoleces, cyst wall and cyst fluid) and alveolar hydatid. Results showed that the protein molecular weight of human hydatid protoscoleces was aggregated in 72 kDa, the protein molecular weight of cyst wall was aggregated in 72 kDa, 26 kDa and 17 kDa, the protein molecular weight of cyst fluid was 72 kDa, 43-55 kDa, 26 kDa and 17 kDa; the protein molecular weight of alveolar hydatid was aggregated in 72 kDa, 55-72 kDa and 26 kDa. Results suggested that the different subspecies may result in different protein expression in human hydatid. And alveolar hydatid also had different protein profile in different subspecies.
Keywords:human hydatid; alveolar hydatid; protein expression profilin
国家自然基金地区项目(No.81360255)和春晖计划项目(No.2012)联合资助
