中国B.afzelii基因型莱姆病螺旋体GDsh1表面蛋白VlsE保守区段的克隆表达及抗原性分析
2016-07-27侯学霞刘慧鑫万康林
刘 炜,张 琳,侯学霞,刘慧鑫,郝 琴,万康林
中国B.afzelii基因型莱姆病螺旋体GDsh1表面蛋白VlsE保守区段的克隆表达及抗原性分析
刘炜,张琳,侯学霞,刘慧鑫,郝琴,万康林
中国疾病预防控制中心传染病预防控制所,传染病预防控制国家重点实验室,北京102206
摘要:目的克隆表达中国莱姆病螺旋体B.afzelii基因型菌株GDsh1的表面蛋白VlsE保守区段,并对其抗原性进行分析,为制备中国莱姆病重组抗原ELISA检测试剂盒提供依据。方法结合文献,下载并比对PubMed上所有莱姆病螺旋体B.a型菌株的VlsE基因序列,确定保守区段,设计引物,扩增GDsh1 的VlsE基因片段。将扩增产物与载体PET-32a连接,转入大肠杆菌BL21(DE3)中表达。对重组载体进行序列测定,表达产物用SDS-PAGE和Western blot 分析。利用重组VlsE蛋白制备ELISA试剂盒,检测83份莱姆病阳性血清,90份阴性血清以及90份梅毒血清,计算重组试剂盒的灵敏度和特异性。并与科室已有的全菌蛋白ELISA试剂盒检测结果进行比较。结果成功克隆表达了B.afzelii型VlsE保守区蛋白,Western blot结果显示VlsE保守区蛋白与免疫兔血清有较强的抗原抗体反应。ELISA结果表明:重组VlsE蛋白的灵敏度60.2%低于全菌蛋白的灵敏度92.8%(P<0.001);特异性分别为73.3%、68.9%,差异无统计学意义(P=0.511)。在检测梅毒血清上特异性分别为83.3%、18.9%,重组蛋白的特异性远远高于全菌蛋白(P<0.001)。结论重组VlsE基因保守区段蛋白在莱姆病的检测中具有一定的灵敏度和特异性,且在区分梅毒血清与莱姆病血清上,其特异性远远高于全菌蛋白,在莱姆病血清学检测中具有不容忽视的重要意义。
关键词:莱姆病螺旋体;VlsE蛋白;克隆表达;抗原性分析
Supported by the National Science and Technology Major Project(Nos. 2013ZX10004-001 and 2013ZX10004-101)
莱姆病是一种蜱传的人兽共患病,其病原体为伯氏疏螺旋体。莱姆病临床征状包括:游走性红斑,面神经麻痹,神经根炎,心脏病,关节炎和慢性萎缩性肢皮炎等,严重的导致终身残疾,甚至死亡[1]。因为莱姆病的临床症状复杂多样,所以莱姆病的实验室辅助诊断尤为重要。
目前莱姆病的实验室诊断主要依靠于血清学诊断方法,包括IFA、ELISA、WB等[2]。用于莱姆病血清学诊断的抗原包括全菌抗原和重组抗原,全菌抗原在检测莱姆病时敏感度较高,但全菌蛋白在诊断过程中易与梅毒血清、钩端螺旋体血清有交叉反应,特异性较低[2]。而莱姆病重组蛋白检测试剂盒可以在一定程度上提高莱姆病检测的特异性,有很好的应用前景。研究表明用于检测莱姆病的表面抗原蛋白具有多种,OspA, OspC,鞭毛蛋白,P83/100,P39,VlsE等[3]。其中,国外有研究发现VlsE蛋白在莱姆病血清IgG诊断上有很好的灵敏度和特异性,其保守区段在诊断上亦得到了广泛的应用[4-6]。由于国内莱姆病螺旋体以B.a(B.afzelii)和B.g(B.garinii)型为主[7],故而表达这两个基因型的VlsE保守区段对我国莱姆病的诊断研究具有重要意义。由于VlsE蛋白变异性大,其在不同菌株中的同源性仅有47%~58%[8],本文探索克隆表达了国内B.a型的VlsE保守区段蛋白,并对其在莱姆病血清上的诊断应用进行评价。
1材料和方法
1.1血清标本83份阳性血清标本来自牡丹江人民医院,90份阴性血清来自河南油田健康体检者。90份梅毒血清来自新疆乌鲁木齐第一人民医院梅毒病人。血清的纳入排除标准:阳性血清为有蜱叮咬史;具有发热、红斑、关节炎等莱姆病症状,且IFA检测阳性(IgG≥1∶128;IgM≥1∶64);阴性血清来自非莱姆病疫区的健康体检者,IFA初筛阴性,非梅毒或钩体病病人;梅毒血清为TPHA试验阳性,典型梅毒且无莱姆病症状患者血清。
1.2莱姆病螺旋体菌株B.a型菌株GDsh1由中国疾病预防控制中心传染病所莱姆病室提供。
1.3质粒和宿主菌载体PET-32a由中国疾病预防控制中心传染病所莱姆病室提供。宿主菌BL21(DE3)购于康为世纪生物科技有限公司。
1.4主要试剂Taq DNA聚合酶购于北京六合通生物公司;T4 DNA连接酶、限制性内切酶等购于北京北方仪涛商贸有限公司;96酶标板、TMB显色液、包被缓冲液等购于北京莱贝斯生物科技有限公司。
1.5B.a型菌株VlsE基因保守区段的确定和引物设计下载并比对PubMed上所有莱姆病螺旋体B.a型菌株的VlsE基因序列,发现有近400 bp的序列,其两端的碱基序列高度保守,针对两端保守区段设计引物,并在上下游两端插入酶切位点。正向引物P1:5′-CGGGGATCCAAGGGGATAAAGGGGATTGTTGA-3′,限制性内切酶位点为BamH I;反向引物 P2:5′-CGGAAGCTTAGCAAACTTTCCATCCTTAGCCA-3′,限制性内切酶位点为Hind III。
1.6VlsE保守区段基因克隆表达及DNA序列测定以GDsh1全基因组为模板,P1-P2为上下游引物,通过PCR扩增得到目的片段,利用PCR产物回收试剂盒回收。同时将PET-32a载体与目的片段用BamH I、Hind III在37 ℃进行双酶切,并回收酶切产物。T4 DNA连接酶16℃过夜连接酶切后的目的片段及载体。将连接产物转化至宿主菌BL21(DE3)中。在转化的平板上挑取阳性菌落,PCR进行验证,并进行序列测定(由北京擎科新业生物技术有限公司完成)。将阳性克隆接种于LB液体培养基中,待OD600达到0.6时加入诱导剂IPTG(诱导浓度为1 mmol/L),37 ℃诱导3~5 h。收集菌体进行SDS-PAGE电泳。
1.7蛋白纯化大量诱导重组菌后,根据德国Merck公司的His标签蛋白纯化试剂盒对目的蛋白进行纯化。 并用Biorad蛋白定量试剂盒(北京康为世纪生物科技有限公司)定量。
1.8免疫印迹(Western blot)以未诱导的重组菌为阴性对照,12%的SDS-PAGE电泳后,通过电转仪将凝胶上的蛋白转移至硝酸纤维素膜上,用5%的脱脂奶粉4 ℃封闭过夜,0.01 mol/L pH7.4 的PBST洗涤3次,将膜转入1∶25稀释的免疫兔血清中室温孵育2 h,PBST洗涤3次,加入FITC标记的羊抗兔IgG,室温孵育2 h,洗涤3次,TMB底物显色液显色5 min。
1.9酶联免疫吸附试验(ELISA) 利用棋盘滴定的方法,阴阳性血清和重组蛋白分别按1∶50,1∶100,1∶200,1∶400倍和1∶20,1∶40,1∶80,1∶160,1∶320倍稀释。结合吸光度和P/N值为判断依据(P/N值=(阳性血清-空白)/(阴性血清-空白)),选择最适的抗原抗体稀释倍数。用最适的抗原浓度包被酶标板,分别检测83份莱姆病阳性血清,90份阴性血清以及90份梅毒血清,同时用科室已有的全菌蛋白包被的ELISA检测试剂盒检测这3批血清,并进行重复实验。两次实验结果取均值,利用SPSS19.0软件制作ROC曲线,判断重组蛋白的灵敏度与特异性,并比较重组VlsE蛋白与全菌蛋白间的差异。
2结果
2.1重组的VlsE区段在宿主菌BL21(DE3)中的诱导表达以及纯化结果重组的VlsE区段蛋白在宿主菌BL21(DE3)中高效、稳定表达。经纯化后,获得了单一的重组VlsE蛋白(见图1)。
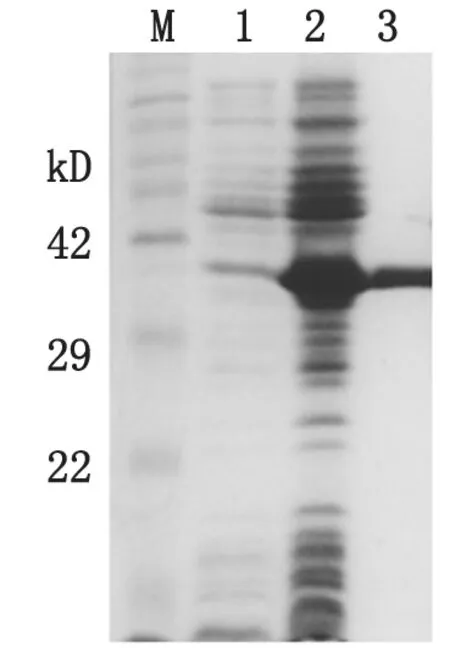
M:蛋白分子量标准; 1.未诱导的重组菌BL21-VlsE; 2.诱导表达的重组菌BL21-VlsE; 3.纯化重组蛋白VlsE
2.2重组VlsE蛋白的Western blot分析Western blot结果显示,重组VlsE蛋白与免疫兔血清发生特异的抗原抗体反应(见图2)。
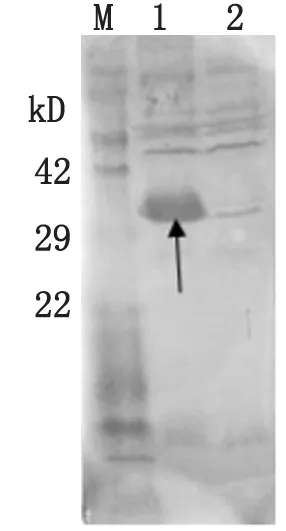
M:蛋白分子量标准 1:诱导表达的重组菌BL21-VlsE 2:未诱导的重组菌BL21-VlsE(阴性对照)
M: protein marker; 1: the expressed recombinant protein in BL21-VlsE; 2: the unexpressed recombinant protein in BL21-VlsE(Negative control).
图2重组蛋白VlsE与免疫兔血清WB分析
Fig.2Western blot analysis of recombiant protein with immune rabbit serum
2.3B.a型菌株GDsh1 VlsE保守区段序列采用BLAST与B.a型欧洲标准菌株PKo的VlsE蛋白保守段序列同源性95%,测序结果如下:
2.4ELISA检测结果
2.4.1重组蛋白最佳包被浓度及血清最佳稀释度的确定据原始吸光度结果以及棋盘滴定的结果确定的最佳抗原稀释度为1∶160,最佳血清稀释度为1∶50。重组蛋白定量结果为355 μg/mL,故而最佳抗原包被浓度为2.2 μg/mL。
2.4.2重组蛋白与全菌蛋白ELISA检测83份阳性血清以及90份阴性血清的吸光度值,利用SPSS19.0制作ROC曲线,以youden指数(youden指数=敏感度-(1-特异度))值最大对应的吸光度值作为cutoff值(ROC曲线见图3)。以cutoff值为界值,得到重组VlsE蛋白在莱姆病血清、阴性血清、梅毒血清中阳性数分别为50、24、15,全菌蛋白阳性数分别为77、28、73(见表1)。利用卡方检验对重组VlsE蛋白与全菌蛋白在莱姆病血清、阴性血清、梅毒血清检测上的差异进行比较,得到χ2值分别为24.432(P<0.001)、0.433(P=0.511)、74.792(P<0.001),由此可见重组VlsE蛋白灵敏度低于全菌蛋白,其特异性与全菌蛋白无统计学差异,但在梅毒血清检测上重组VlsE蛋白特异度远远高于全菌蛋白。

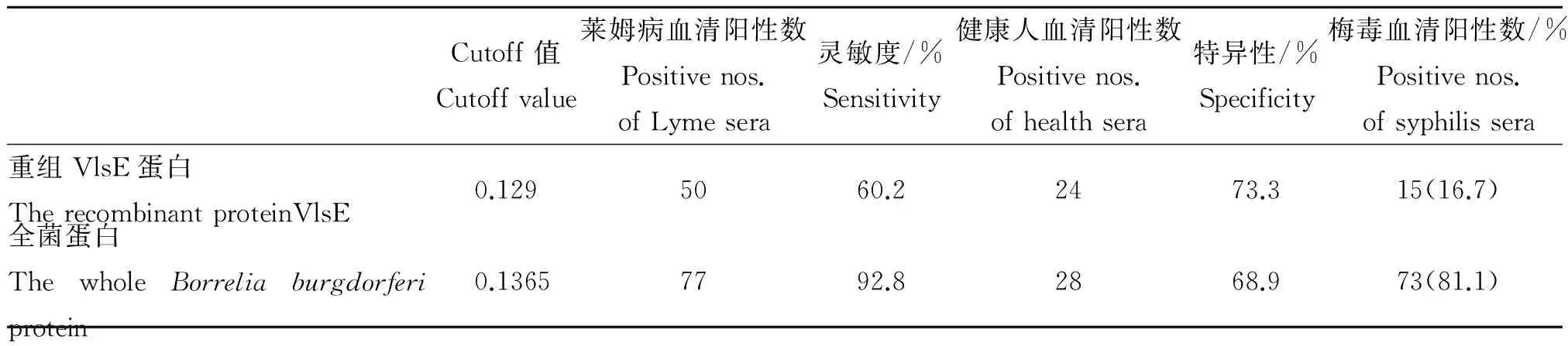
表1 重组VlsE蛋白与全菌蛋白ELISA检测结果
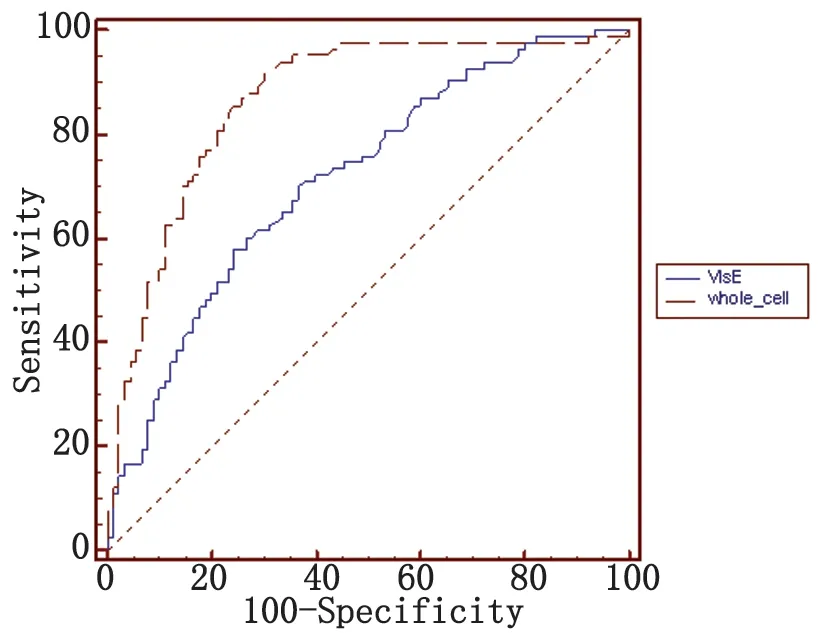
图3 重组蛋白VlsE和全菌蛋白ROC曲线
3讨论
莱姆病诊断的金标准依旧是病原体培养[9],但是其低检出率并不适用于临床诊断。目前莱姆病的临床诊断主要根据流行病学史、临床表现以及实验室检测结果来确诊。近年来不乏有学者报道利用重组蛋白在莱姆病血清ELISA试验诊断中的重要意义。OspC, Fla, P39,DbpA,P83等重组蛋白已被用于莱姆病的ELISA试验中。早在1999年有学者发现,Borreliaburgdorferi型菌株B31的VlsE蛋白在莱姆病血清IgG的检测中有较高的敏感度和特异性,其保守的IR6肽段在区分梅毒血清与莱姆病血清中,90%的特异性远远大于全菌蛋白在梅毒血清中的特异性20%[10-11]。但由于VlsE蛋白在不同基因型不同株的莱姆病螺旋体中变异较大,基因同源性仅有60%左右[8],且并非所有菌株均含有VlsE基因,故而表达一个基因型一株菌的VlsE蛋白在检测诊断中具有一定的偏倚性。Msria J等研究比较了Borreliaburgdorferi型菌株B31和Borreliagarinii型菌株IP90合成的IR6肽在莱姆病血清ELISA检测中的作用,结果显示不同基因型的IR6肽在区分莱姆病血清和梅毒血清的特异性有所不同。且不同型的IR6肽在灵敏度和特异性上与血清的地区来源有正相关性[12]。
由于国内莱姆病螺旋体主要以B.g,B.a型为主[6],本次研究以B.a型菌株为研究对象,通过PubMed上已有的B.a型菌株的VlsE基因序列的对比分析,发现了一段近400 bp两端高度保守的基因序列,并对此保守区进行了克隆表达,获得了高效、稳定表达的重组VlsE蛋白, WB结果显示重组VlsE蛋白具有较好的抗原性。重组VlsE蛋白在莱姆病血清ELISA检测中,其敏感度和特异性与全菌蛋白比较均无明显优势,可能与VlsE基因在病人所感染菌株中是否表达或全菌各蛋白间的相互作用有关。但值得重视的是,全菌蛋白在诊断莱姆病血清时,易与梅毒病人血清产生交叉反应,90份梅毒血清中,全菌蛋白诊断阳性率(81.1%)远远高于重组蛋白(16.7%),可见重组VlsE蛋白在区分莱姆病血清和梅毒血清中具有重要作用,可以作为莱姆病重组试剂盒的抗原成分之一。
参考文献:
[1]Stanek G, Wormser G P, Gray J, et al. Lyme borreliosis[J].The Lancet, 2012, 379(9814): 461-473. DOI: 10.1016/S0140-6736(11)60103-7
[2]Wang YJ, Shi LM, Bao FK, et al. The research progress of Lyme disease diagnostic technology[J].Bull Sci Technol, 2013, 29(5): 37-46.(in Chinese)
汪玉娇,史立敏,宝福凯,等.莱姆病诊断技术研究进展[J].科技通报,2013,29(5): 37-46.
[3]Niu QL,Yin H, Luo JX. The research progress of Lyme disease in China[J].Progr Vet Med, 2009, 30(10): 89-93.(in Chinese)
牛庆丽,殷宏,罗建勋.国内莱姆病研究进展[J].动物医学进展,2009,30(10): 89-93.
[4]Stanek G, Lusa L, Ogrinc K, et al. Intrathecally produced IgG and IgM antibodies to recombinant VlsE, VlsE peptide, recombinant OspC and whole cell extracts in the diagnosis of Lyme neuroborreliosis[J].Med Microbiol Immunol, 2014, 203(2): 125-132. DOI: 10.1007/s00430-013-0322-1
[5]Porwancher RB, Hagerty CG, Fan J, et al. Multiplex immunoassay for Lyme disease using VlsE1-IgG and pepC10-IgM antibodies: improving test performance through bioinformatics[J].Clin Vaccine Immunol, 2011, 18(5): 851-859. DOI: 10.1128/CVI.00409-10
[6]Van Burgel ND, Brandenburg A, Gerritsen HJ, et al. High sensitivity and specificity of the C6-peptide ELISA on cerebrospinal fluid in Lyme neuroborreliosis patients[J].Clin Microbiol Infect, 2011, 17(10): 1495-1500. DOI: 10.1111/j.1469-0691.2011.03459.x
[7]Hao Q, Hou X, Geng Z, et al. Distribution ofBorreliaburgdorferisensu lato in China[J].J Clin Microbiol, 2011, 49(2): 647-650. DOI: 10.1128/JCM.00725-10
[8]Gottner G, Schulte-Spechtel U, Wilske B. Heterogeneity of the immunodominant surface protein VlsE among the three genospecies ofBorreliaburgdorferipathogenic for humans[J].Int J Med Microbiol Suppl, 2004, 293: 172-173.
[9]Marques AR. Laboratory diagnosis of Lyme disease: advances and challenges[J].Infect Dis Clin North Am, 2015, 29(2): 295-307. DOI: 10.1016/j.idc.2015.02.005
[10]Liang FT, Steere AC, Marques AR, et al. Sensitive and specific serodiagnosis of Lyme disease by enzyme-linked immunosorbent assay with a peptide based on an immunodominant conserved region ofBorreliaburgdorferiVlsE[J].J Clin Microbiol, 1999, 37(12): 3990-3996.
[11]Lawrenz MB, Hardham JM, Owens RT, et al. Human antibody responses to VlsE antigenic variation protein ofBorreliaburdorferi[J]. J Clin Microbiol, 1999, 37(12): 3997-4004.
[12]Gomes-Solecki MCJ, Meirelles L, Glass J, et al. Epitope length, genospecies dependency, and serum panel effect in the IR6 enzyme-linked immunosorbent assay for detection of antibody toBorreliaburdorferi[J].Clin Vaccine Immunol, 2007, 14(7): 875-879.
DOI:10.3969/j.issn.1002-2694.2016.01.003
通讯作者:万康林,Email: wankanglin@icdc.cn;
中图分类号:R377
文献标识码:A
文章编号:1002-2694(2016)01-0013-04
Corresponding authors: Wan Kang-lin, Email: wankanglin@icdc.cn; Hao Qin, Email: haoqin@icdc.cn
收稿日期:2015-07-22;修回日期:2015-10-20
Cloning and expressing a conserved region of surface protein VlsE gene from a Chinese Borrelia afzelii strain GDsh1 and analyzing antigenicity of rVlsE protein
LIU Wei,ZHANG Lin,HOU Xue-xia,LIU Hui-xin,HAO Qin,WAN Kang-lin
(StateKeyLaboratoryforInfectiousDiseasesPreventionandControl,CollaborativeInnovationCenterforDiagnosisandTreatmentofInfectiousDiseases,NationalInstituteforCommunicableDiseaseControlandPrevention,ChineseCenterforDiseaseControlandPrevention,Beijing102206,China)
Abstract:We cloned and expressed a conserved region of surface protein VlsE gene from a Chinese Borrelia afzelii strain GDsh1, and analyzed the antigenicity of the rVlsE protein to support the development of Chinese ELISA recombinant antigen detection kit for Lyme disease. According to literature, we downloaded and aligned VlsE sequences of all B. afzelii strains from PubMed to identify conserved segment and design primers. The target fragment was amplified and inserted into an expression vector PET-32a and expressed in E. coli B21. The expressed protein was identified by SDS-PAGE, western blot and gene sequence. ELISA was performed with the rVlsE protein to test 83 Lyme disease sera, 90 negative serum samples and 90 samples of syphilis serum, thereby to determine the sensitivity and specificity of the rVlsE protein. SDS-PAGE analysis showed the conserved region was successful expressed in E. coli. Western blot results confirmed that recombinant protein was able to response with immune rabbit serum. ELISA results showed that the sensitivity of rVlsE protein and the whole borrelia burgdorferi protein were 60.2% and 92.8%(P<0.001), the specificity were 73.3% and 68.9%(P=0.511). The specificity of this method in the detection of syphilis serum was 83.3%, much higher than that using the whole bacterial protein(18.9% specificity)(P<0.001). The method using conserved fragments of VlsE protein has certain sensitivity and specificity in the distinguishing of syphilis and Lyme serum samples, its specificity is much higher than the whole cell protein. Therefore, the conserved fragments of VlsE in Lyme disease serological detection should not be ignored.
Keywords:Borrelia burgdorferi; VlsE protein; gene expressing; antigenic analysis
国家科技重大专项(No.2013ZX10004-001,No. 2013ZX10004-101)
郝琴,Email: haoqin@icdc.cn
