减毒沙门氏菌投递的TGEV S基因疫苗口服免疫猪的动态规律
2016-07-27张小会梁恩涛黄小波曹三杰文心田文翼平
张小会,张 丹,梁恩涛,余 敏,黄小波,2,曹三杰,2,文心田,2,文翼平,2,伍 锐,2
减毒沙门氏菌投递的TGEV S基因疫苗口服免疫猪的动态规律
张小会1,3,张丹1,梁恩涛1,余敏1,黄小波1,2,曹三杰1,2,文心田1,2,文翼平1,2,伍锐1,2
1.四川农业大学动物医学院,动物传染病与基因芯片实验室,雅安625014;2.四川农业大学人兽共患病研究室与猪病防治研究中心,成都611130;3.屏山县畜牧兽医局,宜宾645350
摘要:目的研究TGEV S基因疫苗SL7207(PVAXD-TS)口服免疫仔猪后的动态免疫诱导规律。方法将口服疫苗SL7207(PVAXD-TS)、空载体菌株SL7207(PVAXD)以1.6×1011CFU/头的剂量口服接种20日龄仔猪,以PBS为空白对照,2周后以2.0×1011CFU的剂量加强免疫。分别测定0、2、4、6和8周的血清IgG、IgA、TGEV中和抗体、细胞免疫反应 IL-4、IFN-γ、外周血淋巴细胞增殖情况。结果仔猪口服免疫后第4周即可检测抗TGEV的特异性IgG和粪黏液IgA抗体;在免疫后第6周IgA、IgG、IL-4、IFN-γ抗体和外周血T淋巴细胞增殖与SL7207(PVAXD)、PBS间均存在统计学差异(P<0.01),并在第6周达到最高值;中和实验显示该疫苗诱导的血清IgG具有中和活性。结论证实以减毒沙门菌为载体的TGEV S基因疫苗口服免疫仔猪有较好的免疫原性。
关键词:猪传染性胃肠炎;减毒沙门氏菌;S基因;仔猪;免疫原性
Supported by the National Natural Science Foundation of China(Nos. 30901084 & 31072144)
猪传染性胃肠炎(Transmissible Gastroenteritis ,TGE)是由猪传染性胃肠炎病毒(transmissible gastroenteritis virus ,TGEV)引起的一种肠道传染病,各年龄阶段的猪均可感染本病,尤其是2周龄以内的哺乳仔猪最易感,其死亡率高达100%[1],TGE已给各国养猪业造成了极大危害。目前该病尚无有效的药物可用于治疗,因此,疫苗预防接种仍然是防治该病的最佳选择。
TGEV的S糖蛋白突出于病毒粒子表面,具有重要的免疫学功能。S 蛋白携带主要的B 淋巴细胞抗原决定簇,是唯一能诱导机体产生中和抗体的结构蛋白[2]。猪传染性胃肠炎病毒S蛋白是具有良好免疫原性的结构蛋白,能诱导特异性IgG和黏膜sIgA抗体的产生[3-4]。黄小波等[5]研究的减毒沙门氏菌递呈的TGEV S/N融合基因疫苗在小鼠体内具有良好的免疫原性,但与TGEV S单基因疫苗相比,差异无统计学意义(P>0.05),且SL7207(pVAX-S/N)干扰素水平低于SL7207(pVAX-S)。多项研究表明TGEV S单基因疫苗具有良好的免疫原性。任晓峰等[6]构建的含TGEVS基因主要抗原位点的DNA疫苗,通过肌肉注射免疫小鼠,可诱导小鼠产生较高水平的IgG和IgA抗体。Ahn等[7]将构建的TGEV S基因转基因植物疫苗饲喂小鼠,诱导小鼠产生了特异性IgG和IgA抗体。
减毒沙门氏菌作为疫苗载体被广泛应用各种疫苗的研究中。其所携带的外源性抗原基因可在宿主体内有效表达[8]。减毒沙门氏菌作为DNA疫苗载体的显著优点是能进行口服免疫,刺激机体产生强烈的局部粘膜免疫、体液免疫和细胞免疫[9]。减毒沙门氏菌作为鼠疫疫苗的载体递呈抗原,诱导小鼠产生高滴度的IgG抗体,表明其具有良好的免疫原性[10]。Yang等[11]构建了旋毛虫优势抗原Ts87的重组减毒沙门氏菌菌株,口服免疫小鼠,诱导了全身性Thl/Th2细胞免疫反应和局部黏膜IgA抗体的产生。因此,近年来被广泛用于新型疫苗的研发。
本研究前期构建了携带TGEV S基因的减毒沙门氏菌SL7207(PVAXD-TS) ,经菌株的体外稳定性试验和小鼠的安全性试验,证实该菌株具有良好的稳定性与安全性。同时该疫苗口服免疫小鼠后可有效激发小鼠产生抗TGEV的血清IgG、肠道黏膜IgA抗体和IFN-γ[12]。本研究在前期小鼠实验的基础上,进一步将该疫苗通过口服免疫仔猪,研究其在仔猪体内的免疫诱导规律,为该疫苗的应用提供参考依据。
1材料与方法
1.1菌株、细胞和动物重组减毒沙门氏菌SL7207(PVAXD-TS) 和SL7207(PVAXD)由四川农业大学动物传染病实验室前期构建;Vero细胞和ST细胞由四川农业动物传染病实验室传代保存;15头20 d龄健康的杜-长-大三元仔猪,购自雅安某猪场。
1.2主要试剂小量质粒抽提试剂盒:OMEGA公司产品;Hind III和KpnI限制性内切酶:宝生物工程(大连)有限公司产品;测定抗体(IgG,和IgA)的ELISA试剂盒,测定细胞因子(IFN-γ、IL-4)的ELISA试剂盒:R&D 公司产品;猪淋巴细胞分离液:TBD天津灏洋公司产品;小牛血清和DMEM培养基:GIBCO公司产品;卡那霉素:Biosharp公司产品;MTT、肝素钠、ConA :Amresco公司产品。
1.3复苏与鉴定将菌株SL7207(PVAXD-TS)与对照菌株SL7207(PVAXD)复苏接种于5 mL含Kan的LB液体培养基中,37 ℃ ,220 r/min振荡培养过夜,将过夜培养的菌液涂布于含Kan的LB琼脂平板培养16~20 h。挑取SL7207(pVAXD-TS)和SL7207(PVAXD)的单菌落接种于5 mL含Kan的LB液体培养基中,37 ℃, 220 r/min振荡培养过夜。按OMEGA公司去内毒素质粒提取试剂盒说明书提取质粒,进行PCR与酶切鉴定。
1.4口服疫苗制备选取鉴定后的重组减毒沙门氏菌SL7207(PVAXD-TS) 和对照组SL7207(PVAXD)的单菌落接种于5 mL含100 μg/mL的Kan的LB液体培养基中,37 ℃, 220 r/min振荡培养过夜。将过夜培养的菌液按照1∶100比例接种于2 000 mL含Kan的LB液体培养基中,37 ℃,220 r/min振荡培养至OD600值约为0.8左右。4 000 r/min离心5 min后收集菌体,用含5%NaHCO3的灭菌PBS调整菌液浓度至2×1010CFU/mL。
1.5口服免疫将15头仔猪随机分成3组,每组5头,分别为实验组SL7207(PVAXD-TS) 、对照组SL7207(PVAXD)和PBS,仔猪免疫前禁食禁水5 h,免疫后禁食禁水2 h。口服免疫仔猪,SL7207(PVAXD-TS) 和SL7207(PVAXD)以每只1.6×1011CFU的剂量进行初次免疫,2周后以2.0×1011CFU的剂量进行加强免疫,共免疫2次,PBS组饲喂含5%NaHCO3的PBS,其余相同。每天观察仔猪精神、食欲、饮欲、粪便等情况,连续观察至第8周。
1.6样品收集
1.6.1血液样品在首免后第0、2、4、6和8周分别采集每头猪的血液3 mL,一部分血液加入肝素纳抗凝,用于测定外周血T淋巴细胞的转化率,剩余部分分离血清于-20 ℃保存备用。
1.6.2粪便黏液样品肛拭棉法取粪便样品,做好标记。样品逐个加入200 μL 0.01 mol/L的PBS浸泡肛拭棉,4 ℃作用1.5 h,离心收集上清液,-20 ℃保存待检。
1.7免疫相关指标检测
1.7.1特异性血清IgG和黏膜IgA的测定参照ELISA试剂盒说明书测定血清IgG和IgA,主要步骤:1)ELISA实验设置标准品、待测样本和空白孔,标准品孔对应加入2倍稀释的标准液;样本孔加待测仔猪血清10 μL,样本稀释液40 μL,吹打混匀;2)加入HRP标记的二抗50 μL,37 ℃恒温箱温育1 h;3)弃去酶标板中的液体,加入稀释的洗涤液,洗涤5次,拍干;4)加入底物A和底物B各50 μL,37 ℃避光15 min;5)加入终止液50 μL,反应10 min;6)450 nm波长下测定各孔OD450值。
1.7.2猪 IL-4和IFN-γ水平检测参照ELISA试剂盒说明书测定血清IL-4和IFN-γ,主要步骤同1.7.1,不同之处是:检测IL-4时待测样品孔加入待测仔猪血清40 μL,抗-IL-4抗体10 μL、链霉亲和素-HRP 50 μL;测IFN-γ时加入抗IFN-γ抗体,链霉亲和素-HRP 50 μL。
1.7.3外周血T淋巴细胞实验1)采用一次性注射器无菌采集仔猪前腔静脉血液,于灭菌的已加入肝素钠的4 mL离心管内,取肝素钠抗凝血缓慢加于淋巴细胞分离液上,采用淋巴细胞分离液密度梯度离心法(2 000 r/min,12 min)分离外周血淋巴细胞,收集淋巴细胞;用PBS缓冲液洗涤2次,再用不完全RPMIl640洗涤1次,最后用完全RPMI1640将细胞稀释成5×106个/mL。2)取100 μL淋巴细胞悬液加入96 孔细胞培养板,每个样品重复3孔;加入终浓度为25 μg/mL 的ConA,置培养板于37 ℃、5% CO2的细胞培养箱内培养68 h后每孔加入MTT溶液(5 mg/mL),10 μL,继续培养4 h后每孔加入DMSO 100 μL,培养2 h,于490 nm波长处测定其OD490值。
1.7.4中和实验按常规方法培养ST细胞,接种TGEV病毒,按Reed-Muench法计算出TGEV TCID50。将采集的第6周的仔猪血清56 ℃处理30 min,-80 ℃保存备用。将密度为1×105个/孔的ST细胞接种于24孔细胞培养板中,置于37 ℃、5% CO2条件下培养至长成单层细胞。将滴度为100TCID50的TGEV分别与1∶4,1∶16,1∶64,1∶256,1∶1 024稀释的血清37 ℃,作用1 h,将混合物接种到单层细胞上,每个孔重复4次,同时设细胞对照和病毒对照,置于37 ℃ 5% CO2细胞培养箱中培养,逐日观察,统计出现CPE和未出现CPE的细胞孔数,计算血清的中和抗体效价。
1.8数据处理数据的分析处理用SPSS Statistic17.0软件。
2结果
2.1复苏鉴定将菌株SL7207(PVAXD-TS)复苏培养,提取质粒PVAXD-TS分别进行PCR和酶切鉴定,结果PCR扩增出约1 900 bp的条带,与预期的TGEV S抗原基因(1 896 bp)大小相符(见图1A);用Hind III和KpnI对pVAXD-TS双酶切,可切出与预期大小相符的目的片段约(1 900 bp)和载体片段(3 800 bp)(见图1)。
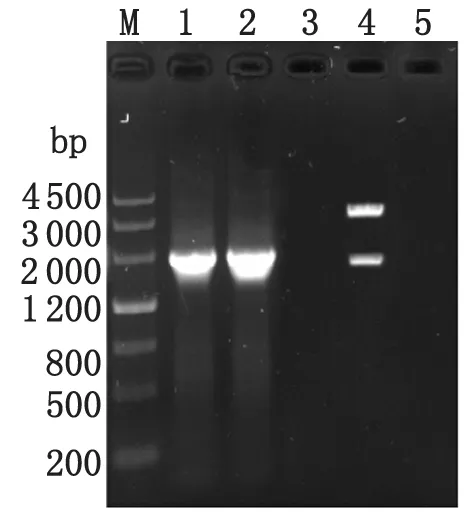
M: DNA Marker; lane1, 2: S gene fragment of TGEV amplified by PCR from pVAXD-TS; lane 3: negative controls; lane 4: plasmid pVAXD-TS digested by Hind III / KpnI.
2.2TGEV特异性抗体的动态变化免疫后第2周,免疫组SL7207(pVAXD-TS)刺激产生的特异性抗体水平IgG、IgA均有所上升,在免疫后第4周特异性抗体含量与对照组SL7207(pVAXD)、PBS间差异存在统计学意义(P<0.01);在第6周抗体含量达到最高值,其中TGEV IgG达(129.24±5.27) ng/mL,(图2A),IgA达(80.88±5.37) ng/mL(2B);免疫后第8周抗体水平下降。
2.3仔猪血清γ-干扰素和IL-4水平动态变化免疫后第2周,免疫组SL7207(pVAXD-TS)刺激产生的IFN-γ含量有所上升; 免疫后第4周IFN-γ含量显著高于免疫前和对照组SL7207(pVAXD)、PBS(P<0.01);免疫后第6周达到最高值(497.07±36.02 pg/mL);免疫后第8周,IFN-γ含量有所下降(图3A)。IL-4检测结果显示:免疫后第2周,免疫组IL-4含量有所上升;免疫后第4周,免疫组SL7207(pVAXD-TS)IL-4含量与SL7207(pVAXD)、PBS和免疫前相比差异极显著(P<0.01);免疫后第6周IL-4含量达到最高峰(289.16±3.44 pg/mL);免疫后第8周,IL-4含量有所下降(图3B)。
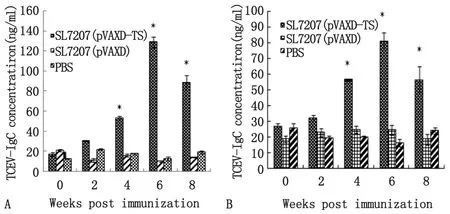
A: serum IgG level; B: feces mucosal IgA level.
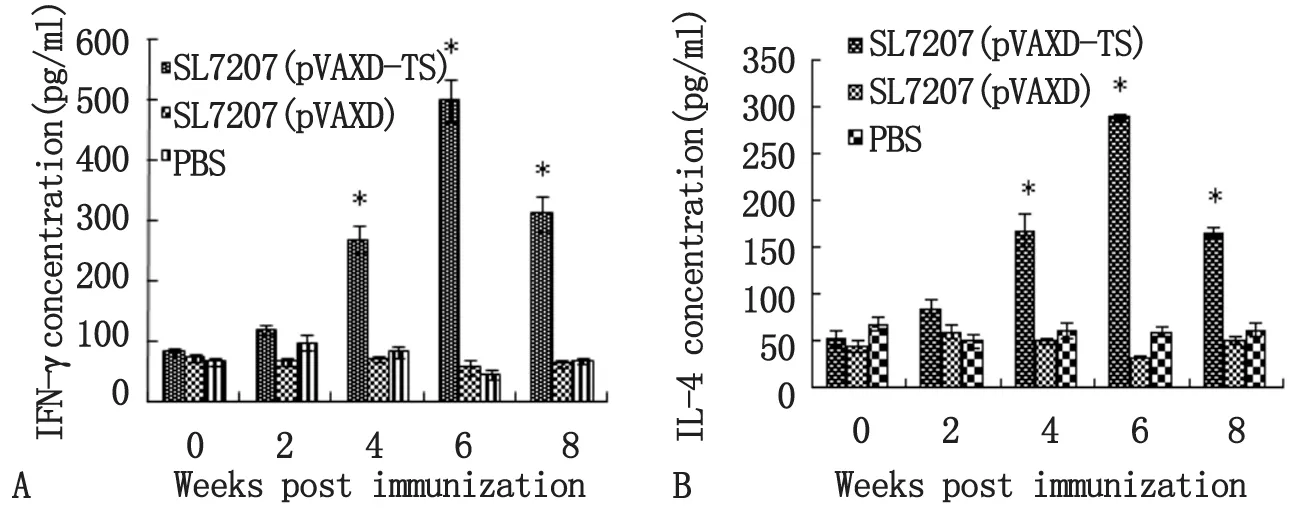
A: interferon-γ level; B: IL-4 level.
2.4仔猪血液T淋巴细胞增殖的动态规律免疫后第2周,免疫组SL7207(pVAXD-TS)对外周血T淋巴细胞的刺激作用开始增强,在4~6周间增长最快,到第6达到最高值;免疫后第6周,免疫组SL7207(pVAXD-TS)与对照组SL7207(pVAXD)和PBS间有极显著差异(P<0.01);免疫后第8周,免疫组T淋巴细胞增殖水平有所下降。整个免疫过程中,SL7207(pVAXD)和PBS对照组对淋巴细胞均无明显刺激作用,一直处于较低水平(图4)。
2.5疫苗诱导的TGEV中和抗体动态变化采集免疫后第6周的仔猪血液,分离血清,采用固定病毒稀释血清的方法测定血清中和效价。中和实验结果显示,随血清稀释度的增加其病毒抑制力明显下降,在血清稀释度为1∶4~1∶64之间具有较强的中和活性,且与对照组SL7207(pVAXD)和PBS间存在统计学差异(P<0.01)。由统计结果计算出SL7207(pVAXD -TS)的中和效价为10-1.58(1∶38.02),显示了较好的中和活性(见图5)。
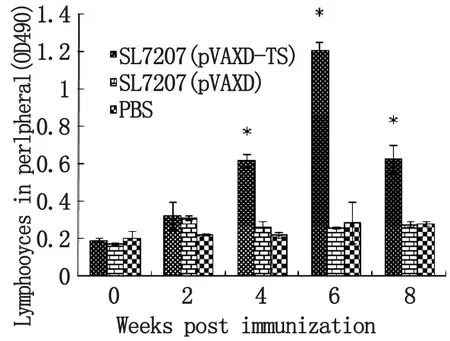
图4 仔猪外周血T淋巴细胞增殖水平
3讨论
减毒沙门氏菌的显著优点是能够作为黏膜免疫载体,进行黏膜免疫接种,其在诱导机体产生黏膜免疫反应方面有着不可比拟的优越性[10]。以减毒沙门氏菌为载体构建的多种疫苗均能够诱导机体产生特异性体液免疫和粘膜免疫反应[13],产生较高的IgG和IgA抗体[14-15]。目前,关于乳酸菌作为 TGEV疫苗载体开展口服免疫研究的报道也较多[16]。Liu[17], Ho等[18],Tang等[19]构建的TGEV S基因的乳酸菌疫苗,免疫小鼠均能诱导产生良好的免疫反应,但诱导的特异性抗体含量均远低于本研究以沙门氏菌为载体的疫苗的免疫结果。上述结果表明,以减毒沙门氏菌为载体的口服疫苗具有良好的免疫应答,且减毒沙门氏菌作为TGEV DNA疫苗载体可能比乳酸菌更具优势。
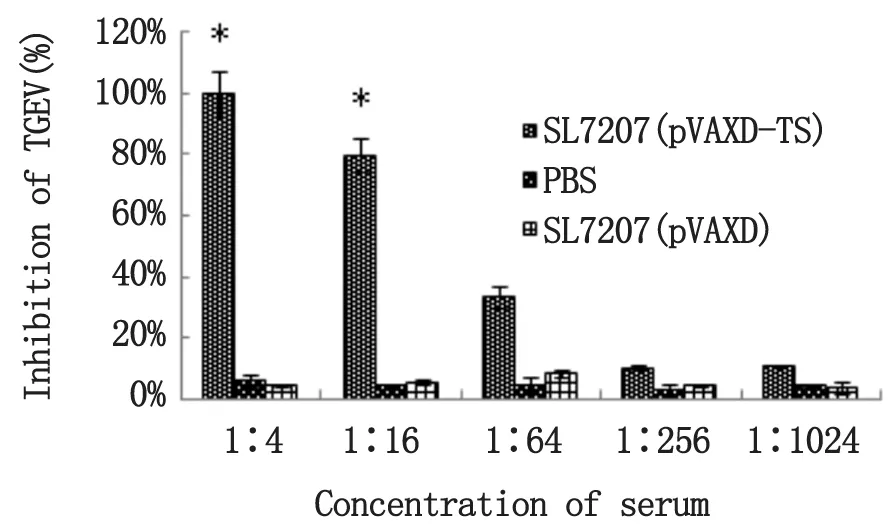
图5 抗TGEV中和抗体检测
TGE主要通过肠道感染猪体,猪小肠是TGEV的重要靶器官。肠道局部粘膜免疫对阻止TGEV的侵入具有极其重要的作用,肠道分泌型 IgA(sIgA)抗体在抗TGEV感染中发挥主要作用[20]。口服免疫主要是通过胃肠黏膜进行抗原递呈,进而刺激肠道产生局部粘膜免疫应答。因此,选择一种能刺激肠道产生IgA抗体的免疫途径符合TGEV的感染机理。目前,关于口服免疫有效激发机体产生免疫应答的报道较多[21]。赵德[22]等将PEDV S(C-COE)重组乳酸菌疫苗通过口服和肌肉注射两种途径免疫小鼠,结果表明口服比肌肉注射更容易吸收,产生较高水平的抗体。本研究结合TGEV肠道粘膜免疫机理,采用口服途径接种仔猪,免疫后第2周即能检测肠道分泌型IgA抗体和血清IgG抗体。本研究结果表明,口服免疫能够诱导仔猪产生针对TGEV的体液免疫和细胞免疫应答。
TGEV S基因疫苗的免疫原性研究前期多在小鼠体内进行[5,12],不能反应其在本种动物体内的免疫原性。本研究中,SL7207(pVAXD-TS)能够诱导仔猪产生较强的体液免疫和细胞免疫应答。根据检测结果比较发现,该疫苗诱导产生的特异性抗体含量,特别是IgG 抗体含量远大于Ho[18]和Liu[17]等报道的特异性抗体含量。同时,SL7207(pVAXD-TS)诱导的抗TGEV中和抗体在血清稀释度为1∶4时,病毒抑制率为100%,高于文献Liu[17,19]等报道的血清稀释度为1∶2时,病毒抑制率为100%。此外,本研究测定的细胞因子含量(IL-4、IFN-γ)和MTT值均远高于此前文献的相关报道[23-25],但IFN-γ含量低于黄小波等[6]报道。这可能与动物模型、免疫剂量、基因片段、长度等有关。
本研究结果显示,重组沙门氏菌SL7207(pVAXD-TS)在仔猪体内诱导的免疫动态规律与小鼠基本相似[12]。该疫苗口服免疫妊娠母猪和其他年龄阶段猪只能否像仔猪一样产生明显的细胞免疫、体液免疫和局部黏膜免疫应答需要进一步研究。此外,本研究为了阐明疫苗的动态免疫规律,为了避免仔猪日龄过小产生应激发病而影响试验,特选用了20日龄左右的仔猪,由于免疫周期长达8周,当研究结束时仔猪日龄已达到70日龄左右,此日龄段的仔猪可感染TGEV但通常无明显症状,所以本研究未进行攻毒保护试验,而是以体外抗体中和试验进行间接评价疫苗效果。在本研究基础上,后续将开展母猪的口服免疫抗体监测,同时以产房一周内的仔猪进行攻毒保护试验,以更贴近临床发病实际情况来科学评价该疫苗的免疫保护效果。
参考文献:
[1]Mateos-Gomez PA, Zuniga S, Palacio L, et al. Gene N proximal and distal RNA motifs regulate coronavirus nucleocapsid mRNA transcription[J]. J Virol, 2011, 85(17): 8968-8980. DOI: 10.1128/JVI.00869-11
[2]Jimenez G, Correa I, Melgosa MP, et al. Critical epitopes in transmissible gastroenteritis virus neutralization[J]. J Virol, 1986, 60(1): 131-139. DOI: 10.1007/978-1-4684-1280-2_44
[3]Tang F, He KW, Hou JB, et al. Construction and immunization of recombinant adenovirus expressing the B, C antigenic sites of spike gene from transmissible gastroenteritis virus(TGEV)[J]. J Agr Biotechnol, 2009, 17(1): 1-6.(in Chinese)
唐芳, 何孔旺, 侯继波, 等.猪传染性胃肠炎病毒(TGEV) S 蛋白 5′ 端基因重组腺病毒的构建及其免疫特性[J]. 农业生物技术学报, 2009(1): 1-6.
[4]Tuboly T, Nagy E. Construction and characterization of recombinant porcine adenovirus serotype 5 expressing the transmissible gastroenteritis virus spike gene[J]. J General Virol, 2001, 82(1): 183-190. DOI: 10.1099/0022-1317-82-1-183)
[5]Huang XB, Zhang XM, Cao SJ, et al. Immunogenicity of attenuatedSalmonellatyphimuriumharbouring S/N fusion gene of porcine transmissible gastroenteritis virus[J]. Chin J Zoonoses, 2013, 29(6): 594-600.(in Chinese)
黄小波, 张鑫淼, 曹三杰, 等.减毒沙门氏菌递呈的TGEVS/N 融合基因疫苗的口服免疫原性[J]. 中国人兽共患病学报, 2013,29(6): 594-600.
[6]Ren XF, Yin JC, Si W, et al. Construction of nucleic acid vaccines containing S gene from TGEV isolate TH-98 and their immune effect in mice[J]. Vet Sci China, 2006, 36(03): 203-206.(in Chinese)
任晓峰,尹杰超,司微,等.猪传染性胃肠炎病毒TH-98株S基因核酸疫苗的构建及其免疫效力[J].中国兽医科学, 2006. 36(3): 203-206.
[7]Ahn DJ, Youm JW, Kim SW, et al. Expression of the S glycoprotein of transmissible gastroenteritis virus(TGEV) in transgenic potato and its immunogenicity in mice[J]. Korean J Vet Res, 2013, 53(4): 217-224. DOI: 10.14405/kjvr.2013.53.4.217
[8]Staats HF, Jackson RJ, Marinaro M, et al. Mucosal immunity to infection with implications for vaccine development[J]. Curr Opin Immunol, 1994, 6(4): 572-583. DOI: 10.1016/0952-7915(94)90144-9
[9]Han YW, Kim SB, Rahman M, et al. Systemic and mucosal immunity induced by attenuatedSalmonellaentericaserovar Typhimurium expressing ORF7 of porcine reproductive and respiratory syndrome virus[J]. Comparat Immunol Microbiol Infect Dis, 2011, 34(4): 335-345. DOI: 10.1016/j.cimid.2011.04.001
[10]Sizemore DR, Warner EA, Lawrence JA, et al. Construction and screening of attenuated ΔphoP/QSalmonellatyphimuriumvectored plague vaccine candidates[J]. Human Vaccines Immunotherapeutics, 2012, 8(3): 371-383. DOI:10.4161/hv.18670
[11]Yang YP, Zhang ZF, Yang J, et al. Oral vaccination with Ts87 DNA vaccine delivered by attenuatedSalmonellatyphimuriumelicits a protective immune response againstTrichinellaspiralislarval challenge[J]. Vaccine, 2010, 28(15): 2735-2742. DOI: 10.1016/j.vaccine .2010.01.026
[12]Liao XD. The oral immunization of attenuatedSalmonellatyphimuriumpresent DNA vaccine of PEDV and TGEV S double-genes[D].Ya'an: Sichuan Agricultural University, 2012.(in Chinese)
廖晓丹. 减毒沙门氏菌递呈 PEDV/TGEV 双基因核酸疫苗研究[D].雅安:四川农业大学, 2012.
[13]Liu JY, Zhang SW, Qi JD, et al. Immunogenicity of a tuberculosisSalmonellatyphimuriumvaccine expressing a fusion protein HspX-ESAT6 in mice[J]. J Anim Vet Adv, 2013, 12(4): 458-463.
[14]Cheng M, He J, Fu Y, et al. Antibody responses induced by mucosal DNA vaccine encoding the codon-optimized F protein of human respiratory syncytial virus(RSV) delivered with attenuated Salmonella typhimurium[J]. Acta Microbiologica Sinica, 2011, 51(7): 965-971.
[15]Yang H, Cao SJ, Huang XB, et al. Intragastric administration of attenuatedSalmonellatyphimuriumharbouring transmissible gastroenteritis virus(TGEV) DNA vaccine induced specific antibody production[J]. Vaccine, 2009, 27(37): 5035-5040. DOI: 10.1016/j.vaccine .2009.06.050
[16]Tang LJ, Ou D, Ge JW, et al. Construction of recombinantLactococcuslactisexpressing porcine transmissible gastroenteritis spike glycoprotein and analysis of immunogenicity[J]. Acta Microbiologica Sinica, 2007, 47(2): 340-344.(in Chinese)
唐丽杰, 欧笛, 葛俊伟.表达猪传染性胃肠炎病毒S基因的重组乳酸乳球菌的构建及免疫原性分析[J]. 微生物学报, 2007,47(2): 340-344.
[17]Liu DQ, Qiao XY, Ge JW, et al. Construction and characterization ofLactobacilluspentosusexpressing the D antigenic site of the spike protein of transmissible gastroenteritis virus[J]. Canadian J Microbiol, 2011, 57(5): 392-397.
[18]Ho P, Kwang J, Lee Y. Intragastric administration ofLactobacilluscaseiexpressing transmissible gastroentritis coronavirus spike glycoprotein induced specific antibody production[J]. Vaccine, 2005, 23(11): 1335-1342. DOI: 10.1016/j.vaccine .2004.09.015
[19]Tang LJ, Li YJ. Oral immunization of mice with recombinantLactococcuslactisexpressing porcine transmissible gastroenteritis virus spike glycoprotein[J]. Virus Genes, 2009, 39(2): 238-245. DOI: 10.1007/s11262-009-0390-x
[20]Shirato K, Maejima M, Matsuyama S, et al. Mutation in the cytoplasmic retrieval signal of porcine epidemic diarrhea virus spike(S) protein is responsible for enhanced fusion activity[J]. Virus Res, 2011, 161(2): 188-193. DOI: 10.1016/j.virusres.2011.07.019
[21]Hou XL, Yu LY, Liu JZ. Development and evaluation of enzyme-linked immunosorbent assay based on recombinant nucleocapsid protein for detection of porcine epidemic diarrhea(PEDV) antibodies[J]. Vet Microbiol, 2007, 123(1): 86-92.
[22]Zhao D, LI P, Gao FS, et al. Immunization of PEDV recombinantLactococcuslactisto mouse[J].Progr Vet Med, 2013, 34(3):6-9.(in Chinese)
赵德,李鹏,高凤山,等.猪流行性腹泻病毒乳酸菌载体疫苗对小鼠初步免疫试验[J]. 动物医学进展, 2013,34(3):6-9.
[23]Meng FD, Ren YD, Suo SQ, et al. Evaluation on the efficacy and immunogenicity of recombinant DNA plasmids expressing spike genes from porcine transmissible gastroenteritis virus and porcine epidemic diarrhea virus[J]. PLoS One, 2013, 8(3): e57468. DOI: 10.1371/journal.pone.0057468
[24]Liu Y. Immunization of recombinantLactococcuslactisexpressing transmissible gastroenteritis virus S gene to mouse and newborn piglets[D].Changchun: Jilin Agricultural University, 2011.(in Chinese)
刘义. TGEV S 基因重组乳酸菌对小鼠和初生仔猪的口服免疫研究[D].长春:吉林农业大学, 2011.
DOI:10.3969/j.issn.1002-2694.2016.01.008
通讯作者:黄小波,Email:rsghb110@126.com
中图分类号:S855.3
文献标识码:A
文章编号:1002-2694(2016)01-0033-06
Corresponding author:Huang Xiao-bo, Email: rsghb110@126.com
收稿日期:2014-12-09;修回日期:2015-11-07
Dynamic oral immuno-induction regulation of attenuated Salmonella typhimurium harboring DNA vaccine expressing S gene of transmissible gastroenteritisvirus in piglets
ZHANG Xiao-hui1,3,ZHANG Dan1,LIANG En-tao1,YU-Min1,HUANG Xiao-bo1,2,CAO San-jie1,2,WEN Xin-tian1,2,WEN Yi-ping1,2,WU Rui1,2
(1.LaboratoryofAnimalInfectiousDiseaseandMicroarray/KeyLaboratoryofAnimalDiseaseandHumanHealthofSichuanProvince,CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Ya'an625014,China;2.LaboratoryofZoonosisandPigDiseasePreventionResearchCenter,SichuanAgriculturalUniversity,Chengdu611130,China;3.PingshanCountyAnimalHusbandryandVeterinaryBureau,Yibin645350,China)
Abstract:To develop the dynamic immune regulation of oral vaccine SL7207(pVAXD-TS) in piglets, 20-day-old piglets were orally immunized with SL7207(pVAXD -TS) and SL7207(pVAXD) at a dosage of 1.6 × 1011CFU per piglet, PBS was used as blank control. The booster immunization was done at a dosage of 2.0×1011CFU after 2 weeks. Virus neutralization assay, the specific serum IgG, intestinal mucosal IgA, IFN-γ assay, IL-4 assay, T lymphocyte proliferation assay were respectively performed at 0, 2, 4, 6, 8 weeks. Results showed that SL7207(pVAXD-TS) could induce specific IgG and IgA antibody after four weeks post immunization, and the level of IgA, IgG, IL-4, IFN-γ, and T lymphocytes proliferation were significantly higher(P<0.01) than SL7207(pVAXD) and PBS at 4 weeks; they reached a peak at 6 weeks. Meanwhile, virus neutralization assay showed that serum IgG had a good neutralization activity. It is suggested that the attenuated Salmonella typhimurium harbouring TGEV S gene have a good oral immunogenicity in piglets.
Keywords:Transmissible gastroenteritis; attenuated Salmonella typhimurium; S gene; oral immunogenicity; piglets; immunogenicity
国家自然科学基金项目(No.30901084; No.31072144)
