卒中后认知障碍小鼠胆碱能神经环路组蛋白乙酰化内稳态失衡的机制研究
2016-07-22王鑫孙彩花徐旸朱小云陈霞施伟杨敏
王鑫,孙彩花,徐旸,朱小云,陈霞,施伟,杨敏
·专题·
卒中后认知障碍小鼠胆碱能神经环路组蛋白乙酰化内稳态失衡的机制研究
王鑫,孙彩花,徐旸,朱小云,陈霞,施伟,杨敏
[摘要]目的观察卒中后认知障碍小鼠胆碱能神经环路组蛋白乙酰化内稳态变化。方法选用清洁级ICR雄性小鼠分为假手术组(n=60)和卒中后认知障碍组(PSCI组,n=60)。采用线栓法制备大脑中动脉栓塞(MCAO)模型。水迷宫测试检测小鼠认知功能;分子生物学等方法检测小鼠梗死对侧胆碱能神经环路功能和组蛋白乙酰化内稳态变化情况。结果与假手术组相比,PSCI组水迷宫成绩下降(t>29.412,P<0.05);中枢胆碱能神经环路中,乙酰胆碱(ACh)的含量降低(t>26.227,P<0.05),胆碱乙酰基转移酶(ChAT)mRNA和蛋白的表达降低(t>28.593,P<0.05),乙酰化组蛋白H3(Ac-H3)水平降低(t>24.126,P<0.05),磷酸化cAMP反应元件结合蛋白(p-CREB)和CREB结合蛋白(CBP)表达降低(t>25.634,P<0.05),ChAT基因M型启动子组蛋白乙酰化水平下降(t>24.704,P<0.05)。结论短暂性MCAO模型可以引起小鼠认知功能障碍。PSCI小鼠中枢胆碱能神经环路的胆碱能系统功能受损,乙酰化内稳态失衡,ChAT基因启动子组蛋白乙酰化程度下降;这些很可能与脑卒中导致环路中相应脑区中p-CREB和CBP表达降低有关。
[关键词]卒中后认知障碍;胆碱能环路;乙酰胆碱;组蛋白乙酰化;cAMP反应元件结合蛋白;小鼠
[本文著录格式]王鑫,孙彩花,徐旸,等.卒中后认知障碍小鼠胆碱能神经环路组蛋白乙酰化内稳态失衡的机制研究[J].中国康复理论与实践,2016,22(6):621-628.
CITED AS:Wang X,Sun CH,Xu Y,et al.Change of histone acetylation homeostasis of central cholinergic circuits in mice with post-stroke cognitive impairment[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(6):621-628.
认知功能障碍是脑卒中患者最常见的并发症之一。卒中后认知障碍(post-stroke cognitive impairment,PSCI)严重影响患者的生活质量及功能康复,给家庭和社会带来很大的负担[1-2]。PSCI特指卒中后发生的认知障碍,它被认为是可以进行有效防治的认知障碍性疾病[3]。其发病机制还不完全明了,因此,探讨PSCI的发病机制,寻找PSCI治疗方法,具有重要的现实意义。
乙酰胆碱(acetylcholine,ACh)是迄今发现的与认知功能关系最为密切的一种神经递质,而脑内的中枢胆碱能神经环路,尤其是基底前脑-海马通路,与认知功能关系紧密[4]。在阿尔茨海默病(Alzheimer's disease,AD)或老年性认知障碍的动物模型和临床病例中,均发现胆碱能神经环路的重要脑区(如海马)ACh含量下降,功能明显受损[4-5]。近年来表观遗传学与认知功能的关系逐渐被人们重视,有研究发现AD患者外周血中单核细胞DNA甲基化变化与认知功能呈负相关,老年性认知障碍也与脑内相关脑区(如海马)的染色体修饰紊乱有关[6-7]。不过,关于中枢胆碱能神经环路中表观遗传学变化对认知功能影响的研究却鲜有报道。
本研究以PSCI小鼠为动物模型,观察其中枢胆碱能神经环路中,表观遗传学中基因转录调控的重要方式之一——组蛋白乙酰化的变化情况,为更好地阐明PSCI的发生机制提供动物学研究支持,并为开发治疗PSCI新的康复治疗手段提供客观依据。
1 材料和方法
1.1实验动物
雄性ICR清洁级小鼠200只,体质量25~30g,10~12周龄,由扬州大学医学院实验动物中心提供。按照单双号对小鼠进行编号,单号为模型组,双号为假手术组。
1.2模型制作
模型组采用线栓法制备小鼠右侧大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型[8]。予小鼠戊巴比妥钠45mg/kg腹腔麻醉,常规消毒,于颈部纵向切开皮肤,逐层钝性分离、暴露右侧颈总动脉,分离右侧颈内动脉和颈外动脉,用动脉夹阻断颈内动脉和颈总动脉血流,于颈外动脉远端距离分叉处约6mm的地方斜行剪一小口(不剪断动脉),结扎颈外动脉远端,从动脉剪开的小口处插入6-0尼龙线栓,送至颈总动脉,然后扎紧预留好的丝线,从破口处剪断颈外动脉,松开颈内动脉上的血管夹,将线栓从远端向近端颈内方向推送,直至遇到轻微阻力不能再前送为止,若无明显血液返流,估计此时置入大脑中动脉的线栓深度约1cm左右,则将颈外动脉残端及线栓结扎,开始记录缺血时间。缺血30min后,拔出线栓,缝合皮肤。
假手术组除不插线栓外,其余步骤相同。
在全部造模过程中,手术室温度保持25℃左右,并在造模后使用烤灯帮助其复温,使体温保持在37℃左右。
1.3三苯基氯化四氮唑(Triphenyltetrazolium chloride,TTC)脑染色[9]
术后24h,假手术组和模型组进行随机编号(均为1~100号),每组选取第5、15、25、35、45号各5只小鼠,断头取脑,在-20℃冰箱冷冻10min待脑组织冷冻变硬后取出,用刀片去除嗅球和脑干部分,然后自额极开始行1.5mm厚连续冠状切片,共5片。每隔2mm切一片。第一刀在脑前极与视交叉连线中点处;第二刀在视交叉部位;第三刀在漏斗柄部位;第四刀在漏斗柄与后叶尾极之间;将5片脑片放入2% TTC溶液(由PBS缓冲液配制),用锡箔纸盖住后,放入37℃温箱孵育15~30min,每间隔5min轻柔晃动平皿,使均匀接触到染色液。然后将TTC液倒出,在PBS液中洗3次,每次1min。最后在4%中性福尔马林PBS溶液中固定24h。脑片中白色区域为梗死区域,红色区域为非梗死正常组织区域。
1.4蔗糖水消耗实验[10]
蔗糖水消耗实验(sucrose preference test)是评价实验动物是否有抑郁倾向的重要行为学方法之一,可有效客观地反映实验动物“快感缺失”的情况。其原理是利用小鼠对蔗糖水的嗜好,用以模拟人类的兴趣感。于造模后第12天进行蔗糖水消耗实验。在进行实验前3d,予小鼠训练饮用1%蔗糖水。在实验时,小鼠单笼喂养,在安静的房间内,禁食、禁水10min后,进行实验。同时给予每只小鼠事先定量好的两瓶水:1瓶1%蔗糖水,1瓶纯水。30min后调换蔗糖水和纯水的位置,60min后取走两瓶并称量。计算小鼠糖水消耗比例。

若模型组蔗糖水偏爱百分比与假手术组相比有所下降,提示该小鼠有抑郁倾向,则予以剔除,不进行水迷宫测试。
1.5水迷宫测试[11]
Morris水迷宫实验是目前世界上被普遍认为的较为客观的评价小鼠学习记忆的方法之一。于造模后第14天,小鼠面向池壁分别从4个入水点放入水中若干次,记录其寻找到隐藏在水面下平台的时间(逃避潜伏期,escape latency)、寻找到平台时总的游泳距离(searching distance)以及穿越原平台次数来评价小鼠的学习记忆能力。
1.6PSCI小鼠的选取[12]
动物麻醉清醒后均出现不同程度的精神萎靡,反应迟钝,进食减少,自洁能力下降。术后1d,假手术组小鼠精神逐渐开始恢复,反应也变得灵敏,进食增多。模型组主要表现为运动减少、不能进食、反应迟钝等现象。3~5d后模型组小鼠精神、反应、进食逐渐恢复,1周后接近正常。模型组24h后TTC染色5只,12d后死亡10只,剩余85只;假手术组24h后TTC染色5只,12d后死亡1只,剩余94只。
在剩余模型组小鼠中,选取完全符合以下4个条件的小鼠作为PSCI小鼠。①蔗糖水消耗实验中,蔗糖水偏爱百分比与假手术组相比无显著性差异;②无明显肢体瘫痪,可沿直线爬行,无绕圈爬行;③水迷宫测试中,游泳速度与假手术组相比无显著性差异;④水迷宫测试中,逃避潜伏期和穿越原平台次数与假手术小鼠相比有显著性差异。
最终PSCI小鼠为70只,认知障碍率约为80%。
1.7脑组织样品的制备[12]
PSCI小鼠选取后,随机将两组小鼠进行编号(假手术组1~94号,PSCI组1~70)。每组选取前60号小鼠进行后续实验。基底前脑-海马胆碱能神经环路是与认知关系最为密切的中枢胆碱能神经环路。小鼠断头取脑,选择左侧(即MCAO模型栓塞对侧)的基底前脑(basal forebrain,BF)和海马(hippocampus,HIP)作为研究对象。标记后,放入液氮中保存,以备行组织中ACh测定、实时定量荧光PCR、Western blotting和染色质免疫共沉淀(chromatin immunoprecipitation,ChIP)检测。
每种检测每组取15只小鼠。小鼠随机编号,每组均为1至60号,ACh测定选用1、5、9……53、57号小鼠;实时荧光定量PCR测定选用2、6、10……54、58号小鼠;Western blotting测定选用3、7、11……55、59号小鼠;染色质免疫共沉淀测定选用4、8、 12……56、60号小鼠。
1.8胆碱能系统的功能相关指标的测定
1.8.1ACh含量[12]
采用ACh浓度测试试剂盒。取基底前脑和海马的组织与组织裂解液按质量:体积=1:9混合,在冰浴中匀浆5min后,3000 r/min,4℃离心10min,取上清液,使用ACh试剂盒、酶标仪,测定组织中ACh含量。样品操作流程如下图。
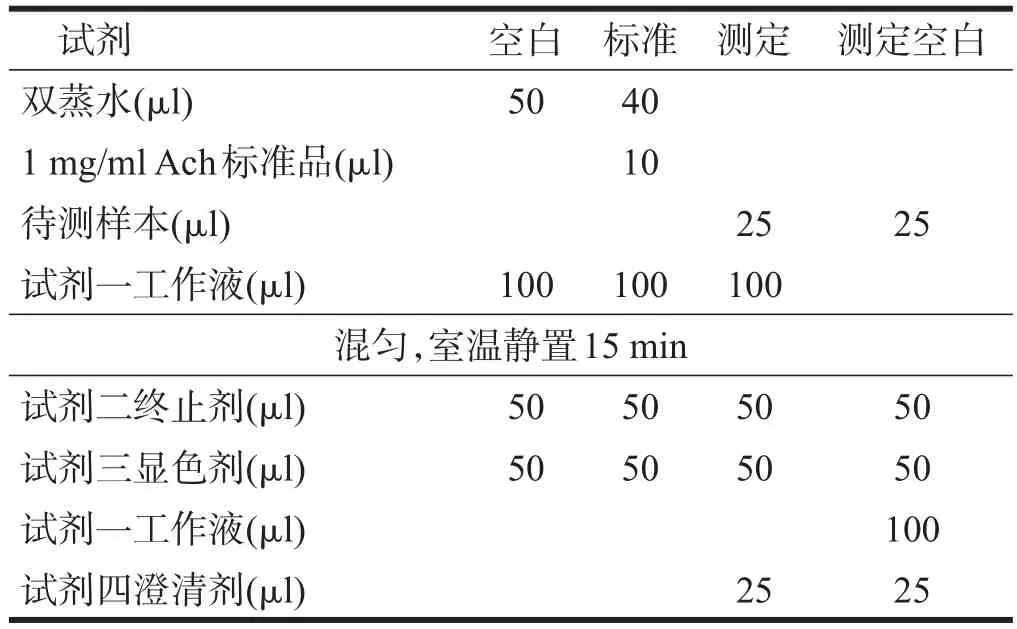
表1 样品操作流程

混匀,静置10min,取200 μl于96孔板在550nm处酶标仪测定各孔OD值。组织中ACh含量的计算公式如下。
1.8.2胆碱乙酰基转移酶mRNA水平
中枢胆碱能神经环路的活性依赖于胆碱乙酰基转移酶(choline acetyl transferase,ChAT)、囊泡ACh转运体、ACh酯酶和ACh受体等,这些物质分别承载着ACh的合成、转运储存、降解和接受功能。ChAT由于稳定性高并且仅存在于胆碱能神经元内,因此被广泛认为是胆碱能神经元活性状态的最佳标记物[13]。采用实时荧光定量PCR测定中枢胆碱能神经环路中ChAT mRNA水平[12]。取基底前脑和海马组织50~100mg,加入1ml预冷TRIZOL试剂裂解组织,用玻璃匀浆器迅速充分匀浆,根据试剂盒(PROMEGA公司,SV total RNA isolation system试剂盒,编号Z3100)操作步骤,提取脑组织中总RNA,并检测RNA的纯度和完整性。选取符合要求的RNA样品,进行Q-PCR检测(每组至少10个样品)。
根据美国基因生物库提供基因核酸序列,选取G+C含量约50%的无发卡结构,相互间无同源序列的两段特异性保守序列,用PRIMER 5.0设计引物。引物均由INVITROGEN公司合成。引物序列见表2。
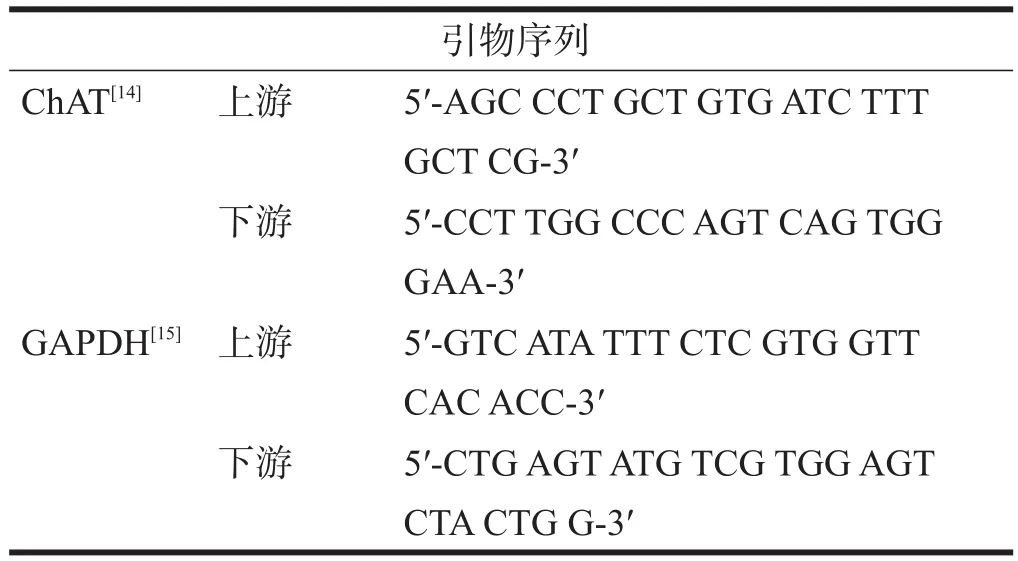
表2 引物序列
根据逆转录试剂盒(TAKARA公司,产品编号DRR036A)操作步骤将RNA逆转录成cDNA,而后根据PCR扩增试剂盒(TAKARA公司,产品编号DRR041A)操作步骤进行PCR扩增反应。PCR扩增反应条件:94 45s;59℃50s;72℃35s;35个循环,20 μl反应体系;应用SDS分析软件(APPLIED BIOSYSTEMS),以2-ΔΔCT法计算ChAT的相对表达量。1.8.3 ChAT蛋白水平
采用Western blotting方法测定神经环路中ChAT蛋白[16]。制备基底前脑和海马组织匀浆,提取蛋白质并作蛋白定量,制胶,用Sample Buffer稀释样本并加热使之变性,加样及电泳,转膜,5%脱脂奶粉封闭PVDF膜,结合一抗ChAT(一抗浓度由多次预试验得出工作浓度,为1:1000),4℃冰箱过夜。结合二抗(1 :5000,闭液稀释),曝光及冲洗胶片,再将X光片结果扫入计算机,用GAPDH作为内参,一抗浓度为1:2000,二抗浓度为1:5000。用Quantity One软件对条带的密度进行分析,计算各条带的平均密度值。
1.9乙酰化内稳态情况的测定
本实验用乙酰化组蛋白H3(acetylated histone H3,Ac-H3)蛋白表达情况,来判断脑内组蛋白乙酰化内稳态情况。采用Western blotting方法测定神经环路中Ac-H3蛋白。具体步骤同ChAT蛋白测定,Ac-H3的一抗浓度为1:500,H3的一抗浓度为1:1000。
1.10CREB结合蛋白(CBP)和p-CREB蛋白的测定
采用Western blotting方法测定神经环路中CBP和磷酸化cAMP反应元件结合蛋白(cAMP response element-binding protein,p-CREB)水平。具体步骤同ChAT蛋白测定,两者的一抗浓度均为1:1000。
1.11ChAT基因M型启动子组蛋白乙酰化程度的测定
利用CHIP(MERCK MILLIPORE公司,产品编号:17-20000)来测定中枢胆碱能神经环路中ChAT基因M型启动子组蛋白乙酰化程度的改变。于冰冻切片上选取约2mm3基底前脑和海马组织,经组织处理液(tissue stabilizing solution)处理后,组织中DNA经甲醛交联,而后由超声波打断为200~1000 bp大小的片段;加入Ac-H3一抗(1:1000,MERCK MILLIPORE)或者阴性对照IgG抗体,旋转,4℃冰箱过夜。第2天,蛋白和DNA交联复合物经过多重洗脱后,进行实时定量荧光PCR扩增。PCR扩增反应条件:94℃20s、59℃30s、72℃30s,共40个循环,20 μl反应体系;PCR扩增引物序列是根据ChAT基因M型启动子而设计,引物序列为如下[17]。上游:5'-CTG TGA GGA AGA GAG GCA GG-3';下游:5'-GAC TGA CTG CAA GCAAAC CA-3'。取PCR产物10 μl,经1.2%的琼脂糖凝胶电泳。结果经紫外凝胶成像系统检测,以条带像素灰度值为结果进行比较。
1.12统计学分析
采用SPSS 17.0软件对数据进行分析。采用独立样本t检验进行组间比较。显著性水平α=0.05。
2 结果
2.1TTC染色
与假手术组小鼠相比,PSCI组小鼠在MCAO造模后24h,右侧皮质、海马和皮质下等脑区均发生不同程度的梗死(白色箭头所指区域),5只小鼠均有梗死区域,梗死区域和部位大致相同,提示大脑中动脉线栓法可使小鼠发生缺血性卒中。见图1。
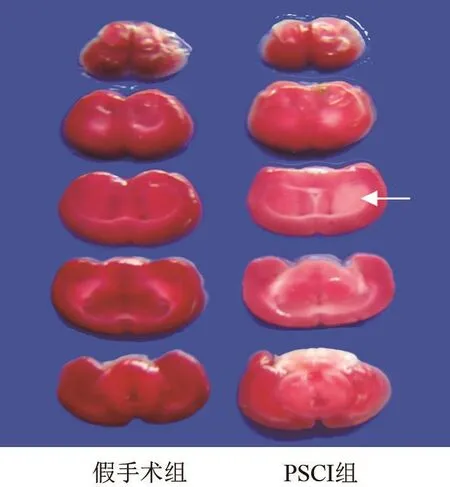
2.2水迷宫测试
仅将最终选定的60只假手术组和60只PSCI组大鼠的水迷宫测试结果进行统计分析。与假手术组小鼠相比,PSCI组寻找到平台时总的游泳距离增加(P<0.05),逃避潜伏期延长(P<0.05)。见表3。
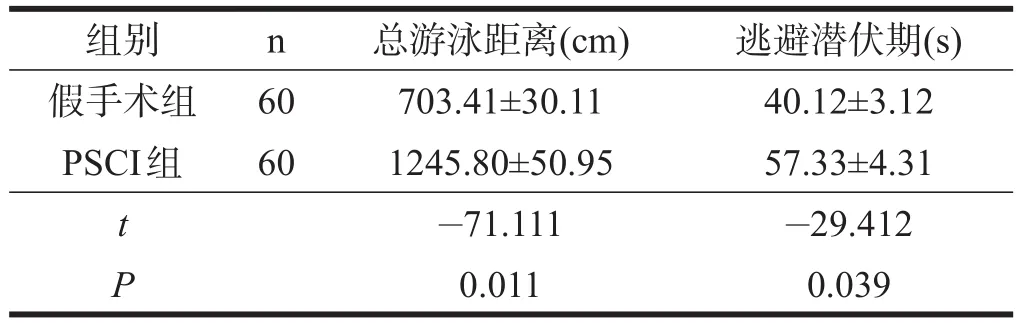
表3 两组小鼠水迷宫测试成绩比较
2.3胆碱能系统的功能测定结果
2.3.1ACh含量
与假手术组相比,PSCI组小鼠无论是基底前脑,还是海马,ACh含量均下降(P<0.05)。见表4、表5。
2.3.2ChAT mRNA表达
与假手术小鼠相比,PSCI组小鼠基底前脑ChAT mRNA表达下降(P<0.05),海马ChAT mRNA表达明显下降(P<0.01)。见表4、表5。
2.3.3ChAT蛋白表达
与假手术组小鼠相比,PSCI组小鼠基底前脑ChAT蛋白表达下降(P<0.05),海马ChAT蛋白表达明显下降(P<0.01)。见图2、表4、表5。
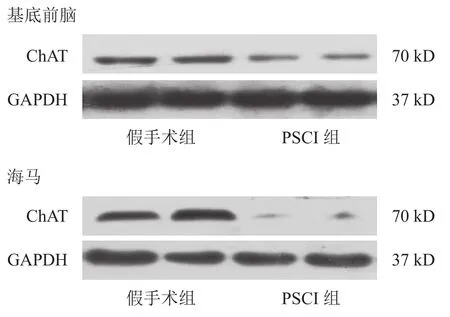
图2 两组ChAT蛋白的Western blotting
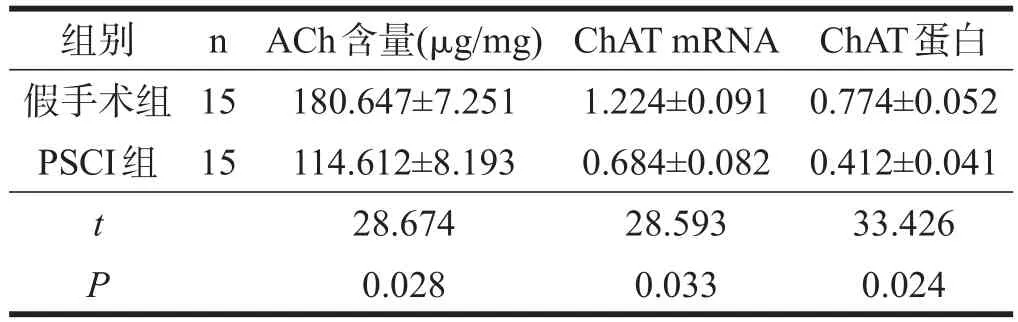
表4 两组小鼠基底前脑胆碱能系统的功能比较
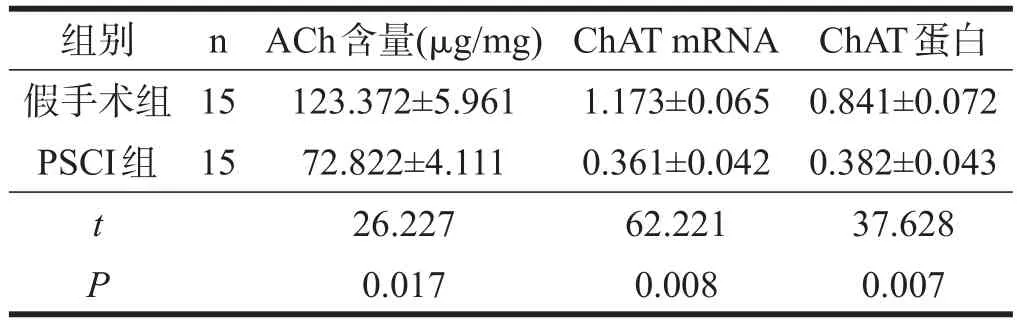
表5 两组小鼠海马胆碱能系统的功能比较
2.4Ac-H3蛋白表达
与假手术组相比,PSCI组小鼠基底前脑和海马的Ac-H3蛋白表达均下降(P<0.05)。见图3、表6。

图3 两组Ac-H3蛋白的Western blotting

表6 两组小鼠基底前脑和海马的Ac-H3蛋白表达比较
2.5CBP和p-CREB蛋白表达
与假手术组小鼠相比,PSCI组小鼠基底前脑和海马的CBP和p-CREB蛋白表达均下降(P<0.05),其中海马p-CREB蛋白表达明显下降(P<0.01)。见图4、表7、表8。
2.6ChAT基因M型启动子组蛋白乙酰化程度
与假手术组小鼠相比,PSCI组小鼠基底前脑的实时定量荧光PCR扩增的条带灰度值下降(P<0.05),海马的实时定量荧光PCR扩增的条带灰度值明显下降(P<0.01)。见表9、图5。
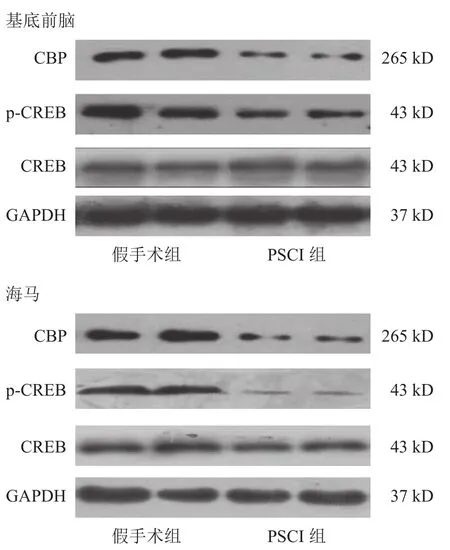
图4 两组CBP和p-CREB蛋白Western blotting
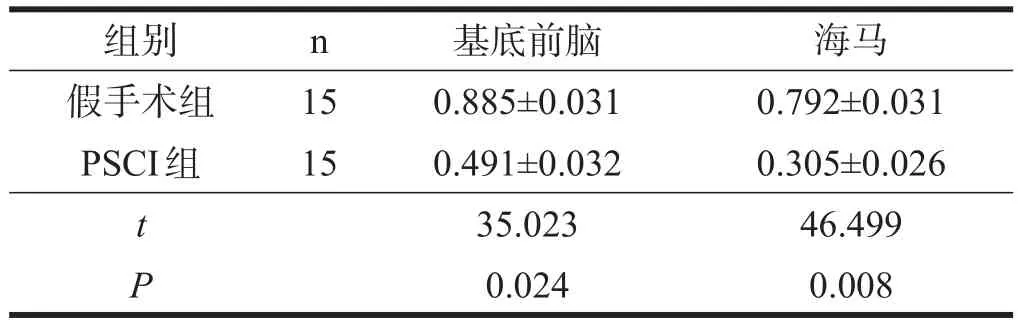
表7 两组p-CREB蛋白表达比较
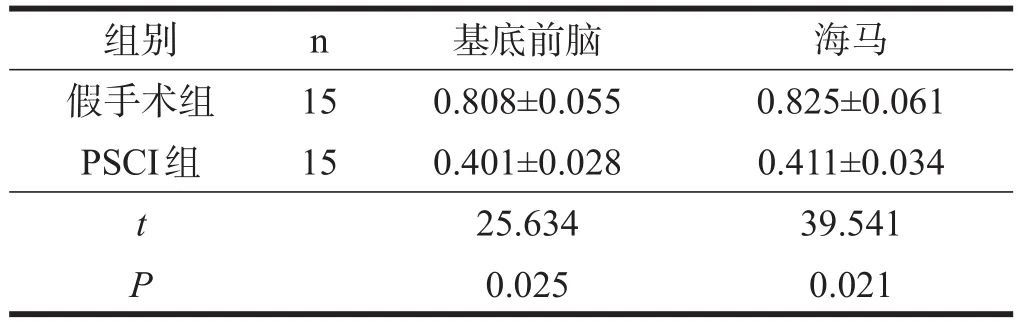
表8 两组CBP蛋白表达比较
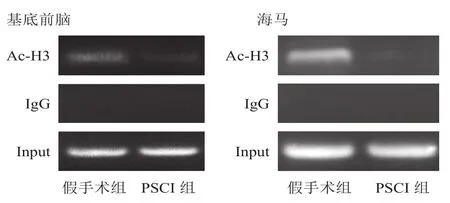
图5 两组ChAT基因M型启动子组蛋白乙酰化水平实时定量荧光PCR扩增条带结果
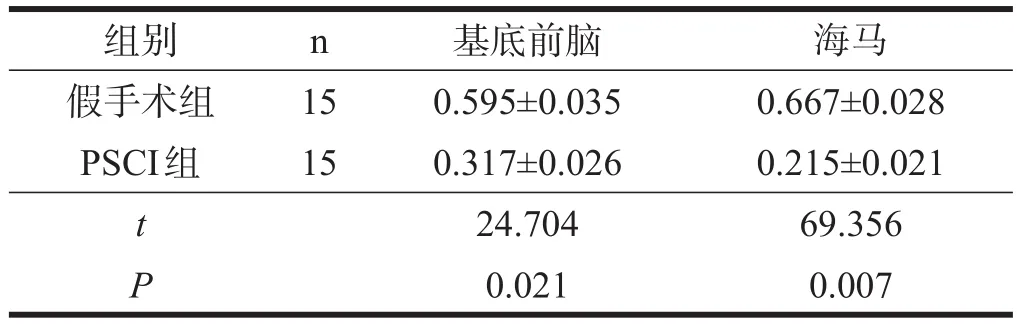
表9 两组ChAT基因M型启动子组蛋白乙酰化程度比较(灰度值)
3 讨论
ACh是迄今发现的与认知功能、学习记忆关系最为密切的一种神经递质[18-19]。脑内胆碱能神经元集中分布于基底前脑、海马、脑干、皮层等部位,各部位神经元之间由突触相互联系,形成广泛而复杂的神经回路,与工作记忆、言语、情绪、注意力调节等有关。其中,基底前脑和海马与认知功能的关系最为密切[20]。基底前脑是指端脑和间脑腹侧和内侧的一些灰质结构,与其他脑区没有十分明确的界线,其经典结构包含:内侧隔核、Broca斜角带的垂直支和水平支、腹侧纹状体苍白球、杏仁核的延伸部、Meynert基底核和大细胞视前区等[20]。基底前脑-海马通路是指基底前脑的胆碱能神经元发出纤维经穹窿海马伞投射至海马,这条通路是被认为是学习记忆的结构基础,一旦损伤此通路可导致学习记忆障碍[13,20]。
在PSCI研究中均可发现胆碱能系统功能缺损,包括胆碱能神经元缺失,ChAT、ACh等水平降低,并出现相应的记忆和学习功能受损[3,21]。而针对胆碱能系统的药物——胆碱能前体补充剂、胆碱酯酶抑制剂等,对PSCI有改善作用[3,21]。这些均说明中枢胆碱能系统功能与PSCI发生机制相关,但具体如何相关,还未完全阐明。
脑卒中累及基底前脑或海马等部位可直接损伤胆碱能神经元而影响认知功能。而临床上,脑卒中最常累及的部位是内囊、屏状核、外囊和白质,通过阻断胆碱能神经环路的联系,导致胆碱能系统功能障碍[22-23]。在本研究中,我们利用MCAO模型模拟临床脑卒中患者的情况。我们发现,MCAO可使得皮质及皮质下区域(包括海马等部位)发生梗死,这些脑区的坏死不可逆转,说明梗死侧的中枢胆碱能系统的功能受到严重的不可逆损害,这一点在我们以往的研究和他人的研究均已证实[12,22]。本研究中,通过检测PSCI的小鼠大脑梗死对侧的基底前脑-海马胆碱能神经环路的胆碱能系统的功能,发现其基底前脑和海马的ACh含量、ChAT mRNA和蛋白表达均有不同程度的减少,提示PSCI的小鼠大脑梗死对侧的基底前脑-海马胆碱能神经环路的胆碱能系统的功能下降;同时,小鼠水迷宫成绩明显下降,认知功能受损。因此,可以推断,当梗死导致同侧中枢胆碱能环路出现不可逆损害,梗死对侧中枢胆碱能环路未出现代偿性的功能提高,却反而出现功能受损,这很可能是PSCI的重要发病机制之一。由于梗死侧中枢胆碱能环路相关脑区已经出现不可逆损伤,因此,PSCI康复和治疗的重点目标应着眼于改善梗死对侧的中枢胆碱能神经环路的功能。
近年来,神经元染色质中组蛋白乙酰化在认知功能方面的重要作用越来越受到关注。组蛋白乙酰化是表观遗传学中基因转录调控的重要方式之一,组蛋白乙酰化状态在组蛋白乙酰基转移酶(histone acetytransferases,HATs)和组蛋白去乙酰化基酶(histone deacetylases,HDACs)的相互拮抗作用下保持动态平衡,HATs促使组蛋白乙酰化并促进转录活性,反之HDACs抑制基因转录[24-25]。Saha等提出的组蛋白乙酰化内稳态学说表明,HATs和HDACs两大家族相互拮抗,使细胞内的乙酰化和去乙酰化处于一种动态平衡中,精确调控基因的转录与表达[26]。
基底前脑-海马胆碱能神经环路作为认知功能的关键环路,其基本组成单位即胆碱能神经元的染色质重塑与认知功能密切相关。本研究也发现,在PSCI的小鼠中,其中枢胆碱能神经环路相关脑区——基底前脑和海马的Ac-H3蛋白水平显著下降。结果提示组蛋白乙酰化内稳态已经在PSCI小鼠中的脑内被打破很可能是其认知障碍的始动因素。
为了探讨PSCI小鼠脑内乙酰化内稳态失衡的原因,我们观测了小鼠中枢胆碱能神经环路中CBP和p-CREB蛋白的变化情况。CBP具有内源性组蛋白乙酰基转移酶活性,可增加组蛋白乙酰化程度[27]。CREB是属于亮氨酸拉链家族的转录因子,通过与数百种基因序列的启动子和增强子区域内的cAMP反应元件(CREs)相结合而发挥转录调控作用[28]。CREB经磷酸化后活性增强,招募CBP并形成CREB-CBP复合物[29]。本实验发现CBP和p-CREB蛋白在PSCI小鼠胆碱能神经环路中均降低,与Ac-H3蛋白水平下降表现一致,说明CBP和p-CREB蛋白表达下降很可能是PSCI小鼠脑内乙酰化内稳态失衡的原因。
已有研究证实,组蛋白乙酰化可以对胆碱能神经环路产生影响[16-17]。例如,曲古霉素A(Trichostatin A,TSA)能促进组蛋白乙酰化,启动ChAT mRNA转录,增强ChAT蛋白合成,并能逆转由于DNA去甲基化导致的ChAT低表达,表明组蛋白乙酰化影响ACh的生成[16-17]。TSA诱导ChAT基因转录与ChAT基因M型启动子组蛋白乙酰化程度增强有关[16-17]。这是由于ChAT基因启动子中含有cAMP反应元件结构[17],是CREB结合位点,CBP增多后,直接结合到启动子上,可使得ChAT基因启动子组蛋白乙酰化程度增强、ChAT基因转录增加;反之,结合到启动子上的CBP减少,ChAT基因启动子组蛋白乙酰化程度降低,ChAT基因转录减少。本实验通过CHIP也证实,PSCI小鼠中,基底前脑和海马的ChAT基因M型启动子组蛋白H3乙酰化程度的确较假手术组小鼠降低,提示乙酰化内稳态失衡已经对PSCI小鼠的胆碱能神经环路产生影响。
综上所述,PSCI小鼠中枢胆碱能神经环路功能受损机制很可能是,脑卒中导致脑内p-CREB和CBP蛋白减少,胆碱能神经环路乙酰化内稳态失衡,ChAT基因M型启动子组蛋白乙酰化程度降低,ChAT基因转录减少,Ach生成减少,认知功能下降。短暂性MCAO模型可以引起小鼠认知功能障碍,PSCI的小鼠中枢胆碱能神经环路的胆碱能系统功能受损,乙酰化内稳态失衡,ChAT基因启动子组蛋白H3乙酰化程度下降,而这些很可能与脑卒中导致环路中相应脑区中p-CREB和CREB结合蛋白表达降低有关。
[参考文献]
[1]Dong Y,Venketasubramanian N,Chan BP,et al.Brief screening tests during acute admission in patients with mild stroke are predictive of vascular cognitive impairment 3-6 months after stroke[J].J Neurol Neurosurg Psychiatry,2012,83(6):580-585.
[2]Brainin M,Tuomilehto J,Heiss WD,et al.Post-stroke cognitive decline:an update and perspectives for clinical research[J].Eur J Neurol,2015,22(2):229-238.
[3]Pasi M,Poggesi A,Salvadori E,et al.Post-stroke dementia and cognitive impairment[J].Front Neurol Neurosci,2012,30:65-69.
[4]Zhang X,Jin G,Li W,et al.Ectopic neurogenesis in the forebrain cholinergic system-related areas of a rat dementia model[J].Stem Cells Dev,2011,20(9):1627-1638.
[5]Muth K,Schnmeyer R,Matura S,et al.Mild cognitive impairment in the elderly is associated with volume loss of the cholinergic basal forebrain region[J].Biol Psychiatry,2010,67(6):588-591.
[6]Di Francesco A,Arosio B,Falconi A,et al.Global changes in DNA methylation in Alzheimer's disease peripheral blood mononuclear cells[J].Brain Behav Immun,2015,45:139-144.
[7]Spiegel AM,Sewal AS,Rapp PR.Epigenetic contributions tocognitive aging:disentangling mindspan and lifespan[J].Learn Mem,2014,21(10):569-574.
[8]Hou SZ,Li Y,Zhu XL,et al.Ameliorative effects of diammonium glycyrrhizinate on inflammation in focal cerebral ischemic-reperfusion injury[J].Brain Res,2012,1447:20-27.
[9]Lee JH,Wei ZZ,Chen D,et al.A neuroprotective role of the NMDA receptor subunit GluN3A(NR3A)in ischemic stroke of the adult mouse[J].Am J Physiol Cell Physiol,2015,308 (7):C570-C577.
[10]Aisa B,Tordera R,Lasheras B,et al.Cognitive impairment associated to HPA axis hyperactivity after maternal separation in rats[J].Psychoneuroendocrinology,2007,32(3):256-266.
[11]Park HR,Kim JY,Lee Y,et al.PMC-12,a traditional herbal medicine,enhances learning memory and hippocampal neurogenesis in mice[J].Neurosci Lett,2016,617:254-263.
[12]Wang X,Li J,Qian L,et al.Icariin promotes histone acetylation and attenuates post-stroke cognitive impairment in the central cholinergic circuits of mice[J].Neuroscience,2013,236:281-288.
[13]Robinson L,Platt B,Riedel G.Involvement of the cholinergic system in conditioning and perceptual memory[J].Behav Brain Res,2011,221(2):443-465.
[14]Shi S,Shi R,Hashizume K.American ginseng improves neurocognitive function in senescence-accelerated mice:possible role of the up-regulated insulin and choline acetyltransferase gene expression[J].Geriatr Gerontol Int,2012,12(1):123-130.
[15]Zhang M,Xu JT,Zhu X,et al.Postsynaptic density-93 deficiency protects cultured cortical neurons from N-methyl-D-aspartate receptor- triggered neurotoxicity[J].Neuroscience,2010,166:1083-1090.
[16]Aizawa S,Teramoto K,Yamamuro Y.Histone deacetylase 9 as a negative regulator for choline acetyltransferase gene in NG108-15 neuronal cells[J].Neuroscience,2012,205:63-72.
[17]Aizawa S,Yamamuro Y.Involvement of histone acetylation in the regulation of choline acetyltransferase gene in NG108-15 neuronal cells[J].Neurochem Int,2010,56:627-633.
[18]Bentley P,Driver J,Dolan RJ.Cholinergic modulation of cognition:insights from human pharmacological functional neuroimaging[J].Prog Neurobiol,2011,94(4):360-388.
[19]Nakauchi S,Sumikawa K.Endogenously released ACh and exogenous nicotine differentially facilitate long-term potentiation induction in the hippocampal CA1 region of mice[J].Eur J Neurosci,2012,35(9):1381-1395.
[20]Mennenga SE,Gerson JE,Koebele SV,et al.Understanding the cognitive impact of the contraceptive estrogen Ethinyl Estradiol:tonic and cyclic administration impairs memory,and performance correlates performance correlates with basal forebrain cholinergic system integrity[J].Psychoneuroendocrinology,2015,54:1-13.
[21]Lim JS,Kim N,Jang MU,et al.Cortical hubs and subcortical cholinergic pathways as neural substrates of poststroke dementia[J].Stroke,2014,45(4):1069-1076.
[22]Ahmad A,Khan MM,Javed H,et al.Edaravone ameliorates oxidative stress associated cholinergic dysfunction and limits apoptotic response following focal cerebral ischemia in rat[J].Mol Cell Biochem,2012,367(1-2):215-225.
[23]Bella R,Cantone M,Lanza G,et al.Cholinergic circuitry function in patients with vascular cognitive impairment-no dementia[J].Brain Stimul,2016,9(2):225-233
[24]Fischer A,Sananbenesi F,Mungenast A,et al.Targeting the correct HDAC(s)to treat cognitive disorders[J].Cell,2010,31 (12):605-617.
[25]Lee W,Lee SY,Son YJ,et al.Gallic acid decreases inflammatory cytokine cytokine secretion through histone acetyltransferase/histone deacetylase regulation in high glucose-induced human monocytes[J].J Med Food,2015,18(7):793-801.
[26]Saha RN,Pahan K.HATs and HDACs in neurodegeneration:a tale of disconcerted acetylation homeostasis[J].Cell Death Differ,2006,13(4):539-550.
[27]Lopez-Atalaya JP,Ciccarelli A,Viosca J,et al.CBP is required for environmental enrichment-induced neurogenesis and cognitive enhancement[J].EMBO J,2011,30:4287-4298.
[28]Flego D,Severino A,Trotta F,et al.Increased PTPN22 expression and defective CREB activation impair regulatory T-cell differentiation in non-ST-segment elevation acute coronary syndromes[J].JAm Coll Cardiol,2015,65(12):1175-1186.
[29]Naqvi S,Martin KJ,Arthur JS.CREB phosphorylation at Ser133 regulates transcription via distinct mechanisms downstream of cAMP and MAPK signaling[J].Biochem J,2014,458(3):469-479.
Change of Histone Acetylation Homeostasis of Central Cholinergic Circuits in Mice with Post-stroke Cognitive Impairment
WANG Xin,SUN Cai-hua,XU Yang,ZHU Xiao-yun,CHEN Xia,SHI Wei,YANG Min
Department of Neurological Rehabilitation,Affiliated Wutaishan Hospital,Medical College of Yangzhou University,Yangzhou,Jiangsu 225001,China
Correspondence to WANG Xin.E-mail:wx000805qm@yeah.net
Abstract:Objective To observe the change of histone acetylation homeostasis of the central cholinergic circuits in mice with post-stroke cognitive impairment(PSCI).Methods The male ICR mice were divided into sham group(n=60)and PSCI group(n=60).The middle cerebral artery occlusion(MCAO)model was established.The Morris water maze test was used to test the cognitive function,and the changes of function and the histone acetylation homeostasis of the central cholinergic circuits of unaffected side were detected by molecular biology methods.Results Compared with the sham group,the scores of Morris water maze test decreased in PSCI group(t>29.412,P<0.05);while the acetylcholine(Ach)level decreased(t>26.227,P<0.05),as well as the expression of choline acetyltransferase(ChAT)mRNA and protein(t>28.593,P<0.05),acetylated histone H3(Ac-H3)(t>24.126,P<0.05),phosphorylated cAMP response element-binding protein(p-CREB)and CREB binding protein(CBP)(t>25.634,P<0.05),and the acetylated histone level of M promoter of ChAT(t>24.704,P<0.05).Conclusion Transient MCAO could cause PSCI.The function of the central cholinergic circuits was impaired,especially the histone acetylation homeostasis of the central cholinergic circuits,such as the acetylated histone level of ChAT promoter decreased.All of that might be related with the decline of p-CREB and CBP level in the corresponding brain regions induced by stroke.
Key words:post-stroke cognitive impairment;cholinergic circuits;acetylcholine;histone acetylation;cAMP response element-binding protein;mice
[中图分类号]R749.1
[文献标识码]A
[文章编号]1006-9771(2016)06-0621-08
DOI:10.3969/j.issn.1006-9771.2016.06.001
基金项目:国家自然科学基金项目(No.81301673)。
作者单位:扬州大学医学院附属江苏省扬州五台山医院神经康复科,江苏扬州市225001。
作者简介:王鑫(1978-),男,汉族,江苏扬州市人,博士,副主任医师,主要研究方向:神经康复基础和临床研究。E-mail:wx000805qm@yeah.net。
收稿日期:(2016-03-11修回日期:2016-05-25)
